Ultrasonic Extraction of β-Carotene from Spirulina platensis in Aqueous Two-phase System and Its Anti-glycosylation Effect
-
摘要: 研究超声辅助有机溶剂/糖双水相体系萃取螺旋藻中β-胡萝卜素最佳提取条件,并对其抗糖基化作用进行分析,在确定萃取体系为叔丁醇/麦芽糖双水相体系基础上,以螺旋藻粉末加入量、超声时间、超声功率为自变量,β-胡萝卜素得率为因变量,采用正交试验设计优化萃取条件。采用赖氨酸-乳糖模拟体系评价萃取后β-胡萝卜素抗糖基化能力。结果表明:3.4 g叔丁醇/2.4 g麦芽糖体系中,螺旋藻粉末加入量为0.05 g,补足水分至10 g,在超声功率90 W,超声时间5 min条件下,螺旋藻中β-胡萝卜素萃取得率为3.19 mg/g,在浓度为50~450 μg/mL范围内,其对模拟体系形成的晚期糖基化终产物的最高抑制率为47.28%,可为新型晚期糖基化终末产物(AGEs)抑制剂开发提供参考依据。Abstract: The optimum extraction conditions of β-carotene from Spirulina platensis by ultrasonic assisted organic solvent / sugar aqueous two-phase system were studied, and its anti glycosylation effect was analyzed. On the basis of determining the extraction system as tert butyl alcohol/maltose aqueous two-phase system, the amount of Spirulina platensis powder, ultrasonic time and ultrasonic power were taken as independent variables, and the yield of β-carotene was taken as dependent variable. The results showed that, in the system of 3.4 g tert-butanol/2.4 g maltose, the amount of Spirulina powder was 0.05 g, fill up with water to 10g, under the ultrasonic power of 90 W and ultrasonic time of 5 min, the extraction yield of β-carotene from Spirulina was 3.19 mg/g. When β-carotene concentration was at ranges of 50 to 450 μg/mL, the highest inhibition rate of AGEs was 47.28%, which could provide a reference for the development of novel AGEs inhibitors.
-
螺旋藻是一种生活在碱性淡水环境中单细胞的蓝藻,富含多种色素,如藻蓝蛋白、藻红蛋白、叶绿素和类胡萝卜素等[1-2]。β-胡萝卜素占总含量的67%~79%[3]。类胡萝卜素的含量相当于视黄醇当量的53%[4]。β-胡萝卜素是一种具有生色团特征的类胡萝卜素,在其结构中存在十一个共轭双键[3]。作为植物、藻类和光合微生物的合成途径中的重要中间体物质[5],对癌症、糖尿病、心血管疾病等具有一定预防和保护作用[6-7]。
近年来,β-胡萝卜素提取主要采用有机溶剂提取法、超临界流体萃取、加压流体萃取、双水相萃取等方法[8-10];但上述方法存在溶剂用量大、提取时间长、提取得率低或设备昂贵及生产成本高或产生大量高盐废水等缺陷。有机溶剂/糖双水相体系是采用糖代替盐与一定量有机溶剂按照一定浓度混合后,由于糖析作用,从而形成不互溶的两相体系,利用目标物质在两相中分配系数不同形成的一种萃取技术[11];该体系采用糖为中性化合物,不会影响体系pH和目标物质活性[12],已成功应用于糠醛、5-羟甲基糠醛(HMF)、阿魏酸、丁香酸、对香豆酸、酚类和香兰素的提取[13-16]。非酶糖基化是指蛋白质或氨基酸游离氨基端与糖之间经脱水、环化、氧化和重排等一系列步骤形成的不可逆的晚期糖基化终产物(AGEs),其与动脉粥样硬化、阿尔茨海默病(AD)、衰老等多种疾病有关[17-18];目前有关有机溶剂/糖双水相体系萃取螺旋藻β-胡萝卜素的研究尚未见报道,尤其对抗糖基化能力缺乏基础研究。
本试验采用超声波辅助有机溶剂/糖双水相体系萃取分离螺旋藻β-胡萝卜素,在确定有机溶剂/糖双水相体系组成基础上,利用单因素和正交试验设计优化螺旋藻β-胡萝卜素提取条件,并对其抑制晚期糖基化终产物抑制效果进行分析,以期为β-胡萝卜素资源利用及新型AGES抑制剂深度开发提供参考依据。
1. 材料与方法
1.1 材料与仪器
螺旋藻干粉 由甘肃凯源生物技术开发中心提供;正丁醇、叔丁醇、乙酸乙酯、乙腈、果糖、麦芽糖、蔗糖、葡萄糖、乳糖、氨基胍 上海源叶科技有限公司;β-胡萝卜素标准品(纯度>99%) 成都德思特生物技术有限公司。
PL-203电子天平 梅特勒-托利多仪器有限公司;DL-820E智能超声波清洗器 上海之信仪器有限公司;DKB-501数显超级恒温水浴锅 扬州市三发电子有限公司;OD-5M立式大容量离心机 湖南凯达科学仪器有限公司;722型分光光度计 上海光谱仪器有限公司;F9700荧光分光光度计 北京世纪科信科学仪器有限公司。
1.2 实验方法
1.2.1 有机溶剂/糖体系萃取螺旋藻中β-胡萝卜素
将一定量有机溶剂、糖和蒸馏水充分混匀后,加入一定量螺旋藻粉末,在一定超声功率和超声时间下进行萃取,萃取结束后,静置一段时间,量取上相体积,测定β-胡萝卜素含量。
1.2.2 β-胡萝卜素标准曲线制备及其含量测定
准确配制浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 μg/mL的β-胡萝卜素标准溶液于25 mL棕色容量瓶中[8],以石油醚定容,在450 nm处测定其吸光值,绘制标准曲线方程:y=3.5482x−0.052,R2
=0.994。式中x为450 nm处测得的吸光度值,y为β-胡萝卜素的质量浓度(μg/mL)。 取萃取后有机溶剂相测定β-胡萝卜素吸光值,代入线性回归方程计算其浓度,按下式计算β-胡萝卜素得率。
β-胡萝卜素得率(μg/g)=萃取液中β-胡萝卜素质量(μg)/螺旋藻粉末的质量(g)
1.2.3 有机溶剂/糖体系组成对螺旋藻中β-胡萝卜素萃取效果的影响
分别称取不同种类的有机溶剂(叔丁醇、乙腈、乙酸乙酯、正丁醇)各3.2 g,加入0.05 g螺旋藻粉末,继续加入不同种类的单糖或双糖(果糖、蔗糖、麦芽糖、葡萄糖、乳糖)各2 g,补足蒸馏水至10 g,充分混匀后,在超声波功率70 W条件下,超声处理5 min,静置至分层,量取上层体积,按照1.2.2方法计算β-胡萝卜素得率。
1.2.4 叔丁醇加入量对螺旋藻中β-胡萝卜素萃取效果的影响
在叔丁醇/麦芽糖体系中,固定麦芽糖加入量为2 g,螺旋藻粉末0.05 g,分别加入3.2、3.4、3.6、3.8、4.0 g叔丁醇,补足蒸馏水至10 g,充分混匀后,在超声波功率70 W条件下,超声处理5 min,静置至分层,量取上层体积,按照1.2.2方法计算β-胡萝卜素得率。
1.2.5 麦芽糖加入量对螺旋藻中β-胡萝卜素萃取效果的影响
在叔丁醇/麦芽糖体系中,固定叔丁醇加入量为3.4 g,螺旋藻粉末0.05 g,分别加入1.8、2.0、2.2、2.4、2.6 g麦芽糖,补足蒸馏水至10 g,充分混匀后,在超声波功率70 W条件下,超声处理5 min,静置至分层,量取上层体积,按照1.2.2方法计算β-胡萝卜素得率。
1.2.6 螺旋藻粉末加入量对螺旋藻中β-胡萝卜素萃取效果的影响
在确定叔丁醇/麦芽糖体系基础上,固定叔丁醇和麦芽糖加入量分别为3.4和2.4 g,分别加入0.025、0.050、0.075、0.100、0.125 g螺旋藻粉末,补足蒸馏水至10 g,充分混匀后,在超声波功率70 W条件下,超声处理5 min,静置至分层,量取上层体积,按照1.2.2方法计算β-胡萝卜素得率。
1.2.7 超声功率对螺旋藻中β-胡萝卜素萃取效果的影响
固定叔丁醇和麦芽糖加入量分别为3.4和2.4 g,螺旋藻粉末0.05 g,补足蒸馏水至10 g。充分混匀后,分别在超声功率为60、70、80、90、100 W条件下超声处理5 min,静置至分层,量取上层体积,按照1.2.2方法计算β-胡萝卜素得率。
1.2.8 超声时间对螺旋藻中β-胡萝卜素萃取效果的影响
超声时间对螺旋藻中β-胡萝卜素萃取效果的影响 固定叔丁醇和麦芽糖加入量分别为3.4和2.4 g,螺旋藻粉末0.05 g,补足蒸馏水至10 g。充分混匀后,在超声功率为90 W条件下,分别超声处理2、5、8、11、14 min,静置至分层,量取上层体积,按照1.2.2方法计算β-胡萝卜素得率。
1.2.9 正交试验设计
在确定叔丁醇/麦芽糖体系组成基础上,根据单因素实验结果,对螺旋藻粉末加入量(A)、超声功率(B)、和超声时间(C)三因素进行L9(34)正交试验设计,确定有机溶剂/糖体系萃取螺旋藻中β-胡萝卜素最佳工艺条件,因素水平如表1。
表 1 因素水平设计Table 1. Factors and levels水平 A螺旋藻粉末加入量(g) B超声功率(W) C超声时间(min) 1 0.025 80 5 2 0.050 90 8 3 0.075 100 11 1.2.10 不同提取方法制备β-胡萝卜比较研究
将正交实验优化后最佳萃取条件与超声辅助提取法、有机溶剂/盐双水相提取法进行比较,比较不同提取方法的优劣性。
1.2.11 萃取后β-胡萝卜素抗糖基化能力评价
采用赖氨酸-乳糖模拟体系评价非酶促反应过程中AGEs形成情况[19],取浓度为0.2 mol/L的赖氨酸溶液和乳糖溶液各1mL,加入1 mL β-胡萝卜素叔丁醇溶液(50~450 μg/mL)充分混匀,采用不同浓度的氨基胍(AG)代替 β-胡萝卜素作为阳性对照,37 ℃条件下水浴10 d后,采用荧光分光光度计在激发波长370 nm、发射波长440 nm下测定不同浓度 β-胡萝卜素对赖氨酸-乳糖模拟体系中AGEs抑制效果。按以下公式计算β-胡萝卜素对赖氨酸-乳糖模拟体系AGEs相对抑制率。
相对抑制率 (%)=F对照 −F样品 F 对照 −F空白 ×100 式中:F样品为加入样品提取液且水浴的反应液的荧光值;F对照为不添加样品但水浴的赖氨酸-乳糖模拟体系的荧光值;F空白为不添加样品也不水浴的赖氨酸-乳糖模拟体系的荧光值。
1.3 数据处理
所有试验均重复3次,数据均以平均值 ± 标准差(n=3)表示。采用SPSS软件包(SPSS25.0S,Chicago,IL)分析其显著性和正交试验结果。
2. 结果与分析
2.1 有机溶剂/糖双水相体系组成对螺旋藻中β-胡萝卜素萃取效果的影响
2.1.1 有机溶剂的选择
四种有机溶剂与糖组成的萃取体系对螺旋藻β-胡萝卜素萃取效果影响如图1,蔗糖、果糖、乳糖与有机溶剂形成萃取体系对β-胡萝卜素萃取效果差异不显著(P>0.05);葡萄糖、麦芽糖与有机溶剂形成萃取体系对β-胡萝卜素萃取效果显著(P<0.05),且叔丁醇/麦芽糖组成糖析体系对β-胡萝卜素萃取效果最佳。叔丁醇是一种独特的一元醇,可与水互溶,在糖存在的条件下,出现分层现象,其作为有机溶剂可溶解非极性物质,同时具有浮选作用,形成三相[20];麦芽糖对萃取后β-胡萝卜素具有一定保护作用[15]。确定有机溶剂/糖体系组成为叔丁醇/麦芽糖。
2.1.2 叔丁醇加入量对螺旋藻中β-胡萝卜素萃取效果的影响
由图2可知,随着叔丁醇加入量逐渐增加,叔丁醇/麦芽糖体系对螺旋藻β-胡萝卜素萃取得率呈现先增加后趋于稳定;与叔丁醇加入量为3.2 g相比,当叔丁醇加入量为3.4 g时,得率达到最大值,β-胡萝卜素得率显著(P<0.05)高于其他加入量;原因可能是叔丁醇加入量增大后,增加了β-胡萝卜素在物料和叔丁醇之间的浓度梯度,有利于传质进行;当叔丁醇加入量超过3.4 g后,β-胡萝卜素得率基本趋于不变(P>0.05),说明螺旋藻中大部分β-胡萝卜素已被萃取溶出,从经济成本考虑,确定叔丁醇加入量为3.4 g。
2.1.3 麦芽糖加入量对螺旋藻中β-胡萝卜素萃取效果的影响
由图3可知,在叔丁醇/麦芽糖体系中,当麦芽糖加入量为2.4 g时,该体系对螺旋藻β-胡萝卜素萃取得率达到最大值(2.93 mg/g),显著(P<0.05)高于其他加入量;原因可能是随着麦芽糖加入量逐渐增加,糖与水分子结合能力较强,使萃取体系中上相部分水分子转移至下相,上相非极性环境更加有利于β-胡萝卜素萃取,从而提高了萃取效果;当麦芽糖加入量过大时,水分子大量转移至下相,导致上相体积减小,萃取不完全[21];因此,确定麦芽糖加入量为2.4 g。
2.2 萃取因素对螺旋藻中β-胡萝卜素萃取效果的影响
2.2.1 螺旋藻粉末加入量对β-胡萝卜素萃取效果的影响
物料加入量也是影响有机溶剂/糖体系萃取效果的因素之一,由图4可知,在叔丁醇/麦芽糖体系中,随着螺旋藻粉末加入量不断增加,β-胡萝卜素得率呈现先增加后减小的趋势,显著(P<0.05)高于其他加入量;原因可能是当加入量较小时,该萃取体系对β-胡萝卜素萃取的得率具有显著(P<0.05)效果;但是,随着螺旋藻粉末加入量继续增加,该体系萃取量达到饱和,会导致其得率下降;因此,确定螺旋藻粉末加入量在0.025~0.075 g范围内,作为后续优化梯度。
2.2.2 超声功率对β-胡萝卜素萃取效果的影响
超声功率是影响超声辅助有机溶剂/糖体系萃取目标产物重要因素之一,由图5可知,在超声功率为60~90 W范围内,该体系对β-胡萝卜素萃取得率随超声功率增加而增大(P<0.05),这可能是由于超声波的机械运动和空穴作用,促使螺旋藻细胞壁发生破裂,增加β-胡萝卜素传质速率,快速进入提取溶剂中[22-23];当功率超过90 W后,超声波作用可能导致β-胡萝卜素结构受到一定程度破坏,同时,细胞内其它有效成分的溶出,影响其萃取得率。因此,确定超声功率在80~100 W范围内进一步优化。
2.2.3 超声时间对β-胡萝卜素萃取效果的影响
由图6可知,随着超声时间的增加,叔丁醇/麦芽糖体系对螺旋藻β-胡萝卜素萃取得率逐渐增加(P<0.05),根据Fick扩散定律[24-25]可知,超声时间与萃取得率在一定范围内成正比;当超声时间为8 min时,萃取得率达到最大值,可能是由于时间延长后,细胞破碎完全,促使β-胡萝卜素转移至有机溶剂中;时间过长伴随着超声温度升高,热效应加剧,影响β-胡萝卜素稳定性,从而影响其得率;因此,超声时间为5~11 min作为后续优化条件。
2.3 正交试验设计及结果
基于单因素研究结果,确定萃取体系组成为叔丁醇/麦芽糖,在此基础上,对螺旋藻粉末加入量(A)、超声功率(B)和超声时间(C)三因素进行L9(34)正交试验设计,试验结果见表2。
表 2 正交试验设计及结果Table 2. Orthogonal test design and result analysis实验号 因素 β-胡萝卜素
得率(mg/g)A(螺旋藻
粉末加入量)B(超声
功率)C(超声
时间)D
空白1 1 1 1 1 2.89 2 1 2 2 2 2.96 3 1 3 3 3 2.81 4 2 1 2 3 2.89 5 2 2 3 1 2.84 6 2 3 1 2 2.99 7 3 1 3 2 2.68 8 3 2 1 3 2.89 9 3 3 2 1 2.85 k1 2.89 2.82 2.92 2.86 k2 2.91 2.90 2.90 2.88 k3 2.81 2.88 2.78 2.86 R 0.10 0.08 0.14 0.02 由表2、表3可知,C对β-胡萝卜素萃取效果的影响显著(P<0.05),A和B影响不明显;三个因素对β-胡萝卜素萃取得率的影响大小顺序为超声时间>螺旋藻粉末加入量>超声功率,此结果与表2中极差分析(R)结果一致;确定最佳萃取条件为A2B2C1,即螺旋藻粉末加入量为0.05 g,超声功率90 W,超声时间5 min,在此条件下,进行三组重复试验,螺旋藻中β-胡萝卜素萃取平均得率为3.19 ± 0.089 mg/g。
表 3 SPSS方差分析数据表Table 3. SPSS ANOVA data table方差来源 III 型平方和 df 均方 F Sig. 校正模型 0.063a 6 0.011 19.671 0.049 截距 73.811 1 73.811 137935.855 0.000 A-螺旋藻粉末加入量 0.015 2 0.008 14.343 0.065 B-超声功率 0.013 2 0.007 12.462 0.074 C-超声时间 0.034 2 0.017 32.208 0.030 D-误差 0.001 2 0.001 总计 73.875 9 校正的总计 0.064 8 2.4 不同提取方法的比较研究
由表4 可知,本试验方法制备的β-胡萝卜素为3.19 mg/g,与有机溶剂/盐双水相体系制备的β-胡萝卜素得率相当,但该法采用为中性盐,导致产生高盐废水;超声辅助提取与有机溶剂提取法对胡萝卜素提取得率相对较低,因此,本试验方法是一种高效制备β-胡萝卜素方法之一。
2.5 β
-胡萝卜素对晚期糖基化终产物抑制效果 天然活性物质可有效抑制模拟体系形成的晚期糖基化终产物,图7可知,在β-胡萝卜素浓度为50~450 μg/mL范围内,AG和β-胡萝卜素均对模拟体系中形成AGEs抑制率呈现逐渐升高的趋势,最高实验浓度下的抑制率为47.28%±1.68%,但β-胡萝卜素抑制效果不如AG显著。原因可能是经有机溶剂/糖萃取后,样品中除主要成分β-胡萝卜素外,可能会有部分脂溶性分子的存在,影响其对AGEs抑制效果。有待于对萃取后β-胡萝卜素进一步纯化。
3. 结论
通过单因素结合正交试验优化了超声波辅助叔丁醇/麦芽糖体系萃取螺旋藻中β-胡萝卜素工艺条件,确定影响β-胡萝卜素萃取因素大小顺序为超声时间>螺旋藻粉末>超声功率;即螺旋藻粉末加入量为0.05 g,超声功率90 W,超声时间5 min,螺旋藻中β-胡萝卜素萃取得率为3.19±0.089 mg/g。萃取后β-胡萝卜素对模拟体系中形成AGEs具有一定的抑制效果。此法可为天然产物脂溶性小分子活性成分提取提供较好的借鉴作用。
-
表 1 因素水平设计
Table 1 Factors and levels
水平 A螺旋藻粉末加入量(g) B超声功率(W) C超声时间(min) 1 0.025 80 5 2 0.050 90 8 3 0.075 100 11 表 2 正交试验设计及结果
Table 2 Orthogonal test design and result analysis
实验号 因素 β-胡萝卜素
得率(mg/g)A(螺旋藻
粉末加入量)B(超声
功率)C(超声
时间)D
空白1 1 1 1 1 2.89 2 1 2 2 2 2.96 3 1 3 3 3 2.81 4 2 1 2 3 2.89 5 2 2 3 1 2.84 6 2 3 1 2 2.99 7 3 1 3 2 2.68 8 3 2 1 3 2.89 9 3 3 2 1 2.85 k1 2.89 2.82 2.92 2.86 k2 2.91 2.90 2.90 2.88 k3 2.81 2.88 2.78 2.86 R 0.10 0.08 0.14 0.02 表 3 SPSS方差分析数据表
Table 3 SPSS ANOVA data table
方差来源 III 型平方和 df 均方 F Sig. 校正模型 0.063a 6 0.011 19.671 0.049 截距 73.811 1 73.811 137935.855 0.000 A-螺旋藻粉末加入量 0.015 2 0.008 14.343 0.065 B-超声功率 0.013 2 0.007 12.462 0.074 C-超声时间 0.034 2 0.017 32.208 0.030 D-误差 0.001 2 0.001 总计 73.875 9 校正的总计 0.064 8 -
[1] Walker T, Purton S, Becker D, et al. Microalgae as bioreactors[J]. Plant Cell Reports,2005,24(11):629−641. doi: 10.1007/s00299-005-0004-6
[2] Moraes C C, Jf D M B, Kalil S J. C-phycocyanin extraction process for large-scale use[J]. Journal of Food Biochemistry,2010,34(s1):133−148.
[3] Ma Q, Fang M, Zheng J, et al. Optimized extraction of β-carotene from Spirulina platensis and hypoglycaemic effect in streptozotocin-induced diabetic mice[J]. Journal of the Science of Food and Agriculture,2016,96(5):1783−1789. doi: 10.1002/jsfa.7286
[4] Dey S, Rathod V K. Ultrasound assisted extraction of β-carotene from Spirulina platensis[J]. Ultrasonics Sonochemistry,2013,20(1):271−276. doi: 10.1016/j.ultsonch.2012.05.010
[5] Yahia E M, de Jesús Ornelas-Paz J, Emanuelli T, et al. Chemistry, stability, and biological actions of carotenoids[J]. Fruit and Vegetable Phytochemicals: Chemistry and Human Health,2017,2:285.
[6] Szpylka J, De Vries J W. Determination of β-carotene in supplements and raw materials by reversed-phase high pressure liquid chromatography: Collaborative study[J]. Journal of AOAC International,2005,88(5):1279−1291. doi: 10.1093/jaoac/88.5.1279
[7] Ford E S, Will J C, Bowman B A, et al. Diabetes mellitus and serum carotenoids: Findings from the third national health and nutrition examination survey[J]. American Journal of Epidemiology,1999,149(2):168−176. doi: 10.1093/oxfordjournals.aje.a009783
[8] 赵楠, 李勇勇, 邵明飞, 等. 螺旋藻粉β-胡萝卜素含量测定方法的优化[J]. 菏泽学院学报,2012(5):36−40. [9] 廖传华, 朱廷风. 螺旋藻中β-胡萝卜素的超临界CO2萃取实验研究[J]. 粮油加工与食品机械,2003(4):66−67. [10] 张喜峰, 杨生辉, 罗光宏, 等. (乙醇+丙酮)/硫酸铵二元双水相萃取分离螺旋藻中β-胡萝卜素[J]. 天然产物研究与开发,2015(3):393−397. [11] Wang B, Ezejias T, Feng H, et al. Sugaring-out: A novel phase separation and extraction system[J]. Chemical Engineering Science,2008,63(9):2595−2600. doi: 10.1016/j.ces.2008.02.004
[12] 孜力汗, 康凯, 牟英, 等. 糖析萃取与发酵耦合分离发酵液中乙醇初探[J]. 中国科学: 化学,2015(5):547−557. [13] Tsai W H, Chuang H Y, Chen H H, et al. Application of sugaring-out extraction for the determination of sulfonamides in honey by high-performance liquid chromatography with fluorescence detection[J]. Journal of Chromatography A,2010,1217(49):7812−7815. doi: 10.1016/j.chroma.2010.10.008
[14] de Brito Cardoso G, Mourão T, Pereira F M, et al. Aqueous two-phase systems based on acetonitrile and carbohydrates and their application to the extraction of vanillin[J]. Separation and Purification Technology,2013,104:106−113. doi: 10.1016/j.seppur.2012.11.001
[15] Wang B, Feng H, Ezeji T, et al. Sugaring-out separation of acetonitrile from its aqueous solution[J]. Chemical Engineering & Technology: Industrial Chemistry-Plant Equipment-Process Engineering-Biotechnology,2008,31(12):1869−1874.
[16] Zhang C, Huang K, Yu P, et al. Sugaring-out three-liquid-phase extraction and one-step separation of Pt (IV), Pd (II) and Rh (III)[J]. Separation and purification technology,2012,87:127−134. doi: 10.1016/j.seppur.2011.11.032
[17] 刘贵梅, 章鼎敏, 李普, 等. 大豆 7S 蛋白-糖体系晚期糖基化终产物形成因素[J]. 食品科学,2017,38(15):20−25. doi: 10.7506/spkx1002-6630-201715004 [18] 马宗艳, 蔡宏斌, 葛朝明. 晚期糖基化终末产物与阿尔茨海默病的关系[J]. 解放军医学杂志,2018,43(1):79−84. [19] 吴茜, 董丽红, 李书艺, 等. 莲原花青素对含有不同饱和度脂肪酸的乳糖-赖氨酸体系中晚期糖基化终末产物的抑制作用[J]. 食品科学,2015(13):44−48. [20] 鞠兴荣, 严梅荣, 三相分离法提取米糠油的初步研究[J]. 中国粮油学报, 2007, 22(6): 125-128. [21] 张兰威, 陈一, 韩雪, 等. 双水相萃取法从风干香肠中分离提取蛋白酶[J]. 分析化学,2008,36(7):900−904. doi: 10.3321/j.issn:0253-3820.2008.07.007 [22] Tu Z, Huang T, Wang H, et al. Physico-chemical properties of gelatin from bighead carp (Hypophthalmichthys nobilis) scales by ultrasound-assisted extraction[J]. Journal of Food Science and Technology,2015,52(4):2166−2174. doi: 10.1007/s13197-013-1239-9
[23] 户宪珍, 杨长花, 杨文娟, 等. 响应面法优化超声辅助提取朱砂根中岩白菜素的提取工艺[J]. 西北药学杂志,2019,34(4):458−462. doi: 10.3969/j.issn.1004-2407.2019.04.008 [24] 王露, 李瑾, 权利娜, 等. 西藏绿萝花总多糖提取的动力学模型研究[J]. 中南药学,2019,17(1):30−33. [25] 赵凯, 牛会平, 侯建平, 等. 香菇多糖提取动力学模型研究[J]. 河北师范大学学报: 自然科学版,2019(1):52−59. [26] 张喜峰, 张芬琴, 杨生辉, 等. 超声集成乙醇/正丁醇双水相萃取螺旋藻中的 β-胡萝卜素[J]. 食品工业科技,2015,36(17):187−191. [27] 房明. 螺旋藻 β-胡萝卜素的提取及降血糖活性研究[D]. 北京: 北京林业大学, 2012. [28] 王海英, 杜为民, 李雯, 等. 螺旋藻干粉中β-胡萝卜素提取工艺研究[J]. 中国食物与营养,2010(6):64−66. doi: 10.3969/j.issn.1006-9577.2010.06.017





 下载:
下载:
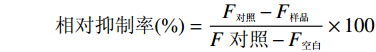







 下载:
下载:
