Optimization of Extraction Technology and Antioxidant Activity of Total Flavonoids from Roots of Cichorium Intybus L. by Ultrasonic Assisted with Complex Enzyme
-
摘要: 目的:菊苣根总黄酮提取工艺条件的优化,并探究其体外抗氧化能力。方法:在单因素实验基础上,选用Box-Behnken试验设计方法,建立以超声时间、液料比、酶解时间、超声功率和复合酶(纤维素酶与果胶酶)的用量为自变量,菊苣根总黄酮得率为因变量的二次回归模型。根据菊苣根总黄酮对ABTS自由基和DPPH自由基的清除效果来判断其体外抗氧化能力。结果:复合酶辅助超声波法提取菊苣根总黄酮的最佳工艺条件为:复合酶用量2.2%、液料比37:1 mL/g、酶解时间66 min、超声功率59 W、超声时间24 min,在此条件下总黄酮得率为5.43 ± 0.12 mg/g。当提取的总黄酮溶液浓度为0.1 mg/mL时,对DPPH、ABTS自由基的清除率分别为84.45%和98.18%,IC50值分别为0.04和0.021 mg/mL。结论:本研究利用响应面法优化了菊苣根总黄酮的提取工艺,建立了总黄酮得率的模拟回归方程,可用于菊苣根总黄酮提取工艺的参数优化。菊苣根总黄酮有着较好的体外抗氧化活性,可用于食品添加剂和开发新的抗氧化药物。Abstract: Objective: Optimization of extraction technology of total flavonoids from roots of Cichorium intybus L., and to study its antioxidative activity in vitro. Methods: On the basis of single-factor test, Box-Behnken test design method was used to establish a quadratic regression model with ultrasonic time, liquid-solid ratio, enzymatic hydrolysis time, ultrasonic power and enzyme (cellulase and pectinase) dosage as independent variables, and the total flavonoids yield of chicory roots as the responsive values. The antioxidative activity in vitro of total flavonoids from chicory roots extracted under optimized conditions was evaluated by scavenging ABTS and DPPH free radicals. Results: The optimum extraction conditions of total flavonoids of chicory roots by ultrasound assisted with complex enzyme were as follows: enzyme dosage was 2.2%, liquid-Solid ratio was 37:1 mL/g, enzymatic hydrolysis time was 66 min, ultrasonic power was 59 W, and ultrasonic time was 24 min. Under these conditions, the total flavonoids yield was 5.43±0.12 mg/g. The scavenging rates of DPPH and ABTS radical were 84.45% and 98.18% respectively at the concentration of total flavonoids solution was 0.1 mg/mL, and IC50 were 0.04 and 0.021 mg /mL, respectively. Conclusion: In this study, the extraction process of total flavonoids from chicory roots was optimized by response surface method, and a simulated regression equation of total flavonoids yield was established, which could be used for parameter optimization of extraction process of total flavonoids from chicory roots. The total flavonoids of chicory roots had good antioxidant activity in vitro and could be used as food additives and to develop new antioxidant drugs.
-
Keywords:
- Chicory roots /
- flavonoids /
- cellulase /
- pectinase /
- ultrasonic /
- process optimization /
- antioxidation
-
菊苣学名Cichorium intybus L.,亦称苦苣、蓝苣、咖啡草等,来源于菊科植物毛菊苣(Cichorium glandulosum Boiss
),是菊科菊苣属的多年生草本植物[1]。菊苣的根、茎、叶和种子可作为药材和食品添加剂[2-3]。菊苣富含多糖类、生物碱、黄酮类、酚类物质、萜类等多种生物活性物质[4-7]。在维药中菊苣主要用于治疗黄痘型肝炎、湿热型肝炎、全身性水肿等疾病[8]。虽然已有众多研究者对菊苣做了大量的研究,但是对于菊苣中有效成分提取和活性研究关注较多的当属多糖类,关于总黄酮的研究甚少。 黄酮类化合物(Flavonoids)广泛存在于植物中,是植物在生长过程中产生的一类由多酚化合物组成的次级代谢产物[9]。黄酮类化合物可分为多种结构类型,包括黄酮类、黄酮醇类、二氢黄酮和二氢黄酮醇类等[10]。研究表明,黄酮类化合物具有显著的抗氧化活性[11-12],还能够降血糖降血脂[13-14]、保护肝脏[15]、抗肿瘤[16]、抗炎症[17]、抗衰老[18]、治疗心血管系统疾病[19-21]等。目前,植物总黄酮的提取方法有很多[22-23],其中超声波辅助提取法在实验室被广泛使用,其优点在于操作简便、提取时间短、具有提取效率高等特点。其原理是利用超声波的空化效应,使植物细胞的细胞壁破裂,而且由于超声波具有机械效应和热效应,加快了细胞内有效成分的释放和溶出,从而缩短提取时间[24]。生物酶也因可提高植物内有效成分的提取率而备受关注。植物细胞壁影响总黄酮的溶出,可选用适当的酶破坏细胞壁,加快有效成分释放,常用于提取总黄酮的酶类主要有纤维素酶、果胶酶和蛋白酶。此方法与其它方法相比,具有提取条件较温和、提取率高等特点,在植物黄酮类化合物的提取中得到广泛应用[25]。目前,有关复合酶辅助超声波法对菊苣根总黄酮进行提取的研究还未见报道。
因此,本研究将超声波技术与复合酶解提取技术相结合,应用响应面设计方案,为菊苣根总黄酮的提取提供了一种高效的提取方法。另外,设计菊苣根总黄酮的体外抗氧化实验,采用DPPH和ABTS法测定其对自由基的清除能力,以期为后续菊苣总黄酮在食品添加剂及药物研发应用等方面给予参考。
1. 材料与方法
1.1 材料与仪器
菊苣根 黄石市润生农业科技发展有限公司;芦丁标准品(HPLC≥98%)、果胶酶(500 U/mg)、纤维素酶(400 U/mg) 上海源叶生物科技有限公司;2, 2-二(4-叔辛基苯基)-1-苦肼基自由基(DPPH)、2, 2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 上海麦克林生化科技有限公司;L(+)-抗坏血酸、氢氧化钠、过硫酸钾 国药集团化学试剂有限公司;硝酸铝 上海新宝精细化工厂;亚硝酸钠 西陇化工股份有限公司;乙醇、石油醚(60~90 ℃) 均为分析纯。
紫外可见分光光度计L6S 上海仪电分析仪器有限公司;超声波清洗器KQ 3200DB 昆山市超声仪器有限公司;电热恒温鼓风干燥箱PCD-C6 上海龙跃仪器设备有限公司;旋转蒸发仪RE-3000 上海亚荣生化仪器厂;电热恒温水浴锅HWS-24 上海慧泰仪器制造有限公司;顶置式搅拌器wb2000-m 德国WIGGENS公司;循环水式真空泵SHZ-Ⅲ 南京科尔沁仪器设备有限公司;电子天平ME204E 瑞士METTLER TOLEDO公司。
1.2 实验方法
1.2.1 菊苣根的预处理
菊苣根60 ℃烘箱干燥2 h,粉碎后过60目筛;将菊苣根粉末放入圆底烧瓶中,加入适量的石油醚(60~90 ℃),浸泡或回流萃取3次,每次40 min;抽滤除去含油脂的滤液,待残渣中石油醚挥发尽后60 ℃条件下干燥,4 ℃下保存备用。
1.2.2 菊苣根总黄酮的提取
取3.0 g预处理后的菊苣根粉末于具塞圆底烧瓶中,加入适量的70%乙醇溶液,按照溶液体积加入适量的纤维素酶与果胶酶,进行搅拌回流提取一段时间后,将圆底烧瓶放入95 ℃水中10 min(灭酶活)。接着用超声波处理提取液30 min后,采用滤膜多次重复抽滤以除去包括复合酶在内的不溶性杂质,得到澄清的滤液置于4 ℃下保存备用。
1.2.3 单因素实验
称取3.0 g预处理好的菊苣根粉末置于具塞圆底烧瓶中,固定乙醇浓度70%、提取液pH=5、提取次数1次、复合酶配比1:1(g/g)、液料比30:1(mL/g)、酶解时间60 min、酶解温度40 ℃、超声功率60 W、超声温度50 ℃、超声时间20 min,以复合酶的用量(0.5%、1.0%、1.5%、2.0%、2.5%)﹑液料比(10:1、20:1、30:1、40:1、50:1 mL/g)、酶解时间(20、40、60、80、100 min)、酶解温度(30、40、50、60 ℃)﹑超声功率(40、60、80、100 W)、超声时间(10、15、20、25、30 min)为要素因子[26],研究各要素因子对菊苣根总黄酮得率的影响。
1.2.4 响应面试验
在单因素实验的基础上,为了获得优化的试验条件,设计自变量为液料比、复合酶用量、超声时间、酶解时间、超声功率,响应值为菊苣根总黄酮得率的响应面试验。试验设计见表1。
表 1 Box-Behnken试验设计Table 1. Box-Behnken test design水平 因素 A复合酶
用量(%)B液料比
(mL/g)C超声时
间(min)D超声功
率(W)E酶解时
间(min)−1 1.5 20:1 20 50 40 0 2.0 30:1 25 60 60 1 2.5 40:1 30 70 80 1.2.5 菊苣根总黄酮得率的测定
1.2.5.1 芦丁标准曲线的绘制
参照文献[27]称取已干燥至恒重的芦丁样品10 mg于100 mL容量瓶中,加入体积份数为70%的乙醇定容至刻度线,混匀,得质量浓度为0.1 mg/mL的标准品溶液。依次精密称取0、1.0、2.0、3.0、4.0、5.0 mL标椎品溶液,分别置于10 mL具塞试管中。各加入质量分数为5%的亚硝酸钠(NaNO2)0.6 mL,摇匀,室温静置6 min。各加入质量分数为10%的硝酸铝(Al(NO3)3)0.6 mL,混匀,室温静置6 min。再各加入质量分数为4%(1 mol/L)的氢氧化钠4 mL,混匀,室温静置15 min。加70%的乙醇定容至10 mL,室温静置15 min。将第一瓶作为空白对照,在510 nm波长处测其紫外吸光度值。以芦丁质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线。得回归方程为:y=13.1x−0.0063,R2=0.9996,其中y为吸光值,x为芦丁浓度(mg/mL)。根据试验结果,芦丁在0.01~0.05 mg/mL的浓度范围内与吸光度有良好的线性关系。
1.2.5.2 菊苣根总黄酮含量的测定
取保存备用的菊苣根总黄酮溶液并定容到100 mL,吸取1 mL于10 mL的具塞刻度管中,按照测芦丁标准曲线的方法测吸光度值,并根据回归方程计算菊苣根总黄酮溶液的浓度。计算公式如下所示[28]:
总黄酮得率(mg/g)=C×V×NM 式中:C:总黄酮溶液的浓度(mg/mL);V:总黄酮溶液的定容体积(mL);N:测定时总黄酮溶液的稀释倍数;M:提取用的菊苣根粉末质量(g)。
1.2.6 菊苣根总黄酮的体外抗氧化活性测定
将提取得到的菊苣根总黄酮配制成0.02、0.04、0.06、0.08、0.1 mg/mL质量浓度的待测液,以相同浓度的维生素C溶液作为阳性对照,分别测定菊苣根总黄酮对DPPH自由基和ABTS+自由基的清除率,评价其体外抗氧化活性。
1.2.6.1 菊苣根总黄酮清除DPPH自由基能力测定
参照文献[29]的测定方法并做稍微修改。精密称取7.89 mg DPPH固体粉末,溶于100 mL无水乙醇中,配成DPPH工作液(0.2 mmol/L),4 ℃下避光保存备用。分别吸取1 mL不同浓度的总黄酮溶液于3 mL DPPH工作液中,混匀,室温黑暗放20 min进行充分反应,在517 nm的波长处测得吸光度值为A1;将DPPH工作液替换成等体积无水乙醇测得吸光值为A2;将样品溶液替换成等体积的样品溶剂(70%乙醇)测得吸光度值为A0。等浓度的维生素C溶液作为阳性对照组,计算公式为:
清除率 (%)=[1−(A1−A2)/A0]×100 式中:A1:样品组吸光度值;A2:样品本底吸光度值;A0:空白对照组吸光度值。
1.2.6.2 菊苣根总黄酮清除ABTS+自由基能力测定
参照文献[30]的测定方法并做稍微修改。吸取5 mL ABTS(7 mmol/L)溶液,加入到5 mL过硫酸钾(2.45 mmol/L)溶液中,黑暗放置12~16 h既得ABTS+·工作液。使用前用ddH2O将吸光度值稀释至0.70±0.02(734 nm波长处)。在试管中加入不同浓度的样品溶液0.4 mL,然后加入3 mL ABTS+·工作液,室温黑暗放置30 min后在734 nm波长处测得吸光值为A1;将ABTS+·工作液替换成等体积ddH2O测得吸光值为A2;将样品溶液替换成等体积的样品溶剂(70%乙醇)测得吸光度值为A0。等浓度的维生素C溶液作为阳性对照组,计算公式为:
清除率 (%)=[1−(A1−A2)/A0]×100 式中:A1:样品组吸光度值;A2:样品本底吸光度值;A0:空白对照组吸光度值。
1.3 数据处理
所有试验均重复3次,结果取平均值并计算标准误差。运用Excel、Origin 7.0软件绘制趋势点线图,SPSS 19.0软件计算半效剂量IC50值,Design-Expert 8.0软件设计响应面试验,并对相关数据结果进行分析。
2. 结果与分析
2.1 单因素实验结果
2.1.1 复合酶用量对菊苣根总黄酮得率的影响
从图1中可以看出,随着复合酶的加入,菊苣根总黄酮得率不断提高,当复合酶用量达到2.0%时得率最高,随后随着酶量的增加而得率下降。可能原因是当酶浓度过高时,酶和部分酶解的纤维素将菊苣根粉末包裹起来,反而不利于有效成分溶出,因此总黄酮得率降低[31]。为了保证菊苣根的纤维素和果胶能尽可能的被降解,同时不影响总黄酮物质溶出,因此后续采用2.0%的复合酶用量进行试验。
2.1.2 液料比对菊苣根总黄酮得率的影响
从图2中可以看出,在液料比的比值较小时,增加乙醇量会导致菊苣根总黄酮得率增加,在液料比30:1 mL/g时总黄酮得率最大,之后呈现缓慢下降趋势。推测这可能是因为液料比过高时,溶剂量大吸收了过多的超声波能量使菊苣根粉末受到的超声波能量减少,从而影响总黄酮得率[32]。因此选择液料比为30:1 mL/g。
2.1.3 酶解时间对菊苣根总黄酮得率的影响
从图3中可以看出,随着酶解时间的延长,菊苣根总黄酮得率逐渐升高,但当酶解时间大于60 min后,得率便稍微下降。可能是因为当酶解时间延长时,酶解效率不再提高,而且溶出的总黄酮中有部分黄酮类化合物可能发生了降解,因此酶解时间超过60 min,总黄酮得率缓慢下降[33]。因此选择酶解的时间为60 min。
2.1.4 酶解温度对菊苣根总黄酮得率的影响
从图4中可以看出,在酶解温度为50 ℃之前,菊苣根总黄酮得率随着温度的升高而逐渐提高。但当酶解温度超过50 ℃后,得率下降,可能是因为酶因温度过高而失活,酶解速率下降,总黄酮得率下降[34]。因此选择酶解温度为50 ℃。
2.1.5 超声功率对菊苣根总黄酮得率的影响
从图5中可以看出,随着超声功率的增加,菊苣根总黄酮得率也逐渐升高,当超声功率达到60 W时,得率达到最高。这是因为当超声功率较低时,对细胞壁的破坏作用较小,故总黄酮浸出率不高。随着超声功率不断增加,分子运动加剧,细胞壁破碎程度加大,总黄酮得率升高。随后总黄酮得率下降,这可能是因为当超声功率太大时,黄酮类化合物遭到破坏,从而造成总黄酮得率的降低[35]。因此选择超声功率为60 W。
2.1.6 超声时间对菊苣根总黄酮得率的影响
从图6中可以看出,随着超声时间的延长,菊苣根总黄酮得率逐渐提高,在超声时间25 min时,得率最高。当继续延长时间时,总黄酮得率下降,原因可能是超声时间过长,导致溶液中很多其它物质溶出,从而造成总黄酮得率的降低[36]。
2.2 响应面试验结果
表 2 Box-Behnken设计的各因素水平及响应值Table 2. Experimental design and response results of Box-Behnken design实验号 因素 总黄酮得
率(mg/g)A B C D E 1 1 0 0 0 1 5.08 2 0 0 0 −1 −1 4.73 3 0 0 0 0 0 5.31 4 0 −1 0 0 −1 4.11 5 0 −1 0 0 1 4.40 6 0 1 −1 0 0 5.25 7 −1 0 0 0 −1 4.57 8 0 0 0 0 0 5.36 9 1 0 0 0 −1 4.55 10 0 0 1 1 0 4.44 11 0 0 0 1 −1 4.40 12 0 −1 −1 0 0 4.38 13 0 1 0 1 0 5.08 14 0 0 −1 0 1 4.95 15 0 1 0 −1 0 5.20 16 0 0 −1 1 0 4.74 17 −1 0 −1 0 0 4.68 18 0 1 0 0 1 5.30 19 0 0 0 0 0 5.29 20 0 0 0 −1 1 4.98 21 0 1 1 0 0 4.76 22 0 0 1 0 1 4.99 23 1 0 0 1 0 4.64 24 1 1 0 0 0 5.21 25 0 −1 1 0 0 4.09 26 1 0 0 −1 0 4.97 27 0 0 0 0 0 5.25 28 0 −1 0 1 0 4.36 29 −1 0 0 1 0 4.53 30 0 0 0 1 1 4.95 31 1 0 1 0 0 4.73 32 −1 1 0 0 0 5.02 33 0 0 −1 −1 0 4.74 34 0 0 1 −1 0 4.56 35 −1 0 1 0 0 4.43 36 −1 0 0 0 1 4.56 37 −1 0 0 −1 0 4.30 38 0 0 0 0 0 5.39 39 1 −1 0 0 0 4.56 40 −1 −1 0 0 0 4.03 41 0 0 0 0 0 5.23 42 0 1 0 0 −1 4.70 43 0 0 1 0 −1 4.33 44 0 −1 0 −1 0 4.45 45 0 0 −1 0 −1 4.55 46 1 0 −1 0 0 5.01 表 3 响应面试验回归模型方差分析Table 3. Anovariance analysis of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 6.03 20 0.30 30.50 < 0.0001 ** A 0.43 1 0.43 43.73 < 0.0001 ** B 2.36 1 2.36 238.34 < 0.0001 ** C 0.24 1 0.24 24.54 < 0.0001 ** D 0.039 1 0.039 3.95 0.0581 E 0.67 1 0.67 67.60 < 0.0001 ** AB 0.029 1 0.029 2.92 0.0997 AC 2.250E-004 1 2.250E-004 0.023 0.8813 AD 0.078 1 0.078 7.93 0.0093 ** AE 0.073 1 0.073 7.37 0.0118 * BC 0.010 1 0.010 1.01 0.3242 BD 2.250E-004 1 2.250E-004 0.023 0.8813 BE 0.024 1 0.024 2.43 0.1316 CD 3.600E-003 1 3.600E-003 0.36 0.5516 CE 0.017 1 0.017 1.71 0.2029 DE 0.023 1 0.023 2.28 0.1439 A2 0.87 1 0.87 87.92 < 0.0001 ** B2 0.86 1 0.86 86.56 < 0.0001 ** C2 0.98 1 0.98 99.44 < 0.0001 ** D2 0.78 1 0.78 78.90 < 0.0001 ** E2 0.75 1 0.75 75.42 < 0.0001 ** 残差 0.25 25 9.886E-003 失拟值 0.23 20 0.011 2.98 0.1149 纯误差 0.019 5 3.830E-003 总离差 6.28 45 R2 0.9606 Adj R2 0.9291 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 利用Design Expert软件对表2数据进行多元回归拟合,得到多元回归模型为:Y=5.30+0.16A+0.38B−0.12C−0.049D+0.20E−0.085AB−0.0075AC− 0.14AD+0.14AE−0.050BC−0.0075BD+0.077BE− 0.030CD+0.065CE+0.075DE−0.32A2−0.31B2−0.34C2−0.30D2−0.29E2。为检验试验模型方程的有效性,对菊苣根总黄酮得率的回归模型进行方差分析,分析结果见表3。
由表3可知,菊苣根总黄酮得率的模型方程的F值为30.50,具有显著性(PModel<0.0001),失拟项不显著(P>0.05),方程的决定系数R2为0.9606,表明以菊苣根总黄酮得率的变化而建立的方程对实验的拟合程度较好,试验误差较小,因此该模型可以用来分析和预测菊苣根总黄酮提取的工艺条件。各自变量因素对菊苣根总黄酮得率的影响情况如下:一次项因素A(酶解时间)、B(液料比)、C(超声时间)和E(复合酶用量),二次项因素A2、B2、C2、D2、E2、AD(酶解时间与超声功率)对菊苣根总黄酮得率的影响均具有极显著性(P<0.01);交互项因素AE(酶解时间与复合酶用量)对菊苣根总黄酮得率的影响显著(P<0.05);一次项因素D(超声功率)、交互项因素AB(酶解时间与液料比)、AC(酶解时间与超声时间)、BC(液料比与超声功率)、BD(液料比与超声功率)、BE(液料比与复合酶用量)、CD(超声时间与超声功率)、CE(超声时间与复合酶用量)和DE(超声功率与复合酶用量)对菊苣根总黄酮得率的影响不显著(P>0.05)。因此,根据该回归模型方差分析的结果可以得知,各因素对菊苣根总黄酮得率的影响次序为:B(液料比)> E(复合酶的用量)> A(酶解时间)> C(超声时间)>D(超声功率)。
图7反映了交互项因素AD(酶解时间与超声功率)和交互项因素AE(酶解时间和复合酶用量)对菊苣根总黄酮得率具有显著影响(P<0.05)。由图7可知,固定超声功率不变时,酶解时间的延长会导致菊苣根总黄酮得率先提高后降低;固定酶解时间不变时,超声功率的升高会导致菊苣根总黄酮得率先提高后降低。当固定酶解时间不变时,复合酶用量的增多会导致菊苣根总黄酮得率先提高后降低;固定复合酶用量不变时,酶解时间的延长会导致菊苣根总黄酮得率先提高后降低。从菊苣根总黄酮得率回归方程可知,优化的工艺条件为:酶解时间为66 min、超声功率为59.1 W、液料比为36.5:1 mL/g、复合酶的用量为2.24%、超声时间为24.05 min,在该优化条件下,总黄酮得率最高为5.52 mg/g。
为了方便实际试验操作,上述优化的提取条件修改成:酶解时间为66 min、超声功率为59 W、液料比为37:1 mL/g、复合酶的用量为2.2%、超声时间为24 min,根据以上修改的优化条件做3组重复试验,测得菊苣根总黄酮得率为5.43 ± 0.12 mg/g,与模型预测值相比较,相对误差较小(1.66%),可靠性较高,可以作为超声波协同酶法提取菊苣根总黄酮工艺的回归分析和参数优化。
2.3 菊苣根总黄酮体外抗氧化活性试验结果
2.3.1 菊苣根总黄酮对DPPH自由基的清除能力
如图8所示,随着质量浓度的增大,菊苣根总黄酮和维生素C对DPPH的清除率先不断增大再趋于平缓。在质量浓度为0.10 mg/mL时,维生素C的清除率达到95.62%,菊苣根总黄酮的清除效果稍弱于维生素C,清除率为84.45%。通过计算,维生素C和菊苣根总黄酮清除DPPH自由基的IC50值分别为0.026、0.04 mg/mL。结果表明菊苣根总黄酮对DPPH自由基有较好的清除效果。
2.3.2 菊苣根总黄酮对ABTS+自由基的清除能力
如图9所示,在质量浓度达到0.08 mg/mL时,菊苣根总黄酮和维生素C对ABTS+自由基的清除率均达到97%以上。当质量浓度达到0.10 mg/mL时,维生素C的清除率为100%,菊苣根总黄酮的清除率为98.18%,接近维生素C的清除能力。通过计算,维生素C和菊苣根总黄酮清除ABTS+自由基的IC50值分别为0.016、0.021 mg/mL。结果表明菊苣根总黄酮能有效清除ABTS+自由基,有很好的体外抗氧化活性。
3. 结论
近年来,菊苣叶和籽总黄酮提取的相关研究报道较多[37-38],而菊苣根总黄酮提取的文献较少。因此,本研究采用超声波,并辅以复合酶解提取技术的方法,设计单因素实验及通过响应面法优化菊苣根总黄酮提取工艺,建立了总黄酮得率的模拟回归方程,且模型拟合程度较好。最终确定最佳工艺条件为:酶解时间66 min、复合酶的用量2.2%、超声功率59 W、液料比37:1 mL/g、超声时间24 min。该结果可为今后的相关研究提供技术支持和工艺参考,加快菊苣资源的开发与利用。
体外抗氧化活性研究表明,当菊苣根总黄酮溶液浓度为0.1 mg/mL时,对DPPH、ABTS+自由基的清除率接近维生素C,可达到84.45%和98.18%,IC50值分别为0.04、0.021 mg/mL,表现出显著的体外抗氧化活性。因此,菊苣根总黄酮可用于食品生产添加剂和开发新的天然抗氧化药物。
本研究仍然存在很多不足及需要改进的地方。菊苣根总黄酮的提取工艺需要结合实际生产应用等因素对提取条件进行优化和改进,另外,本研究中对抗氧化活性的考察仅涉及DPPH、ABTS+自由基试验,还需补做总还原力、体内抗氧化等相关实验工作。因此,本研究是对菊苣根总黄酮提取及抗氧化活性的初步探索,后期仍需深入研究。
-
表 1 Box-Behnken试验设计
Table 1 Box-Behnken test design
水平 因素 A复合酶
用量(%)B液料比
(mL/g)C超声时
间(min)D超声功
率(W)E酶解时
间(min)−1 1.5 20:1 20 50 40 0 2.0 30:1 25 60 60 1 2.5 40:1 30 70 80 表 2 Box-Behnken设计的各因素水平及响应值
Table 2 Experimental design and response results of Box-Behnken design
实验号 因素 总黄酮得
率(mg/g)A B C D E 1 1 0 0 0 1 5.08 2 0 0 0 −1 −1 4.73 3 0 0 0 0 0 5.31 4 0 −1 0 0 −1 4.11 5 0 −1 0 0 1 4.40 6 0 1 −1 0 0 5.25 7 −1 0 0 0 −1 4.57 8 0 0 0 0 0 5.36 9 1 0 0 0 −1 4.55 10 0 0 1 1 0 4.44 11 0 0 0 1 −1 4.40 12 0 −1 −1 0 0 4.38 13 0 1 0 1 0 5.08 14 0 0 −1 0 1 4.95 15 0 1 0 −1 0 5.20 16 0 0 −1 1 0 4.74 17 −1 0 −1 0 0 4.68 18 0 1 0 0 1 5.30 19 0 0 0 0 0 5.29 20 0 0 0 −1 1 4.98 21 0 1 1 0 0 4.76 22 0 0 1 0 1 4.99 23 1 0 0 1 0 4.64 24 1 1 0 0 0 5.21 25 0 −1 1 0 0 4.09 26 1 0 0 −1 0 4.97 27 0 0 0 0 0 5.25 28 0 −1 0 1 0 4.36 29 −1 0 0 1 0 4.53 30 0 0 0 1 1 4.95 31 1 0 1 0 0 4.73 32 −1 1 0 0 0 5.02 33 0 0 −1 −1 0 4.74 34 0 0 1 −1 0 4.56 35 −1 0 1 0 0 4.43 36 −1 0 0 0 1 4.56 37 −1 0 0 −1 0 4.30 38 0 0 0 0 0 5.39 39 1 −1 0 0 0 4.56 40 −1 −1 0 0 0 4.03 41 0 0 0 0 0 5.23 42 0 1 0 0 −1 4.70 43 0 0 1 0 −1 4.33 44 0 −1 0 −1 0 4.45 45 0 0 −1 0 −1 4.55 46 1 0 −1 0 0 5.01 表 3 响应面试验回归模型方差分析
Table 3 Anovariance analysis of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 6.03 20 0.30 30.50 < 0.0001 ** A 0.43 1 0.43 43.73 < 0.0001 ** B 2.36 1 2.36 238.34 < 0.0001 ** C 0.24 1 0.24 24.54 < 0.0001 ** D 0.039 1 0.039 3.95 0.0581 E 0.67 1 0.67 67.60 < 0.0001 ** AB 0.029 1 0.029 2.92 0.0997 AC 2.250E-004 1 2.250E-004 0.023 0.8813 AD 0.078 1 0.078 7.93 0.0093 ** AE 0.073 1 0.073 7.37 0.0118 * BC 0.010 1 0.010 1.01 0.3242 BD 2.250E-004 1 2.250E-004 0.023 0.8813 BE 0.024 1 0.024 2.43 0.1316 CD 3.600E-003 1 3.600E-003 0.36 0.5516 CE 0.017 1 0.017 1.71 0.2029 DE 0.023 1 0.023 2.28 0.1439 A2 0.87 1 0.87 87.92 < 0.0001 ** B2 0.86 1 0.86 86.56 < 0.0001 ** C2 0.98 1 0.98 99.44 < 0.0001 ** D2 0.78 1 0.78 78.90 < 0.0001 ** E2 0.75 1 0.75 75.42 < 0.0001 ** 残差 0.25 25 9.886E-003 失拟值 0.23 20 0.011 2.98 0.1149 纯误差 0.019 5 3.830E-003 总离差 6.28 45 R2 0.9606 Adj R2 0.9291 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 -
[1] 饶路路. 菊苣[J]. 蔬菜,1997,3:12−13. [2] 王佺珍, 崔健. 菊苣的药理药效研究及开发前景[J]. 中国中药杂志,2009,34(17):2269−2272. doi: 10.3321/j.issn:1001-5302.2009.17.033 [3] 杜欣. 菊苣的应用价值研究[J]. 中外食品工业,2014,6:74−75. [4] 胡君萍, 李渊, 柳惠斌, 等. UPLC同时测定维药毛菊苣和菊苣中5种化学成分的含量[J]. 中国实验方剂学杂志,2014,20(17):65−68. [5] Mascherpa D, Carazzone C, Marrubini G, et al. Identification of phenolic constituents in Cichorium endivia var. crispum and var. latifolium salads by high-performance liquid chromatography with diode array detection and electrospray ioniziation tandem mass spectrometry[J]. Journal of Agricultura and Food Chemistry,2012,60(49):142−150.
[6] Graziani G, Ferracane R, Sambo P, et al. Profiling chicory sesquiterpene lactones by high resolution mass spectrometry[J]. Food Research International,2015,67(1):193−198.
[7] 骆旭东, 杨建华, 张海波, 等. HPLC法同时测定毛菊苣根和种子7种化学成分的含量[J]. 西北药学杂志,2019,34(3):289−294. doi: 10.3969/j.issn.1004-2407.2019.03.002 [8] 中国药物生物制品检定所. 中国民族药志(第二卷)[M]. 北京: 人民出版社, 1990: 476−481. [9] Kumar, Shashank, Pandey, et al. Chemistry and biological activities of flavonoids: An overview[J]. The Scientific World Journal,2013,2013:1−16.
[10] 吴立军. 天然药物化学[M]. 北京: 人民卫生出版社, 2011. [11] Kumar S, Mishra A, Pandey AK. Antioxidant mediated protective effect of Parthenium hysterophorus against oxidative damage using in vitro models[J]. BMC Complementary and Alternative Medicine,2013,13(1):120−120. doi: 10.1186/1472-6882-13-120
[12] Barzegar A. Antioxidant activity of polyphenolic myricetin in vitro cell-free and cell-based systems[J]. Molecular Biology Research Communications,2016,5:87−95.
[13] Zhuo X, Tian Y, Wei Y, et al. Flavone of Hippophae (H-flavone) lowers atherosclerotic risk factors via upregulation of the adipokine C1q/tumor necrosis factor-related protein 6(CTRP6) in macrophages[J]. Bioscience Biotechnology & Biochemistry,2019(10):1−8.
[14] 陈玉峰, 付诗尧, 金露, 等. 膳食黄酮消脂减肥的分子作用机制研究进展[J]. 中国食品学报,2019,19(10):315−330. [15] Jahan S, Khan M, Imran S, et al. The hepatoprotective role of silymarin in isoniazid induced liver damage of rabbits[J]. Journal of the Pakistan Medical Association,2015,65:620−623.
[16] Du W, Yang X, Song Z, et al. Antitumor activity of total flavonoids from daphne genkwa in colorectal cancer[J]. Phytotherapy Research,2016,30:323−330. doi: 10.1002/ptr.5540
[17] Bettaieb A, Cremonini E, Kang H, et al. Anti-inflammatory actions of (-)-epicatechin in the adipose tissue of obese mice[J]. International Journal of Biochemistry & Cell Biology,2016,81:383−392.
[18] 李萌茹, 周玉枝, 杜冠华, 等. 中药黄酮类化合物抗衰老作用及其机制研究进展[J]. 药学学报,2019,54(8):1382−1391. [19] 李旭光, 方莲花, 杜冠华. 黄酮类化合物的心血管保护作用机制研究进展[J]. 中国药理学通报,2018,34(6):741−744. doi: 10.3969/j.issn.1001-1978.2018.06.001 [20] Jiao Yi, Li Ya-Nan, Chen Zhi-Wu, et al. Mechanism of H2S-mediated ROCK inhibition of total flavones of Rhododendra against myocardial ischemia injury[J]. Experimental and Therapeutic Medicine,2019,18(5):783−792.
[21] Nagula Ruchika L, Wairkar Sarika. Recent advances in topical delivery of flavonoids: A review[J]. Journal of Controlled Release,2019,296:190−201. doi: 10.1016/j.jconrel.2019.01.029
[22] 荆常亮. 紫花苜蓿总黄酮的提取、纯化及其抗氧化活性研究[D]. 北京: 中国农业科学院, 2016. [23] 李洪娟. 几种耐盐植物中黄酮化合物的大孔树脂分离及抑藻活性评价[D]. 北京: 中国科学院大学, 2018. [24] Dranca F, Oroian M. Optimization of ultrasound assisted extraction of total monomeric anthocyanin(TMA) and total phenolic content(TPC) from eggplant(Solanum melongena L.) peel[J]. Ultrasonics Sonochemistry,2016,31:637−646. doi: 10.1016/j.ultsonch.2015.11.008
[25] 师婷婷. 生物酶与超滤纯化在枸杞多糖和总黄酮提取中的应用研究[D]. 甘肃: 甘肃中医药大学, 2016. [26] 张成, 胡紫薇, 罗映, 等. 紫茉莉籽黄酮响应面法优化提取及其抗氧化活性研究[J]. 中国农学通报,2019,35(34):127−133. doi: 10.11924/j.issn.1000-6850.casb20190600327 [27] 刘媛洁, 张良. 响应面法优化复合酶辅助超声波提取柚子皮总黄酮工艺[J]. 食品工业科技,2019,40(23):143−150. [28] 谢挺, 赵晖. 响应面法优化微波辅助提取菜豆总黄酮工艺及对运动大鼠心肌线粒体的影响[J]. 食品研究与开发,2020,41(12):90−95. doi: 10.12161/j.issn.1005-6521.2020.12.015 [29] Ai S, Tanabe S, Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. J Agric Food Chem,2003,51(12):3661−3667. doi: 10.1021/jf021156g
[30] Ewelina Z, Barbara B, Monika K. Antioxidant and anti-inflammatory activities of hydrolysates and peptide fractions obtained by enzymatic hydrolysis of selected heat-treated edible insects[J]. Nutrients,2017,9:970. doi: 10.3390/nu9090970
[31] 刘玉梅, 张家俊, 吴浪. 复合酶协同超声波法提取香椿老叶总黄酮工艺研究[J]. 现代食品科技,2019,35(11):223−230. [32] 钟翠娟, 王小明, 张鹏, 等. 超声波-乙醇法提取甜茶总黄酮工艺优化[J]. 安徽农业科学,2019,47(20):172−175. doi: 10.3969/j.issn.0517-6611.2019.20.046 [33] 施伟梅, 王妙飞, 罗双慧, 等. 超声联合酶法提取紫花苜蓿总黄酮及其抗氧化性能研究[J]. 作物杂志,2015(6):64−69. [34] 唐婷范, 黄芳丽, 朱家庆, 等. 超声波辅助提取葛根异黄酮的工艺优化及其抑菌活性研究[J]. 食品研究与开发,2020,41(12):30−36. doi: 10.12161/j.issn.1005-6521.2020.12.006 [35] 蒋丽施, 孟晓, 左蕾蕾, 等. 超声波辅助提取会理石榴皮中总黄酮的工艺研究[J]. 中国食品添加剂,2019,30(9):106−110. [36] 魏春红, 姜秀杰, 包鸿慧, 等. 超声波辅助提取绿豆芽总黄酮工艺及抗氧化活性研究[J]. 黑龙江八一农垦大学学报,2019,31(4):50−55. doi: 10.3969/j.issn.1002-2090.2019.04.008 [37] 赵月, 李荣, 姜子涛. 栽培菊苣籽总黄酮的提取、成分鉴定及抗氧化活性成分的识别[J]. 食品科学,2016,37(16):36−42. doi: 10.7506/spkx1002-6630-201616006 [38] 刘馨瑶, 李金秒, 张利萍, 等. 结球菊苣叶总黄酮提取工艺研究[J]. 沈阳化工大学学报,2018,32(2):161−165. doi: 10.3969/j.issn.2095-2198.2018.02.013





 下载:
下载:
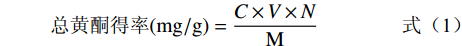

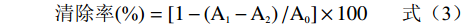









 下载:
下载:
