Effect of Formulation Composed of Maltodextrin and β-Cyclodextrin on the Quality of Spray-dried Sweet Potato Flour
-
摘要: 为提高喷雾干燥所制备出甘薯全粉的品质,本研究探讨了麦芽糊精及β-环糊精作为助干剂对产品品质的影响。通过比对麦芽糊精及β-环糊精单独及复配使用后,甘薯全粉的出粉率、营养组分及特性(色泽、粒度、流动性、水合特性、抗氧化成分以及抗氧化力)变化,得出甘薯全粉喷雾干燥的最优助干剂配方。结果表明,采用最优复合组合的添加比例为20 g/100 g麦芽糊精+4 g/100 g β-环糊精。所得产品的出粉率最高可达到61.14%,花色苷、类黄酮及总酚的保留率分别可达到69.24%、68.12%以及60.42%。本文借助喷雾干燥助干剂制备甘薯全粉,进一步为产品提升提供了技术参考。Abstract: In order to improve the quality of spray-dried sweet potato flour (SSPF), this study mainly focused on the application of maltodextrin and β-cyclodextrin during the spray-dring process. Through the comparison of flour yield, nutritious components, and characteristics (color, particle size, flowability, water holding capacity, and antioxidant capacity) of SSPF by using maltodextrin and β-cyclodextrin alone or a combination of them, the best drying agent formulation for sweet potato powder spray drying was obtained.The results showed that, the most recommended drying agent was: 20% maltodextrin + 4% β-cyclodextrin, which presented a highest flour yield of 61.14%, and highest anthocyanin, flavonoids and total phenols retention ability of 69.24%, 68.12% and 60.42%. In this paper, the dried sweet potato powder was prepared by spray drying and drying agents, which provides a technical reference for the upgrading of the products.
-
Keywords:
- sweet potato flour /
- spray drying /
- maltodextrin /
- β-cyclodextrin /
- quality
-
甘薯又名甜薯、红薯,是世界上重要的粮食作物的一种。甘薯含有丰富的营养成分,除淀粉外还有膳食纤维、维生素、矿物质等,其中维生素B1、B2的含量是大米的6倍[1]。甘薯还具有很高的药用价值,被营养学家称为营养最均衡的保健食品之一[2]。近年来甘薯产业发展趋势:甘薯深加工规模化;由生产淀粉为主向生产全粉为主转化,综合利用日渐被重视[3]。甘薯全粉是近10年新兴的一种甘薯脱水制品,其加工是集中化、规模化和高效化增值甘薯的有效途径。甘薯去皮烘干粉碎后加工成全粉,色泽美观,营养全面;可用于80%以上的甘薯食品加工,作为面包、膨化食品、馒头、汤料、冲服剂等制品的原辅料[4]。但是,由于其淀粉含量高,熟化后料液黏度大,喷雾干燥过程中能耗高且产品团聚现象严重[5]。因此,改进生产工艺对甘薯全粉的生成与应用意义重大。
本小组前期对不同助干剂对喷雾干燥甘薯全粉的影响进行了研究,发现不添加助干剂时,出粉率低,且产品质量差,添加助干剂(麦芽糊精及β-环糊精)能有效降低甘薯全粉水分含量、提高出粉率和VC保留率,改善甘薯全粉综合品质[6],本实验在喷雾干燥生产工艺确定的基础上,对助干剂的浓度、添加量等进行研究,以期对工业上助干剂的选择和用量提供一定的参考。
1. 材料与方法
1.1 材料与仪器
甘薯:紫云红芯薯 由贵州省甘薯工程中心提供;麦芽糊精(食品级) 山东西王食品有限公司;β-环糊精(食品级) 上海化学试剂公司;溴甲酚绿(分析纯) 天津东昌精细化工工贸有限公司;甲基红、氢氧化钠、甲醇、盐酸、硝酸铝、铁氰化钾、三氯乙酸等(分析纯) 成都科龙化工试剂厂;1,1-二苯基-2-苦肼基(生化试剂) 日本和光纯药试剂公司。
GYB-60-63均质机 上海东华高压均质机厂;YC-015喷雾干燥器 上海雅程仪器设备有限公司;NR110高品质电脑色差仪 深圳市三恩时科技有限公司;SHZ-Ⅲ D型循环水真空泵 上海亚荣生化试剂厂;HWS-28电热恒温水浴锅 金坛市言华仪器有限公司;BSA223S电子天平 赛多利斯科学仪器(北京)有限公司;2000 E激光粒度分析仪 英国马尔文仪器有限公司;DHG-9140电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;Hitachi S-4800扫描电子显微镜 日本HITACHI公司;SDTQ600差示热量扫描仪 美国TA Instrument公司等。
1.2 实验方法
1.2.1 甘薯全粉的制备
鲜甘薯→清洗→蒸煮(蒸馏水:甘薯6:1,蒸煮温度100 ℃,蒸煮时间25 min)→去皮→捣泥→冷却→胶体磨(2次)→不同助干剂的加入→均质(30 MPa,2次)→喷雾干燥(17 g/100 g,进风温度200 ℃,出风温度100 ℃,入料流量50 mL/min)→收集。
1.2.2 喷雾干燥助干剂添加量的确定
为了提高喷雾干燥甘薯全粉品质,本实验选用水溶性好且可食用的麦芽糊精、β-环糊精及其混合物作为助干剂,且在入料固形物质量分数为17 g/100 g,进风温度200 ℃,出风温度100 ℃下,入料流量50 mL/min的喷雾条件下,按以下方法确定助干剂添加量:
麦芽糊精添加量的确定:本实验选择麦芽糊精的添加量为甘薯泥干基占比(23.85%)的0、10%、20%、30%、40%,结果以出粉率作为评价指标。
β-环糊精添加量的确定:选择β-环糊精的添加量为甘薯泥干基占比(23.85%)的0、5%、10%、15%、20%,结果以出粉率为指标确定最佳添加量。
麦芽糊精与β-环糊精添加比例的确定:考虑到成本问题,试验以麦芽糊精为主,适量添加β-环糊精。根据前面试验先确定麦芽糊精添加量,再通过以下不同的比例确定β-环糊精的添加量,选取麦芽糊精与β-环糊精的添加比例为10:1、8:1、5:1和3:1,结果以出粉率为指标确定其最佳添加量。
出粉率(%)=(收集粉末固形物质量/干燥前进料溶液的总固形物质量)×100[7]
1.2.3 甘薯全粉基本成分的测定
水分测定:直接干燥法[8];灰分测定:高温灼烧法[8];粗蛋白测定:凯氏定氮法[8];粗脂肪测定:索氏抽提法[8];淀粉测定:酸水解-高锰酸钾滴定法[8];粗纤维测定:国标方法GB/T 5009.10-2003[9]。
1.2.4 甘薯全粉色泽的测定
本试验采用色差仪进行色泽测定和评价[7]。L*称为明度指数,L*=0表示黑色,L*=100表示白色;a*、b*代表一个直角坐标的两个方向,a*值为正值时越大,颜色越接近纯红色;a*=0时为灰色;a*为负值时绝对值越大,颜色越接近纯绿色。b*为正值时值越大,颜色越接近纯黄色;b*=0时为灰色;b*为负值时绝对值越大,颜色越接近纯蓝色。称取一定量的甘薯粉放入透明玻璃盒中,然后置于色差仪检测口处进行色泽测定。测定参数如下:
色差(ΔE)=[(L0−L∗)2+(a0−a∗)2+(b0−b∗)2]1/2 式中:L*、a*、b*:甘薯全粉的色度值;L0、a0、b0:甘薯泥的色度值。
1.2.5 甘薯全粉粒度的测定
选用通用的样品池,以0.5 g全粉悬浮于5 mL蒸馏水当中[10],用超声分散10 s,折光系数为1.54。利用光衍射法进行自动样品分析,所得结果记录为D0.1、D0.5、D0.9。
1.2.6 甘薯全粉流动性的测定
1.2.6.1 休止角的测定
甘薯全粉休止角的测定根据Zhao等[11]的方法稍作修改。将一漏斗固定于铁架台上,并垂直于坐标纸且漏斗的下端离坐标纸的高度为1 cm。称取一定量的甘薯粉缓慢倾倒入漏斗,直至粉末锥体的顶部刚好接触漏斗的下端。记录锥体直径。
休止角=arctan(H/R) 式中:H为漏斗的下端离坐标纸的高度,cm;R为粉末锥体直径,cm。
1.2.6.2 滑角的测定
甘薯全粉滑角的测定根据Ileleji等[12]的方法稍作修改。准确称取甘薯粉5.000 g,置于一长130 mm,宽100 mm的玻璃板上,缓慢举起玻璃板直至粉体表面开始滑动,记录此时玻璃板的垂直高度。
滑角=arcsin(H/L) 式中:H为倾斜玻璃板的垂直高度,cm;L为玻璃板长度,cm。
1.2.7 甘薯全粉持水力的测定
持水力的测定根据Ahmed等[13]的方法。
持水力(g/g干基)=[M2−(M1+M)]/M 式中:M1:离心管质量,g;M2:离心管+沉淀物的质量,g;M:样品质量,g。
1.2.8 甘薯全粉抗氧化物质与抗氧化能力的测定
花色苷测定使用pH示差法[14];类黄酮测定采用芦丁标准曲线法,参考Ahmed等[13]的方法;总酚含量使用福林酚法测定[15-17];DPPH自由基清除力的测定:采用Huang等[18]的方法。
1.2.9 电镜扫描
将甘薯粉样品干燥后,用导电胶粘在样品座上。把样品座置于离子溅射仪中,在样品表面蒸镀一层10~20 nm厚的铂金膜后,在2000倍的放大倍数下进行电镜观察并拍摄照片。
1.3 数据分析
用SPSS 16.0进行数据分析。方差分析(P<0.05为显著差异),用Duncan进行分析,数据以平均值 ± 标准差表示。
2. 结果与分析
2.1 助干剂添加量对甘薯粉出粉率的影响
图1显示了麦芽糊精、β-环糊精及二者不同的混合比例(10:1、8:1、5:1和3:1,w/w)分别对喷雾干燥甘薯粉出粉率的影响。随着麦芽糊精和β-环糊精添加量的增加,甘薯粉的出粉率显著提高(P < 0.05)。麦芽糊精(20 g/100 g)/β-环糊精(6.67 g/100 g)时,出粉率最高达到61.14 g/100 g。随着麦芽糊精添加量的增加,水分含量逐渐降低,一方面可能是由于麦芽糊精的添加增加了料液的总固形物含量,相对减少了水分含量[19],另一方面可能因为,助干剂的添加有助于紫薯在干燥过程中水分的损失。随着麦芽糊精添加量的增加,甘薯全粉的出粉率显著升高,这可能是由于助干剂能在甘薯全粉喷雾干燥时在其表面形成一层膜,降低了粘壁现象[20-22],从而增加了出粉率。在麦芽糊精和β-环糊精复合添加时,当麦芽糊精固定添加量为20 g/100 g,随着β-环糊精添加量的增大(从2 g增大到6.67 g),出粉率显著提高(P < 0.05)。为比较不同助干剂的全粉品质,选取出粉率没有显著性差异(P > 0.05)的一组进行后续试验,即麦芽糊精添加量30 g/100 g,β-环糊精添加量10 g/100 g,麦芽糊精(20 g/100 g)/β-环糊精(4 g/100 g)。
2.2 助干剂对甘薯粉基本成分的影响
喷雾干燥甘薯粉的基本成分见表1。添加助干剂显著降低了喷雾干燥甘薯粉的水分含量(P < 0.05),这表明助干剂在喷雾干燥过程中有助于水分流失,此结果与Valle等[23]和Quek等[19]研究结果相似。各组样品间粗脂肪和灰分含量无显著差异(P > 0.05),麦芽糊精组的淀粉含量较低,这可能是由于麦芽糊精的添加导致喷雾干燥甘薯粉中甘薯淀粉含量降低。
表 1 喷雾干燥甘薯粉的基本成分含量(%)Table 1. Proximate composition of spray-dried sweet potato flours(%)样品 水分含量 淀粉含量 粗蛋白含量 粗脂肪含量 粗纤维含量 灰分含量 对照组 8.68 ± 0.06a 75.21 ± 0.03 a 5.09 ± 0.07a 0.71 ± 0.05a 4.13 ± 0.09a 2.30 ± 0.21a β-环糊精 7.39 ± 0.10c 75.09 ± 0.57a 4.53 ± 0.20b 0.59 ± 0.08a 4.02 ± 0.10ab 2.28 ± 0.25a 麦芽糊精 7.62 ± 0.04b 74.03 ± 0.76a 4.88 ± 0.29ab 0.64 ± 0.13a 3.80 ± 0.07b 2.15 ± 0.22a 麦芽糊精/β-环糊精 7.13 ± 0.04d 74.85 ± 0.42a 4.71 ± 0.16ab 0.68 ± 0.05a 3.91 ± 0.16ab 2.20 ± 0.18a 注:不同小写字母表示同一成分不同处理之间有显著性差异(P < 0.05)。 2.3 助干剂对甘薯粉色泽的影响
由表2可知,助干剂的添加显著增加了L*值,并且显著降低了a*值(P < 0.05),麦芽糊精组的b*值显著高于其他组(P < 0.05),不同样品间的ΔE值无显著差异(P > 0.05)。这些变化可能与助干剂的添加和总酚、花色苷含量的变化有关[19, 24]。
表 2 喷雾干燥甘薯粉的色泽参数Table 2. Color parameters of spray-dried sweet potato flours样品 L* a* b* ΔΕ 对照组 68.61 ± 0.79c 18.20 ± 0.27a −12.00 ± 0.20d 44.37 ± 1.27a β-环糊精 71.83 ± 0.18b 15.55 ± 0.04c −11.02 ± 0.01c 44.67 ± 1.04a 麦芽糊精 73.04 ± 1.05a 16.04 ± 0.17b −9.80 ± 0.06a 46.82 ± 1.64a 麦芽糊精/β-环糊精 72.75 ± 0.78ab 15.29 ± 0.21b −10.73 ± 0.12b 45.46 ± 1.24a 注:标有不同小写字母表示同一参数不同处理之间有显著性差异(P < 0.05);表4同。 2.4 助干剂对甘薯粉粒度的影响
表3中D0.1、D0.5、D0.9分别表示累计分布10%、50%、90%所对应的粒径,径距 = (D0.9−D0.1)/D0.5。其中D0.5是代表粉体粘结度的平均直径。由表3可知,助干剂的添加对粉末的平均粒度有一定的影响。麦芽糊精组的全粉径距最大,而β-环糊精组的径距较小。径距表示粒度大小分布的跨度,其值越小表示粒度大小分布值范围越小和粒度大小越均一。β-环糊精组的径距值小于其他组,说明其粒度大小较均一。一般来讲,粉末粒度越小,比表面积越大;麦芽糊精/β-环糊精组和对照组的比表面积最大。
表 3 喷雾干燥甘薯粉的粒度大小Table 3. The particle size of spray-dried purple sweet potato flours体积粒径 对照组 β-环糊精 麦芽糊精 麦芽糊精/β-环糊精 D0.1(μm) 3.71 3.06 5.60 3.53 D0.5(μm) 13.71 14.61 17.77 13.92 D0.9(μm) 163.58 69.17 393.93 102.33 径距span 11.66 4.52 21.85 7.10 比表面积(m2/g) 0.76 0.87 0.50 0.77 2.5 助干剂对甘薯粉粉体流动性的影响
休止角和滑角通常被用于描述粉末的流动性。由图2可知,助干剂的添加提高了粉末的流动性,整体表现为较低的休止角和滑角值。休止角反映了物料的内摩擦特性和散落性能,而滑角反映了物料的表面光滑度。图2中可以看出,麦芽糊精组的休止角和滑角值最低。这一数据间接反映出微观上的粉体之间的聚集程度及单个粉体的表面特性。说明麦芽糊精使颗粒更利于彼此分离及具有较好的流动性(形成的颗粒较大)。对照组粉末的流动性差可能是由于粉末淀粉颗粒被破坏的粘结区域之间的相互作用而导致粉末聚集[25]。
2.6 助干剂对甘薯粉吸湿性的影响
Halsey模型拟合如图3所示,粉末的平衡水分含量随水分活度的增加而增加,满足BET方程,Ⅲ型吸附等温线。这表明粉末和水分子的吸附相互作用小于水分子之间的相互作用。在同一平衡水分含量下,样品水分活度大小为对照组 < β-环糊精 < 麦芽糊精 < 麦芽糊精/β-环糊精,但无显著差异。在同一水分活度下,对照组的平衡水分含量最高,说明助干剂的添加可降低喷雾干燥甘薯粉的吸湿性,这与Ahmed等[13]对α-淀粉酶和麦芽糊精进行喷雾干燥甘薯粉的实验结果一致。
2.7 助干剂对甘薯粉水合特性的影响
如图4所示,持水性随着浸泡时间的增加而增加。不同样品之间持水力的大小为对照组 > β-环糊精 > 麦芽糊精/β-环糊精 > 麦芽糊精,这是由于对照组中甘薯粉的淀粉颗粒结构破坏程度较高[26],而麦芽糊精能在液滴表面形成膜从而降低颗粒的表面黏度,能保护淀粉颗粒,因此麦芽糊精组甘薯粉的持水力最低[20-22]。
2.8 助干剂对甘薯粉抗氧化成分的影响
新鲜甘薯中抗氧化成分的含量分别为花色苷44.28 mg/100 g(干基),类黄酮1.217 g/100 g(干基)和总酚2.504 g/100 g(干基)。如表4所示,麦芽糊精组的花色苷含量显著高于其他组(P < 0.05),但花色苷依旧损失了14.57%,这可能是由于喷雾干燥过程中花色苷成分的热降解和氧化所致[13-14]。不同助干剂对花色苷的保护效果为麦芽糊精 > 麦芽糊精/β-环糊精 > β-环糊精,这可能是由于在喷雾干燥过程中,麦芽糊精在液滴表面形成膜[20-22],从而保护花色苷不被过度氧化和热降解。
表 4 喷雾干燥甘薯粉的花色苷、类黄酮和总酚含量(干基)及其保留率Table 4. The content and retention rate of anthocyanins, flavonoids and total phenolics of spray-dried sweet potato flours样品 花色苷 类黄酮 总酚 含量(mg/100 g) 保留率(%) 含量(g/100 g) 保留率(%) 含量(g/100 g) 保留率(%) 对照组 26.48 ± 0.06b 72.25 ± 0.01b 0.67 ± 0.01b 55.06 ± 0.01c 1.39 ± 0.01b 55.50 ± 0.01c β-环糊精 22.76 ± 0.04d 57.11 ± 0.01d 0.61 ± 0.02c 55.70 ± 0.01c 1.11 ± 0.02c 49.25 ± 0.01d 麦芽糊精 31.99 ± 0.07a 85.43 ± 0.02a 0.76 ± 0.02a 89.22 ± 0.02a 1.45 ± 0.02a 82.72 ± 0.01a 麦芽糊精/β-环糊精 23.30 ± 0.04c 69.24 ± 0.01c 0.63 ± 0.02c 68.12 ± 0.01b 1.15 ± 0.02c 60.42 ± 0.01b 从表4可以看出,不同样品的喷雾干燥甘薯粉中类黄酮和总酚含量大小都为β-环糊精 < 麦芽糊精/β-环糊精 < 对照组 < 麦芽糊精。对照组中类黄酮和总酚含量较高的原因可能是由于粉末之间聚集度较高,降低了甘薯粉末与氧气的接触范围,从而阻止了类黄酮和酚类物质的降解[13]。由类黄酮和总酚的保留情况可以得知,在喷雾过程中,麦芽糊精和麦芽糊精/β-环糊精对其保护效果最好。
2.9 助干剂对甘薯粉抗氧化力的影响
如图5所示,甘薯粉甲醇提取液的DPPH自由基清除力随着样品浓度的增加而升高。但是,据Chan等[26]在不同的干燥方法对姜叶和姜茶抗氧化性能的研究发现,姜茶抗氧化能力主要取决于抗氧化成分的类型而不是其浓度大小。结合图5可知,不同样品在同一浓度下的抗氧化力大小顺序为麦芽糊精 > 对照组 > 麦芽糊精/β-环糊精 > β-环糊精,此顺序与类黄酮和总酚含量一致。和Oki等[27]研究结果一致,花色苷和总酚是甘薯中清除DPPH自由基的主要物质。
2.10 电镜扫描分析
如图6所示,对照组(图A)的颗粒不规则,有凹陷且粘结较严重,这与Tan等、Vergara等[28-29]的结果一致。这可能是由于淀粉颗粒在喷雾干燥过程中被高温破坏,且破坏的淀粉颗粒结构疏松。相反,其他组(图6B~D)颗粒表面光滑,分散性好。由此可看出助干剂的添加对淀粉颗粒具有保护作用。
3. 结论
本文研究利用喷雾干燥技术制备甘薯全粉,发现麦芽糊精及β-环糊精的添加对产品品质产生明显影响。添加助干剂后,麦芽糊精和麦芽糊精/β-环糊精能提高喷雾干燥甘薯粉的出粉率、粉体亮度、溶水指数和流动性,但是降低了甘薯粉的持水力。24 g/100 g麦芽糊精/β-环糊精的添加对抗氧化成分的保护效果低于30 g/100 g麦芽糊精但高于10 g/100 g β-环糊精,得出甘薯全粉喷雾干燥中,采用最优复合组合的添加比例为20 g/100 g麦芽糊精+4 g/100 g β-环糊精。所得产品的出粉率最高,可达到61.14%,花色苷、类黄酮及总酚的保留率分别可达到69.24%、68.12%以及60.42%。
-
表 1 喷雾干燥甘薯粉的基本成分含量(%)
Table 1 Proximate composition of spray-dried sweet potato flours(%)
样品 水分含量 淀粉含量 粗蛋白含量 粗脂肪含量 粗纤维含量 灰分含量 对照组 8.68 ± 0.06a 75.21 ± 0.03 a 5.09 ± 0.07a 0.71 ± 0.05a 4.13 ± 0.09a 2.30 ± 0.21a β-环糊精 7.39 ± 0.10c 75.09 ± 0.57a 4.53 ± 0.20b 0.59 ± 0.08a 4.02 ± 0.10ab 2.28 ± 0.25a 麦芽糊精 7.62 ± 0.04b 74.03 ± 0.76a 4.88 ± 0.29ab 0.64 ± 0.13a 3.80 ± 0.07b 2.15 ± 0.22a 麦芽糊精/β-环糊精 7.13 ± 0.04d 74.85 ± 0.42a 4.71 ± 0.16ab 0.68 ± 0.05a 3.91 ± 0.16ab 2.20 ± 0.18a 注:不同小写字母表示同一成分不同处理之间有显著性差异(P < 0.05)。 表 2 喷雾干燥甘薯粉的色泽参数
Table 2 Color parameters of spray-dried sweet potato flours
样品 L* a* b* ΔΕ 对照组 68.61 ± 0.79c 18.20 ± 0.27a −12.00 ± 0.20d 44.37 ± 1.27a β-环糊精 71.83 ± 0.18b 15.55 ± 0.04c −11.02 ± 0.01c 44.67 ± 1.04a 麦芽糊精 73.04 ± 1.05a 16.04 ± 0.17b −9.80 ± 0.06a 46.82 ± 1.64a 麦芽糊精/β-环糊精 72.75 ± 0.78ab 15.29 ± 0.21b −10.73 ± 0.12b 45.46 ± 1.24a 注:标有不同小写字母表示同一参数不同处理之间有显著性差异(P < 0.05);表4同。 表 3 喷雾干燥甘薯粉的粒度大小
Table 3 The particle size of spray-dried purple sweet potato flours
体积粒径 对照组 β-环糊精 麦芽糊精 麦芽糊精/β-环糊精 D0.1(μm) 3.71 3.06 5.60 3.53 D0.5(μm) 13.71 14.61 17.77 13.92 D0.9(μm) 163.58 69.17 393.93 102.33 径距span 11.66 4.52 21.85 7.10 比表面积(m2/g) 0.76 0.87 0.50 0.77 表 4 喷雾干燥甘薯粉的花色苷、类黄酮和总酚含量(干基)及其保留率
Table 4 The content and retention rate of anthocyanins, flavonoids and total phenolics of spray-dried sweet potato flours
样品 花色苷 类黄酮 总酚 含量(mg/100 g) 保留率(%) 含量(g/100 g) 保留率(%) 含量(g/100 g) 保留率(%) 对照组 26.48 ± 0.06b 72.25 ± 0.01b 0.67 ± 0.01b 55.06 ± 0.01c 1.39 ± 0.01b 55.50 ± 0.01c β-环糊精 22.76 ± 0.04d 57.11 ± 0.01d 0.61 ± 0.02c 55.70 ± 0.01c 1.11 ± 0.02c 49.25 ± 0.01d 麦芽糊精 31.99 ± 0.07a 85.43 ± 0.02a 0.76 ± 0.02a 89.22 ± 0.02a 1.45 ± 0.02a 82.72 ± 0.01a 麦芽糊精/β-环糊精 23.30 ± 0.04c 69.24 ± 0.01c 0.63 ± 0.02c 68.12 ± 0.01b 1.15 ± 0.02c 60.42 ± 0.01b -
[1] 王炜, 李鹏霞, 黄开红. 甘薯全粉研究进展[J]. 粮食与油脂,2009,22(1):11−13. doi: 10.3969/j.issn.1008-9578.2009.01.004 [2] 丁媛媛, 毕金峰, 木泰华, 等. 干燥技术在甘薯加工中的应用现状及前景[J]. 食品与机械,2010,26(2):155−158. [3] 徐飞, 钮福祥, 张爱君, 等. 速溶紫薯粉的加工工艺研究[J]. 江苏农业科学,2005,33(1):102−104. doi: 10.3969/j.issn.1002-1302.2005.01.039 [4] 陈芳, 彭珍, 刘嘉, 等. 麦芽糊精对喷雾干燥紫薯全粉理化性质的影响[J]. 食品工业科技,2014,35(11):134−137, 277. [5] 易佳礼. 红薯全粉加工特性及产品开发研究[D]. 长沙: 中南林业科技大学, 2018. [6] De Ramos R M Q, Siacor F D C, Taboada E B. Effect of maltodextrin content and inlet temperature on the powder qualities of spray-dried pineapple (Ananas comosus) waste extract[J]. Waste and Biomass Valorization,2020,11(7):3247−3255. doi: 10.1007/s12649-019-00651-8
[7] AOAC International. Official methods of analysis of AOAC International[M]// Official methods of analysis of AOAC International, 16th edition, 1995.
[8] 吴谋成. 食品分析与感官评定[M]. 北京: 中国农业出版社, 2006: 79-80. [9] 中华人民共和国国家质量监督检验检疫总局. GB/T 5795-2002中国标准书号[S]. 北京: 中国标准出版社, 2004. [10] Saari H, Heravifar K, Rayner M, et al. Preparation and characterization of starch particles for use in Pickering emulsions[J]. Cereal Chemistry Journal,2016,93(2):116−124. doi: 10.1094/CCHEM-05-15-0107-R
[11] Zhao X Y, Yang Z B, Gai G S, et al. Effect of superfine grinding on properties of ginger powder[J]. Journal of Food Engineering,2009,91(2):217−222. doi: 10.1016/j.jfoodeng.2008.08.024
[12] Ileleji K E, Zhou B. The angle of repose of bulk corn stover particles[J]. Powder Technology,2008,187(2):110−118. doi: 10.1016/j.powtec.2008.01.029
[13] Ahmed M, Akter M S, Lee J C, et al. Encapsulation by spray drying of bioactive components, physicochemical and morphological properties from purple sweet potato[J]. LWT - Food Science and Technology,2010,43(9):1307−1312. doi: 10.1016/j.lwt.2010.05.014
[14] Hosseinian F S, Li W, Beta T. Measurement of anthocyanins and other phytochemicals in purple wheat[J]. Food Chemistry,2008,109(4):916−924. doi: 10.1016/j.foodchem.2007.12.083
[15] 万利秀, 肖更生, 徐玉娟, 等. 甲醇提取柑橘皮总黄酮的工艺优化[J]. 安徽农业科学,2010,38(27):15087−15089. doi: 10.3969/j.issn.0517-6611.2010.27.102 [16] Andarwulan N, Batari R, Sandrasari D A, et al. Flavonoid content and antioxidant activity of vegetables from Indonesia[J]. Food Chemistry,2010,121(4):1231−1235. doi: 10.1016/j.foodchem.2010.01.033
[17] 于亚莉, 高峰, 刘静波, 等. 超声波法提取花生壳众多酚类物质的研究[J]. 食品科学,2007,28(11):257−261. doi: 10.3321/j.issn:1002-6630.2007.11.057 [18] Huang Y C, Chang Y H, Shao Y Y. Effects of genotype and treatment on the antioxidant activity of sweet potato in Taiwan[J]. Food Chemistry,2006,98(3):529−538. doi: 10.1016/j.foodchem.2005.05.083
[19] Quek S Y, Chok N K, Swedlund P. The physicochemical properties of spray-dried watermelon powders[J]. Chemical Engineering and Processing: Process Intensification,2007,46(5):386−392. doi: 10.1016/j.cep.2006.06.020
[20] Ahmed M, Akter M S, Eun J B. Impact of α-amylase and maltodextrin on physicochemical, functional and antioxidant capacity of spray-dried purple sweet potato flour[J]. Journal of the Science of Food and Agriculture,2010,90(3):494−502. doi: 10.1002/jsfa.3845
[21] Saénz C, Tapia S, Chávez J, et al. Microencapsulation by spray drying of bioactive compounds from cactus pear (Opuntia ficus-indica)[J]. Food Chemistry,2009,114:616−622. doi: 10.1016/j.foodchem.2008.09.095
[22] Cano-Chauca M, Stringheta P C, Ramos A M, et al. Effect of the carriers on the microstructure of mango powder obtained by spray drying and its functional characterization[J]. Innovative Food Science & Emerging Technologies,2005,6(4):420−428.
[23] Valle E M M D. Cyclodextrins and their uses: A review[J]. Process Biochemistry,2004,39(9):1033−1046. doi: 10.1016/S0032-9592(03)00258-9
[24] Garcia-Viguera C, Bridle P. Influence of structure on colour stability of anthocyanins and flavylium salts with ascorbic acid[J]. Food Chemistry,1999,64(1):21−26. doi: 10.1016/S0308-8146(98)00107-1
[25] Fang Z, Bhandari B. Effect of spray drying and storage on the stability of bayberry polyphenols[J]. Food Chemistry,2011,129(3):1139−1147. doi: 10.1016/j.foodchem.2011.05.093
[26] Chan E W C, Lim Y Y, Wong S K, et al. Effects of different drying methods on the antioxidant properties of leaves and tea of ginger species[J]. Food Chemistry,2009,113(1):166−172. doi: 10.1016/j.foodchem.2008.07.090
[27] Oki T, Masuda M, Furuta S, et al. Involvement of anthocyanins and other phenolic compounds in radical-scavenging activity of purple-fleshed sweet potato cultivars[J]. Journal of Food Science,2010,67(5):1752−1756.
[28] Tan Y, Zhao Y, Hu H, et al. Drying kinetics and particle formation of potato powder during spray drying probed by microrheology and single droplet drying[J]. Food Research International,2019,116:483−491. doi: 10.1016/j.foodres.2018.08.064
[29] Vergara C, Pino M T, Zamora O, et al. Microencapsulation of anthocyanin extracted from purple flesh cultivated potatoes by spray drying and its effects on in vitro gastrointestinal digestion[J]. Molecules,2020,25(3):722.





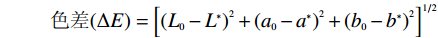
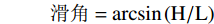
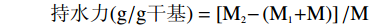

 下载:
下载:





 下载:
下载:
