Study on the Gel Properties and Taste of Three Kinds of Poultry Blood Tofu
-
摘要: 为探究不同家禽血液所制得的血豆腐之间的差异,以鸡血、鸭血和鹅血为样本,制成血豆腐后,对三种血豆腐的保水性、色差、氨基酸分析、滋味物质和微观结构等指标通过显著性差异分析并进行综合评价。结果表明三种血豆腐保水性强弱顺序为鸭血豆腐 > 鹅血豆腐 > 鸡血豆腐(P<0.05);质构分析发现鸡血豆腐比鹅血豆腐有更高的硬度、更好的弹性和咀嚼性(P<0.05),鸭血豆腐硬度、咀嚼性最高,口感最好。鸭血豆腐色泽鲜亮诱人、质构指标最优、肌苷酸含量较高,鹅血豆腐其次,鸡血豆腐综合品质最差;低场核磁结果显示,鸭血豆腐中的结合水更加稳定,不易流失,鹅血豆腐次之,鸡血豆腐中的弱结合水的结合性较低,更容易流失;电子舌结果表明,鸭血豆腐鲜味值更显著,鹅血豆腐咸味更明显,鸡血豆腐在酸味和鲜味丰富性较差;微观结构结果表明,鸭血豆腐具有均一的网络结构,能够更加有效地锁住水分。结果表明鸭血是制造血豆腐的最佳材料。以上研究可为家禽血资源的综合利用提供理论支持。Abstract: To explore the difference of blood tofu made from different poultry blood, in this paper, different blood tofu was made from chicken, duck and goose blood. The indexes of water holding capacity(WHC), color difference, amino acid analysis, flavor substance and microstructure of three kinds of blood tofu were analyzed and evaluated by their significant differences. The results showed that the order of WHC of the three kinds of blood tofu was duck blood tofu>goose blood tofu>chicken blood tofu (P<0.05).Texture analysis found that chicken blood tofu had higher hardness, better elasticity and chewiness than goose blood tofu (P<0.05).Duck blood tofu had the highest hardness, chewiness, and taste.In addition, duck blood tofu presented bright and attractive, with the best texture index and high inosinic acid content. Goose blood tofu second, chicken blood tofu has the worst comprehensive quality. The low-field NMR results showed that the bound water in duck blood tofu was more stable and not easy to lose, followed by goose blood tofu, and weakly bound water in chicken blood tofu was less bound and easier to lose.The results of the electronic tongue showed that duck blood tofu had a more significant umami value.Goose blood tofu had a more salty taste, and chicken blood tofu was less rich in sourness and umami.The microstructure results showed that duck blood tofu had a uniform network structure which could lock moisture more effectively.Duck blood was the best raw material for making blood tofu. The above research can provide theoretical support for the comprehensive utilization of poultry blood resources.
-
Keywords:
- chicken blood /
- duck blood /
- goose blood /
- blood tofu /
- gel properties /
- taste
-
我国是家禽养殖大国,2018年我国出栏肉鸡共计89.3亿只,鸡血占体重约6%;同年,我国肉鸭出栏44.3亿只,鸭血占全鸭质量的3%~5%;我国肉鹅年饲养量约8亿只,占全球总量的40%,其中鹅血体重占比约5%[1-3]。我国有丰富的家禽血资源,其血液中富含蛋白质、血红素铁、无机盐及多种微量元素和磷脂等[4]。家禽血液能够显著改善吸收障碍性贫血和缺铁性贫血,预防动脉粥样硬化[5]。鸡血富含矿物质和蛋白质,是最理想的补血佳品之一[1]。鸭血具有补血及清热解毒的功效,有较高的营养和保健价值[2]。鹅血的营养价值极高,其蛋白质含量高达19%,并且含有多种生理活性物质[6]。目前,我国家禽血液的利用率不高,可供人类食用的产品不多。很多小型加工企业直接丢弃,造成了严重的环境污染。血豆腐加工简单,是合理利用家禽血液的良好途径。
家禽血豆腐是人们日常生活中常见的血液制品,由于人们日常饮食的习惯,市场上家禽血豆腐制品主要是鸭血,关于血豆腐的相关研究也主要集中在鸭血豆腐上,对鸡血和鹅血豆腐的研究较少。王斌[7]研究发现在鸭血豆腐中添加谷氨酰胺转氨酶可提高鸭血豆腐的持水性、焦灼性和内聚性;姚星星[8]对盒装鸡血豆腐品质的稳定性进行了研究;伍梦婷等[6]研究了木薯改性淀粉对鹅血凝胶特性的影响,发现对鹅血添加木薯改性淀粉后能够显著提高鹅血的凝胶特性。目前还未有文献对鸡、和鹅血豆腐的品质优劣进行整体的评价。因此本文以鸡鸭鹅血为样本,分别制成血豆腐后从保水性、色差、质构、低场核磁及滋味物质等指标进行研究,以期为家禽血资源的合理利用提供理论支持。
1. 材料与方法
1.1 材料与仪器
鸡、鸭、鹅 购自南京市孝陵卫菜市场,带回实验室现杀取血;柠檬酸三钠、无水氯化钙、高氯酸 均为国产分析纯,购自国药集团化学试剂有限公司;磷酸二氢钾(色谱级)、甲醇(色谱级) 赛默飞世尔科技有限公司;腺苷酸(AMP)、肌苷酸(IMP)、鸟苷酸(GMP)标准品 纯度均为99%,Sigma公司。
T-25型数显匀浆机 德国IKA;EVO-LS10扫描电镜 德国ZEISSE Oberkochen;Centrifuge 5810 R离心机 德国Eppendorf;TVT300XP 质构仪 瑞典TexVol;PTX-FA210S电子天平 福州华志科学仪器;HH-4数显恒温水浴锅 常州国华;Alpha 1-2 LD plus实验室型冻干机 德国 Christ;Direct-Q3uv超纯水机 美国Millipore;DF-101S即热式磁力搅拌器 上海吉众;ST20便携式pH计 美国奥豪斯;NMR PQ001低场核磁共振分析仪 上海纽迈;ASTREE电子舌检测系统 法国Alpha M.O.S;CR-400色彩色差计 日本柯尼卡美能达;Waters e2695高效液相色谱仪 美国Waters。
1.2 实验方法
1.2.1 家禽血豆腐的制作
实验室自制,0.5 g/100 mL Na3C6H5O7作为抗凝剂,将鸡血、鸭血和鹅血中加入Na3C6H5O7后用玻璃棒于室温下搅拌30 s,再加入一定量纯水控制血水比1:1.2(v/v),取15 mL家禽血与抗凝剂的混合液,加入1 mL1%无水CaCl2与原料血用玻璃棒于室温下搅拌30 s;凝血时间为10 min,凝固后于90 ℃水浴锅中加热30 min,制成家禽血豆腐,再立即用冷水冷却,置于4 ℃的冰箱保存。
1.2.2 离心损失的测定
参考Xue等[9]的方法,精确称取3 g之前制得的家禽血豆腐置于10 mL离心管中,放入离心机在转速4000 r/min的条件下离心5 min后,取出称取离心后的家禽血豆腐的质量。根据公式(1)计算离心损失,每种样品采样3次,取其平均值。
离心损失(%)=m1−m2m1×100 (1) 式中:m1为离心前家禽血豆腐的质量/g,m2为离心后家禽血豆腐的质量/g。
1.2.3 蒸煮损失的测定
参考Yang等[10]的方法,并稍作修改。精确称取3 g家禽血豆腐于10 mL试管中,然后放入90 ℃恒温水浴锅中水浴10 min。室温冷却后取出血豆腐称量蒸煮后鸭血的质量。根据公式(2)来计算蒸煮损失,每种样品采样3次,取其平均值。
蒸煮损失(%)=m3−m4m3×100 (2) 式中:m3为蒸煮前家禽血豆腐的质量/g,m4为蒸煮后家禽血豆腐的质量/g。
1.2.4 析水率的测定
参考孙月萍等[11]的方法,并稍作修改。精确称取3 g家禽血豆腐放入平皿,将其均匀切成4块后放入4 ℃冰箱中保存48 h。取出用滤纸吸收家禽血豆腐表面水分后称取重量。根据公式(3)计算析水率,每种样品采样3次,取其平均值。
析水率(%)=m5−m6m5×100 (3) 式中:m5为析水前家禽血豆腐的质量/g,m6为析水后家禽血豆腐的质量/g。
1.2.5 色泽的测定
参考李鹏等[12]的方法,并稍作修改。将制得的家禽血豆腐切片成长、宽、厚为4 cm× 4 cm×1 cm的血豆腐片,使用色差计测定新鲜家禽血豆腐切面的颜色。L*表示亮度值、a*表示红度值、b*表示黄度值。每种样品采样5次,取其平均值。
1.2.6 质构的测定
参考Hu等[13]的方法,并稍作修改。将质构仪调成TPA模式进行测定分析,设定测定参数为:探头型号P36R,压缩比50%,测前速率2.0 mm/s、测中速率1.0 mm/s、返回速率5.0 mm/ s,2次下压间隔时间3 s,触发力Auto-5g。每种样品重复测定3次,取其平均值。
1.2.7 低场核磁的测定
使用台式脉冲NMR分析仪上进行NMR弛豫测量。测试条件及参数参考Wang等[14]和Han等[15]的方法并加以修改:测量温度32 ℃,质子共振频率22.6 MHz。将直径15 mm的核磁管中放入2 g的家禽血豆腐,然后进行水浴加热,以1 ℃/min的速度将家禽血豆腐样品从20 ℃升温至80 ℃,在80 ℃保温20 min后从水浴锅中取出迅速放入冰中冷却,于4 ℃环境下冷却24 h,然后进行低场NMR测定。使用参数为:r值200 μs,重复扫描32次,重复时间6.5 s,取得12000回波自旋驰像时间T2,用CMPG序列进行测量,每组3次重复。
1.2.8 氨基酸组成分析
将20 mg家禽血豆腐蛋白样品溶解于6 mol/L的盐酸溶液中,在110 ℃条件下水解24 h,再将水解产物放置于氨基酸自动分析仪测定家禽血豆腐的氨基酸组成。
1.2.9 HPLC测定家禽血豆腐核苷酸含量
采用高效液相色谱法测定家禽血豆腐中的5’-肌苷酸(IMP),5’-腺苷酸(AMP)和5’-鸟苷酸(GMP)含量。参考杨肖等[16]的方法并稍加修改,精确称取5 g家禽血豆腐于100 mL离心管中,加入10 mL浓度为5%的高氯酸溶液,冰浴条件下使用均质机对其进行均质。然后用5 mL浓度为5%的高氯酸溶液冲洗均质器,洗液与均质液混合后放至离心机于4 ℃,5000 r/min条件下离心10 min。将上清液取出保存,沉底物加入5 mL浓度为5%的高氯酸溶液,以上述方法再次均质并离心,合并两次上清液。将上清液使用氢氧化钾溶液调节pH至5.5,用去离子水定容至50 mL备用,进样时过0.22 μm水相滤膜后进行HPLC分析。
HPLC主要参数:C18(5 μm,4.6 mm×250 mm)反相色谱柱,柱温25 ℃,紫外检测器(254 nm)。流动相A:0.05 mol/L pH为5.5的磷酸氢二钾缓冲液,流动相B:甲醇,流动相经0.22 μm滤膜过滤后于室温下超声脱气30 min。
洗脱程序:等度洗脱,流动相A:97%,流动相B:3%,洗脱时间10 min。
标准曲线:5’-GMP:y=15702x − 1381.5,R2= 0.9999;5’-IMP:y=11031x+7177.9,R2=0.9998;5’-AMP:y=15036x−1603,R2=0.9999。
1.2.10 电子舌分析滋味特征
参考Zaukuu等[17]的方法,使用法国Alpha M.O.S公司的ASTREE电子舌检测系统对家禽血豆腐样品进行滋味分析,此系统配备1个Ag/AgCl参比电极和自动采样器,传感阵列浸没家禽血豆腐样品溶液,于平衡态获取响应信号进行统计分析。系统中各个不同的传感器对家禽血豆腐中的酸、甜、鲜、苦、咸等滋味物质进行检测。在采集数据前进行电子舌检测系统自检、诊断、校正等程序,以保证电子舌的传感器响应信号的稳定性和可靠性,电子舌检测系统的工作温度保持在25 ℃。精确称取家禽血豆腐4 g,加入50 mL超纯水对样品进行均质,然后于4 ℃下12000 r/min离心10 min,取30 mL上清液加超纯水定容至1000 mL后待测。将待测液倒入100 mL烧杯,使用待测液与超纯水交替进行的模式进行数据采集,每个样品采集120 s,取120 s时的数据作为特征值进行分析。
1.2.11 血豆腐微观结构的测定
参考Fan等[18]的方法,将家禽血豆腐样品切成5 mm×2 mm×2 mm的薄片,3%戊二醛固定,乙醇梯度洗脱后冷冻干燥,再经离子溅射仪真空干燥,金粉喷镀,再放入电子显微镜样品台调节电镜加速电压,对样品进行扫描观测摄图。
1.2.12 数据处理
上述每组实验均重复三次,数据以“平均值 ± 标准差”表示。采用软件SPSS 18.0对数据进行统计分析,P < 0.05表示两组数据差异显著。使用Origin 9.0作图。
2. 结果与分析
2.1 三种家禽血豆腐的保水性分析
家禽血豆腐的保水性是指家禽血液中水化后的蛋白胶体束缚水的能力,主要通过毛细管作用和蛋白水合作用把水分拦截于凝胶体系中,保水性影响着家禽血豆腐的色、香、味、嫩度、多汁性和营养成分等食物品质,所以保水性是体现蛋白凝胶稳定性的重要参数[19]。本文以蒸煮损失、离心损失和失水率来体现三种家禽血豆腐的保水性。由表1可知,鸭血豆腐经离心过后的离心损失最低为11.56%,其次是鹅血豆腐的12.94%,鸡血豆腐的离心损失最大,三者均差异显著(P < 0.05);蒸煮损失的数据与离心损失类似,三者均差异显著(P < 0.05),鸭血豆腐的蒸煮损失最小为4.44%,其次是蒸煮损失为6.78%的鹅血豆腐,鸡血豆腐的蒸煮损失最大(8.22%);三种家禽血豆腐的析水率均有显著差异(P < 0.05),最低的是鸭血豆腐,其次是鸡血豆腐,析水率最高的是鹅血豆腐。以上数据表明,鸭血豆腐的各项保水性指标均明显优于鸡血和鹅血豆腐,其保水性最强。其次是鹅血豆腐,鹅血豆腐在离心损失和蒸煮损失这两项指标上优于鸡血豆腐,但其析水率远远大于鸡血豆腐。已有文章提出,家禽血豆腐的保水性与其凝胶形成的网络结构有关,凝胶网络越致密,越均匀,网络结构越均一则凝胶体系的保水性越好[20]。因此,三种家禽血豆腐的保水性差异可能是由于其凝胶结构不同,鸭血豆腐形成的凝胶体系稳定性强,孔隙大小均一,而鸡血豆腐和鹅血豆腐的凝胶体系不稳定,结构松散不均一导致其水分容易流失,保水性能较差。
2.2 色差分析
色泽是消费者购买和食用血豆腐时辨别血豆腐辨别血豆腐质量好坏的重要指标之一,其中L*和a*对人的感官影响更为强烈,可作为评价家禽血豆腐的主要参照指标[21]。由表2可知,鸡血豆腐和鹅血豆腐的L*值分别为31.42和31.92,两者差异不显著(P > 0.05),鸭血豆腐的L*值为32.49,显著高于鸡血和鹅血豆腐(P < 0.05);家禽血豆腐的a*值由高到低分别为鹅血、鸭血和鸡血豆腐(13.70、12.28、11.66),且三者之间差异显著(P < 0.05),说明鹅血豆腐颜色更加深红;在b*值方面,三种家禽血豆腐之间差异显著(P < 0.05),鸭血豆腐的b*值最高,鸡血豆腐最低。数据表明,鸭血豆腐在亮度和黄度方面优于其他两种家禽血豆腐,而鹅血豆腐红度略优,说明鹅血豆腐颜色更加深红,鸡血豆腐的颜色比较暗沉,鸭血豆腐的颜色则更加鲜亮,呈鲜红色,从外表上更加诱人。因为鸭血豆腐更加稳定的蛋白凝胶网络能够结合更多水分,使其对血红蛋白产生一定的保护作用,从而呈现鲜艳的颜色[22]。
表 2 鸡血、鸭血和鹅血豆腐的色泽比较Table 2. Color comparison of chicken, duck and goose blood tofu种类 L* a* b* 鸡血豆腐 31.42 ± 0.12b 11.66 ± 0.13c 6.39 ± 0.11c 鸭血豆腐 32.49 ± 0.06a 12.48 ± 0.35b 9.16 ± 0.05a 鹅血豆腐 31.92 ± 0.42b 13.70 ± 0.13a 7.86 ± 0.21b 表 4 鸡血、鸭血和鹅血豆腐的氨基酸含量Table 4. Amino acid content of chicken, duck and goose blood tofu氨基酸(g/100 g) 鸡血豆腐 鸭血豆腐 鹅血豆腐 天门冬氨酸(Asp) 7.02 ± 0.01a 7.12 ± 0.07a 6.67 ± 0.16b 苏氨酸(Thr) 3.98 ± 0.01a 3.55 ± 0.03b 3.42 ± 0.08c 丝氨酸(Ser) 2.94 ± 0.03a 3.33 ± 0.02b 2.98 ± 0.07a 谷氨酸(Glu) 8.72 ± 0.01a 8.42 ± 0.08a 8.07 ± 0.20b 甘氨酸(Gly) 3.15 ± 0.01a 3.20 ± 0.03a 2.99 ± 0.07b 丙氨酸(Ala) 6.00 ± 0.03a 6.83 ± 0.03b 6.18 ± 0.13a 胱氨酸(Cys) 0.99 ± 0.01a 0.82 ± 0.01b 0.91 ± 0.02c 缬氨酸(Val) 5.08 ± 0.01a 5.37 ± 0.02b 5.12 ± 0.11a 蛋氨酸(Met) 1.18 ± 0.02a 1.23 ± 0.01a 0.87 ± 0.01b 异亮氨酸(Ile) 3.02 ± 0.02a 2.87 ± 0.02b 2.61 ± 0.04c 亮氨酸(Leu) 8.55 ± 0.06a 8.71 ± 0.02a 8.19 ± 0.17b 酪氨酸 (Tyr) 2.78 ± 0.02a 2.64 ± 0.02b 2.37 ± 0.06c 苯丙氨酸(Phe) 4.73 ± 0.03a 5.15 ± 0.12b 4.92 ± 0.02c 赖氨酸(Lys) 6.89 ± 0.04a 7.20 ± 0.07b 6.79 ± 0.16a 氨(NH3) 1.07 ± 0.05a 1.07 ± 0.03a 0.99 ± 0.05a 组氨酸 (His) 4.27 ± 0.03a 4.69 ± 0.01b 4.38 ± 0.10c 精氨酸 (Arg) 4.50 ± 0.03a 4.37 ± 0.04a 4.03 ± 0.10b 脯氨酸 (Pro) 2.95 ± 0.01a 2.69 ± 0.03b 2.56 ± 0.06c 合计 78.22 ± 0.26a 78.87 ± 0.47a 74.51 ± 1.68b 2.3 三种家禽血豆腐的质构特性
食物的质构特性影响它的口感和嫩度,质构常用的指标包括硬度、弹性和咀嚼性等。适量的咀嚼性有利于增加血豆腐的口感,但是如果超过了合适的范围,则会对其口感产生不利的作用[23]。表3显示的是三种家禽血豆腐的质构比较,从表中可知,三种家禽血豆腐的硬度有显著差异(P < 0.05),最高的是鸭血豆腐,其次是鸡血豆腐,鹅血豆腐的硬度最低,鹅血豆腐的硬度比鸭血和鸡血豆腐的硬度分别低49.70%及22.97%;这三种家禽血豆腐中,鸡血豆腐的弹性最高,其次是鸭血豆腐,鹅血豆腐的弹性最低,鸡血豆腐和鸭血豆腐的弹性分别比鹅血高72.04%及45.97%,三者间有显著性差异(P < 0.05);三种家禽血豆腐的咀嚼性由低到高分别是鹅血、鸡血和鸭血豆腐,鹅血豆腐的咀嚼性显著低于鸡血豆腐(P < 0.05),鸭血豆腐的咀嚼性与鸡血豆腐无显著性差异(P > 0.05)。由上述数据可知,这三种家禽血豆腐在质构方面,鸭血豆腐的各项指标最优,但弹性略低于鸡血豆腐,鹅血豆腐的各项质构指标差于其他两种家禽血豆腐。血豆腐的感官品质与其质构结果高度相关,硬度、弹性和咀嚼性对家禽血豆腐的品质有很大影响[24]。硬度是评价家禽血豆腐凝胶强度的主要指标,鸭血豆腐的硬度值最大,表明其蛋白凝胶的网络结构稳定,抗形变能力强,提升了它的感官品质。弹性和咀嚼性能够赋予家禽血豆腐独特的口感,而且对其外观和储藏性也有很大的影响。鸭血豆腐最佳的硬度、较好的弹性和咀嚼性表明其在三种家禽血豆腐中有最好的感官品质及耐储藏性。
表 3 鸡血、鸭血和鹅血豆腐的质构特性比较Table 3. Comparison of the texture properties of chicken, duck and goose blood tofu种类 硬度(g) 弹性(N) 咀嚼性(N) 鸡血豆腐 426.11 ± 16.30b 3.63 ± 0.11a 2.50 ± 0.08a 鸭血豆腐 652.49 ± 9.17a 3.08 ± 0.12b 2.53 ± 0.13a 鹅血豆腐 328.25 ± 5.09c 2.11 ± 0.09c 2.21 ± 0.09b 2.4 三种家禽血豆腐的低场核磁共振性质
在热加工条件下,蛋白质之间可能会在分子相互作用力影响下产生相互作用,从而影响家禽血豆腐的最终凝胶结构,且凝胶结构与毛细管水的存在直接相关[25]。图1中,3种家禽豆腐的低场NMR T2弛豫时间分布为4个峰,所对应T2弛豫时间段可能对应水四种状态,分别是蛋白质结合水(T2b)、乳化层水(T2b–1)、不易流动水(T21)以及自由水(T22)。在0~8.21 ms(T2b,T2b–1)出现两个小峰,代表强弱结合水,59~250 ms(T21)出现的峰是主峰,代表蛋白凝胶网络中的不易流动水,725~723 ms(T22)出现的峰代表了三种家禽血豆腐蛋白凝胶网络之外的自由水。图中不易流动水和自由水的峰面积占总峰面积的90%以上。由图1可知,三种家禽血豆腐的T2弛豫时间分布峰形基本一致,但鹅血和鸡血豆腐的T21弛豫时间后移,说明在储藏过程中结合水与大分子物质之间作用力的强度不同。根据仪器的分析原理,T2坐标右移,说明对应的水分流动性增强,结合性减弱[26]。说明鸭血豆腐中的结合水更加稳定,不易流失,鹅血豆腐次之,鸡血豆腐右移更多,说明鸡血豆腐中的弱结合水的结合性较低,更容易流失。可能鸭血豆腐蛋白凝胶网络具有更加精细的氢键网络和疏水相互作用,形成了更好的保水性。影响血豆腐保水性的水大部分是不易流动水,能够通过位阻效应或者吸引结合水而保持[27]。加热后,有些固定水变成了自由水,这与烹饪损失有关[28]。袁乙平等[29]的研究也从水分分布的角度证实低场核磁性质与凝胶稳定性有关。
2.5 三种家禽血豆腐氨基酸含量
根据表4三种家禽血豆腐的氨基酸含量结果分析可知,三种家禽所制得的血豆腐氨基酸组成基本相似,鸭血豆腐的氨基酸总量最高,其次是鸡血豆腐,鹅血豆腐最低。鸡血、鸭血和鹅血豆腐中,必需氨基酸的含量分别占总量的41.23%、41.65%和34.72%。根据FAO/ WHO理想模式,必需氨基酸/总氨基酸含量为超过40%时,是氨基酸模式中的优质蛋白质[30],可知鸡血与鸭血豆腐蛋白为符合FAO/ WHO理想模式标准的优质蛋白质。谷氨酸含量在三种家禽血豆腐中所占氨基酸总量比例最大,分别为11.15%、10.68%和10.83%。谷氨酸在生物体蛋白质代谢中起到了至关重要的作用,作用于食品能够显著提升其鲜味。另外,三种家禽血豆腐中的天冬氨酸、丙氨酸、苯丙氨酸、丝氨酸和丙氨酸等呈味氨基酸含量也比较高,这些氨基酸为家禽血豆腐提供了独特的滋味。呈味氨基酸在鸡血、鸭血和鹅血豆腐中的含量分别为78.22、78.87和74.51 g/100 g。鸭血豆腐的呈味氨基酸在三种家禽血豆腐中含量最高,可能其将因此而呈现更多的鲜味。
2.6 三种家禽血豆腐中核苷酸的含量
核苷酸是主要的鲜味物质之一,具有代表性的鲜味核苷酸主要为5’-肌苷酸(IMP)、5’-腺苷酸(AMP)和5’-鸟苷酸(GMP),科研常用C18反相色谱柱法测定核苷酸[31]。由表5可以看出三种家禽血豆腐含量最高的都是5’-IMP,鹅血豆腐的5’-GMP和5’-IMP含量均显著高于鸭血豆腐及鸡血豆腐(P < 0.05);鸭血豆腐的5’-AMP含量在三种家禽血豆腐中含量最高,且显著高于鹅血豆腐及鸡血豆腐(P < 0.05)。此外,鲜味氨基酸如谷氨酸钠和核苷酸之间具有协同作用,可增强食物的鲜味,王天泽等[32]的研究表明,5’-IMP可与丝氨酸、谷氨酸、丙氨酸等甜味氨基酸产生协同作用,使得食品更加鲜美。因此5’-IMP含量较高的鸭血和鹅血豆腐可能会和血豆腐中的呈味氨基酸产生协同作用,促进其鲜味。
表 5 鸡血、鸭血和鹅血豆腐中3种核苷酸含量Table 5. The contents of three nucleotides in chicken, duck and goose blood tofu核苷酸 鸡血豆腐(μg/g) 鸭血豆腐(μg/g) 鹅血豆腐(μg/g) 5’-GMP 12.59 ± 0.56c 68.41 ± 2.33b 87.87 ± 3.12a 5’-IMP 24.83 ± 1.05c 88.34 ± 1.96b 113.09 ± 0.96a 5’-AMP 19.71 ± 0.83c 80.75 ± 1.15a 74.72 ± 1.09b 2.7 电子舌分析三种家禽血豆腐的滋味特征
采用电子舌的传感器分别测定鸡鸭鹅血豆腐的酸味、苦味、涩味、回味A、回味B、鲜味、鲜味丰富性和咸味8组滋味指标,其结果如表6所示,在苦味、鲜味及咸味上三者之间有显著差异(P < 0.05),鸡血豆腐在酸味数值上显著低于鸭血豆腐(P < 0.05),而鸭血和鹅血豆腐之间差异不显著(P > 0.05),三种血豆腐的涩味值由高到低分别是鹅血、鸡血和鸭血豆腐,鹅血豆腐的涩味显著高于鸡血和鸭血豆腐(P < 0.05),鸭血豆腐的鲜味显著高于鹅血及鸡血豆腐(P < 0.05),说明鸭血豆腐比其他两种血豆腐鲜味更浓,而鹅血豆腐则显得更咸更苦,而鸡血豆腐在酸味和鲜味丰富性较差。影响家禽血豆腐鲜味的主要成分是呈味核苷酸(5’-GMP、5’-AMP及5’-IMP)和鲜味氨基酸[33],由于鸭血豆腐中的鲜味氨基酸及鲜味核苷酸总含量高于其他两种血豆腐,使其拥有更高的鲜味值,这与氨基酸分析及核苷酸含量测定结果一致。
表 6 鸡血、鸭血和鹅血豆腐电子舌滋味响应强度Table 6. Electronic tongue taste response intensity of chicken, duck and goose blood tofu组别 酸味 苦味 涩味 回味B 回味A 鲜味 鲜味丰富性 咸味 基准 –13.00 0.00 0.00 0.00 0.00 0.00 0.00 –6.00 鸡血豆腐 –47.24 ± 0.02a 9.54 ± 0.18a 0.65 ± 0.03a –1.12 ± 0.04ab –0.36 ± 0.01a 13.79 ± 0.25a 3.93 ± 0.21ab –2.04 ± 0.12a 鸭血豆腐 –48.93 ± 0.05b 9.68 ± 0.05b 0.43 ± 0.01a –1.11 ± 0.01b –0.43 ± 0.01b 14.37 ± 0.64b 4.18 ± 0.12a –1.63 ± 0.09b 鹅血豆腐 –47.72 ± 0.02a 10.30 ± 0.09c 1.43 ± 0.01b –1.21 ± 0.03a –0.42 ± 0.03b 13.47 ± 0.23c 3.71 ± 0.13b –3.34 ± 0.03c 2.8 三种家禽血豆腐的微观结构分析
由图2可以观察到鸡血豆腐由纤维蛋白形成了错综复杂的凝胶体系,呈网状结构,有连片现象,杂乱无序、孔径较大。这种粗糙不稳定的网状结构易造成鸡血豆腐凝胶硬度和弹性较差,保水效果较差,极大影响其口感;鸭血豆腐样品的表面平整,蛋白质较好地结合在自身形成的凝胶网络中,网络支架大小均一,这种均一的网络结构能够更加有效地锁住水分,减少鸭血豆腐的水分流失,同时也增加了鸭血豆腐的稳定性,不易变形,使其硬度和弹性显著提升,口感更佳[7]。鹅血豆腐在放大3000倍时呈现出错综复杂的网状结构,这种不规则的凝胶体系容易导致水分渗漏,进而对质构产生影响。蛋白凝胶网络劣变会降低其持水性,弱化蛋白凝胶与水的结合能力,从而产生大量的蒸煮损失,使水分发生迁移[34],最终导致家禽血豆腐品质的下降,这与本文所测得的蒸煮损失和低场核磁结果一致。
3. 结论
本研究对鸡血、鸭血和鹅豆腐的凝胶特性和滋味物质含量等指标进行了比较,结果表明鸭血豆腐的保水性优于其他两种血豆腐,色泽更加鲜亮,质构最佳,耐储藏性更好。鹅血和鸡血豆腐的T2弛豫时间右移,对应的水分流动性增强,结合性减弱,该结果进一步表明鸭血豆腐保水性更强,凝胶体系更稳定。氨基酸分析、高效液相色谱及电子舌结果表明,鸭血豆腐比其他两种血豆腐滋味更佳。
综上所述,鸭血豆腐在各指标均优于鸡、鹅血豆腐,具有更优质的口感。但由于市场上的家禽血豆腐需求量较大,后续可进一步研究并改善鹅血豆腐及鸡血豆腐品质,以提高血豆腐的产量及其他家禽类血液的利用率。
-
表 1 鸡血、鸭血和鹅血豆腐的保水性比较
Table 1 The comparison WHC of chicken, duck and goose blood tofu
表 2 鸡血、鸭血和鹅血豆腐的色泽比较
Table 2 Color comparison of chicken, duck and goose blood tofu
种类 L* a* b* 鸡血豆腐 31.42 ± 0.12b 11.66 ± 0.13c 6.39 ± 0.11c 鸭血豆腐 32.49 ± 0.06a 12.48 ± 0.35b 9.16 ± 0.05a 鹅血豆腐 31.92 ± 0.42b 13.70 ± 0.13a 7.86 ± 0.21b 表 4 鸡血、鸭血和鹅血豆腐的氨基酸含量
Table 4 Amino acid content of chicken, duck and goose blood tofu
氨基酸(g/100 g) 鸡血豆腐 鸭血豆腐 鹅血豆腐 天门冬氨酸(Asp) 7.02 ± 0.01a 7.12 ± 0.07a 6.67 ± 0.16b 苏氨酸(Thr) 3.98 ± 0.01a 3.55 ± 0.03b 3.42 ± 0.08c 丝氨酸(Ser) 2.94 ± 0.03a 3.33 ± 0.02b 2.98 ± 0.07a 谷氨酸(Glu) 8.72 ± 0.01a 8.42 ± 0.08a 8.07 ± 0.20b 甘氨酸(Gly) 3.15 ± 0.01a 3.20 ± 0.03a 2.99 ± 0.07b 丙氨酸(Ala) 6.00 ± 0.03a 6.83 ± 0.03b 6.18 ± 0.13a 胱氨酸(Cys) 0.99 ± 0.01a 0.82 ± 0.01b 0.91 ± 0.02c 缬氨酸(Val) 5.08 ± 0.01a 5.37 ± 0.02b 5.12 ± 0.11a 蛋氨酸(Met) 1.18 ± 0.02a 1.23 ± 0.01a 0.87 ± 0.01b 异亮氨酸(Ile) 3.02 ± 0.02a 2.87 ± 0.02b 2.61 ± 0.04c 亮氨酸(Leu) 8.55 ± 0.06a 8.71 ± 0.02a 8.19 ± 0.17b 酪氨酸 (Tyr) 2.78 ± 0.02a 2.64 ± 0.02b 2.37 ± 0.06c 苯丙氨酸(Phe) 4.73 ± 0.03a 5.15 ± 0.12b 4.92 ± 0.02c 赖氨酸(Lys) 6.89 ± 0.04a 7.20 ± 0.07b 6.79 ± 0.16a 氨(NH3) 1.07 ± 0.05a 1.07 ± 0.03a 0.99 ± 0.05a 组氨酸 (His) 4.27 ± 0.03a 4.69 ± 0.01b 4.38 ± 0.10c 精氨酸 (Arg) 4.50 ± 0.03a 4.37 ± 0.04a 4.03 ± 0.10b 脯氨酸 (Pro) 2.95 ± 0.01a 2.69 ± 0.03b 2.56 ± 0.06c 合计 78.22 ± 0.26a 78.87 ± 0.47a 74.51 ± 1.68b 表 3 鸡血、鸭血和鹅血豆腐的质构特性比较
Table 3 Comparison of the texture properties of chicken, duck and goose blood tofu
种类 硬度(g) 弹性(N) 咀嚼性(N) 鸡血豆腐 426.11 ± 16.30b 3.63 ± 0.11a 2.50 ± 0.08a 鸭血豆腐 652.49 ± 9.17a 3.08 ± 0.12b 2.53 ± 0.13a 鹅血豆腐 328.25 ± 5.09c 2.11 ± 0.09c 2.21 ± 0.09b 表 5 鸡血、鸭血和鹅血豆腐中3种核苷酸含量
Table 5 The contents of three nucleotides in chicken, duck and goose blood tofu
核苷酸 鸡血豆腐(μg/g) 鸭血豆腐(μg/g) 鹅血豆腐(μg/g) 5’-GMP 12.59 ± 0.56c 68.41 ± 2.33b 87.87 ± 3.12a 5’-IMP 24.83 ± 1.05c 88.34 ± 1.96b 113.09 ± 0.96a 5’-AMP 19.71 ± 0.83c 80.75 ± 1.15a 74.72 ± 1.09b 表 6 鸡血、鸭血和鹅血豆腐电子舌滋味响应强度
Table 6 Electronic tongue taste response intensity of chicken, duck and goose blood tofu
组别 酸味 苦味 涩味 回味B 回味A 鲜味 鲜味丰富性 咸味 基准 –13.00 0.00 0.00 0.00 0.00 0.00 0.00 –6.00 鸡血豆腐 –47.24 ± 0.02a 9.54 ± 0.18a 0.65 ± 0.03a –1.12 ± 0.04ab –0.36 ± 0.01a 13.79 ± 0.25a 3.93 ± 0.21ab –2.04 ± 0.12a 鸭血豆腐 –48.93 ± 0.05b 9.68 ± 0.05b 0.43 ± 0.01a –1.11 ± 0.01b –0.43 ± 0.01b 14.37 ± 0.64b 4.18 ± 0.12a –1.63 ± 0.09b 鹅血豆腐 –47.72 ± 0.02a 10.30 ± 0.09c 1.43 ± 0.01b –1.21 ± 0.03a –0.42 ± 0.03b 13.47 ± 0.23c 3.71 ± 0.13b –3.34 ± 0.03c -
[1] 刘海洋. 鸡血蛋白粉在饲料工业的应用[J]. 新农业,2019(9):54−55. [2] 周丰, 周志扬, 廖玉英, 等. 工业化肉鸭屠宰加工销售过程细菌污染防控措施[J]. 现代农业科技,2020,4:222−223. doi: 10.3969/j.issn.1007-5739.2020.18.113 [3] 郭彬彬, 朱欢喜, 施振旦. 鹅的季节性繁殖及其调控机制与技术的研究进展[J]. 黑龙江动物繁殖,2020,28(1):42−46. [4] 张炫, 唐道邦, 陈之遥, 等. 动物血中血红蛋白多肽开发利用的研究进展[J]. 中国食品添加剂,2015,9:141−146. doi: 10.3969/j.issn.1006-2513.2015.09.017 [5] 王征南, 范润梅. 我国动物血深加工产业发展状况及对策[J]. 饲料与畜牧: 新饲料,2011,1:60−68. [6] 伍梦婷, 郭娟娟, 徐云强, 等. 木薯改性淀粉对鹅血凝胶特性的影响[J]. 食品工业科技,2019,40(6):95−99, 113. [7] 王斌, 陈希玲. 谷氨酰胺转氨酶处理对鸭血豆腐品质的影响[J]. 食品与机械,2019,35(2):167−172. [8] 姚星星, 蔡华珍, 吕凤云, 等. 盒装鸡血豆腐品质稳定性研究[J]. 食品工业科技,2015,36(5):208−212. [9] Xue S, Xu X, Shan H, et al. Effects of high-intensity ultrasound, high-pressure processing, and high-pressure homogenization on the physicochemical and functional properties of myofibrillar proteins[J]. Innovative Food Science & Emerging Technologies,2018,45:354−360.
[10] Yang H, Zhang W, Li T, et al. Effectof protein structure on water and fat disb. ibution duringmeat gelling[J]. Food Chemistry,2016,204:239−245. doi: 10.1016/j.foodchem.2016.01.053
[11] 孙月萍, 李鹏, 孙京新, 等. 魔芋胶和瓜尔豆胶对鸭血豆腐食用品质的影响[J]. 肉类研究,2018,32(6):35−39. [12] 李鹏, 王宝维, 孙京新, 等. 超声波处理对鸭血豆腐品质的影响[J]. 肉类工业,2017,6:30−33. doi: 10.3969/j.issn.1008-5467.2017.11.009 [13] Hu T, Zhao S, Fan M, et al. Gel characteristics and microstructure of fish myofibrillar protein cassava starch composites[J]. food Chemistry,2017,218:221−230. doi: 10.1016/j.foodchem.2016.09.068
[14] Wang P, Xu X, Huang M, et al. Effect of pH on heat-induced gelation of duck blood plasma protein[J]. Food Hydrocolloids,2014,35:324−331. doi: 10.1016/j.foodhyd.2013.06.015
[15] Han M, Zhang Y, Fei Y, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009,228(4):665−670. doi: 10.1007/s00217-008-0976-x
[16] 杨肖, 孔琰, 丁奇, 等. 加盐方式对鸡汤中呈味物质的影响分析[J]. 精细化工,2018,35(7):1196−1200. [17] Zaukuu J Z, Soos J, Bodor Z, et al. Authentication of tokaj wine (hungaricum) with the electronic tongue and near infrared spectroscopy[J]. Journal of Food Science,2019,84(12):3437−3444. doi: 10.1111/1750-3841.14956
[18] Fan M, Damgaard H, Greve-Poulsen M, et al. Gel properties of potato protein and the isolated fractions of patatins and protease inhibitors – impact of drying method, protein concentration, pH and ionic strength[J]. Food Hydrocolloids,2019,96:246−258. doi: 10.1016/j.foodhyd.2019.05.022
[19] 林娴萍, 杨文鸽. 辐照对肌肉蛋白凝胶性能的影响[J]. 辐射研究与辐射工艺学报,2014,32(1):1−7. [20] 杨雪松, 孙杨赢, 潘道东, 等. 阿拉伯胶、瓜尔豆胶复配对鸭血凝胶特性的影响[J]. 食品科学,2018,39(5):26−32. doi: 10.7506/spkx1002-6630-201805005 [21] 王家勤, 姚月凤, 袁海波, 等. 基于色差系统的工夫红茶茶汤亮度的量化评价方法研究[J]. 茶叶科学,2020,40(2):259−268. doi: 10.3969/j.issn.1000-369X.2020.02.012 [22] Wang D Y, Zhang M H, Bian H, et al. Effects of blood cell membrane disruption by ultrasonic technology on the quality of duck blood tofu[J]. Agricultural Science & Technology,2014,15(4):616−619, 626.
[23] 李翔. 猪血和鸭血豆腐质构分析(TPA)几种测试条件的确定[J]. 西南师范大学学报: 自然科学版,2015,11:36−42. [24] Aaslyng M D, Bejerholm C, Ertbjerg P, et al. Cooking loss and juiciness of pork in relation to raw meat quality and cooking procedure[J]. Food Quality and Preference,2003,14(4):277−288. doi: 10.1016/S0950-3293(02)00086-1
[25] Qiao S C, Tian Y W, Song P, et al. Analysis and detection of decayed blueberry by low field nuclear magnetic resonance and imaging[J]. Postharvest Biology and Technology,2019,156:190−206.
[26] Zhang Q Q, Wei L, Hao K L, et al. Low-field nuclear magnetic resonance for online determination of water content during sausage fermentation[J]. Journal of Food Engineering,2017,212:291−297. doi: 10.1016/j.jfoodeng.2017.05.021
[27] Huff-Lonergan E, Lonergan S M. Mechanism of water-holding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science,2005,71(1):194−204. doi: 10.1016/j.meatsci.2005.04.022
[28] Shao JH, Deng YM, Jia N, et al. Low-field NMR determination of water distribution in meat batters with NaCl and polyphosphate addition[J]. Food Chemistry,2016,200:308−314. doi: 10.1016/j.foodchem.2016.01.013
[29] 袁乙平, 李靖, 马嫄, 等. 低场核磁结合理化指标分析低温贮藏真空包装牦牛肉的品质[J]. 食品工业科技,2019,40(6):31−36. [30] 王潇, 韩刚, 张小军, 等. 不同水域中华绒螯蟹雄体营养成分及风味成分差异性研究[J]. 大连海洋大学学报,2019,34:688−696. [31] 何小峰, 岳馨钰, 王益, 等. 瓦罐鸡汤主要滋味物质研究[J]. 食品科学,2010,31(22):306−310. [32] 王天泽, 谭佳, 杜文斌, 等. 北京油鸡鸡汤滋味物质分析[J]. 食品科学,2019,40(15):245−255. [33] 张秀洁, 郭全友, 王鲁民, 等. 养殖大黄鱼滋味和气味物质组成及评价[J]. 食品与发酵工业,2019,45(20):242−249. [34] Rhee MS, Wheeler TL, Shackelford SD, et al. Variation in palatability and biochemical traits within and among eleven beef muscles[J]. Journal of Animal Science,2004,82(2):534−550. doi: 10.2527/2004.822534x





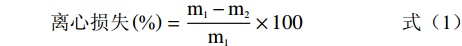
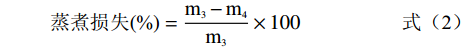
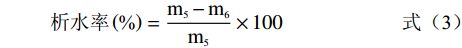
 下载:
下载:


 下载:
下载:
