Comparison of Properties of Membrane-Bound and Soluble Polyphenol Oxidase from Dangshan Pear
-
摘要: 为探究砀山酥梨膜结合态多酚氧化酶(mPPO)性质,本文以砀山酥梨为原料,研究其mPPO催化特性及热失活动力学,并与可溶态多酚氧化酶(sPPO)性质进行比较。结果表明:以邻苯二酚为底物时,mPPO与sPPO催化特性及热失活动力学性质不同。mPPO比活力及对底物亲和力高于sPPO。mPPO在pH4.50时酶活最高,而sPPO最适pH为5.00。mPPO酸碱稳定性高于sPPO,mPPO在pH3.50~4.50环境中保持24 h后酶活大于原始酶活。砀山酥梨mPPO在35~45 ℃温度区间内活性最高,且mPPO在55~75 ℃区间热稳定性高于sPPO。热失活动力学分析结果表明,热处理对sPPO及mPPO的钝化均符合一级反应动力学,动力学参数Ea值及ZT值分析表明mPPO比sPPO催化反应对温度的依赖性更小,热耐受性更高。Abstract: In order to study the properties of membrane-bound polyphenol oxidase (mPPO) from Dangshan pear, the catalytic characteristics and thermal inactivation kinetics of mPPO from Dangshan pear were studied. Properties of mPPO were also compared with those of soluble polyphenol oxidase (sPPO). Results showed that, when catechol was used as substrate, the catalytic properties and thermal deactivation mechanical properties of mPPO and sPPO were quite different. The activity of mPPO had a stronger affinity to the substrate than sPPO with catechol as the substrate. The optimal pH of mPPO and sPPO was pH4.50 and 5.00, respectively. The pH stability of mPPO was higher than that of sPPO, and the residual enzyme activity of mPPO at pH3.50~4.50 for 24 h was higher than that of the original enzyme activity. The optimum reaction temperature for mPPO was 35~45 ℃ and mPPO had higher thermal stability than sPPO at 55~75 ℃. The kinetic analysis of thermal deactivation showed that the passivation of sPPO and mPPO was in accordance with the first-order kinetics model. Kinetic parameters Ea and ZT indicated that mPPO had less dependence on temperature and higher heat tolerance than sPPO.
-
Keywords:
- dangshan pear /
- browning /
- polyphenol oxidase /
- mPPO /
- thermal deactivation
-
果蔬中的褐变以多酚氧化酶(Polyphenol Oxidase,PPO)引起的酶促褐变反应最为明显[1-4]。PPO在细胞内有两种存在形式:可溶态(sPPO)和膜结合态(mPPO)[5]。正常情况下,sPPO以可溶的形式存在于细胞质中,mPPO结合在质体、线粒体、叶绿体等细胞器膜和细胞膜或细胞壁上[6],PPO基因在细胞质中合成含有转运肽的前体肽,分子质量一般为60~75 ku,随后前体肽被转运肽转运至质体的内囊体膜上,即为mPPO。mPPO被分解成分子质量约为45~69 ku的成熟肽,即为sPPO。在贮藏初期,果实的PPO主要以mPPO形式存在,随着贮藏时间的延长,当细胞膜结构遭到破坏以后,mPPO便从细胞膜上脱离,并向sPPO转化,表现PPO的催化活性[7]。或在某些外界刺激下,如鲜切处理、超高压处理梨汁及非浓缩还原果汁时,其活性受到激发,表现出高活性[8]。随着分子生物学、细胞生物学、分子遗传学等学科的发展,PPO褐变机制研究逐步向分子水平深入[9-11]。但mPPO在褐变中的作用及其激活机制尚不明确。前期对sPPO性质研究较多[12],而砀山酥梨mPPO的研究暂时空白。
砀山酥梨属于白梨系统,是我国果品中的名优产品。该品种以果大、核小、黄亮、形美、皮薄、多汁、果肉细腻、甘甜酥脆等特点驰名中外,深受国内外消费者青睐,是我国出口创汇的主要梨品种之一[13-14]。但砀山酥梨采后的生理病害—黑皮病,严重影响它的经济价值。且鲜切处理、超高压处理梨汁及非浓缩还原果汁时,多酚氧化酶活性出现上升,是由于sPPO结构变化还是因为mPPO被激活,具体原因尚不明确。本文以砀山酥梨为原料,采用超声处理结合温度诱导的方法提取mPPO,对mPPO的性质进行研究,并与sPPO催化特性进行比较,为mPPO在砀山酥梨褐变中的作用及机制研究奠定基础,为其加工过程中褐变控制提供理论依据。
1. 材料与方法
1.1 材料与仪器
砀山酥梨 购自陕西杨凌,挑选形状规则、无机械伤、无绿变、大小均匀的酥梨为实验材料,洗净,4 ℃贮藏;Triton X-100、PMSF、聚乙烯吡咯烷酮(PVPP)、考马斯亮蓝G-250、牛血清蛋白 北京索莱宝生物科技有限公司;邻苯二酚、磷酸氢二钠、磷酸二氢钠、Tris、HCl、柠檬酸、醋酸、磷酸 北京金锐林生物科技有限公司。
FE20-KpH计 梅特勒-托利多公司;紫外可见分光光度计(T6 spectrophotometer) 北京普析通用仪器有限公司;HW.SY11-K电热恒温水浴锅 北京医疗设备厂;DW-HL328低温冰箱 北京中科美菱公司;CI7600色度仪 爱色丽(上海)色彩科技有限公司;TGL 16-C高速冷冻离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 砀山酥梨mPPO分离提取
砀山酥梨mPPO提取方法参考Bravo等[1]以及刘芳[12]的mPPO提取方法略有修改。将砀山酥梨洗净、切块,分别加入0.05 mol/L的4 ℃预冷PBS缓冲溶液(pH6.80、含2% PVPP,PMSF),料液比为体积比1:1,搅打30 s后离心15 min(11000 r/min),所得滤液弃去。滤渣加入150 mL Tris-HCl缓冲液(含0.25% Triton X-100)匀浆30 s,60 W超声处理10 min后静置30 min。4 ℃下11000 r/min离心15 min后,置于冰箱30 min,然后35 ℃水浴保温15 min。25 ℃下离心15 min,上清液即为mPPO粗提液。mPPO粗提液进行60%~80%硫酸铵分级沉淀,收集沉淀,用0.05 mol/L PBS缓冲液溶解透析24 h(4 ℃)。透析结束后,离心20 min(9000 r/min,4 ℃),收集上清液经DEAE Sepharose Fast Flow层析0.1 mol/L NaCl梯度洗脱,将所得mPPO酶活高的组分收集备用。
1.2.2 砀山酥梨sPPO分离提取
砀山酥梨sPPO提取方法参考刘芳[12]中sPPO提取方法。
1.2.3 蛋白质含量测定
采用Bradford法[15]进行蛋白含量测定。以牛血清蛋白(BSA)标准品作为标准蛋白,绘制标准曲线。根据标准曲线计算样品中蛋白质的浓度。标准曲线方程:Y=0.0055X − 0.0048(R2=0.999)。
1.2.4 酶活测定
以邻苯二酚为反应底物,将0.5 mL酶液和2.5 mL的邻苯二酚底物溶液混合,在25 ℃下用分光光度计测定混合液在1 min内在特征吸收波长下的吸光值的变化。一个酶活力单位(IU)为在测定条件下1 s内吸光值的改变。酶的比活力为酶活与酶液蛋白含量的比值。
1.2.5 米氏常数测定
分别配制浓度为0.00625、0.0125、0.0250、0.0500、0.100和0.150 mol/L的邻苯二酚溶液。测定不同底物浓度下mPPO的活性。参照Lineweaver-Burk作图法,绘出的直线,纵坐标值即为1/Vmax,横截距即为1/Km,即Km=−1/X。
1.2.6 最适反应pH及酸碱稳定性的测定
配制0.05 mol/L的醋酸钠缓冲溶液(pH3.50、pH4.00、pH4.50、pH5.00、pH5.50),0.05 mol/L的磷酸缓冲溶液(pH6.00、pH6.50、pH7.00、pH7.50),0.05 mol/L Tris-HCl缓冲溶液(pH8.00、pH8.50)。
最适反应pH:用不同pH的缓冲液配制浓度为0.2 mol/L的邻苯二酚溶液。按照1.2.4酶活测定方法测定在不同pH条件下mPPO和sPPO的活性,计算比活力。
酸碱稳定性:将酶液与不同pH缓冲液按体积比1:4混合,24 h后,测定mPPO和sPPO活性。以磷酸缓冲液(0.05 mmol/L,pH6.80)中酶液的活性为原始活性,并计算不同pH缓冲液下mPPO和sPPO活性与原始酶活的百分比,做为相对活性。
1.2.7 最适反应温度的测定
用缓冲溶液(0.05 mol/L,pH6.80)配制0.2 mol/L的邻苯二酚溶液,分别置于温度为25~85 ℃(每个处理间隔10 ℃)水浴槽中预热。在未添加mPPO之前,先在各设定温度下预热15 min,然后迅速加入酶液,混匀。按照1.2.4酶活测定方法分别测定各温度下的mPPO和sPPO活性,计算比活力。
1.2.8 温度稳定性的测定
将mPPO酶液置于温度为25~75 ℃(每个处理间隔10 ℃)的水槽中,分别水浴10、20、30、40、50、60 min后,测定不同温度下mPPO和sPPO的活性。
1.2.9 热失活动力学参数的计算
砀山酥梨sPPO及mPPO热失活动力学参数计算方法参考Ioniţă等[16]中的计算方法。失活动力学参数计算公式如式(1)~式(5)所示。
k=ln(A/A0)/t (式1) D=2.303/k (式2) t1/2=ln(2)/k (式3) logD=logD0−(T−T0)/ZT (式4) lnk=lnk0+Ea/R×(1/T0−1/T) (式5) 式中,A代表酶活;A0代表初始酶活;k为热失活速率(min−1);D为指数递减时间(min),即在设定的温度下,酶活降低90%所需要的时间;ZT表示D值对温度的敏感性(℃),即D值变化一个对数时对应的温度的变化;T为绝对温度(K);t1/2是失活半衰期(min);Ea失活活化能(kJ/mol);R为常数8.314(J/mol/K)。
1.3 数据处理
利用SPSS 20.0和Origin 8.0软件进行数据统计分析及作图,每个实验重复3次,数据均以平均值 ± 标准差(meana ± SD)表示。采用邓肯式多重差异比较,当P<0.05时,差异显著。
2. 结果与分析
2.1 比活力比较
酶的比活力为酶活与酶液蛋白含量的比值。mPPO与sPPO比活力结果如表1所示。从表1中可看出,当以邻苯二酚为底物时,砀山酥梨sPPO酶活高于mPPO。这与Webb等[17]研究结果一致。果蔬中存在不同的PPO亚型,且PPO在不同条件下表达量不同,所以不同果蔬中mPPO与sPPO的比活力差异很大。Tsurutani等[18]发现某些苹果品种sPPO活性明显高于其他苹果品种中的潜伏态PPO。Sellés-Marchart等[19]发现以绿原酸为底物时,mPPO活性比sPPO更高。
表 1 砀山酥梨sPPO和mPPO比活力比较Table 1. The specific activity of sPPO and mPPO from Dangshan pear fruit名称 蛋白含量(mg·g−1) 酶活(IU) 比活力(IU·mg−1) sPPO 0.0057 ± 0.0002 0.510 ± 0.004 89.47 ± 1.01 mPPO 0.0006 ± 0.0001 0.066 ± 0.060 108.20 ± 0.94 2.2 米氏常数比较
当以邻苯二酚为底物时,计算可得Km(sPPO)为0.062 mol/L,Km(mPPO)为0.023 mol/L。这与其他果蔬中以邻苯二酚为底物时的Km值研究结果一致,比如葡萄PPO(Km=52.6 mmol/L),杏PPO(Km=61 mmol/L)[20]。Km可表示酶对底物亲和力的大小,从二者的Km值可看出,mPPO对邻苯二酚的亲和力更强,更易催化底物发生褐变。
2.3 最适反应pH比较
sPPO与mPPO最适反应pH如图3所示。sPPO在pH5.00出现酶活高峰,而当pH为4.50时,mPPO活性最高,明显高于其他pH时的酶活。mPPO在pH7.00时有一个酶活小峰,这可能与其结构相关,有研究表明富士苹果mPPO在其结构中存在一段未知功能区域,但其功能尚未明确[12]。在以往研究文献中,也有类似结果。George等[21]研究发现以邻苯二酚为底物时,鳄梨最适pH为5.0和7.0,这与本研究结果一致。文献报道中果蔬最适pH大多处于4.0~8.0之间[22]。这可能与底物、酶的活性中心、酶与底物形成的复合物存在不同的电离状态等有关[23]。
2.4 酸碱稳定性比较
砀山酥梨mPPO与sPPO的酸碱稳定性如图4所示。从图4中可看出,mPPO酸碱稳定性较好,在pH3.50~4.50时,24 h后酶活高于原酶活,其中在pH4.50时,24 h后酶活为原酶活的375.40%。这可能是由于在此区间内mPPO构象变化,活性中心暴露,更易与底物结合。在pH6.5时,24 h后mPPO酶活为原酶活的90.08%。pH6.50~7.50时,sPPO酶活稳定性较好,其中pH7.0,24 h后酶活最高,为原酶活的45.33%。与sPPO相比较,mPPO酸碱稳定性较高,这可能与其生理功能相关,但mPPO在果蔬采后生理中的作用及机制尚无深入研究。对mPPO在果蔬采后生理中的作用及机制研究有助于揭示果蔬采后贮藏保鲜及鲜切果蔬加工过程中的褐变机理,这将是mPPO今后的研究热点。
2.5 最适反应温度比较
最适反应温度测定结果如图5所示。从图5中可以看出,mPPO最适温度高于sPPO。当温度为35~45 ℃时,mPPO活性最高。在45~55 ℃区间内,酶活下降稍为缓慢,当温度超过达到55 ℃后,酶活迅速下降。当温度达到85 ℃时,酶活性接近为零。sPPO在35 ℃的活性最高。随着温度的升高,sPPO活性下降迅速。果蔬PPO最适温度呈现很大差异,这不仅与其来源相关,与其在果蔬中的存在形式及状态也密切相关。比如蛇皮果mPPO最适温度为30 ℃[24],枇杷果实潜伏态PPO最适温度为70 ℃[19],这与PPO在果蔬中参与抵御外界伤害的功能有关。
2.6 温度稳定性比较
sPPO及mPPO 温度稳定性及失活速率曲线如图6、图7所示。从图6(a)可以看出,sPPO在25、35 ℃水浴时活性下降不明显,稳定性较好。在45~65 ℃时残余活性随着水浴时间的延长而降低,热稳定性迅速下降。75 ℃水浴10 min时活性几乎为零。从图7(a)可以看出,当加热10 min时,mPPO活性随温度升高而升高,75 ℃加热10 min后,mPPO活性显著高于其他加热温度的酶活(P<0.05)。当温度低于55 ℃时,mPPO热稳定性较好,超过55 ℃后酶活下降迅速。
为了进一步的研究sPPO及mPPO耐热性的差异,实验比较了两者的失活动力学参数。sPPO及mPPO在不同温度下热失活后,将酶活取对数,即ln(A/A0),并与失活时间t进行线性拟合,确定其失活动力学模型。由图6(b)、图7(b)可知,sPPO及mPPO失活时间t与残留酶活的对数ln(A/A0)在各温度下均呈线性关系(决定系数R2>0.946),表明sPPO及mPPO活力受加热温度及时间的影响显著,随时间及温度升高而快速失活。同时,表明砀山酥梨sPPO及mPPO的热失活遵循一级反应动力学规律。
2.7 热失活动力学比较
图6(b)、图7(b)中线性回归的斜率即为热失活速率常数的相反数(−k)。在热失活动力学研究中,热失活速率常数(k)、失活半衰期(t1/2)和失活活化能(Ea)是表征酶热稳定性的三个重要参数。不同温度下的失活速率k和半衰期t1/2反映酶失活快慢。由表2可知,sPPO及mPPO的失活速率常数k均随着加热温度升高而增大,表明温度越高sPPO及mPPO失活速率越快。45~65 ℃区间内sPPO的失活速率常数k比mPPO小,表明其失活速率低于mPPO。而75 ℃时,sPPO失活速率常数k比mPPO大,表明在75 ℃高温时,sPPO失活速率高于mPPO。
表 2 砀山酥梨mPPO及sPPO失活的一级动力学模型参数Table 2. Parameters of first-order kinetic model for Dangshan pear mPPO and sPPO inactivation热失活参数 温度(℃) mPPO sPPO 失活速率常数
k (×10−3 min−1)45 10.594 ± 0.357 6.909 ± 0.298 55 21.648 ± 1.032 16.121 ± 0.789 65 51.127 ± 2.463 31.091 ± 1.964 75 112.617 ± 4.651 153.840 ± 5.432 半衰期
t(1/2)(min)45 65.430 ± 0.896 100.325 ± 1.236 55 32.019 ± 0.625 42.997 ± 0.591 65 13.557 ± 0.222 22.295 ± 0.313 75 6.155 ± 0.154 4.506 ± 0.101 D值
(min)45 217.391 ± 2.108 333.333 ± 2.011 55 106.383 ± 1.033 142.857 ± 0.931 65 45.045 ± 0.581 74.074 ± 0.664 75 20.450 ± 0.432 14.970 ± 0.512 反应活化能
Ea (kJ·mol−1)78.257(R2=0.9999) 106.560(R2=0.9404) ZT (℃) 27.933(R2=0.9994) 20.408(R2=0.9450) 酶失活半衰期t1/2和D值也是表征酶热失活速率的重要参数,sPPO及mPPO的半衰期t1/2和D值均随着加热温度升高而减小,表明温度越高,sPPO及mPPO失活速率越快。75 ℃时,sPPO半衰期t1/2和D值均比mPPO小,说明在此温度下mPPO失活速率低于sPPO。这可能与其生理生化功能相关。Iyidoğan等[25]在Amasya苹果中发现了三个在80 ℃下具有高稳定性的PPO亚型。前期研究发现苹果mPPO序列中有与热激蛋白类似片段[13],具体作用及机制有待于进一步研究。热失活活化能Ea反映酶热稳定性强弱,在同样的处理条件下,Ea值越高表示反应对温度的依赖性越大。ZT值是表征酶对温度钝化敏感性的指标,ZT值越大,说明该酶对温度的耐受性越大。从表2可知,mPPO的Ea值为78.257 kJ·mol−1,sPPO的Ea值为106.560 kJ·mol−1,说明sPPO活性对温度的依赖性更大。mPPO钝化的ZT值为27.933 ℃,sPPO的ZT值为20.408 ℃,表明mPPO的热耐受性更高。
3. 结论
砀山酥梨mPPO与sPPO酶促性质差异明显。以邻苯二酚为底物时,mPPO对底物亲和力比sPPO强,最易发生褐变。砀山酥梨mPPO酸碱稳定性好于sPPO。mPPO在pH3.50~4.50残余酶活大于100%,其中在pH4.50时,残余酶活为原来酶活的375.40%。mPPO最适反应温度为35~45 ℃,且在高温区间热稳定性高于sPPO,且75 ℃处理10 min后mPPO活性显著上升(P<0.05)。热失活动力学分析表明,相同温度下mPPO更易发生酶促反应,且其热耐受性更高。实验发现,mPPO与sPPO酶促产物相比,mPPO酶促产物不易发生交联,呈浅黄色,而不会出现sPPO酶促产物的棕褐色,这也从侧面表明mPPO不是褐变的主要形式,它主要参与果蔬采后及加工中生理防御,比如贮藏期及鲜切货架期内的抗逆性,这将是后期研究重点。
-
表 1 砀山酥梨sPPO和mPPO比活力比较
Table 1 The specific activity of sPPO and mPPO from Dangshan pear fruit
名称 蛋白含量(mg·g−1) 酶活(IU) 比活力(IU·mg−1) sPPO 0.0057 ± 0.0002 0.510 ± 0.004 89.47 ± 1.01 mPPO 0.0006 ± 0.0001 0.066 ± 0.060 108.20 ± 0.94 表 2 砀山酥梨mPPO及sPPO失活的一级动力学模型参数
Table 2 Parameters of first-order kinetic model for Dangshan pear mPPO and sPPO inactivation
热失活参数 温度(℃) mPPO sPPO 失活速率常数
k (×10−3 min−1)45 10.594 ± 0.357 6.909 ± 0.298 55 21.648 ± 1.032 16.121 ± 0.789 65 51.127 ± 2.463 31.091 ± 1.964 75 112.617 ± 4.651 153.840 ± 5.432 半衰期
t(1/2)(min)45 65.430 ± 0.896 100.325 ± 1.236 55 32.019 ± 0.625 42.997 ± 0.591 65 13.557 ± 0.222 22.295 ± 0.313 75 6.155 ± 0.154 4.506 ± 0.101 D值
(min)45 217.391 ± 2.108 333.333 ± 2.011 55 106.383 ± 1.033 142.857 ± 0.931 65 45.045 ± 0.581 74.074 ± 0.664 75 20.450 ± 0.432 14.970 ± 0.512 反应活化能
Ea (kJ·mol−1)78.257(R2=0.9999) 106.560(R2=0.9404) ZT (℃) 27.933(R2=0.9994) 20.408(R2=0.9450) -
[1] Bravo K, Osorio E. Characterization of polyphenol oxidase from Cape gooseberry (Physalis peruviana L.) fruit[J]. Food Chemistry,2016,197:185−190.
[2] Mayer A M. Polyphenol oxidases in plants and fungi: Going places?A review[J]. Phytochemistry,2006,67(21):2318−2331.
[3] Ibrahim G E, Hassan I M, Abd-Elrashid A M, et al. Effect of clouding agents on the quality of apple juice during storage[J]. Food Hydrocolloids,2011,25(1):91−97.
[4] Yan S J, Li L, He L H, et al. Maturity and cooling rate affects Browning, polyphenol oxidase activity and gene expression of ‘Yali ’ pears during storage[J]. Postharvest Biology and Technology,2013,85:39−44. doi: 10.1016/j.postharvbio.2013.04.016
[5] Mishra B B, Gautam S, Sharma A. Browning of fresh-cut eggplant: Impact of cutting and storage[J]. Postharvest Biology and Technology,2012,67:44−51. doi: 10.1016/j.postharvbio.2011.12.009
[6] 李晓丽, 王成, 朱靖蓉, 等. 干制速度对无核白葡萄酚类物质和多酚氧化酶细胞化学定位及褐变的影响[J]. 食品工业科技,2019,40(5):99−107. [7] Orenes-Piñero E, García-Carmona F, Sánchez-Ferrer A. Latent polyphenol oxidase from quince fruit pulp (Cydonia oblonga): Purification, activation and some properties[J]. Journal of the Science of Food and Agriculture,2006,86(13):2172−2178.
[8] 尚海涛, 宣晓婷, 崔燕, 等. 超高压激活鲜榨梨汁多酚氧化酶的酶学特性[J]. 食品科学,2019,40(19):149−155. doi: 10.7506/spkx1002-6630-20180824-263 [9] Navarro J L, Tárrega A, Sentandreu M A, et al. Partial purification and characterization of polyphenol oxidase from persimmon[J]. Food Chemistry,2014,157:283−289. doi: 10.1016/j.foodchem.2014.02.063
[10] Di Guardo M, Tadiello A, Farneti B, et al. A multidisciplinary approach providing new insight into fruit flesh Browning physiology in apple (Malus x domestica Borkh.)[J]. PLoS One,2013,8(10):e78004.
[11] Yan S, Li S J, Zhai G W, et al. Molecular cloning and expression analysis of duplicated polyphenol oxidase genes reveal their functional differentiations in Sorghum[J]. Plant Science,2017,263:23−30. doi: 10.1016/j.plantsci.2017.07.002
[12] 刘芳. 苹果膜结合态多酚氧化酶分离纯化及性质研究[D]. 北京: 中国农业大学, 2015. [13] 王志华, 王文辉, 郭黄萍, 等. ‘砀山酥’梨黑皮病影响因素分析及监测预警和防控措施[J]. 中国果树,2019(4):104−109, 119. [14] 惠伟, 牛瑞雪, 宋要强, 等. 1-MCP和DPA对砀山酥梨黑皮病的抑制效果[J]. 中国农业科学,2010,43(6):1212−1219. doi: 10.3864/j.issn.0578-1752.2010.06.014 [15] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248−254.
[16] Ioniţă E, Gurgu L, Aprodu I, et al. Characterization, purification, and temperature/pressure stability of polyphenol oxidase extracted from plums (Prunus domestica)[J]. Process Biochemistry,2017,56:177−185. doi: 10.1016/j.procbio.2017.02.014
[17] Webb K J, Cookson A, Allison G, et al. Gene expression patterns, localization, and substrates of polyphenol oxidase in red clover (Trifolium pratense L.)[J]. Journal of Agricultural and Food Chemistry,2013,61(31):7421−7430.
[18] Tsurutani M, Yanagida Y, Hagiwara S, et al. Comparison of soluble and plastidal polyphenol oxidase in mature apples[J]. Food Science and Technology Research,2002,8(1):42−44. doi: 10.3136/fstr.8.42
[19] Sellés-Marchart S, Casado-Vela J, Bru-Martínez R. Isolation of a latent polyphenol oxidase from loquat fruit (Eriobotrya japonica Lindl.): Kinetic characterization and comparison with the active form[J]. Archives of Biochemistry and Biophysics,2006,446(2):175−185. doi: 10.1016/j.abb.2005.12.004
[20] Yemenicioǧlu A, Cemeroǧlu B. Consistency of polyphenol oxidase (PPO) thermostability in ripening apricots (Prunus armeniaca L.): evidence for the presence of thermostable PPO forming and destabilizing mechanisms in apricots[J]. Journal of Agricultural and Food Chemistry,2003,51(8):2371−2379. doi: 10.1021/jf025988q
[21] George H L, Christoffersen R E. Differential latency toward (–)-epicatechin and catechol mediated by avocado mesocarp polyphenol oxidase (PPO)[J]. Postharvest Biology and Technology,2016,112:31−38.
[22] Taranto F, Pasqualone A, Mangini G, et al. Polyphenol oxidases in crops: Biochemical, physiological and genetic aspects[J]. International Journal of Molecular Sciences,2017,18(2):377. doi: 10.3390/ijms18020377
[23] Ünal M Ü, Şener A. Two-year comparison of the biochemical properties of polyphenol oxidase from Turkish Alyanak apricot (Prunus armenica L.)[J]. Food Chemistry,2016,190:741−747. doi: 10.1016/j.foodchem.2015.06.025
[24] Zaini N A M, Osman A, Hamid A A, et al. Purification and characterization of membrane-bound polyphenoloxidase (mPPO) from Snake fruit[Salacca zalacca (Gaertn.) Voss[J]. Food Chemistry,2013,136(2):407−414. doi: 10.1016/j.foodchem.2012.08.034
[25] İyidoǧan N F, Bayındırlı A. Effect of L-cysteine, kojic acid and 4-hexylresorcinol combination on inhibition of enzymatic browning in Amasya apple juice[J]. Journal of Food Engineering,2004,62(3):299−304. doi: 10.1016/S0260-8774(03)00243-7








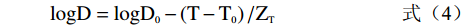
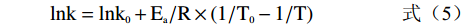
 下载:
下载:







 下载:
下载:
