High-efficiency Expression and Activity Identification of SrtA Protein in Escherichia coli
-
摘要: 按大肠杆菌偏好优化密码子并合成高活性突变型srtA基因,构建Trx蛋白共表达载体pTIG-srtA,转入大肠杆菌BL21(DE3)后低温诱导表达,通过Ni2+柱亲和层析纯化SrtA蛋白,连接LHN-LPETG和G-HC蛋白检测SrtA蛋白活性。菌液PCR鉴定和测定序列比对结果显示,构建pTIG-srtA载体成功;SDS-PAGE及Western Blot分析结果显示,在大肠杆菌中实现了SrtA蛋白的可溶性高表达,Ni2+柱亲和层析后得到纯度大于95%的SrtA蛋白,LHN-LPETG和G-HC蛋白成功连接表明,原核系统表达纯化的SrtA蛋白具有良好的转肽酶活性。Abstract: Optimize codons according to E. coli preference and synthesize highly active mutant srtA geneto construct the Trx protein co-expression vector pTIG-srtA. Then it was transformed into E. coli BL21(DE3) and induced expression at low temperature, and the SrtA protein was purified by Ni2+ column affinity chromatography, and connected LHN-LPETG and G-HC protein to detect SrtA protein activity. The results of bacterial liquid PCR identification and determination of sequence comparison showed that the pTIG-srtA plasmid was successfully constructed. The results of SDS-PAGE and Western Blot analysis showed that high soluble expression of SrtA protein was achieved in E. coli, Ni2+ column affinity chromatography obtains SrtA protein with a purity greater than 95%. The successful connection of LHN-LPETG and G-HC protein indicated that the SrtA protein expressed and purified by the prokaryotic system had good transpeptidase activity.
-
Keywords:
- Sortase A /
- codon optimization /
- enzyme ligation method /
- botulinum neurotoxin A
-
Sortase酶是一组存在于革兰氏阳性细菌中介导表面蛋白与细胞壁共价结合的蛋白酶,负责细胞表面蛋白的修饰和细菌鞭毛的构建,在帮助病原细菌逃避宿主免疫系统方面起重要作用[1]。Sortase酶根据识别表面蛋白序列的不同可以分为A、B、C、D等多种,其中以在金黄色葡萄球菌(Staphylococcus aureus)中发现的转肽酶A(Sortase A,SrtA)研究得最为广泛,其结构、功能及催化机制均已阐明[2-3]。Sortase A酶具有一个典型的类似Ⅱ型膜蛋白的N端跨膜区域和一个尾部富集正电荷的C端结构域,可以特异性识别底物蛋白上的分选序列LPXTG(X为除半胱氨酸以外的任一氨基酸)[4-5],在苏氨酸(Thr)和甘氨酸(Gly)之间进行剪切[6-7],并将其与含有多甘氨酸接头(GlyGlyGly-,G-)的底物蛋白进行连接[8-9]。SrtA酶催化的连接反应具有反应条件温和、效率高、特异性强等优点[10-11],近年来已应用于蛋白质与蛋白质、肽、核酸类似物[12-13]、糖等活性物质连接以及蛋白质固定化[14-15],展示出良好的应用前景。但是野生型SrtA酶催化的连接反应耗时长、产率低,不同研究者开展了包括提高催化活性、改变底物识别特征等一系列改造,Chen等报道P94S、D160N、D165A和K196T这4个位点的突变可将SrtA酶催化活性提高140多倍,推测突变型SrtA酶更利于底物进入结合区域,从而大大提升连接效率[16-17]。
密码子(codon)是中心法则的重要组成部分,同时也是生物遗传和变异的最基本单元,对某物种基因组来说, 一些同义密码子会频繁出现,称为优化密码子;还有一些密码子则很少出现甚至不出现,称为非优化密码子或稀有密码子,这一现象称为密码子偏好性(codon usage bias)[18-19]。不同物种之间对密码子使用存在各自的偏好,各同义密码子之间虽然不会改变氨基酸的序列,但对于蛋白的表达水平具有一定程度的影响[20-21]。基因合成是一项较为成熟的技术[22-23],常与密码子优化配合使用[24-25],本文选择了高活性突变型的srtA酶基因,为解决SrtA酶在大肠杆菌表达系统中表达水平低、包涵体比例高的缺点,按照大肠杆菌偏好性进行了密码子优化后合成了srtA基因并连入硫氧还蛋白(Thioredoxin,Trx)共表达载体pTIG,导入大肠杆菌BL21(DE3)后通过低温诱导实现了SrtA酶的可溶性高表达,纯化的SrtA酶成功实现了A型肉毒毒素(Botulinum toxins A,BoNT/A)活性缺失突变体LHN-LPETG结构域和GHC结构域的连接。
1. 材料与方法
1.1 材料与仪器
DH5α大肠杆菌感受态、BL21(DE3)大肠杆菌感受态 北京擎科生物技术有限公司;质粒提取试剂盒 北京达科为生物科技有限公司;DNA凝胶回收试剂盒、限制性内切酶 赛默飞世尔科技(中国)有限公司;BCA法蛋白浓度测定试剂盒 康为世纪生物科技有限公司;琼脂糖 索莱宝科技有限公司;T4 DNA连接酶 NEB有限公司;IPTG 北京经科宏达生物技术有限公司;pTIG-GHC、pTIG-LHN-LPETG、PUC57-srtA质粒(克隆载体) 军事医学科学院军事医学研究院生物工程研究所。
Ni2+亲和层析柱、强阴离子亲和层析柱、强阳离子亲和层析柱 GE公司;3K-18型低温冷冻离心机 Sigma;T-1型PCR仪 Biometra;DYⅢ 3A型凝胶电泳仪 北京六一仪器厂;Gel-pro 2020D凝胶成像仪 pHarmacia Biotech;MiniPROTEAN®3 Cell蛋白电泳仪 Bio-RAD;AKTA UPC-900蛋白质纯化仪 GE;PAC200半干转膜仪 Bio-Rad等。
1.2 实验方法
1.2.1 srtA基因密码子优化
将高活性突变型srtA基因序列按大肠杆菌偏好性进行密码子优化,交由北京擎科生物技术有限公司进行合成。
1.2.2 引物设计
利用edit seq软件设计引物,引物序列如表1。
表 1 引物设计Table 1. Primer design引物 引物序列(5’ -3’) F- pTIG-srtA GGGAATTCTAATGGCTAAACCTCAAATTCCGAAAG R- pTIG-srtA CCCTCGAGTTTGACTTCTGTAGCTACAAAGATTTTAC 注:下划线为酶切位点,GAATTC:EcoRI;CTCGAG:XhoI。 1.2.3 pTIG-srtA质粒构建
根据优化后的srtA基因序列设计正、反向引物,降落PCR扩增目的基因片段后进行琼脂糖凝胶电泳,切胶分离目的片段后回收。将目的片段与pTIG表达载体经EcoRI+XhoI双酶切后再次电泳验证并回收,二者于16℃连接过夜后转化至DH5α感受态,将菌液涂布于LB(Amp)固体培养基,倒置在37 ℃培养过夜,次日挑单菌落进行菌落PCR鉴定,阳性对照的PCR模板为PUC57-srtA,阴性对照的PCR模板为pTIG空载体。鉴定筛选后将阳性克隆送至公司测序。
1.2.4 SrtA蛋白表达鉴定
将表达载体pTIG-srtA转入BL21(DE3)感受态,然后挑取转化子培养至对数生长期,加入终浓度0.5 mmol的IPTG置于16 ℃诱导过夜。次日取1 mL菌液离心后重悬于500 μL TE裂解液,经过超声破碎后,取出20 μL备用(全菌),其余裂解液离心,吸取20 μL上清待用,去掉上清后沉淀部分用480 μL裂解液重悬,取20 μL备用(沉淀)。将全菌、上清、沉淀进行SDS-PAGE鉴定,并利用Gelpro Analyzer软件分析蛋白表达量。
1.2.5 SrtA蛋白纯化
取pTIG-srtA/BL21(DE3)单菌落至摇瓶培养,按1.2.4低温诱导表达,超声裂解后利用AKTA纯化仪梯度洗脱纯化蛋白。经前期纯化条件摸索,srtA蛋白需经过两步纯化,第一步使用强阳离子柱进行纯化,收集洗脱液后液通过3 kDa截留分子量的超滤管进行超滤换液脱盐,将溶液置换为Ni2+柱平衡液。第二步通过Ni2+亲和层析柱进行二次纯化,纯化后采用3 kDa截留分子量的超滤管进行超滤换液脱盐浓缩,利用SDS-PAGE及Gelpro Analyzer软件分析纯化蛋白纯度,同时使用抗His标签抗体为一抗进行Western Blot鉴定。纯化体系平衡液、洗脱液见表2。
表 2 纯化平衡液、洗脱液Table 2. loading buffer and elution buffer名称 配方及pH Ni2+柱纯化平衡液 20 mmol/L PB,200 mmol/L氯化钠,20 mmol/L咪唑,调整pH至7.4 Ni2+柱纯化洗脱液 20 mmol/L PB,200 mmol/L氯化钠,500 mmol/L咪唑,调整pH至7.4 LHN强阴离子柱纯化平衡液 20 mmol/L Tris-HCl,调整pH至7.0 LHN强阴离子柱纯化洗脱液 20 mmol/L Tris-HCl,1 mol/L NaCl调整pH至7.0 SrtA强阳离子柱纯化平衡液 20 mmol/L PB,调整pH至7.5 SrtA强阳离子柱纯化洗脱液 20 mmol/L PB,1 mol/L NaCl调整pH至7.5 G-HC强阳离子柱纯化平衡液 20 mmol/L PB,调整 pH至8.0 G-HC强阳离子柱纯化洗脱液 20 mmol/L PB,1 mol/L NaCl 调整pH至8.0 1.2.6 SrtA蛋白活性鉴定
分别将pTIG-G-HC、pTIG-LHN-LPETG质粒转入BL21(DE3)感受态细胞,按照1.2.4及1.2.5进行表达鉴定及纯化,G-HC纯化步骤同SrtA纯化。LHN-LPETG蛋白需经过两步纯化,第一步进行Ni2+亲和层析柱纯化,利用30 kDa截留分子量的超滤管对收集的洗脱液进行超滤换液,将溶液置换为强阴离子柱平衡液,第二步利用强阴离子柱进行纯化,纯化后两种蛋白利用抗His标签抗体进行WesternBlot鉴定。
将纯化后的SrtA、G-HC、LHN-LPETG蛋白按照摩尔比1:1:1混合后分装于EP管中,每支20 μL,分别置于37和30 ℃孵育0.5、1、2、4 h进行蛋白连接。孵育完成后进行SDS-PAGE鉴定及Western Blot鉴定,Western Blot所用一抗为特异性针对G-HC的抗体,二抗为山羊抗人IgG抗体。
1.2.7 分子筛纯化BoNT/A失活突变体
利用SuperdexG200分子筛(平衡液为20 mmol/L PBS、150 mmol/L NaCl)纯化连接体系中的BoNT/A失活突变体,少量多次收取穿过液,待完全收集穿过液后进行SDS-PAGE鉴定。
1.3 数据处理
利用DNAMAN软件比对分析阳性克隆序列是否正确;使用Gelpro Analyzer软件分析纯化蛋白纯度。
2. 结果与分析
2.1 pTIG-srtA质粒构建
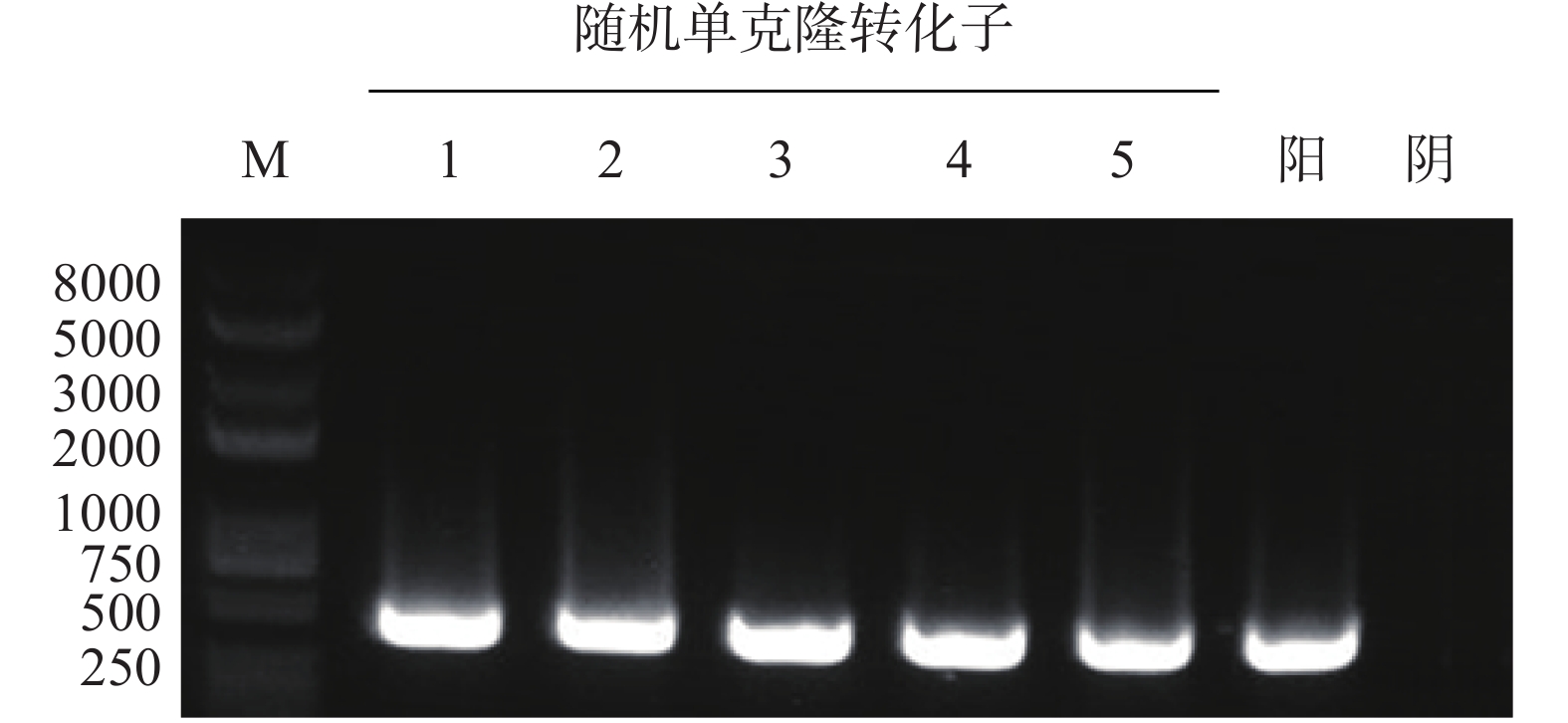
高活性突变型srtA基因序列按大肠杆菌表达系统密码子偏好性进行优化,并送公司进行全基因合成。PCR扩增后经EcoRI+XhoI双酶切连入pTIG质粒,转化至DH5α感受态,菌液PCR筛选阳性克隆,结果如图1所示,PCR扩增片段大小与srtA基因大小相符。阳性克隆测定序列经DNAMAN软件比对,结果显示与预期序列一致,表明成功构建pTIG-srtA基因表达载体。
2.2 SrtA蛋白表达
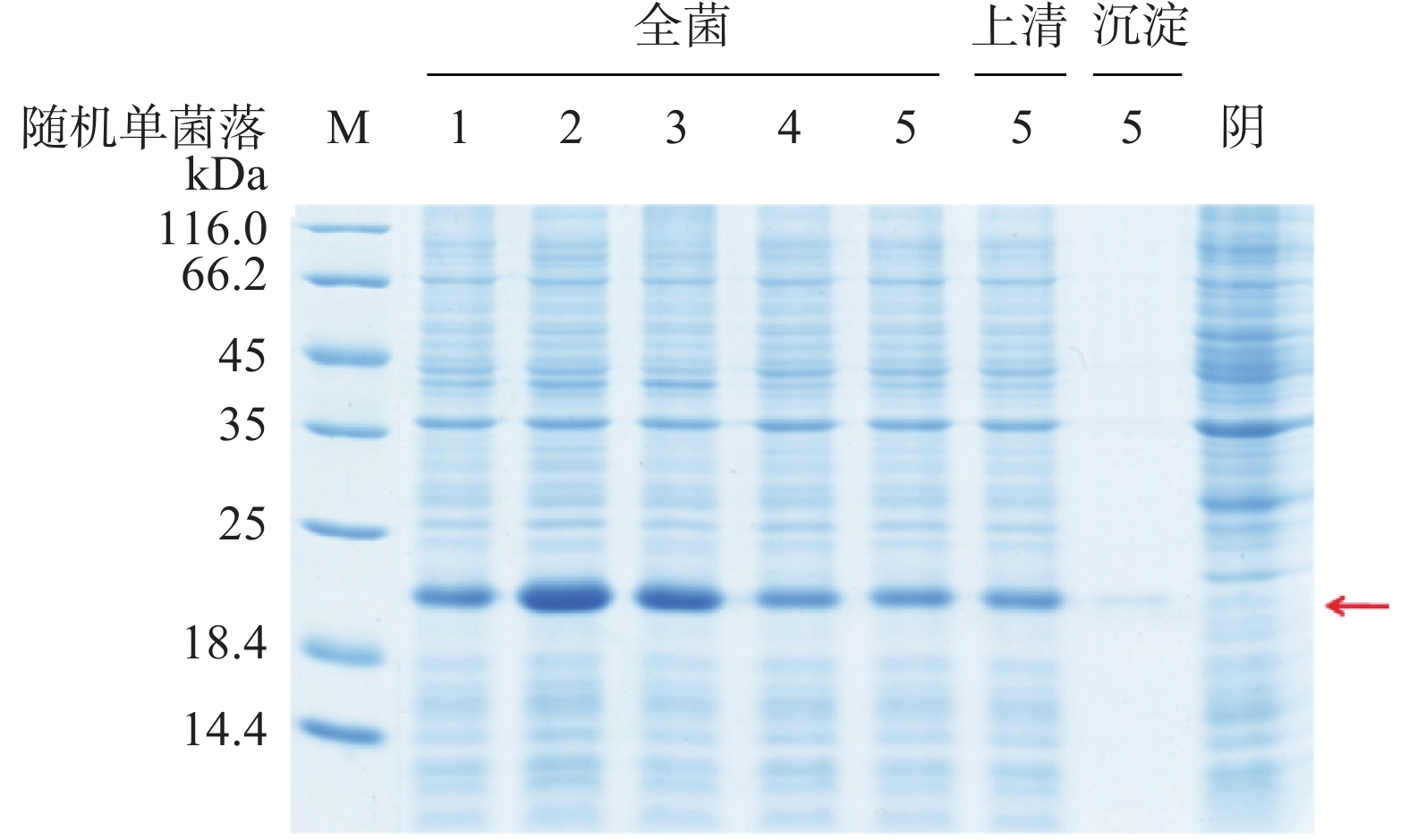
将表达载体pTIG-srtA基因转化至BL21(DE3)感受态,挑单菌落至LB(Amp)液体培养基中培养至对数期,加入IPTG,诱导表达过夜,收集菌体经超声裂解后进行SDS-PAGE分析。结果如图2所示,与阴性对照相比,1~5泳道都有特异性蛋白表达条带,分子量为20 kDa左右,与SrtA蛋白大小相符;而且目的蛋白大部分在菌体裂解上清部分,说明SrtA蛋白主要为可溶性表达。Gelpro Analyzer软件分析SrtA蛋白表达量占全菌蛋白55%。
2.3 SrtA蛋白纯化
挑取新鲜pTIG-srtA/BL21(DE3)单菌落至LB(Amp)液体培养基培养活化,转接至LB(Amp)液体培养基培养至对数生长期,加入IPTG置于16 ℃诱导过夜。离心收集菌体并超声裂解,第一步使用强阳离子柱进行纯化,收集洗脱液后液通过 3 kDa截留分子量的超滤管进行超滤换液,将溶液置换为Ni2+柱平衡液。第二步通过Ni2+亲和层析柱进行二次纯化,收集洗脱液20%~40%部分的洗脱峰(图3)进行SDS-PAGE鉴定,各泳道为分段接取的洗脱液,于20 kDa附近可见清晰条带。采用3 kDa截留分子量的超滤管进行超滤换液脱盐,经SDS-PAGE分析纯化蛋白纯度,Gelpro Analyzer软件分析纯化的结果表明SrtA蛋白纯度>95%(图4)。Western Blot分析表明纯化的SrtA蛋白能特异性地与抗His标签抗体结合(图5)。
2.4 SrtA蛋白活性鉴定
将表达载体pTIG-G-HC、pTIG-LHN-LPETG分别转化至BL21(DE3)感受态中进行表达,利用SDS-PAGE鉴定蛋白表达方式,Gelpro Analyzer软件分析蛋白表达量。如图6(a)所示,各泳道为分段接取的洗脱液,在50 kDa 附近有清晰条带,分子量大小与G-HC蛋白相符,表达量占全菌蛋白40%,且主要为可溶性表达。如图6(b)所示,各泳道为分段接取的洗脱液,在100 kDa附近有特异表达条带,分子量大小与LHN-LPETG蛋白相符,表达量占全菌蛋白25%,且主要为可溶性表达。
SDS-PAGE鉴定结果表明,G-HC及LHN-LPETG表达蛋白经纯化后得到较高纯度目的蛋白(图7);Western Blot分析表明纯化的G-HC及LHN-LPETG蛋白蛋白能特异性地与抗His标签抗体结合(图5)。
将纯化后的SrtA、G-HC、LHN-LPETG蛋白按照摩尔比1:1:1混合后分装于EP管中,于37和30 ℃连接0.5、1、2、4 h,结果如图8所示。随着连接时间的增加,在150 kDa附近逐渐出现条带,大小与BoNT/A失活突变体全长蛋白相符。如图9所示,Western Blot鉴定结果表明,连接蛋白可以与抗G-Hc抗体结合,进一步表明150 kDa处连接蛋白为BoNT/A失活突变体全长蛋白。
连接体系经分子筛纯化后收集目的蛋白洗脱峰,SDS-PAGE电泳结果显示在150 kDa附近有可见条带,表明纯化得到全长BoNT/A活性突变体蛋白(图10)。
3. 结论
大肠杆菌表达系统是一种应用广泛的蛋白制备技术,其具有操作难度低、成本低廉、 制备周期短等优点[26-27],实验室前期尝试在大肠杆菌原核表达系统中表达未经密码子优化的srtA基因,但与文献报道结果一致,原始SrtA蛋白表达水平低而且主要为包涵体[11],后续纯化难度较大且需要复性[28],其原因可能是在原核细胞表达系统中,由于蛋白合成速度过快,导致目的蛋白存在来不及正确折叠及组装的情况,会形成无生物活性的蛋白聚集物即包涵体[29-30]。本研究将srtA基因按大肠杆菌表达系统偏好性进行密码子优化,并克隆入pTIG表达载体与硫氧还蛋白(Trx)进行共表达,结果表明在大肠杆菌BL21(DE3)中经16℃低温诱导过夜实现了SrtA蛋白的可溶性高表达,表达量占全菌蛋白的50%以上。进一步亲和层析纯化得到了纯度>95%的SrtA蛋白。纯化的SrtA蛋白能够完成带有特征识别序列的BoNT/A失活突变体的两部分片段LHN-LPETG和G-HC的酶法连接,得到全长的BoNT/A失活突变体蛋白,这充分说明在大肠杆菌中表达纯化的SrtA蛋白具有转肽酶活性。
-
表 1 引物设计
Table 1 Primer design
引物 引物序列(5’ -3’) F- pTIG-srtA GGGAATTCTAATGGCTAAACCTCAAATTCCGAAAG R- pTIG-srtA CCCTCGAGTTTGACTTCTGTAGCTACAAAGATTTTAC 注:下划线为酶切位点,GAATTC:EcoRI;CTCGAG:XhoI。 表 2 纯化平衡液、洗脱液
Table 2 loading buffer and elution buffer
名称 配方及pH Ni2+柱纯化平衡液 20 mmol/L PB,200 mmol/L氯化钠,20 mmol/L咪唑,调整pH至7.4 Ni2+柱纯化洗脱液 20 mmol/L PB,200 mmol/L氯化钠,500 mmol/L咪唑,调整pH至7.4 LHN强阴离子柱纯化平衡液 20 mmol/L Tris-HCl,调整pH至7.0 LHN强阴离子柱纯化洗脱液 20 mmol/L Tris-HCl,1 mol/L NaCl调整pH至7.0 SrtA强阳离子柱纯化平衡液 20 mmol/L PB,调整pH至7.5 SrtA强阳离子柱纯化洗脱液 20 mmol/L PB,1 mol/L NaCl调整pH至7.5 G-HC强阳离子柱纯化平衡液 20 mmol/L PB,调整 pH至8.0 G-HC强阳离子柱纯化洗脱液 20 mmol/L PB,1 mol/L NaCl 调整pH至8.0 -
[1] Paterson G K, Mitchell T J. The biology of Gram-positive sortase enzymes[J]. Trend Microbiol,2004,12(2):89−95. doi: 10.1016/j.tim.2003.12.007
[2] Otto M. Staphylococcus epidermidis-the accidental pathogen[J]. Nat Rev Microbiol,2009,7(8):555−567. doi: 10.1038/nrmicro2182
[3] 谭超, 邹黎黎, 王君. 以转肽酶A为靶点的表皮葡萄球菌感染干预机制初探[J]. 中国新药杂志,2013,22(12):1406−1409. [4] Huang X, Aulabaugh A, Ding W, et al. Kinetic mechanism of Staphylococcus aureus sortase SrtA[J]. Biochemistry,2003,42(38):11307−11315. doi: 10.1021/bi034391g
[5] Davies J R, Svensäter G, Herzberg M C. Identification of novel LPXTG-linked surface proteins from Streptococcus gordonii[J]. Microbiology (13500872),2009,2(1):7−8.
[6] 朱芳, 邓思, 罗立新. 分选酶A在pET32a(+)原核表达载体中的表达和鉴定[J]. 生物技术通报,2011(6):218−222. [7] Navarre W W, Schneewind O. Proteolytic cleavage and cell wall anchoring at the LPXTG motif of surface proteins in gram-positive bacteria[J]. Molecular Microbiology, 1994, 14(1): 115−121.
[8] Wu Z, Hong H, Zhao X, et al. Efficient expression of sortase A from Staphylococcus aureus in Escherichia coli and its enzymatic characterizations[J]. Bioresources and Bioprocessing,2017,4(1):63−65.
[9] Lu C, Zhu J, Wang Y, et al. Staphylococcus aureus sortase A exists as a dimeric protein in vitro[J]. Biochemistry,2007,46(32):9346−9354. doi: 10.1021/bi700519w
[10] 邓思, 罗立新. 分选酶A(SrtA)的GST融合表达、纯化及活性测定[J]. 生物技术通报,2012(5):121−125. [11] 胡义芳, 杨朝博, 秦松, 等. 金黄色葡萄球菌SortaseA原核表达纯化方法的研究进展[J]. 海南医学,2016,27(10):1640−1643. doi: 10.3969/j.issn.1003-6350.2016.10.031 [12] Zhao X, Hong H, Wu Z. Efficient extracellular expression of transpeptidase sortase A in Pichia pastoris[J]. Protein Expression & Purification,2017,133:132−138.
[13] Z Wu, X Guo, Z Guo. Sortase a-catalyzed peptide cyclization for the synthesis of macrocyclic peptides and glycopeptides[J]. Chemical Communications, 2011, 47(32): 9218-9220.
[14] Guo X, Wang Q, Swarts B M, et al. Sortase-catalyzed peptide-glycosylphosphatidylinositol analogue ligation[J]. Journal of the American Chemical Society,2009,131(29):9878. doi: 10.1021/ja903231v
[15] Levary D A, Ranganath P, Boder E T, et al. Protein-protein fusion catalyzed by sortase A[J]. Plos One,2011,6(4):e18342. doi: 10.1371/journal.pone.0018342
[16] 李健, 王鹏举, 崔云凤, 等. 检测SortaseA酶催化蛋白质连接效率的新型报道系统[J]. 生物工程学报,2014,30(2):284−293. [17] Chen I, Dorr B M, Liu D R. A general strategy for the evolution of bond-forming enzymes using yeast display[J]. Proceedings of the National Academy of Sciences,2011,108(28):11399−11404. doi: 10.1073/pnas.1101046108
[18] 任桂萍, 董璎莹, 党云琨. 密码子中的密码: 密码子偏好性与基因表达的精细调控[J]. 中国科学: 生命科学,2019,49(7):839−847. [19] Ruth, Hershberg, Dmitri A, et al. Selection on codon bias.[J]. Annual review of genetics,2008,42:287−299. doi: 10.1146/annurev.genet.42.110807.091442
[20] 朱沛煌, 陈妤, 朱灵芝, 等. 马尾松转录组密码子使用偏好性及其影响因素[J]. 林业科学,2020,56(4):74−81. doi: 10.11707/j.1001-7488.20200408 [21] 刘慧, 王梦醒, 岳文杰, 等. 糜子叶绿体基因组密码子使用偏性的分析[J]. 植物科学学报,2017,35(3):362−371. doi: 10.11913/PSJ.2095-0837.2017.30362 [22] 冯淼, 王璐, 田敬东. 基因合成技术研究进展[J]. 生物工程学报,2013,29(8):1075−1085. [23] 李雷, 姜卫红, 覃重军, 等. 合成生物学使能技术的研究进展[J]. 中国科学: 生命科学,2015,45(10):950−968. [24] 周栋, 成子强, 刘建柱, 等. 猪附红细胞体ORF2的全基因合成、表达与鉴定[J]. 中国兽医学报,2011,31(8):1184−1188. [25] 杨鼎, 吴江鸿, 祁云霞, 等. 牛肌酸激酶同功酶CK-BB的全基因合成及其原核表达[J]. 畜牧与饲料科学,2016,37(2):29−33. doi: 10.3969/j.issn.1672-5190.2016.02.012 [26] 刘爽, 胡宝成. 原核系统可溶性表达策略[J]. 生物技术通讯,2005(2):172−175. doi: 10.3969/j.issn.1009-0002.2005.02.019 [27] Mitraki A, Fane B, Haase-Pettingell C, et al. Global suppression of protein folding defects and inclusion body formation.[J]. Science,1991,253(5015):54−58. doi: 10.1126/science.1648264
[28] 朱翔宇, 蔡熙姮, 史宁, 等. 水貂细小病毒VP2基因的可溶性表达优化及包涵体蛋白复性研究[J]. 动物医学进展,2020,41(6):1−6. doi: 10.3969/j.issn.1007-5038.2020.06.001 [29] 邓春梅, 葛玉强, 刘丽, 等. 外源基因表达系统的研究进展[J]. 现代生物医学进展,2010,10(19):3744−3746. [30] Nuc P, Nuc K. Recombinant protein production in Escherichia coli[J]. Postepy Biochem,2006,52(4):448−456.





 下载:
下载:



 下载:
下载:
