Microwave-assisted Extraction Technology and Functional Properties of Protein from Amygdalus communis L. Seed Kernel
-
摘要: 本文采用微波辅助碱溶酸沉法提取巴旦木中的蛋白质,在单因素实验基础上,采用L16(45)正交试验设计,研究微波预处理功率、微波预处理时间、提取液pH、提取温度和料液比对巴旦木蛋白提取率的影响。结果表明,微波辅助提取巴旦木蛋白的最佳工艺条件为:微波功率400 W、微波时间180 s、提取液pH 9.5、提取温度50 ℃和料液比1:25 g/mL,在此条件下测出的巴旦木蛋白提取率达到46.69%。相较于未经微波辅助提取的巴旦木蛋白,微波处理后蛋白的溶解性、持水性、持油性、乳化性和起泡性分别提升了15.35%、26.07%、26.22%、30.61%和20.53%,而乳化稳定性和泡沫稳定性分别降低了1.05%和13.29%,研究表明,微波处理有助于提高巴旦木蛋白的提取率并改善功能性质。Abstract: The protein was extracted from almond (Amygdalus communis L.) seed kernel by microwave-assisted alkaline extraction and acid precipitation method. Based on single factor test, the effect of microwave power, microwave time, extracted pH, extracted temperature and solid/liquid ratio (W/V) on the extraction rate of protein were studied according to L16(45) orthogonal test. The results showed that the optimum microwave-assisted extracting conditions of protein from almond seed kernel were microwave power 300 W, microwave time 180 s, extracted pH9.5, extracted temperature 50 ℃ and solid/liquid ratio 1:25 g/mL. The extraction rate of protein was 46.69% under the above optimal extracting conditions. Compared with commonly extracted methods, the functional properties of almond seed kernel protein by microwave-assisted were improved, such as solubility, water holding capacity, oil holding capacity, emulsifying ability and foaming ability were increased by 15.35%, 26.07%, 26.22%, 30.61% and 20.53%, respectively. the emulsion stability and foam stability were slightly decreased by 1.05% and 13.29%, respectively. It was concluded that microwave-assisted treatment would be favor to increase the extraction rate and improve functional properties of almond seed kernel protein.
-
巴旦木(Amygdalus communis L.)又名巴旦杏,是蔷薇科李亚科桃属乔木,因其外形扁如桃,又名扁桃,为世界上著名的木本油料和干果树种[1]。巴旦木作为坚果,不但具有很好的口感,其营养价值也极高,巴旦木含有丰富的蛋白质、脂肪、膳食纤维等,是诸多营养物质的良好资源,如单不饱和脂肪酸、α-生育酚、多种维生素、无机盐、精氨酸、植物甾醇和多酚类物质等[2-4]。但目前国内外针对于巴旦木蛋白的提取和应用报道较少,孙月娥等[2]采用碱提酸沉法和超声辅助碱法提取巴旦木蛋白工艺的研究,陶永霞等[5]采用酶法制备巴旦木蛋白,但还未见采用微波辅助碱法提取巴旦木蛋白的相关报道。
本研究通过单因素实验和正交试验对微波辅助碱法提取巴旦木蛋白的工艺条件进行研究,并进一步对微波辅助减法提取的巴旦木蛋白与未经微波辅助提取的巴旦木蛋白的功能性质进行对比评价,旨在为提取、开发利用巴旦木蛋白和工业化生产巴旦木蛋白提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
巴旦木 哈尔滨南极百货批发市场新疆产薄壳类品种;石油醚、考马斯亮蓝G-250、氢氧化钠、盐酸、苯酚、浓硫酸、十二烷基磺酸钠等试剂 分析纯,国药集团。
Buchi凯式定氮仪 瑞士Buchi实验室设备有限公司;722型紫外可见分光光度计 上海佑科仪器仪表厂;JB-2型恒温磁力搅拌器 上海新泾仪器有限公司;TDL-4离心机 安亭科学仪器厂;PHS-25系列酸度计、AUY120分析天平 上海精密科学仪器有限公司;HH-4数显恒水浴锅 索式抽提器 南京晚晴化玻仪器有限公司;数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;微波仪 上海新仪微波化学科技有限公司。
1.2 实验方法
1.2.1 巴旦木基本成分含量的测定
水分:按照GB 5009.3-2016中直接干燥法进行测定;粗蛋白:按照GB 5009.5-2016中凯氏定氮法进行测定;粗脂肪:按照GB 5009.6-2016中索氏抽提法进行测定;总糖:苯酚-硫酸法[6],标曲方程为y=11.012x+0.0132,R2=0.9989;灰分:按照GB 5009.3-2016进行测定。
1.2.2 巴旦木的脱脂
对巴旦木的脱脂操作参考孙月娥等[2]的方法进行。将巴旦木手工去壳后于40 ℃烘箱干燥,粉碎过40目筛,室温下用石油醚(30~60 ℃)脱脂3 h,置通风橱中12 h以挥发溶剂,得脱脂巴旦木粕,于4 ℃保存备用。
1.2.3 微波辅助提取巴旦木蛋白的工艺流程
将脱脂巴旦木粕以一定料液比制成溶液,并用0.5 mol/LNaOH溶液调节pH至9.5,然后将溶液置于微波仪中进行微波处理,之后在4500 r/min下离心20 min并收集上清液,并用1 mol/L的盐酸调节上清液pH至4.5,此后对上清液再次进行离心处理收集沉淀并水洗,重复该操作数次直至水洗为中性,最后将沉淀物冻干,即得到巴旦木蛋白。
1.2.4 单因素实验设计
以巴旦木蛋白提取率为指标,选取微波功率、微波时间、提取液pH、提取温度和料液比5个因素进行单因素实验,考察各因素对巴旦木蛋白提取率的影响。
1.2.4.1 微波功率对巴旦木蛋白提取率的影响
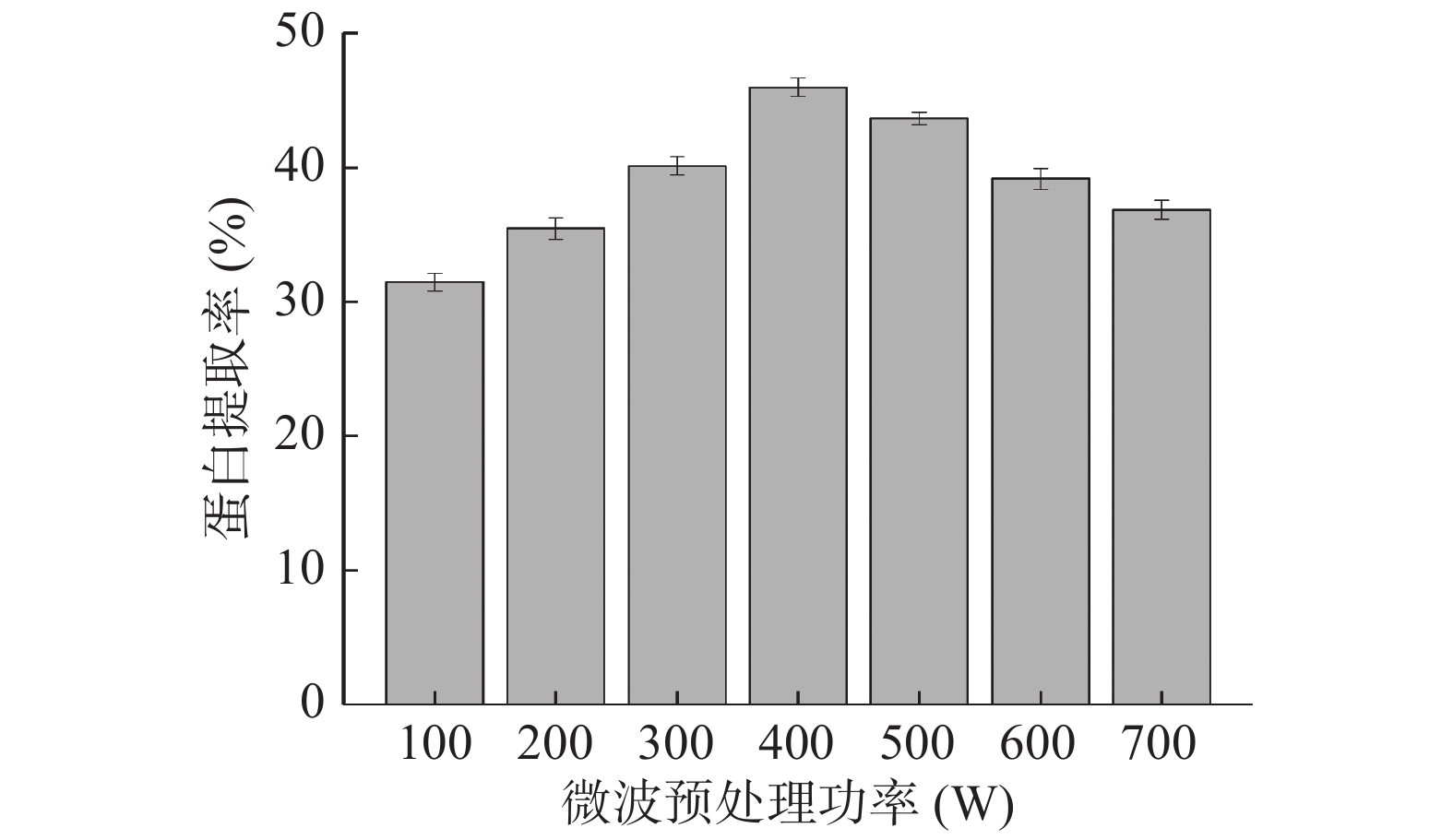
固定微波时间为180 s,提取液pH为9.5,提取温度为45 ℃,料液比为1:25 g/mL,研究微波功率(100、200、300、400、500、600、700 W)对巴旦木蛋白提取率的影响;
1.2.4.2 微波时间对巴旦木蛋白提取率的影响
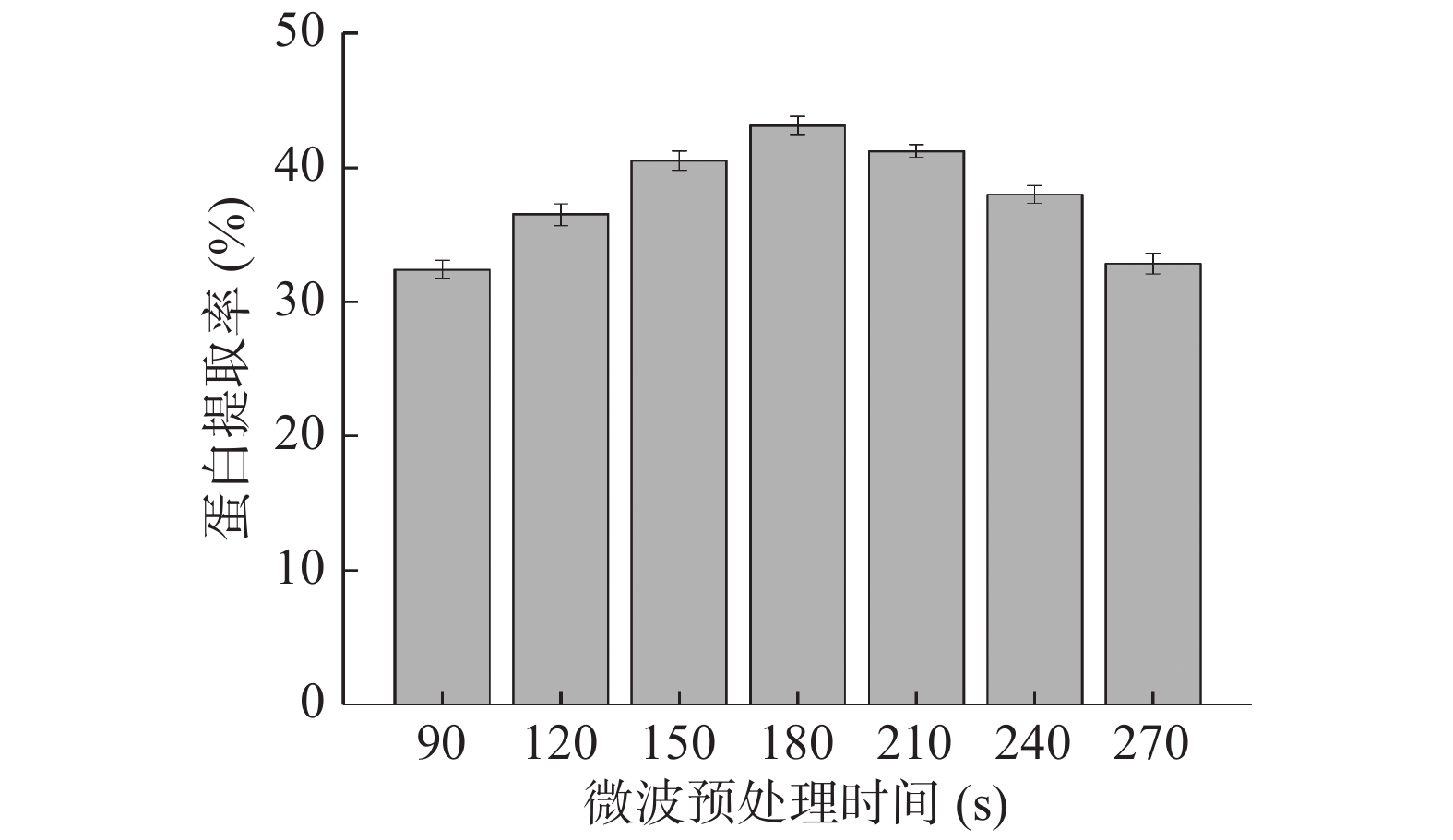
固定微波功率400W,提取液pH为9.5,提取温度为45℃,料液比为1:25 g/mL,研究微波时间(90、120、150、180、210、240、270 s)对巴旦木蛋白提取率的影响;
1.2.4.3 提取液pH对巴旦木蛋白提取率的影响
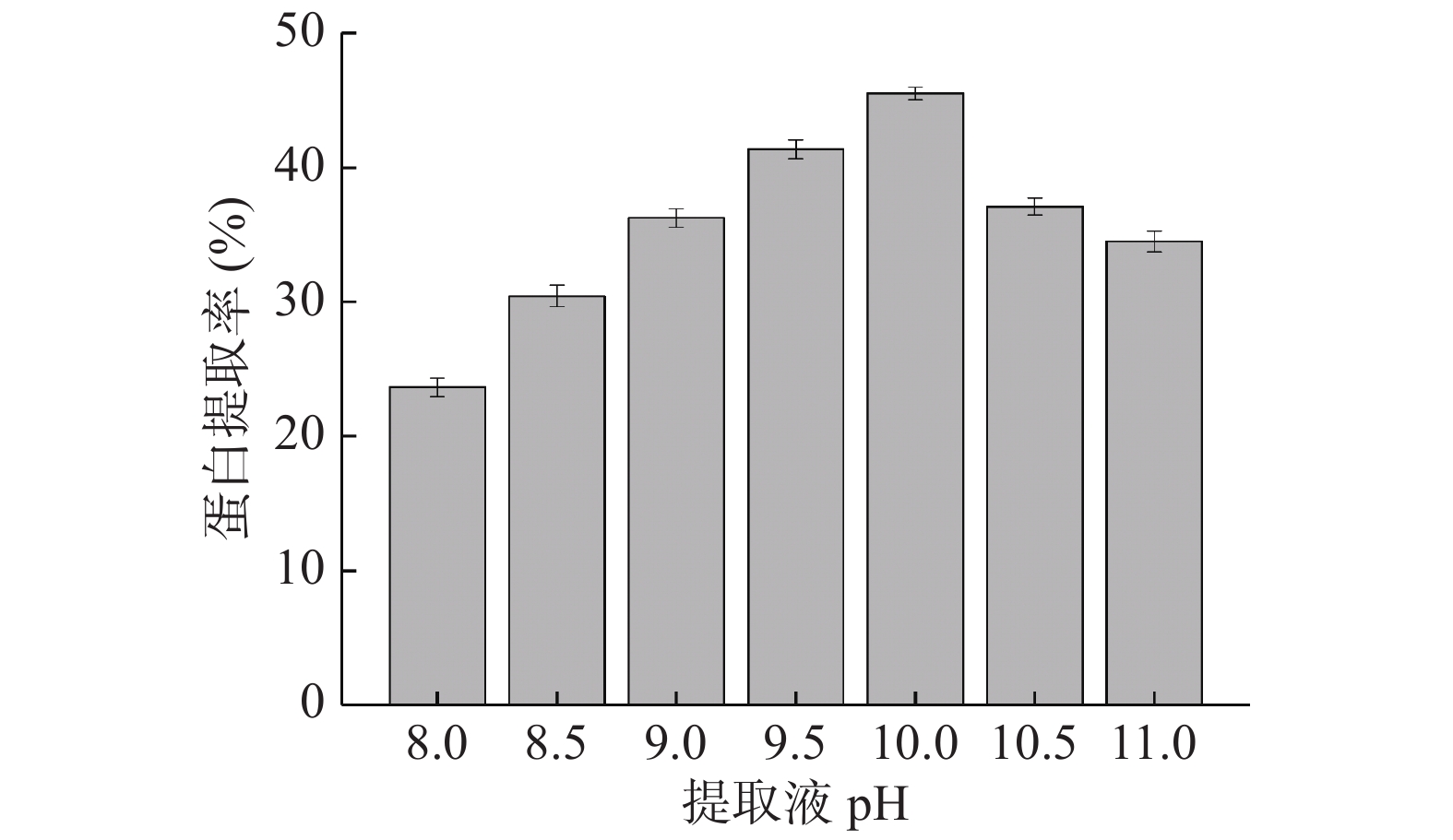
固定微波功率400 W,微波时间180 s,提取温度45 ℃,料液比为1:25 g/mL,研究提取液pH(8.0、8.5、9.0、9.5、10、10.5、11.0)对巴旦木蛋白提取率的影响;
1.2.4.4 提取温度对巴旦木蛋白提取率的影响
固定微波功率400 W,微波时间180 s,提取液pH为9.5,料液比为1:25 g/mL,研究提取温度(30、35、40、45、50、55、60 ℃)对巴旦木蛋白提取率的影响;
1.2.4.5 料液比对巴旦木蛋白提取率的影响
固定微波功率400 W,微波时间180 s,提取液pH为9.5,提取温度为45 ℃,研究料液比(1:10、1:15、1:20、1:25、1:30、1:35、1:40 g/mL)对巴旦木蛋白提取率的影响。
1.2.5 正交试验设计
在单因素实验设计基础上,对影响巴旦木蛋白提取率的主要因素微波功率、微波时间、提取液pH、提取温度和料液比进行L16(45)正交试验,因素水平见表1。
表 1 L16(45)试验设计的因素水平设计Table 1. Levels and factors of L16 (45) orthogonal experiment水平 因素 A微波功率(W) B微波时间(s) C提取液pH D提取温度(℃) E料液比(g/mL) 1 300 150 9.0 40 1:20 2 400 180 9.5 45 1:25 3 500 210 10 50 1:30 4 600 240 10.5 55 1:35 1.2.6 巴旦木蛋白的提取率计算
采用考马斯亮蓝法测定提取液中的蛋白质含量,按照下式计算蛋白提取率:
(1) 1.2.7 巴旦木蛋白功能性的测定
采用正交试验优化的最佳条件提取巴旦木蛋白,然后冷冻干燥并于−4℃条件下冷藏备用,进一步分别测定巴旦木蛋白的溶解性、持水性和持油性、乳化性和乳化稳定性、起泡性和起泡稳定性等功能性质,以未经微波处理且相同其他条件下提取的巴旦木蛋白作为对照。
1.2.7.1 溶解性的测定
蛋白质溶解性的测定参考李永恒等[7]的方法进行。配制1 g/100 mL的蛋白溶液,调节蛋白溶液pH至7.0,混匀后在室温下震荡30 min,取出10 mL在4000 r/min下离心20 min,倒出上清液并定容至25 mL,再取出10 mL上清液测定其中蛋白质含量,上清液中的蛋白质含量和样品中的总蛋白质含量均采用采用考马斯亮蓝法进行测定。蛋白质溶解性用溶氮指数(NSI)来表示,测定公式如下:
(2) 1.2.7.2 持水性和持油性的测定
蛋白质持水性和持油性测定参考李永恒等[7]方法进行。取1 g蛋白样品放入离心管中,称量质量m1,加入10 mL蒸馏水/大豆油,混匀并在室温下静置30 min。然后在4000 r/min下离心20 min,弃去上清液。测量离心管和沉淀的总质量m2。持水性和持油性的计算公式如下:
(3) 式中,m0为蛋白样品的质量,g;m1为蛋白与离心管的质量,g;m2为离心后沉淀物与离心管的质量,g。
1.2.7.3 乳化性和乳化稳定性的测定
蛋白质乳化性和乳化稳定性的测定参考李永恒等[7]方法进行。用蒸馏水配制浓度为0.1 g/100 mL的蛋白溶液。用1 mol/L的氢氧化钠溶液和1 mol/L的盐酸溶液调节蛋白溶液pH至7.0。分别取30 mL溶液于烧杯中,加入10 mL的大豆油,在10000 r/min下均质1 min。然后立即从烧杯底部取200 μL溶液加到0.1%的SDS溶液中,以0.1%的SDS溶液作为空白对照,于500 nm波长下测定吸光值A0。室温下静置10 min后再次取样,测定吸光值A1。乳化性(EAI)和乳化稳定性(ESI)的计算公式如下:
(4) (5) 式中:A0为0时刻的样品吸光值;A1为10 min时的样品吸光值;N为稀释倍数;φ为油相所占的体积分数;L为比色皿的光路长度,1 cm;c为蛋白的质量浓度,g/mL;T0为放置时间为0min;T为放置时间10 min。
1.2.7.4 起泡性和气泡稳定性的测定
起泡性和气泡稳定性的测定参考李永恒等[7]方法进行。用蒸馏水配制1 g/100 mL的蛋白溶液。用1 mol/L的氢氧化钠溶液和1 mol/L的盐酸溶液调节蛋白溶液pH至7.0。分别取50 mL溶液于烧杯中,用高速均质机在10000 r/min条件下均质2 min。均质后立即转移至量筒中并测定体积V1,30 min后再次测定体积V2。起泡性(FC)和泡沫稳定性(FS)的计算公式如下:
(6) (7) 式中:V0为均质前溶液体积,mL;V1为均质2 min后的溶液体积,mL;V2为均质后静置30 min后的溶液体积,mL。
1.3 数据处理
所有单因素及正交试验分别进行3次平行试验,结果以x±s表示,并采用Origin 9.2进行图表绘制,SPSS 23.0分析软件对实验数据进行分析。
2. 结果与分析
2.1 巴旦木基本成分
从表2中可以看出,巴旦木中含有较多的蛋白质和脂肪,可以进一步用于提取蛋白质和脂肪,因此,具有很好的开发和利用价值以提高该特产资源的附加值。
表 2 巴旦木基本成分Table 2. Basic chemical of composition of almond seed kernel基本成分 含量(%) 水分 6.23±0.05 粗蛋白 26.36±0.08 粗脂肪 55.43±0.09 总糖 9.64±0.06 灰分 2.34±0.04 2.2 单因素实验结果
2.2.1 微波功率对蛋白质提取率的影响
由图1可见,随着微波功率的不断提高,巴旦木蛋白的提取率也随之增加,当功率达到400 W时,蛋白提取率达到最大值,这是由于在微波功率较低时,巴旦木蛋白有效成分还未完全释放,随着微波功率的升高,有效成分的释放程度也随之增加[8],因此,巴旦木蛋白的提取率呈上升趋势。此后,随着微波功率继续增大至700 W时,巴旦木蛋白的提取率反而出现明显的下降,这可能是当微波功率进一步增加时会导致温度升高,微波的强热效应会引起蛋白质发生热变性[9],并且还会造成杂质成分被释放出来[8],从而降低了巴旦木蛋白的提取率,因此综合考虑,选取微波功率为300~600 W范围用于进一步的正交优化试验。
2.2.2 微波时间对蛋白质提取率的影响
由图2可见,当微波时间小于180 s时,随着微波时间的增加巴旦木蛋白提取率不断增大,当达到180 s时,蛋白提取率达到最大值,此后,随着微波时间进一步延长,蛋白提取率反而逐渐下降。巴旦木蛋白中的肽键和部分氨基酸侧链等极性基团在微波的作用下会产生振动而促进蛋白质分子结构逐渐松散,从而有利于可溶性蛋白的溶出,表现为较高的蛋白提取率[7,10];然而,微波时间较短时却不足以促进巴旦木中的可溶性蛋白得到充分释放;相反,微波时间过长则会引起物料温度升高而导致蛋白被破坏,并造成蛋白变性程度加深,引起水溶性氮含量的下降[11-12],从而影响了对蛋白质的提取效果。综合考虑,选取微波时间150~240 s进行进一步的正交优化试验。
2.2.3 提取液pH对巴旦木蛋白提取率的影响
从图3中可以看出,当提取液pH小于10.0时,巴旦木蛋白的提取率随着pH的升高而逐渐增加,当pH达到10.0时,蛋白提取率达到最大值,由于巴旦木蛋白中清蛋白含量最为丰富[13],而清蛋白易溶于稀碱溶液,所以巴旦木蛋白的提取率会随着pH的升高而不断增加。此后,随着pH的继续增加,蛋白提取率呈现下降趋势,这可能是由于提取液碱性增强,会部分改变蛋白质分子表面的电荷数量及分布,增加了蛋白质的水溶解性,在酸沉淀过程中造成了部分蛋白质的损失[14-15];而当碱性过强时,容易出现蛋白质脱氨、脱羧、肽键断裂等现象,这会引起胱赖反应而产生有毒物质[2],并会产生不良异味,造成蛋白质的损失,从而导致蛋白质的提取率降低。综合考虑,选取提取液pH9.0~10.5进行进一步的正交优化试验。
2.2.4 提取温度对蛋白提取率的影响
由图4可知,巴旦木蛋白的提取率随着提取率温度的升高表现出先升高后降低的趋势,并且在提取温度为50 ℃时蛋白的提取率最高。在蛋白提取的过程中,蛋白质分子结构的构象会随着提取温度的升高发生一定变化,主要表现为升温能够促使蛋白质分子的立体结构逐渐疏松,这有利于蛋白质分子和水分子之间的相互作用,促进了蛋白质的溶解,从而起到了对蛋白质的增溶效果[7,16];然而,当提取温度超过50 ℃以后,随着提取温度的继续升高,会造成维系蛋白质空间构象的较弱作用力和次级键减弱或断裂,导致更多的非极性基团暴露在蛋白分子表面,这会降低蛋白质分子和水分子之间的相互作用而促进了蛋白质分子之间的结合并形成沉淀[5],从而影响了巴旦木蛋白的提取率。综合考虑,选取提取温度40~55 ℃进行进一步的正交优化试验。
2.2.5 料液比对蛋白质提取率的影响
由图5可知,料液比在1:10~1:25 g/mL范围时,随着提取溶剂比例的增加,巴旦木蛋白的提取率也随之升高,这可能是因为适当提高提取溶剂加入的比例能够增强溶质的分散程度,促进了溶质与溶剂之间的接触,这有利于蛋白质的充分溶出,从而提高了蛋白质的提取率[16-17];此后随着提取溶剂加入比例继续增加时,蛋白质的提取率出现了略微下降的趋势,这是由于提取溶剂加入过多,会导致蛋白质分子与水分子间的相互作用增加,反而会导致的蛋白质分子不易于沉淀,在酸沉淀过程会有一部分蛋白质流失到上清液中,从而造成了蛋白质的损失[18]。此外,料液比过低时,会导致提取溶剂的浪费,并会增加后处理的负担,使产品成本增加,综合考虑实际生产及经济因素,确定选取料液比1:20~1:35 g/mL进行进一步的正交优化试验。
2.3 正交试验结果
在单因素实验基础上,以微波功率、微波时间、提取液pH、提取温度和料液比为因素,以蛋白提取率为指标设计L16(45)正交试验优化微波辅助提取巴旦木蛋白的最佳工艺参数,正交试验结果见表3。
表 3 正交试验结果Table 3. Orthogonal experiment results实验号 A微波功率(W) B微波时间(s) C提取液pH D提取温度(℃) E料液比(g/mL) 蛋白提取率(%) 1 300 150 9.5 40 1:20 43.38 2 300 180 10.0 45 1:25 45.92 3 300 210 10.5 50 1:30 45.59 4 300 240 11.0 55 1:35 44.12 5 400 150 10.0 50 1:35 46.13 6 400 180 9.5 55 1:30 46.52 7 400 210 11.0 40 1:25 45.43 8 400 240 10.5 45 1:20 45.27 9 500 150 10.5 55 1:25 45.07 10 500 180 11.0 50 1:20 44.78 11 500 210 9.5 45 1:35 44.21 12 500 240 10.0 40 1:30 44.69 13 600 150 11.0 45 1:30 43.87 14 600 180 10.5 40 1:35 43.69 15 600 210 10.0 55 1:20 44.16 16 600 240 9.5 50 1:25 44.92 k1 44.753 44.613 44.758 44.297 44.398 k2 45.838 45.227 45.225 44.818 45.335 k3 44.688 44.848 44.905 45.355 45.168 k4 44.160 44.750 44.550 44.968 44.538 R 1.678 0.614 0.675 1.058 0.937 由表3的极差分析可知,影响微波辅助提取巴旦木蛋白的因素顺序依次为:微波功率>提取温度>料液比>提取液pH>微波时间。以蛋白提取率为指标优化的理论最佳提取工艺因素水平组合为A2B2C2D3E2,即微波温度400 W、微波时间180 s、提取液pH9.5、提取温度50 ℃和料液比1:25 g/mL时,巴旦木蛋白的提取率达到最高。参照此最佳组合条件实施平行试验,测出巴旦木蛋白提取率为46.69%。相较于未经微波处理而相同其他条件下测定得到的巴旦木蛋白提取率31.28%可以看出,采用微波辅助碱提法能够显著提高巴旦木蛋白的提取率。
2.4 巴旦木蛋白质功能性质的评价
蛋白质的功能性质包括溶解性、持水性、持油性、起泡性和气泡稳定性、乳化性和乳化稳定性等。蛋白质的这些功能性质对食品的可加工性能以及产品的口感、质地等食用品质等具有重要的影响。因此,通过测定巴旦木蛋白这5个性质指标,对比分析微波处理对提取的巴旦木蛋白功能性质的影响,结果如表4所示。
表 4 微波预处理与未经微波预处理的巴旦木蛋白功能性质比较Table 4. Comparison of functional properties of microwave-assisted extracted and commonly extracted almond seed kernel proteins原料预处理方式 溶解性(%) 持水性(g·g−1) 持油性(g·g−1) 乳化性(m2·g−1) 乳化稳定性(%) 起泡性(%) 气泡稳定性(%) 微波 55.24±0.25a 4.11±0.12a 6.21±0.08a 25.94±0.15a 6.94±0.12b 74.86±0.38a 71.22±0.42b 未微波 47.89±0.17b 3.26±0.09b 4.92±0.10b 19.86±0.11b 7.59±0.09a 62.11±0.25b 82.14±0.53a 注 同列不同字母表示差异显著(P<0.05)。 从表4中可以看出,微波辅助提取的巴旦木蛋白的溶解性、持水性、持油性、乳化性和起泡性分别为55.24%、4.11 g/g、6.21 g/g、25.94 m2/g和74.86%,相较于未经微波处理的巴旦木蛋白,其溶解性、持水性、持油性、乳化性和起泡性分别提升了15.35%、26.07%、26.22%、30.61%和20.53%,然而,微波辅助提取的巴旦木蛋白的乳化稳定性和泡沫稳定性略有降低,降低幅度分别为1.05%和13.29%。巴旦木蛋白在微波的作用下,其蛋白质分子内部的二硫键断裂并形成巯基,这阻碍了蛋白质之间的聚集,同时,蛋白分子结构的伸展有利于水分向其内部的进入,这促进了亲水基团与水分子的充分结合,因此,微波处理后蛋白的溶解性和持水性均得到提高[7,19]。蛋白质的起泡性、乳化性等功能性质与其溶解性大小密切相关,随着蛋白质溶解性的增大,蛋白更易于向气-水或油-水界面扩散并降低表面张力,从而提高了蛋白质的起泡性和乳化性等功能性质[20]。
3. 结论
在微波辅助提取巴旦木蛋白的实验中,影响巴旦木蛋白提取率的因素顺序依次为:微波功率>提取温度>料液比>提取液pH>微波时间。通过正交优化试验得到微波辅助提取巴旦木蛋白的最佳工艺条件为:微波温度400 W、微波时间180 s、提取液pH 9.5、提取温度50 ℃和料液比1:25 g/mL,在此条件下测出巴旦木蛋白提取率可达到46.69%。相较于未经微波处理而相同其他条件下提取的巴旦木蛋白来说,微波处理显著提高了巴旦木蛋白的功能性质,如溶解性、持水性、持油性、乳化性和起泡性分别提升了15.35%、26.07%、26.22%、30.61%和20.53%,但乳化稳定性和泡沫稳定性略有降低,降低幅度分别为1.05%和13.29%。研究结果表明对巴旦木进行合理的微波处理,有助于提高巴旦木蛋白的提取率并改善功能性质。
-
表 1 L16(45)试验设计的因素水平设计
Table 1 Levels and factors of L16 (45) orthogonal experiment
水平 因素 A微波功率(W) B微波时间(s) C提取液pH D提取温度(℃) E料液比(g/mL) 1 300 150 9.0 40 1:20 2 400 180 9.5 45 1:25 3 500 210 10 50 1:30 4 600 240 10.5 55 1:35 表 2 巴旦木基本成分
Table 2 Basic chemical of composition of almond seed kernel
基本成分 含量(%) 水分 6.23±0.05 粗蛋白 26.36±0.08 粗脂肪 55.43±0.09 总糖 9.64±0.06 灰分 2.34±0.04 表 3 正交试验结果
Table 3 Orthogonal experiment results
实验号 A微波功率(W) B微波时间(s) C提取液pH D提取温度(℃) E料液比(g/mL) 蛋白提取率(%) 1 300 150 9.5 40 1:20 43.38 2 300 180 10.0 45 1:25 45.92 3 300 210 10.5 50 1:30 45.59 4 300 240 11.0 55 1:35 44.12 5 400 150 10.0 50 1:35 46.13 6 400 180 9.5 55 1:30 46.52 7 400 210 11.0 40 1:25 45.43 8 400 240 10.5 45 1:20 45.27 9 500 150 10.5 55 1:25 45.07 10 500 180 11.0 50 1:20 44.78 11 500 210 9.5 45 1:35 44.21 12 500 240 10.0 40 1:30 44.69 13 600 150 11.0 45 1:30 43.87 14 600 180 10.5 40 1:35 43.69 15 600 210 10.0 55 1:20 44.16 16 600 240 9.5 50 1:25 44.92 k1 44.753 44.613 44.758 44.297 44.398 k2 45.838 45.227 45.225 44.818 45.335 k3 44.688 44.848 44.905 45.355 45.168 k4 44.160 44.750 44.550 44.968 44.538 R 1.678 0.614 0.675 1.058 0.937 表 4 微波预处理与未经微波预处理的巴旦木蛋白功能性质比较
Table 4 Comparison of functional properties of microwave-assisted extracted and commonly extracted almond seed kernel proteins
原料预处理方式 溶解性(%) 持水性(g·g−1) 持油性(g·g−1) 乳化性(m2·g−1) 乳化稳定性(%) 起泡性(%) 气泡稳定性(%) 微波 55.24±0.25a 4.11±0.12a 6.21±0.08a 25.94±0.15a 6.94±0.12b 74.86±0.38a 71.22±0.42b 未微波 47.89±0.17b 3.26±0.09b 4.92±0.10b 19.86±0.11b 7.59±0.09a 62.11±0.25b 82.14±0.53a 注 同列不同字母表示差异显著(P<0.05)。 -
[1] 孙月娥, 王卫东, 王举婷. 水酶法从巴旦木中提油及水解蛋白研究[J]. 食品科学,2013,34(2):72−77. [2] 孙月娥, 明鸣, 王卫东, 等. 巴旦木蛋白提取工艺[J]. 食品科学,2011(18):19−23. [3] 刘志彬, 戈瑚瑚, 张雯, 等. 巴旦木和巴旦木皮对健康成人血脂水平、抗氧化能力和寒热证的影响[J]. 中国食品学报,2015,15(12):24−30. [4] 尤努斯江·吐拉洪, 马木提·库尔班, 木妮热·依布拉音. 巴旦木的营养保健作用研究进展[J]. 中国食物与营养,2008(10):56−58. doi: 10.3969/j.issn.1006-9577.2008.10.018 [5] 陶永霞, 闵昌荣, 李靖瑜, 等. 酶法制备巴旦杏蛋白工艺研究[J]. 食品科技,2012,37(4):215−218, 223. [6] 李志洲, 刘军海. 甜杏仁有效成份分析及多糖的体外抗氧化性研究[J]. 氨基酸和生物资源,2008,30(4):34−36. [7] 李永恒, 田双起, 赵仁勇, 等. 微波辅助碱法提取麦胚蛋白及其功能特性的研究[J]. 河南工业大学学报(自然科学版),2018,39(4):14−19. [8] 张永芳, 原媛. 微波萃取-考马斯亮蓝法提取大豆蛋白的工艺研究[J]. 食品工业,2018,39(9):44−48. [9] Amma Amponsah, Balunkeswar Nayak. Effects of microwave and ultrasound assisted extraction on the recovery of soy proteins for soy allergen detection[J]. Journal of Food Science,2016,18:2876−2885.
[10] Wen Le, Álvarez Carlos, Zhang Zhihang, et al. Optimisation and characterisation of protein extraction from coffee silverskin assisted by ultrasound or microwave techniques[J]. Biomass Conversion and Biorefinery,2020. doi: 10.1007/s13399-020-00712-2
[11] Suphat Phongthai, Seung-Taik Lim, Saroat Rawdkuen. Optimization of microwave-assisted extraction of rice bran protein and its hydrolysates properties[J]. Journal of Cereal Science, 2016, 70, 146-154.
[12] 侯菲菲, 张泽英. 微波法提取小麦醇溶蛋白的工艺优化[J]. 现代食品,2018(16):147−150. [13] 李颖, 易晓华, 李庆典. 新疆巴旦姆种仁高级脂肪酸与氨基酸营养评价[J]. 中国食品学报,2004(4):67−73. [14] 翁霞, 辛广, 程健欣. 微波辅助-碱溶酸沉法提取豌豆分离蛋白[J]. 食品科技,2012(11):245−248. [15] Sidmara Bedin, Karine Zanella, Neura Bragagnolo, et al. Implication of microwaves on the extraction process of rice bran protein[J]. Brazilian Journal of Chemical, 2019, 36(4): 1653-1665.
[16] 张艳荣, 高宇航, 刘婷婷, 等. 白灵菇蛋白提取及功能特性和结构分析[J]. 食品科学,2018,39(14):42−50. doi: 10.7506/spkx1002-6630-201814007 [17] 李西腾, 皮林林, 张佳佳, 等. 响应面法优化微波辅助提取蛤蟆草蛋白工艺研究[J]. 食品工业,2019,40(1):52−55. [18] 刘花花, 康健, 欧荣. 响应面法优化超声提取石榴籽蛋白工艺的研究[J]. 食品工业,2015(12):137−142. [19] TarunaVarghese, AkashPare. Effect of microwave assisted extraction on yield and protein characteristics of soymilk[J]. Journal of Food Engineering,2019,262:92−99. doi: 10.1016/j.jfoodeng.2019.05.020
[20] 朱建华, 邹秀容, 陈侠涛. 微波提取碎米中蛋白质的工艺研究[J]. 现代食品科技,2013,29(2):294−296.





 下载:
下载:









 下载:
下载:
