Hypoglycemic Activity of Enteromorpha intestinalis Polysaccharide
-
摘要: 为探究肠浒苔多糖(Enteromorpha intestinalis polysaccharide,EIP)的降血糖活性,通过DEAE纤维素柱层析进行分离,测定了各组分的理化性质,研究了EIP-2组分对小鼠降血糖指标的影响。实验动物分为正常组、模型组、二甲双胍阳性组(50 mg/kg/day)、EIP-2低剂量组(50 mg/kg/day)、EIP-2中剂量组(100 mg/kg/day)、EIP-2高剂量组(200 mg/kg/day),连续灌胃5周。分别测定了小鼠体重、空腹血糖浓度、葡萄糖和胰岛素耐受量、血清胰岛素和脂质水平、肝脏抗氧化酶水平等。实验结果表明,EIP-2干预后,相比于模型组各剂量组小鼠体重极显著增加(P<0.001)、空腹血糖极显著降低(P<0.001)、葡萄糖和胰岛素耐受量得到改善。高剂量组血清游离脂肪酸水平较显著降低(P<0.01)、各剂量组血清胰岛素和甘油三酯水平降低且具有剂量依赖性。与模型组相比,各剂量组肝脏谷草转氨酶水平较显著降低(P<0.01)、谷丙转氨酶水平极显著降低(P<0.001)、超氧化物歧化酶水平较显著提高(P<0.01),低剂量组肝脏过氧化氢酶水平显著提高(P<0.05)。综上所述,肠浒苔多糖对T2DM小鼠的血糖调节、血脂代谢和肝脏氧化应激具有明显改善作用,这为肠浒苔多糖降血糖机制的研究和药物开发利用提供了参考依据。Abstract: In order to explore the hypoglycemic activity of Enteromorpha intestinalis polysaccharide, the components were separated by DEAE cellulose column chromatography and their physical and chemical properties were determined, and the effect of EIP-2 components on hypoglycemic indexes in mice was studied. The experimental animals were divided into normal group, model group, metformin positive group (50 mg/kg/day), EIP-2 low dose group (50 mg/kg/day), EIP-2 medium dose group (100 mg/kg/day), EIP-2 high dose group (200 mg/kg/day). The body weight, fasting blood glucose concentration, glucose and insulin tolerance, serum insulin and lipid levels, liver antioxidant enzyme levels were measured. The results showed that compared with the model group, the weight of mice in each dose groups was significantly increased (P<0.001), fasting blood glucose was significantly decreased (P<0.001), glucose and insulin tolerance were improved after EIP-2 intervention. The levels of serum nonestesterified fatty acid in high dose group were significantly lower than those in model group (P<0.01), and the levels of serum insulin and triglyceride were decreased in a dose-dependent manner. Compared with the model group, the liver aspartate aminotransferase level was significantly decreased (P<0.01), alanine aminotransferase level was significantly decreased (P<0.001), superoxide dismutase level was significantly increased (P<0.01), and the liver catalase level was significantly increased in the low-dose group (P<0.05). In summary, EIP can improve blood glucose regulation, blood lipid metabolism and liver oxidative stress in T2DM mice, which provides a reference for study of the hypoglycemic mechanism of EIP and the development and utilization of hypoglycemic drugs.
-
Keywords:
- Enteromorpha intestinalis /
- polysaccharides /
- hypoglycemic /
- blood lipid level /
- oxidative stress
-
2型糖尿病(Type 2 Diabetic Mice, T2DM)是最常见的糖尿病形式,是一种以胰岛素抵抗和胰岛β细胞功能受损为特征的复杂代谢紊乱[1]。组织对胰岛素的反应能力下降的现象称为胰岛素抵抗[2],胰腺β细胞功能受损会影响胰岛素分泌。2型糖尿病的特点是糖脂代谢的慢性代谢失调,与肾功能衰竭、心血管疾病和失明密切相关[3]。目前用于治疗T2DM的药物主要有阿卡波糖、双胍类、噻唑烷二酮类和磺脲类等,存在副作用强、高成本和具有毒性等缺陷[4]。因此,开发制备简单、安全可靠的降血糖药物具有重要意义。
海洋藻类是具有生物活性的天然物质的重要来源[5]。许多研究表明,海洋藻类多糖能降低血糖和治疗糖尿病并发症[6-11]。浒苔是可食用海藻,其主要活性成分有浒苔多糖、蛋白质多肽、脂肪酸等[12]。已有一些研究发现浒苔具有降血糖活性。Yan等[1]发现分子量小于3 kDa的浒苔醇提物,通过激活IRS1/PI3K/AKT和抑制JNK1/2胰岛素通路发挥降血糖作用。Yuan等[13]发现酶解浒苔多糖可以缓解胰腺损伤,改善糖尿病。孙世红等[14]发现碱提浒苔多糖能显著降低四氧嘧啶诱导的糖尿病小鼠血糖浓度。刘乾阳等[15]通过检测糖尿病小鼠血糖、糖化白蛋白和糖耐量并观察胰腺组织病理切片初步研究了浒苔多糖的降血糖活性。这些研究表明浒苔提取物具有一定降血糖活性,但具体降血糖机制仍有待补充和扩展。本研究从肠浒苔中提取多糖,通过检测肠浒苔多糖对小鼠体重、采食、空腹血糖、血清及肝脏相关指标的影响,综合评价肠浒苔多糖的降血糖活性,为肠浒苔多糖的降血糖机制的进一步研究奠定基础、为相关药物开发利用提供参考依据。
1. 材料和方法
1.1 材料与仪器
雄性肥胖型糖尿病db/db小鼠和正常db/m小鼠(5周龄) 购买于江苏集萃药康生物科技有限公司,生产许可证号:SCXK(苏)2019-0009。正常小鼠体重21±2 g,肥胖型糖尿病小鼠体重31±3 g;小鼠饲料为实验鼠维持饲料(Co60辐照) 饲料营养组成见表1,江苏省协同医药生物工程有限责任公司;肠浒苔 采于中国浙江杭州湾,由宁波大学朱文荣教授鉴定;二乙基氨基乙基纤维素(DEAE) 上海恒信化学试剂有限公司;乙醇、葡萄糖、盐酸、硫酸、苯酚、氨基磺酸、D-半乳糖醛酸、二甲基亚砜、间羟基联苯、考马斯亮蓝G-250、3,5-二硝基水杨酸、碳酸钠、柠檬酸钠、氯化钠 均为国产分析纯试剂;胰岛素 生物试剂,西格玛奥德里奇(上海)贸易有限公司;胰岛素试剂盒、游离脂肪酸试剂盒、甘油三酯试剂盒、谷草转氨酶试剂盒、谷丙转氨酶试剂盒、超氧化物歧化酶试剂盒、过氧化氢酶试剂盒 南京建成生物工程研究所有限公司。
表 1 饲料营养组成Table 1. Nutrient composition of feed组分 含量(g/kg) 组分 含量(g/kg) 水分 ≤100 钙 10~18 粗蛋白 ≥180 总磷 6~12 粗脂肪 ≥40 钙:总磷 1.2:1~1.7:1 粗纤维 ≤50 赖氨酸 ≥8.2 粗灰分 ≤80 蛋氨酸+胱氨酸 ≥5.3 ALPHA1-2 LD冷冻干燥机 德国Martin Christ 公司;LRH-250-Z恒温培养箱 韶关市泰宏医疗器械有限公司;YK722PC紫外可见分光光度计 北京瑞利分析仪器有限公司;安准血糖仪 三诺生物传感股份有限公司。
1.2 实验方法
1.2.1 肠浒苔多糖提取、分离
参考刘玉凤等[16]使用的方法提取肠浒苔多糖,药材按料液比1:20(w/v,g/mL)加入80%乙醇加热回流提取3次(每次2 h),干燥后按料液比1:16(w/v,g/mL)加入蒸馏水,浸泡过夜,100 ℃下提取2次(每次3 h),收集水提液,蒸发浓缩,75%乙醇醇沉,离心(4000 r/min,15 min)取沉淀冷冻干燥得水提肠浒苔粗多糖(polysaccharides from Enteromorpha intestinalis, EIP)。
利用DEAE纤维素制备柱(8 cm×40 cm)分离EIP。预实验确定各参数后,配制20 mg/mL EIP溶液200 mL,于−20 ℃冷冻24 h,4 ℃融化12 h,离心(4000 r/min,10 min)取上清液备用。打开纤维素层析柱下端出水口待液面与纤维素相平后缓慢加入EIP溶液,上样后依次使用蒸馏水、0.7 mol/L NaCl溶液、0.1 mol/L NaOH溶液洗脱,流速为15 mL/min。蒸馏水洗脱液经蒸发浓缩、冷冻干燥得到肠浒苔中性多糖(EIP-1),NaCl和NaOH洗脱液经蒸发浓缩、透析、冷冻干燥分别得到酸性多糖(EIP-2)、碱洗多糖(EIP-3)。
1.2.2 肠浒苔多糖理化性质测定
采用苯酚-硫酸法[17]测定总糖含量,间羟基联苯法[18]测定糖醛酸含量,考马斯亮蓝法[19]测定蛋白质含量,二硝基水杨酸法[20]测定还原糖含量。
1.2.3 动物实验
1.2.3.1 动物分组与饲养
db/m小鼠(血糖正常小鼠)6只,作为正常对照组(NC)。db/db小鼠(2型糖尿病T2DM肥胖小鼠)30只,随机分为5组:模型对照组(MC,无菌生理盐水)、阳性对照组(PC,50 mg/kg/day二甲双胍)、EIP-2低剂量组(L,50 mg/kg/day)、中剂量组(M,100 mg/kg/day)、高剂量组(H,200 mg/kg/day)。小鼠在实验环境(温度25±1 ℃,湿度50%±10%,12 h光/暗循环)适应一周后,每日灌胃干预一次,持续5周,期间自由饮水和进食。
1.2.3.2 日采食和体重检测
每日给药前,称量小鼠体重、称量饲料质量并记录。
1.2.3.3 空腹血糖检测(Fasting blood glucose, FBG)
给药后第0、7、14、28 d,测量小鼠的空腹血糖。检测前禁食12 h,使用血糖仪测量血糖浓度并记录。
1.2.3.4 葡萄糖耐受实验(Glucose tolerance test, GTT)
给药第14 d,检测各组小鼠葡萄糖耐受量,检测前禁食12 h,尾部取血,使用血糖仪测量血糖浓度。检测小鼠的空腹血糖30 min后,腹腔注射葡萄糖溶液(1.5 g/kg),分别在第15、30、60、120 min检测小鼠血糖并记录。
1.2.3.5 胰岛素耐受实验(Insulin tolerance test, ITT)
给药第22 d,检测各组小鼠胰岛素耐受量,检测前禁食12 h,尾部取血,使用血糖仪测量血糖浓度。测量空腹血糖30 min后,腹腔注射胰岛素溶液(1.5 U/kg),分别在第15、30、60、120 min检测小鼠血糖并记录。
1.2.3.6 血清生化因子检测
给药35 d后,小鼠眼眶取血,4 ℃下2500 r/min离心10 min取上清液,根据试剂盒说明检测游离脂肪酸(nonestesterified fatty acid, NEFA)、甘油三酯(triglyceride, TG)、血清胰岛素(insulin, INS)和谷草转氨酶(aspartate aminotransferase, AST)水平。
1.2.3.7 肝脏生化因子检测
取血后,小鼠脱颈处死,解剖并收集肝脏、肾脏、胰腺和结肠,液氮冷冻保存。肝脏在预冷生理盐水(1:9,w/v)中研磨制成肝匀浆,4 ℃下2500 r/min离心10 min,收集上清液,参考各试剂盒说明书分别检测NEFA、AST、谷丙转氨酶(alanine aminotransferase, ALT)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)水平。
1.3 数据处理
使用Origin 9.0软件作图,SPSS 17.0软件进行数据统计分析,结果
2. 结果与分析
2.1 肠浒苔多糖的理化性质
肠浒苔多糖的理化性质测定结果见表2。EIP经DEAE纤维素柱层析分离获得EIP-1、EIP-2、EIP-3。EIP、EIP-1、EIP-2、EIP-3总糖含量分别为33.30%、19.77%、39.89%、35.53%,EIP、EIP-1、EIP-2、EIP-3糖醛酸含量分别为14.51%、6.49%、17.58%、8.92%。许多研究结果表明,多糖的降血糖活性可能与糖醛酸的含量有关。EIP-2的总糖和糖醛酸含量最高,分别为39.89%和17.58%。因此,使用肠浒苔多糖EIP-2进行小鼠实验,研究肠浒苔多糖的降血糖活性。
表 2 肠浒苔多糖的理化性质Table 2. Physical and chemical properties of polysaccharide from Enteromorpha intestinalis样品 糖含量(%) 蛋白质含量(%) 糖醛酸含量(%) 还原糖含量(%) EIP 33.30 4.18 14.51 5.52 EIP-1 19.77 2.01 6.49 3.99 EIP-2 39.89 6.67 17.58 3.28 EIP-3 35.53 7.14 8.92 4.81 2.2 体重和采食
肠浒苔多糖对小鼠体重的影响见表3。实验5周后,正常小鼠体重增加了4.64 g,模型组和阳性对照组小鼠体重均增加了10 g左右,EIP-2低、中、高剂量组体重分别增加了17.52、15.68、18.37 g。肠浒苔多糖对小鼠采食量的影响见图1。正常小鼠日采食量始终保持在3 g/day左右,T2DM小鼠给药前采食量为8~9 g/day随时间逐渐降低且组间差异不大。模型组、阳性对照组、EIP-2低、中、高剂量组第5周采食量较给药前分别降低了39.4%、39.5%、36.3%、39.4%、39.8%。
表 3 EIP-2对T2DM小鼠体重的影响Table 3. Effects of EIP-2 on body weight of T2DM mice组别 体重(g) 给药前 第1周 第2周 第3周 第4周 第5周 正常对照 19.33±0.84 19.45±1.05 22.16±1.01 22.64±1.00 23.30±0.93 23.97±0.85 模型对照 32.00±0.28### 35.06±0.57### 40.62±0.88### 41.26±0.60### 42.85±0.55### 42.44±0.48### 二甲双胍 32.20±0.77 33.37±1.43 38.03±0.32** 41.39±0.49 43.79±0.61 43.00±0.65 EIP-2低剂量 31.47±1.06 34.99±0.94 42.54±1.31* 44.88±1.45** 47.64±1.19*** 48.99±1.55*** EIP-2中剂量 31.32±0.67 34.23±0.87 40.61±0.35 42.70±0.91 46.10±0.89** 47.00±0.61*** EIP-2高剂量 32.53±1.04 35.60±1.24 41.95±1.72 45.37±1.67*** 48.92±1.59*** 50.90±1.62*** 注:#、##、###分别表示与正常组相比P<0.05、P<0.01、P<0.001,*、**、***分别表示与模型组相比P<0.05、P<0.01、P<0.001;表4~表6同。 2型糖尿病的治疗通常伴随着体重增加,以及食物和水的消耗减少[21]。肠浒苔多糖对T2DM小鼠采食影响不大,但是可以使小鼠体重增加,高剂量组体重较给药前增长了56.5%,与模型组相比差异极显著(P<0.001)。
2.3 空腹血糖
EIP-2对T2DM小鼠空腹血糖的影响如表4所示。正常组小鼠血糖浓度维持在3.5~4.5 mmol/L范围内,T2DM小鼠初始空腹血糖在10~11 mmol/L范围内。模型组小鼠血糖浓度前2周略有降低,后2周开始升高,第4周血糖浓度达到了22.4 mmol/L。二甲双胍和EIP-2组小鼠的血糖浓度整体呈下降趋势,第4周二甲双胍、EIP-2低、中、高剂量组血糖浓度较给药前分别降低了6.0%、17.8%、23.8%、24.0%。空腹血糖是糖尿病缓解的一项重要指标[22],EIP-2可以极显著降低空腹血糖( P <0.001)。
表 4 EIP-2对T2DM小鼠空腹血糖的影响Table 4. Effects of EIP-2 on FBG in T2DM mice组别 血糖浓度(mmol/L) 给药前 第1周 第2周 第3周 第4周 正常对照 3.9±0.2 4.2±0.2 4.2±0.2 3.9±0.1 4.4±0.1 模型对照 10.3±1.0### 10.4±0.6### 9.8±0.4### 16.3±0.3### 22.4±0.5### 二甲双胍 10.0±0.2 6.0±0.1*** 10.5±0.6 10.3±0.6*** 9.4±0.4*** EIP-2低剂量 10.7±0.4 6.6±0.4*** 7.2±0.4*** 6.8±0.5*** 8.8±0.5*** EIP-2中剂量 10.5±0.5 6.7±0.5*** 9.5±0.3 7.0±0.3*** 8.0±0.2*** EIP-2高剂量 10.4±0.6 6.3±0.6*** 8.2±0.6** 6.0±0.6*** 7.9±0.3*** 2.4 葡萄糖耐受实验结果
肠浒苔多糖对糖尿病小鼠葡萄糖耐受量的影响见图2。
小鼠注射葡萄糖后,血糖的变化可反映机体对餐后血糖的处理能力。注射葡萄糖溶液后,正常小鼠经过60 min后血糖浓度降至正常水平,二甲双胍和EIP-2剂量组小鼠的血糖浓度经过120 min恢复至初始水平,但模型组小鼠的血糖浓度仍处于高水平。相比于二甲双胍和EIP-2中、高剂量组,EIP-2低剂量组小鼠的血糖浓度恢复速度相对较快。糖耐受量是检测人体对急性高血糖的反应能力的一项重要指标[14]。通过葡萄糖耐受性的强弱判断胰岛β细胞对血液中血糖调节的能力[23]。EIP-2可以改善T2DM小鼠的葡萄糖耐受性,增强机体的血糖调节能力。
2.5 胰岛素耐受实验结果
肠浒苔多糖对糖尿病小鼠胰岛素耐受的影响见图3。注射胰岛素后,模型组小鼠前30 min血糖浓度升高后90 min略有降低。正常组小鼠注射胰岛素15 min后血糖浓度开始下降,120 min后回升至正常水平。低剂量组小鼠的血糖浓度15min后升高至峰值,120 min后降至初始水平。中剂量组与阳性对照组30 min后血糖浓度降至最低,后90 min血糖浓度略有回升。高剂量组小鼠血糖浓度变化较为平滑,前60 min下降,后60 min回升至正常水平。胰岛素功能障碍是T2DM的显著特征[24]。长期胰岛素抵抗可干扰糖脂代谢,进一步导致脂质和葡萄糖水平异常升高[25]。注射胰岛素后小鼠的血糖浓度变化可以反映胰岛素抵抗性。高剂量EIP-2治疗后的T2DM小鼠胰岛素抵抗性得到了明显改善。
2.6 血清生化因子
给药35 d后,小鼠血清NEFA、TG、INS和AST水平见表5。模型组小鼠的血清NEFA水平比正常组高24.7%;二甲双胍、EIP-2低、中、高剂量组NEFA水平比模型组分别低7.7%、1.5%、6.2%、13.8%。血清NEFA升高是肝脏和外周细胞胰岛素抵抗引起的糖尿病血脂异常的一个特征指标[4],NEFA水平升高在一定程度上可以解释为高胰岛素抵抗,EIP-2高剂量组显著降低了小鼠血清NEFA水平( P<0.01)、缓解了T2DM小鼠胰岛素抵抗性。模型组小鼠的血清TG水平是正常组的2.9倍,二甲双胍、低、中、高剂量EIP-2组血清TG水平比模型组分别低49.8%、39.6%、61.0%、63.5%。模型组小鼠的血清INS水平是正常组的4.2倍;二甲双胍、EIP-2低、中、高剂量组血清INS水平比模型组分别低56.2%、17.9%、21.2%、34.7%。T2DM小鼠胰岛素敏感性降低或作用缺陷会使机体产生过多的胰岛素[26],胰岛素水平的显著降低反映了EIP-2对小鼠胰岛素敏感性降低或作用缺陷的良好疗效。T2DM是一种长期而复杂的疾病,通常伴有血脂异常和肝肾功能不全,血清中AST、ALT和TBA水平被认为是肝细胞损伤和肝功能的指标[21]。模型组小鼠的血清AST含量是正常对照组NC的1.7倍;二甲双胍、EIP-2低、中、高剂量组血清AST水平比模型组分别低34.2%、22.1%、31.0%、39.6%。EIP-2与血清指标水平呈量效关系,高剂量EIP-2对INS水平降低作用比二甲双胍弱,而对血清NEFA、TG和AST水平的降低作用优于二甲双胍。
表 5 EIP-2对小鼠血清指标的影响Table 5. Effects of EIP-2 on serum indexes in mice组别 游离脂肪酸NEFA(mmol/L) 甘油三酯TG(mmol/L) 胰岛素INS(pg/mL) 谷草转氨酶AST(U/mg protein) 正常对照 1.01±0.06 1.67±0.10 12.74±0.71 47.92±1.38 模型对照 1.30±0.03### 4.90±0.91### 54.01±0.90### 79.10±1.07### 二甲双胍 1.20±0.04 2.46±0.64*** 23.67±1.53*** 52.06±1.91*** EIP-2低剂量 1.28±0.05 2.96±0.32** 44.32±1.41 61.59±2.23** EIP-2中剂量 1.22±0.01 1.91±0.37*** 42.54±1.92* 54.58±2.17*** EIP-2高剂量 1.12±0.08** 1.79±0.13*** 35.27±1.82** 47.75±1.02*** 2.7 肝脏生化因子
给药35 d后,小鼠肝脏NEFA、AST、ALT、SOD和CAT水平见表6。二甲双胍、EIP-2低、中、高剂量组肝脏NEFA水平比模型组分别低16.9%、4.3%、9.2%、17.4%。EIP-2低剂量组和模型组AST水平相近,二甲双胍、EIP-2中、高剂量组AST水平比模型组分别低20.2%、16.8%、17.0%。二甲双胍、EIP-2高剂量组ALT水平比模型组分别低12.5%、20.5%、22.1%。EIP-2对肝脏NEFA、AST、ALT水平的降低作用随剂量增加而增强。肝脏NEFA、AST和ALT水平的降低说明EIP-2改善了小鼠的脂质代谢、缓解了T2DM引起的肝损伤。
表 6 EIP-2对小鼠肝脏指标的影响Table 6. Effects of EIP-2 on liver indicators in mice组别 游离脂
肪酸 NEFA
(mmol/L)谷草转
氨酶AST
(U/mg protein)谷丙转
氨酶 ALT
(U/mg protein)超氧化物
歧化酶SOD
(U/mg protein)过氧化
氢酶 CAT
(U/mg protein)正常
对照1.73±0.08 303.1±5.5 967.5±11.8 1638±63 62.20±5.39 模型
对照2.07±0.04## 429.0±9.0# 896.5±13.1## 1367±37 53.20±5.52 二甲
双胍1.72±0.04** 342.5±7.9** 784.0±23.3** 1501±5** 70.11±2.02** EIP-2低剂量 1.98±0.03 435.2±19.3** 722.3±18.4*** 1363±53** 75.28±5.50*** EIP-2中剂量 1.88±0.16* 356.9±11.1** 712.7±14.1*** 1413±69** 35.17±4.13** EIP-2高剂量 1.71±0.08** 356.2±7.2** 698.5±20.1*** 1430±23** 34.18±3.17** 模型组小鼠的SOD、CAT水平比正常组分别低16.6%、14.5%。肠浒苔多糖对肝脏SOD水平影响较小,二甲双胍、EIP-2高剂量组SOD水平比模型组分别高9.8%、4.6%。二甲双胍、EIP-2低剂量组CAT水平比模型组分别高31.8%、41.5%,但EIP-2中、高剂量组CAT水平均比模型组低,说明低浓度EIP-2对肝脏过氧化氢酶水平升高有促进作用,浓度过高会抑制过氧化氢酶产生。EIP-2剂量与SOD酶活性正相关而与CAT酶活性负相关,这可能是由于过氧化物酶在清除H2O2过程中发挥了主要作用,过氧化氢酶竞争底物的能力减弱活性也减弱[27-28]。研究表明,糖尿病的持续高血糖可能导致体内的氧化应激[25]。氧化损伤和糖代谢紊乱会形成恶性循环,加重糖尿病症状[29]。SOD和CAT是哺乳动物的主要抗氧化酶,是抗氧化防御系统抵御体内自由基的第一道防线[3]。中、高剂量EIP-2可以提高小鼠肝脏SOD水平、低剂量EIP-2可以提高CAT水平,T2DM引起的氧化损伤得到改善。
3. 结论
实验结果显示肠浒苔多糖分离组分EIP-2的总糖(39.89%)和糖醛酸(17.58%)含量最高。以不同剂量的EIP-2对T2DM小鼠进行干预,通过检测降血糖指标综合评价肠浒苔多糖的降血糖活性。EIP-2给药后T2DM小鼠空腹血糖降低、葡萄糖和胰岛素耐受量的改善及血清INS水平的降低说明浒苔多糖有利于调节血糖平衡。有关研究表明糖代谢的改善可能与浒苔多糖调节肝脏和脂肪组织中INSR、GCK、APN和GLUT-4基因mRNA水平的能力有关[11]。血清AST和肝脏AST、ALT水平的降低说明浒苔多糖可以缓解肝损伤。给药后血清NEFA、TG和肝脏NEFA水平降低说明浒苔多糖有利于改善脂质代谢,肝脏抗氧化酶(SOD、CAT)活性升高说明浒苔多糖具有抗氧化活性、可减轻T2DM引起的氧化损伤,Tang等[30]发现浒苔多糖通过发挥抗氧化作用、减轻氧化损伤可能是改善糖尿病一种有效途径。综上所述,肠浒苔多糖可改善糖脂代谢、缓解肝损伤,其降血糖机制可能与其抗氧化作用有关,通过缓解组织氧化损伤从而减轻胰岛素抵抗。
-
表 1 饲料营养组成
Table 1 Nutrient composition of feed
组分 含量(g/kg) 组分 含量(g/kg) 水分 ≤100 钙 10~18 粗蛋白 ≥180 总磷 6~12 粗脂肪 ≥40 钙:总磷 1.2:1~1.7:1 粗纤维 ≤50 赖氨酸 ≥8.2 粗灰分 ≤80 蛋氨酸+胱氨酸 ≥5.3 表 2 肠浒苔多糖的理化性质
Table 2 Physical and chemical properties of polysaccharide from Enteromorpha intestinalis
样品 糖含量(%) 蛋白质含量(%) 糖醛酸含量(%) 还原糖含量(%) EIP 33.30 4.18 14.51 5.52 EIP-1 19.77 2.01 6.49 3.99 EIP-2 39.89 6.67 17.58 3.28 EIP-3 35.53 7.14 8.92 4.81 表 3 EIP-2对T2DM小鼠体重的影响
Table 3 Effects of EIP-2 on body weight of T2DM mice
组别 体重(g) 给药前 第1周 第2周 第3周 第4周 第5周 正常对照 19.33±0.84 19.45±1.05 22.16±1.01 22.64±1.00 23.30±0.93 23.97±0.85 模型对照 32.00±0.28### 35.06±0.57### 40.62±0.88### 41.26±0.60### 42.85±0.55### 42.44±0.48### 二甲双胍 32.20±0.77 33.37±1.43 38.03±0.32** 41.39±0.49 43.79±0.61 43.00±0.65 EIP-2低剂量 31.47±1.06 34.99±0.94 42.54±1.31* 44.88±1.45** 47.64±1.19*** 48.99±1.55*** EIP-2中剂量 31.32±0.67 34.23±0.87 40.61±0.35 42.70±0.91 46.10±0.89** 47.00±0.61*** EIP-2高剂量 32.53±1.04 35.60±1.24 41.95±1.72 45.37±1.67*** 48.92±1.59*** 50.90±1.62*** 注:#、##、###分别表示与正常组相比P<0.05、P<0.01、P<0.001,*、**、***分别表示与模型组相比P<0.05、P<0.01、P<0.001;表4~表6同。 表 4 EIP-2对T2DM小鼠空腹血糖的影响
Table 4 Effects of EIP-2 on FBG in T2DM mice
组别 血糖浓度(mmol/L) 给药前 第1周 第2周 第3周 第4周 正常对照 3.9±0.2 4.2±0.2 4.2±0.2 3.9±0.1 4.4±0.1 模型对照 10.3±1.0### 10.4±0.6### 9.8±0.4### 16.3±0.3### 22.4±0.5### 二甲双胍 10.0±0.2 6.0±0.1*** 10.5±0.6 10.3±0.6*** 9.4±0.4*** EIP-2低剂量 10.7±0.4 6.6±0.4*** 7.2±0.4*** 6.8±0.5*** 8.8±0.5*** EIP-2中剂量 10.5±0.5 6.7±0.5*** 9.5±0.3 7.0±0.3*** 8.0±0.2*** EIP-2高剂量 10.4±0.6 6.3±0.6*** 8.2±0.6** 6.0±0.6*** 7.9±0.3*** 表 5 EIP-2对小鼠血清指标的影响
Table 5 Effects of EIP-2 on serum indexes in mice
组别 游离脂肪酸NEFA(mmol/L) 甘油三酯TG(mmol/L) 胰岛素INS(pg/mL) 谷草转氨酶AST(U/mg protein) 正常对照 1.01±0.06 1.67±0.10 12.74±0.71 47.92±1.38 模型对照 1.30±0.03### 4.90±0.91### 54.01±0.90### 79.10±1.07### 二甲双胍 1.20±0.04 2.46±0.64*** 23.67±1.53*** 52.06±1.91*** EIP-2低剂量 1.28±0.05 2.96±0.32** 44.32±1.41 61.59±2.23** EIP-2中剂量 1.22±0.01 1.91±0.37*** 42.54±1.92* 54.58±2.17*** EIP-2高剂量 1.12±0.08** 1.79±0.13*** 35.27±1.82** 47.75±1.02*** 表 6 EIP-2对小鼠肝脏指标的影响
Table 6 Effects of EIP-2 on liver indicators in mice
组别 游离脂
肪酸 NEFA
(mmol/L)谷草转
氨酶AST
(U/mg protein)谷丙转
氨酶 ALT
(U/mg protein)超氧化物
歧化酶SOD
(U/mg protein)过氧化
氢酶 CAT
(U/mg protein)正常
对照1.73±0.08 303.1±5.5 967.5±11.8 1638±63 62.20±5.39 模型
对照2.07±0.04## 429.0±9.0# 896.5±13.1## 1367±37 53.20±5.52 二甲
双胍1.72±0.04** 342.5±7.9** 784.0±23.3** 1501±5** 70.11±2.02** EIP-2低剂量 1.98±0.03 435.2±19.3** 722.3±18.4*** 1363±53** 75.28±5.50*** EIP-2中剂量 1.88±0.16* 356.9±11.1** 712.7±14.1*** 1413±69** 35.17±4.13** EIP-2高剂量 1.71±0.08** 356.2±7.2** 698.5±20.1*** 1430±23** 34.18±3.17** -
[1] Yan X, Yang C F, Lin G P, et al. Antidiabetic potential of green seaweed Enteromorpha prolifera flavonoids regulating insulin signaling pathway and gut microbiota in type 2 diabetic mice[J]. Journal of Food Science,2019,84(1):165−173. doi: 10.1111/1750-3841.14415
[2] 聂绪强, 张丹丹, 张涵. 炎症、胰岛素抵抗与糖尿病的中药治疗[J]. 中国药学杂志,2017,52(1):1−7. [3] Cui J F, Ye H, Zhu Y J, et al. Characterization and hypoglycemic activity of a rhamnan-type sulfated polysaccharide derivative[J]. Marine Drugs,2019,17(1):21. doi: 10.3390/md17010021
[4] Chen C, Huang Q, Li C, et al. Hypoglycemic effects of a Fructus mori polysaccharide in vitro and in vivo[J]. Food & Function,2017,8(7):2523−2535.
[5] Zhao C, Yang C F, Liu B, et al. Bioactive compounds from marine macroalgae and their hypoglycemic benefits[J]. Trends in Food Science & Technology,2018,72:1−12.
[6] Jia R B, Wu J, Li Z R, et al. Structural characterization of polysaccharides from three seaweed species and their hypoglycemic and hypolipidemic activities in type 2 diabetic rats[J]. International Journal of Biological Macromolecules,2020,155:1040−1049. doi: 10.1016/j.ijbiomac.2019.11.068
[7] Jin D Q, Li G, Kim J S, et al. Preventive effects of Laminaria japonica aqueous extract on the oxidative stress and xanthine oxidase activity in streptozotocin-induced diabetic rat liver[J]. Biological & Pharmaceutical Bulletin,2004,27(7):1037−1040.
[8] Parikh P, Mani U, Iyer U. Role of Spirulina in the control of glycemia and lipidemia in type 2 diabetes mellitus[J]. Journal of Medicinal Food,2001,4(4):193−199. doi: 10.1089/10966200152744463
[9] Cao C L, Li C, Chen Q, et al. Physicochemical characterization, potential antioxidant and hypoglycemic activity of polysaccharide from Sargassum pallidum[J]. International Journal of Biological Macromolecules,2019,139:1009−1017. doi: 10.1016/j.ijbiomac.2019.08.069
[10] Sim S Y, Shin Y E, Kim H K, et al. Fucoidan from Undaria pinnatifida has anti-diabetic effects by stimulation of glucose uptake and reduction of basal lipolysis in 3T3-L1 adipocytes[J]. Nutrition Research,2019,65:54−62. doi: 10.1016/j.nutres.2019.02.002
[11] Lin W T, Wang W X, Liao D D, et al. Polysaccharides from Enteromorpha prolifera improve glucose metabolism in diabetic rats[J]. Journal of Diabetes Research,2015,2015:675201.
[12] 金浩良, 徐年军, 严小军. 浒苔中生物活性物质的研究进展[J]. 海洋科学,2011,35(4):100−106. [13] Yuan X B, Zheng J P, Ren L S, et al. Enteromorpha prolifera oligomers relieve pancreatic injury in streptozotocin (STZ)-induced diabetic mice[J]. Carbohydrate Polymers,2019,206:403−411. doi: 10.1016/j.carbpol.2018.11.019
[14] 孙士红, 陈艳, 刘莹. 碱提浒苔多糖降血糖作用研究[J]. 中国医学创新,2010,7(20):181−182. doi: 10.3969/j.issn.1674-4985.2010.20.104 [15] 刘乾阳, 殳叶婷, 刘睿, 等. 江苏地产浒苔多糖对四氧嘧啶诱导糖尿病小鼠的降糖作用研究[J]. 南京中医药大学学报,2017,33(4):403−407. [16] 刘玉凤, 贾淑颖, 刘飞飞, 等. 不同取代度的硫酸化肠浒苔多糖抗氧化活性研究[J]. 食品工业科技,2016,37(19):142−147, 152. [17] 张居作, 许巧玲, 徐君飞. 苦瓜多糖含量的苯酚硫酸法检测研究[J]. 食品研究与开发,2015,36(5):82−85. doi: 10.3969/j.issn.1005-6521.2015.05.021 [18] 姜瑞芝, 陈英红, 杨勇杰, 等. 银耳多糖中糖醛酸含量的测定[J]. 中草药,2004(9):36−38. [19] 王文平, 郭祀远, 李琳, 等. 考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J]. 食品研究与开发,2008(1):115−117. doi: 10.3969/j.issn.1005-6521.2008.01.036 [20] 程柳, 李静. 3, 5-二硝基水杨酸法测定山楂片中还原糖和总糖含量[J]. 轻工科技,2016,32(3):25−28. [21] Liao Z Z, Zhang J Y, Liu B, et al. Polysaccharide from okra (Abelmoschus esculentus (L.) moench) improves antioxidant capacity via PI3K/AKT Pathways and Nrf2 translocation in a type 2 diabetes model[J]. Molecules,2019,24(10):1906. doi: 10.3390/molecules24101906
[22] Liu J, Zhao Y P, Wu Q X, et al. Structure characterisation of polysaccharides in vegetable "okra" and evaluation of hypoglycemic activity[J]. Food Chemistry,2018,242:211−216. doi: 10.1016/j.foodchem.2017.09.051
[23] 马永强, 张凯, 王鑫, 等. 甜玉米芯多糖对糖尿病大鼠的降血糖作用[J]. 食品科学,2020,41(13):169−173. doi: 10.7506/spkx1002-6630-20190702-030 [24] Jia R B, Li Z R, Wu J, et al. Physicochemical properties of polysaccharide fractions from Sargassum fusiforme and their hypoglycemic and hypolipidemic activities in type 2 diabetic rats[J]. International Journal of Biological Macromolecules,2020,147:428−438. doi: 10.1016/j.ijbiomac.2019.12.243
[25] Chen Z Q, Wang C, Pan Y X, et al. Hypoglycemic and hypolipidemic effects of anthocyanins extract from black soybean seed coat in high fat diet and streptozotocin-induced diabetic mice[J]. Food & Function,2018,9(1):426−439.
[26] 刘亚萍, 高文鸽, 梁隽杰, 等. 菊粉复配灵芝多糖对2型糖尿病大鼠的降血糖作用[J]. 食品工业科技,2019,40(20):310−315, 324. [27] Gaetani G F, Ferraris A M, Rolfo M, et al. Predominant role of catalase in the disposal of hydrogen peroxide within human erythrocytes[J]. Blood,1996,87(4):1595−1599. doi: 10.1182/blood.V87.4.1595.bloodjournal8741595
[28] 顾华杰, 王琰, 奚红, 等. 灰树花多糖对罗非鱼非特异性免疫力的影响[J]. 水产科学,2013(8):453−458. doi: 10.3969/j.issn.1003-1111.2013.08.004 [29] 段懿涵, 徐健, 卢学春, 等. 鸡腿菇多糖对链脲佐菌素诱导糖尿病大鼠的降血糖作用[J]. 中国比较医学杂志,2019,29(12):76−81. [30] Tang Z H, Gao H W, Wang S, et al. Hypolipidemic and antioxidant properties of a polysaccharide fraction from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules,2013,58:186−189. doi: 10.1016/j.ijbiomac.2013.03.048





 下载:
下载:
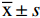



 下载:
下载:
