Optimization of Preparation Process of Protein Feed by Solid Fermentation of Wild Broussonetia papyrifera Leaves with Different Treatment Methods
-
摘要: 为降低构树叶中单宁含量,采用蒸汽爆破、球磨等方式对构树叶进行预处理,以抗营养因子单宁含量为考察指标,通过响应面分析法确定枯草芽孢杆菌、乳酸菌和酿酒酵母菌的复合菌固态发酵构树叶制备蛋白饲料的最佳工艺。结果表明:最佳工艺条件为汽爆压强1.4 MPa,维压时间90 s;球磨时间20 min;发酵时间4 d,含水量60%,发酵温度32.50 ℃,酿酒酵母菌:乳酸菌:枯草芽孢杆菌=1:1:1。构树叶经发酵、汽爆后发酵和球磨发酵后发酵单宁含量分别降低了36.2%、39.5%和60.5%;粗蛋白含量分别增加了23.59%、10.28%和7.84%;粗灰分含量分别增加了16.7%、31.80%和24.23%;粗纤维含量分别降低了15.33%、12.32%和7.85%。构树叶的钙含量为2.70%,经发酵后钙含量无明显变化,经汽爆发酵后和球磨发酵后分别增加了23.33%和22.22%(P<0.05),预处理和发酵对磷和粗脂肪的含量几乎无影响,磷含量约为0.3%,粗脂肪含量约为2.4%。原料发酵、汽爆发酵和球磨发酵的酶活力分别高达41.43、44.77和65.10 U。球磨发酵降单宁效果要远远优于汽爆发酵和原料发酵,原料发酵的蛋白增加效果最佳。Abstract: To reduce tannin content in Broussonetia papyrifera leaves, steam explosion and ball milling were used to pretreat Broussonetia papyrifera leaves, and response surface methodology was used to determine the best technology for preparing protein feed by solid fermentation of Broussonetia papyrifera leaves with complex bacteria of Bacillus subtilis, lactic acid bacteria and Saccharomyces cerevisiae. Results showed that, the optimum process conditions were as follows: Steam explosion pressure 1.4 MPa, maintaining pressure time 90 s. The ball milling time was 20 min. The fermentation time was 4 d, water content was 60.07%, fermentation temperature was 32.50 ℃, and the ratio of Saccharomyces cerevisiae:lactic acid bacteria:Bacillus subtilis was 1:1:1. The tannin content of Broussonetia papyrifera leaves after fermentation, steam explosion fermentation and ball milling decreased by 36.2%, 39.5% and 60.5% respectively. The crude protein content increased by 23.59%, 10.28% and 7.84% respectively. Crude ash content increased by 16.7%, 31.80% and 24.23% respectively. The crude fiber content decreased by 15.33%, 12.32% and 7.85% respectively. The calcium content of Broussonetia papyrifera leaves was 2.70%, which had no obvious change after fermentation. But the calcium content increased by 23.33% and 22.22% respectively after steam explosion and ball milling (P<0.05) by fermentation. Pretreatment and fermentation had little effect on phosphorus and crude fat content, with phosphorus content being 0.3% and crude fat content being 2.4%. The enzyme activities of raw material fermentation, steam explosion fermentation and ball milling fermentation were as high as 41.43, 44.77 and 65.10 U. The tannin reduction effect of ball milling fermentation is far superior to steam explosion fermentation and raw material fermentation, and the protein increase effect of raw material fermentation is the best.
-
随着生活水平的提高,人们对肉制品的需求量日益剧增,从而促使了畜牧业的快速发展。目前,作为饲料资源的饼粕、牧草及常规饲料粮的供需缺口已经越来越大。需要发展新型饲料来填补空缺,而构树(Broussonetia papyrifera)是一种优质的非常规蛋白饲料资源,具有极强的适应性和抗逆性,广泛分布于我国黄河、长江及珠江流域,是一种多功能综合性经济树种,应用于造纸、饲料、医药等行业[1-2]。虽然构树叶含有丰富的粗蛋白,但是因为抗营养因子的存在,动物不能完全吸收利用构树叶饲料。研究表明构树叶中的抗营养因子主要为单宁[3]。单宁能与生物碱、核酸、脂质、蛋白质等生物大分子发生很强的复合作用,从而阻碍这些物质的生物降解[4]。单宁与生物大分子的这种结合会对动物产生许多不利影响,例如与动物口腔中唾液蛋白结合,产生苦涩味道;与动物细胞膜上的蛋白质、磷脂和多糖等成分结合,使动物细胞膜通透性改变;与蛋白质结合,降低动物对饲料的消化率[5-7]。Teixeira等[8]发现用部分高粱(高粱主要抗营养因子为单宁)代替大米进行饲养成犬,消化率明显降低。Omnes等[9]饲喂10 g/kg含单宁日粮的鱼类其蛋白质消化率明显低于饲喂对照日粮的鱼类,添加单宁到鱼饲料中,单宁摄入可显著降低累积采食量、生长、饲料和蛋白质效率、表观消化系数、肝体指数和胴体脂类。
目前,降低抗营养因子单宁有很多途径。通过物理、化学、生物和其他方法处理来削弱单宁的抗营养性。现有研究表明,通过微生物来降解植物饲料中的单宁,不仅对单宁的去除高效彻底,而且成本较低、不污染环境,是解决其抗营养性的有效途径[10]。微生物对单宁的降解主要通过两种途径来实现:一是微生物向细胞外分泌可以和单宁高度亲和的物质,使其不能与生物体内维持生命所必需的物质相结合;二是分泌可使单宁降解的酶类并作用于单宁,使其转化成微生物生长所需要的物质和能量[11]。
蒸汽爆破预处理主要是利用高温高压蒸汽,通过瞬间释放压力过程,实现原料的组分离散和结构变化[12]。汽爆使接触面积增大,更有利于发酵。应用球磨技术,可将各类构树叶加工成超细粉,具有很好的固香性、分散性和溶解性,特别容易消化吸收,能最大限度地利用原料、节约资源。杨华等[13]通过高压蒸汽爆破处理使秸秆的木质纤维素结构得到改变,结合有益菌发酵显著提高了秸秆的营养价值。本文旨在研究不同处理方式复合菌固体发酵构树叶制备蛋白饲料的工艺条件优化,并跟踪发酵过程中酶活力和微生物生长情况。实验为后续构树叶作为非常规饲料投入生产提供科学依据。
1. 材料与方法
1.1 材料与仪器
构树叶 采自于杭州市西湖区浙江科技学院,晒干磨粉过20目筛;酿酒酵母菌BY4741、乳酸菌JI2176、枯草芽孢杆菌KD-N2 浙江省农产品化学与生物加工技术重点实验室提供;没食子酸(分析纯) 国药集团化学有限公司;无水碳酸钠(分析纯) 天津市化学试剂研究所有限公司;乙醇、单宁酸等(以上均为分析纯) 上海阿拉丁生化科技股份有限公司;福林酚(分析纯) 上海长哲生物科技有限公司;胰蛋白胨、蛋白胨、琼脂粉、酵母浸粉等(以上均为生物试剂) 北京奥博星生物技术有限责任公司;MRS肉汤(生物试剂) 杭州百思生物技术有限公司。
UDK159凯氏定氮仪、FIWE6纤维素测定仪、SER 148脂肪测定仪 意大利VELP;X3R高速冷冻离心机 美国Thermo;SW-CJ-1C型双人单面净化工作台 苏州净化设备有限公司;UV-5500PC型紫外分光光度计 上海市元析仪器有限公司;PTX-FA210型电子天平 福州华志科学仪器有限公司;SB-130旋转蒸发仪 东京理化;JXFSTPRP-24全自动样品快速研磨机 上海净信实业发展有限公司;QBS-800汽爆试验台 鹤壁正道生物能源有限公司。
1.2 实验方法
1.2.1 发酵饲料的制作
称取适量的构树叶粉置于250 mL锥形瓶内在超净台上紫外灭菌2 h。按物料:菌液:去离子水一定比例配比混合拌匀,加塞,置于培养箱在合适温度的环境下培养。菌种发酵构树叶到一定时间取出置于烘箱60 ℃下烘干,冷却装入样品袋。
1.2.2 单宁标准曲线的绘制
准确称取单宁酸5 mg,用少量去离子水溶解后移入50 mL容量瓶中定容,配制成0.1 mg/mL的标准液。取6个50 mL容量瓶,先在每个容量瓶中装约30 mL去离子水,再分别量取单宁标准溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL于容量瓶中,分别加入2.5 mL福林酚试剂、5 mL饱和碳酸钠溶液,用蒸馏水定容至刻度处,最后超声使溶液混匀,放置30 min后开始测定吸光度,以未加单宁的混合液做空白,在756 nm处[14]测定吸光值,并以单宁含量(mg)为横坐标,吸光度值为纵坐标绘制标准曲线。得到单宁酸标准曲线的回归方程:y=1.946x+0.00589,R2=0.9994。
1.2.3 单宁的提取及含量测定
准确称取构树叶饲料样品1 g(精确到0.0001 g),加入50 mL提取试剂(体积分数为20%的乙醇溶液),置于70 ℃的恒温水浴锅中加热回流40 min,以双层滤纸过滤,得到的澄清溶液即为单宁溶液。量取1 mL单宁溶液于装有30 mL去离子水的容量瓶中,按照上述制作标准曲线的顺序依次加入2.5 mL福林酚试剂、5 mL饱和碳酸钠溶液,静置30 min后,在756 nm处测定吸光度[15]。单宁含量的计算,公式如下:
单宁(%)=B×50m×1000×100 式中:B:测定到的吸光光度值并在标准曲线上计算处相应50 mL溶液里面的单宁含量,mg;m:样品质量,g。
1.2.4 不同预处理对构树叶抗营养因子的影响
1.2.4.1 汽爆条件优化
称取300 g构树叶原料,用汽爆试验台爆破,在蒸汽压强1.4 MPa的条件下,考察维压时间(60、120、180、240、300 s)对构树叶中单宁含量的影响;在维压时间120 s的条件下,考察蒸汽压强(1.0、1.2、1.4、1.6、1.8 MPa)对构树叶中单宁含量的影响,每个处理三组重复。
在以上实验的基础上,选取蒸汽压强(1.3、1.4、1.5 MPa)和维压时间(90、120、150 s),并研究不同条件下对构树叶中单宁含量的影响,每个处理三组重复,实验设计见表1。得到构树叶汽爆粉。
表 1 汽爆条件优化设计Table 1. Optimization design of steam explosion conditions编号 汽爆发酵时间(s) 汽爆发酵压强(MPa) 1 90 1.3 2 120 1.3 3 150 1.3 4 90 1.4 5 120 1.4 6 150 1.4 7 90 1.5 8 120 1.5 9 150 1.5 1.2.4.2 球磨条件研究
称取1 g构树叶原料置于研磨仪中,考查球磨时间(5、10、15、20、25 min),研究球磨时间对构树叶中单宁含量的影响。得到构树叶球磨粉。
1.2.5 构树叶发酵工艺条件优化
1.2.5.1 构树叶发酵菌种配比的优化
称取5 g构树叶原料,按1.2.1方法发酵,在30 ℃、含水量40%,发酵3 d的条件下考查菌种配比(酵母菌:芽孢杆菌:乳酸菌分别为1:1:1、2:1:1、3:1:1、1:2:1、2:2:1、3:2:1、1:3:1、2:3:1、3:3:1),研究菌种配比对构树叶中单宁含量的影响,每个处理三组重复。
1.2.5.2 发酵温度对单宁含量的影响
称取5 g构树叶原料,按1.2.1方法发酵,在发酵3 d、含水量40%的条件下,把构树叶分别置于24、27、30、33、36、39 ℃的培养箱恒温发酵,通过测定单宁含量来确定最佳的发酵温度。
1.2.5.3 发酵时间对单宁含量的影响
称取5 g构树叶原料,按1.2.1方法发酵,在33 ℃、含水量40%的条件下,构树叶分别发酵1、2、3、4、5、6 d,通过测定单宁含量来确定最佳的发酵时间。
1.2.5.4 含水量对单宁含量的影响
称取5 g构树叶原料,按1.2.1方法发酵,构树叶含水量20%、30%、40%、50%、60%、70%,在33 ℃、发酵4 d的条件下,通过测定单宁含量来确定最佳的含水量。
1.2.6 响应面试验
在单因素实验的基础上,选取发酵温度(A,℃)、发酵时间(B,d)、含水量(C,%),以构树叶中单宁含量(%)为响应值,根据Box-Behnken中心组合实验原理,设计三因素三水平响应面分析实验。其因素水平编码表见表2。
表 2 Box-Behnken实验因素水平表及编码Table 2. Box-Behnken experimental factor level table and coding因素 水平 −1 0 1 A发酵温度(℃) 30 33 36 B发酵时间(d) 3 4 5 C含水量(%) 50 60 70 1.2.7 不同方式处理发酵参数
原料发酵参数:构树叶原料,发酵时间4 d,含水量60%,发酵温度32.50 ℃,酿酒酵母菌:乳酸菌:枯草芽孢杆菌为1:1:1。
球磨发酵参数:构树叶球磨粉,发酵时间4 d,含水量60%,发酵温度32.50 ℃,酿酒酵母菌:乳酸菌:枯草芽孢杆菌为1:1:1。
汽爆发酵参数:构树叶汽爆粉,发酵时间4 d,含水量60%,发酵温度32.50 ℃,酿酒酵母菌:乳酸菌:枯草芽孢杆菌为1:1:1。
1.2.8 营养成分测定方法
粗蛋白(CP)的测定采用GB/T 6432-2018的方法,粗纤维(CF)的测定采用DB37/T 3370-2018的方法;粗灰分(Ash)的测定采用GB/T 6438-2007的方法;粗脂肪(EE)的测定采用GB/T 6433-2006的方法;钙(Ca)的测定采用GB/T 6436-2018的方法,磷(P)的测定采用GB/T 6437-2018的方法。
1.2.9 单宁酶活力测定
1.2.9.1 没食子酸标准曲线的绘制
称取0.1701 g没食子酸用去离子水溶解后移入1000 mL容量瓶中定容,配制成0.1 mmol/L溶液,分别吸取0、2、4、6、8、10 mL标准溶液到50 mL容量瓶中定容,配制成6个不同浓度梯度的标准液。分别取0.5 mL没食子酸标准溶液和0.3 mL甲醇绕丹宁溶液(0.05 mol/L),加到所有试管中,在30 ℃反应5 min。将0.2 mL(0.5 mol/L)的KOH水溶液加入到所有的试管后,再次在30 ℃水浴5 min,最后在所有试管中加入4 mL蒸馏水稀释,以蒸馏水作空白,在520 nm波长下测定吸光值,得到没食子酸溶液标准曲线。并以没食子酸浓度(µmol/L)为横坐标,吸光度值为纵坐标绘制标准曲线。得到没食子酸标准曲线的回归方程:y=0.003x−0.0023,R2=0.9988。
1.2.9.2 单宁酶活力测定
此方法是根据没食子酸(单宁酶催化没食子酸丙酯水解产生没食子酸)与甲醇罗丹宁在碱性条件下之间形成色团物质的方法来测定单宁酶的活性,将30 ℃条件下每分钟产生1 µmol没食子酸所需的酶量定义为一个酶活单位(1 U)。取三支洁净的试管分别标记为空白管、测试管、对照管。将底物没食子酸丙酯(0.01 mol/L)以及粗酶液在反应开始之前先放入30 ℃水浴中预热10 min。在被标记的三支试管中都加入0.25 mL没食子酸丙酯溶液,接着取0.25 mL柠檬酸缓冲液(pH=5,0.1 mol/L)加入空白管中,0.25 mL粗酶液加入到测试管中后将三支试管都放入30 ℃水浴10 min,然后将0.3 mL甲醇罗丹宁溶液(0.05 mol/L)加入所有试管中,30 ℃水浴10 min,之后取0.2 mL的KOH(0.5 mol/L)溶液加入所有试管中,30 ℃水浴10 min,然后仅在对照管的反应混合物中加入0.25 mL粗酶液,摇匀充分混合。最后每支试管都加入4 mL去离子水,在30 ℃下保温10 min后,在520 nm波长下测定反应混合物的吸光值,以去离子水为参比溶液。所有测试都做3个平行实验,取算术平均值。根据没食子酸标准曲线换算酶活力。
Δ520=(Δ测试管−Δ空白管)−(Δ对照管−Δ空白管) 1.2.10 微生物多样性
参照GB 4789.35-2016对饲料中的乳酸菌进行菌落计数,参照GB/T 26428-2010对饲料中的枯草芽孢杆菌进行菌落计数,参照GB 4789.15-2016对饲料中的酵母菌进行菌落计数。
1.3 数据处理
采用Origin2017和SPSS22.0进行数据整理并进行统计分析,测定数据用“平均值±标准差”表示,各项测定均三次重复。
2. 结果与分析
2.1 汽爆条件优化
2.1.1 维压时间对单宁含量的影响
由图1可知,在汽爆压强1.6 MPa的条件下,随着维压时间的延长,单宁含量呈现先下降再升高的趋势。维压120 s时具有显著性差异(P<0.05)。原因是由于水蒸气与构树叶接触的时间延长,让一部分单宁发生了聚合或缩合反应,同时将构树叶中未被检测出的单宁释放出来。当维压时间在120 s对构树叶中得到单宁含量最低,此时构树叶中的单宁含量为2.19%,因此选择维压时间120 s进一步优化汽爆条件。
2.1.2 汽爆压强对单宁含量的影响
由图2可知,在维压时间120 s的条件下,构树叶中单宁含量随着汽爆压强的增加先增加后降低最后又呈增加趋势。汽爆压强为1.4 MPa时含量最低,单宁含量为1.68%。刚开始单宁含量升高的原因是构树叶中未被检测到的单宁释放出来,随着压强的增加,蒸汽不断挤压构树叶结块,导致蒸汽无法进去结块内部,使单宁无法被降解[16]。汽爆压强在1.4 MPa时最有利分解单宁。因此选择汽爆压强1.4 MPa、维压时间120 s进一步优化。
2.1.3 汽爆条件的优化与选择
由图3可知,汽爆压强1.3 MPa时,构树叶中单宁含量随着维压时间的增加而减少。汽爆压强在1.4、1.5 MPa时,单宁含量随着维压时间的增加而增加。相同维压时间,单宁含量随着汽爆压强的增加先减小后增加。验证了汽爆压强和维压时间对构树叶中单宁含量具有一定的影响,单宁含量减低是因为汽爆会降解单宁。升高是因为蒸汽不断挤压构树叶结块,导致蒸汽无法就如结块内部。气爆压强1.4 MPa、维压时间90 s时构树叶中的单宁含量最低,有显著性差异(P<0.05)。因此,以单宁含量为指标,汽爆的最佳条件选择汽爆压强1.4 MPa、维压时间90 s。
2.2 球磨对单宁含量的影响
由图4可知,构树叶中单宁含量先随着球磨时间的延长而增加,到了10 min之后,单宁含量呈下降趋势,20 min之后单宁含量呈上升趋势。球磨20 min时,构树叶中单宁含量最低,单宁含量为1.7%,降单宁效果具有显著性差异(P<0.05)。单宁含量降低的原因是,球磨过程中产生大量热量导致单宁降解。因此,以单宁含量为指标,球磨构树叶的球磨时间宜选择20 min。
2.3 发酵构树叶菌种配比的选择
从图5可知,酵母菌:芽孢杆菌:乳酸菌=1:1:1时发酵构树叶,单宁含量最低,此时含量为1.81%,降单宁效果有显著性差异(P<0.05)。混菌发酵时,菌种会有协同作用,也会抑制其他菌的生长,从实验结果,选择酵母菌:芽孢杆菌:乳酸菌=1:1:1时发酵构树叶。
2.4 单因素实验结果
2.4.1 发酵温度对单宁含量的影响
由图6可知,发酵温度在24~33 ℃,单宁含量呈下降趋势;超过33 ℃,单宁含量呈上升趋势,因此可以确定33 ℃是构树叶发酵生产蛋白饲料的最佳温度,此时单宁含量1.31%。一部分原因是因为随着温度对菌种活性的影响,酵母菌产生胞外单宁酶对单宁进行一定的降解,当温度超过33 ℃时,菌种的活性变弱,对单宁的降解也变弱,导致温度升高,单宁的含量反而呈上升趋势;另一个原因是单宁属于多酚,多酚随着温度升高会发生自缩合或聚合,含量降低[17]。因此,确定最近的发酵温度是33 ℃。
2.4.2 发酵时间对单宁含量的影响
由图7可知,发酵第1~2 d时,构树叶单宁含量呈降低趋势,第3 d单宁含量增加,到第4 d时降单宁效果最佳,此时单宁含量为1.53%,之后又开始呈升高趋势。可能原因是,随着发酵时间的增加,菌的活性变强,单宁酶增加导致单宁分解。随着发酵的进行,微生物把许多大分子降解为小分子,其中含有酚类物质,这就导致了单宁含量又开始上升。构树叶中的单宁缩合物在发酵开始时处于不溶于水的状态而未被检测出来,但随着发酵的进行,缩合物水解出来进而转化成了单宁[18]。由于微生物在固态发酵的封闭环境中,氧气被逐渐消耗,微生物的呼吸方式变成无氧呼吸,微生物体内的新陈代谢途径发生变化,导致新生成的单宁未被立即分解[19]。因此,确定最佳的发酵时间是4 d。
2.4.3 含水量对单宁含量的影响
由图8可知,随着含水量增加,构树叶单宁含量呈降低趋势,此时单宁含量为1.50%,含水量60%时降单宁具有显著性差异(P<0.05),之后又开始呈升高趋势。可能原因是由于高水分增加了固体构树叶中的物料膨胀,微生物能更充分地与物料接触获得营养物质和足够的氧气,更好地生长[20]。含水量对发酵饲料pH变化有显著影响,但含水量过高或过低不利于pH的降低[21]。因此,确定最佳的含水量是60%。
2.5 响应面试验结果
2.5.1 响应面试验结果及回归方程拟合
利用Design-Expert V8.0.6软件,对实验结果进行多项式回归方程分析,结果见表3。对实验数据回归拟合,得到自变量与单宁含量的二次回归方程方程式为:Y=1.35+0.12C−0.075AC+0.48A2+0.63B2+0.38C2。
表 3 响应面试验设计与结果Table 3. Design and results of response surface experiment实验号 发酵时间(d) 含水量(%) 发酵温度(℃) 单宁含量(%) 1 3 50 33 2.58 2 4 60 33 1.25 3 5 60 30 2.17 4 5 50 33 2.47 5 4 60 33 1.39 6 4 50 30 2.13 7 4 60 33 1.42 8 3 60 36 2.39 9 5 70 33 2.43 10 3 60 30 2.01 11 4 70 36 2.46 12 4 70 30 2.32 13 5 60 36 2.25 14 4 50 36 2.52 15 4 60 33 1.42 16 3 70 33 2.35 17 4 60 33 1.28 2.5.2 响应面模型方差及显著性分析
对回归方程进行方差分析结果如表4。由表4可知,该回归模型高度显著(P<0.001),失拟项F值为1.06,P为0.4584(P>0.05),失拟项不显著,表明拟合度良好,能较好解释响应面中的变异。模型决定系数R2=0.9876,校准决定系数R2Adj=0.9716,说明该拟合度良好,能用该模型分析和预测发酵构树叶制备工艺过程中各参数的变化。模型回归系数显著性分析显示,一次项C极显著(P<0.01),二次项A2、B2、C2对降抗营养因子的影响均为高度显著(P<0.001)。各因素显著性程度依次为发酵温度>含水量>发酵时间。
表 4 回归模型方差分析Table 4. Variance analysis of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 3.75 9 0.42 61.73 <0.0001 *** A 0 1 0 0.002 0.9669 B 0.002 1 0.002 0.36 0.5657 C 0.12 1 0.12 18.17 0.0037 ** AB 0.009 1 0.009 1.34 0.2853 AC 0.023 1 0.023 3.34 0.1105 BC 0.016 1 0.016 2.32 0.1718 A2 0.96 1 0.96 141.77 <0.0001 *** B2 1.67 1 1.67 247.03 <0.0001 *** C2 0.6 1 0.6 88.51 <0.0001 *** 残差 0.047 7 0.007 失拟项 0.021 3 0.007 1.06 0.4584 不显著 纯误差 0.026 4 0.007 总回归 3.79 16 注:***差异高度显著(P<0.001);**差异极显著(P<0.01);*差异显著(P<0.05);R2=0.9876,RAdj2=0.9716。 2.5.3 交互作用分析结果
由图9可知,单宁含量随着发酵时间的延长,含水量增加以及发酵温度的升高均呈现先减小后增加的趋势,说明两两因素交互中均存在极小值且极值对应的点接近椭圆的中心。同时观察到响应面斜率随发酵温度的变化而变化较大,说明发酵温度对构树叶中单宁含量的影响大于发酵时间和含水量,与上述方差分析结果相一致。
2.5.4 模型验证结果
经过响应面优化最佳发酵工艺为:发酵时间4 d,含水量60%,发酵温度32.50 ℃,预测该条件下构树叶单宁含量为1.34%。根据所拟合的最佳条件进行验证试验,平行三次,取平均值得到构树叶单宁含量为1.42%,误差值为0.03%,与预测值接近,证明了该方程的可行度和准确性。
2.6 常规营养成分分析
由表5可知,原料的粗蛋白含量为16.83%,经过发酵构树叶中粗蛋白含量为20.80%,差异性显著(P<0.05),粗蛋白含量提高了23.59%,经汽爆后发酵和球磨后发酵的粗蛋白分别提高了10.28%和7.84%;原料的粗纤维含量为15.66%,经过发酵粗纤维含量降低了15.33%(P<0.05),经汽爆后发酵和球磨后发酵的粗纤维分别降低了12.32%和7.85%;原料的钙含量为2.70%,经发酵后钙含量无明显变化,经汽爆发酵后和球磨后发酵分别增加了23.33%和22.22%(P<0.05)。预处理和发酵对磷、粗灰分和粗脂肪的含量几乎无影响,磷含量在0.3%左右,粗脂肪含量在2.4%左右。
表 5 常规营养成分表(%,干基)Table 5. Table of conventional nutrients (%, dry basis)类别 原料 原料发酵 汽爆发酵 球磨发酵 单宁 2.1±0.05a 1.34±0.03b 1.27±0.02b 0.85±0.02c 粗蛋白 16.83±0.15b 20.80±0.25a 18.56±0.01b 18.15±0.21b 粗灰分 16.26±0.29d 16.32±0.26c 16.43±0.13a 16.20±0.29b 粗纤维 15.66±0.29a 13.26±0.13b 13.73±0.44b 14.43±0.34ab 粗脂肪 2.37±0.05 2.36±0.04 2.36±0.03 2.45±0.04 磷 0.29±0.01 0.31±0.02 0.32±0.01 0.32±0.02 钙 2.70±0.05b 2.78±0.10b 3.33±0.03a 3.30±0.22a 注:同行相比,肩标不同的小写字母表示差异性显著(P<0.05),肩标相同的小写字母表示差异性不显著(P>0.05)。 2.7 发酵过程中的酶活力
由图10可知,从发酵开始到发酵第3 d,酶活力不断增加,且在第3 d酶活力最高,球磨发酵、汽爆发酵和原料发酵的酶活力分别达到了65.10、44.77和41.43 U。到了第4 d,酶活力开始下降。在第3 d的时间,按酶活力大小进行排序:球磨发酵>汽爆发酵>原料发酵。与2.6中降单宁的结果一致,说明单宁酶活力越大,降单宁效果越好,符合实验的规律。
2.8 发酵过程中微生物多样性
构树叶发酵过程中的益生菌计数结果见表6。酵母菌、枯草芽孢杆菌和乳酸菌的总菌数呈现先增加后减少的趋势,发酵到第3 d的时候,菌落总数最多。原料发酵的酵母菌、枯草芽孢杆菌和乳酸菌分别为6.0×107、1.1×108和3.0×106 CFU·g−1。球磨发酵的酵母菌、枯草芽孢杆菌和乳酸菌分别为2.25×107、1.1×108和5.5×106 CFU·g−1。汽爆发酵的酵母菌、枯草芽孢杆菌和乳酸菌分别为2.0×107、9.0×107和2.5×106 CFU·g−1。
表 6 构树叶发酵过程中的益生菌计数结果Table 6. Probiotic counting results during fermentation of Broussonetia papyrifera leaves项目 发酵时间(d) 酵母菌
(CFU·g−1)枯草芽孢杆菌
(CFU·g−1)乳酸菌
(CFU·g−1)原料发酵 1 9.5×105 9.5×105 7.5×105 2 1.5×106 7.5×106 2.25×106 3 6.0×107 1.1×108 3.0×106 4 2.0×107 4.0×107 9.5×104 球磨发酵 1 1.1×105 4.0×105 2.7×105 2 2.5×106 8.0×106 7.5×105 3 2.25×107 1.1×108 5.5×106 4 2.5×105 2.0×106 9.0×104 汽爆发酵 1 1.55×105 8.0×105 7.0×105 2 3.5×105 9.0×106 1.5×106 3 2.0×107 9.0×107 2.5×106 4 1.5×105 1.0×106 9.5×105 3. 结论与讨论
本实验采用蒸汽爆破、球磨等方式对构树叶进行预处理,以抗营养因子单宁含量为考察指标,通过响应面分析法确定枯草芽孢杆菌、乳酸菌和酿酒酵母菌的复合菌固态发酵构树叶制备蛋白饲料的最佳工艺。最佳工艺条件为:汽爆压强1.4 MPa,维压时间90 s;球磨时间20 min;发酵时间4 d,含水量60%,发酵温度32.50 ℃,酿酒酵母菌:乳酸菌:枯草芽孢杆菌=1:1:1。构树叶经发酵、汽爆后发酵和球磨后发酵单宁含量分别降低了36.2%、39.5%和60.5%;粗蛋白含量分别增加了23.59%、10.28%和7.84%。原料发酵、汽爆发酵和球磨发酵的酶活力分别高达41.43、44.77和65.10 U。
本实验通过球磨和汽爆处理构树叶发酵的蛋白质增加率低于未处理是因为微生物的生命活动过程中会消耗营养物质,球磨和汽爆处理可以加快发酵时间,其发酵条件还可以进一步优化。发酵构树叶提高了蛋白质含量,降低了单宁含量,大大提高了构树叶的利用度,可以缓解目前畜禽饲料短缺的问题。
构树叶蛋白质结构复杂和抗营养因子单宁的存在,导致动物难以消化和吸收利用,这降低了饲料的营养价值。通过微生物的发酵,降解构树叶中复杂蛋白质为动物可消化的氨基酸、小肽等易被动物消化利用的形式并降解掉其中的粗纤维,构树叶完全可以成为应用广发的绿色饲料资源[22]。通过发酵,微生物降解单宁,实质上是微生物分泌的单宁酶作用于单宁分子中的醋键,使之降解成倍酸(或靴花酸)和葡萄糖,而且微生物还可继续分泌其他酶(如多酚氧化酶等),进一步将其降解为芳香族脂肪酸等小分子物质[3]。管维等[23]等通过微生物发酵,菜籽饼的单宁降解率14.75%,叶添梅等[24]等通过混菌发酵处理,桑叶的单宁降解率46.35%。本实验将构树叶直接发酵,单宁降解率为36.2%,通过球磨处理后发酵,单宁降解率为60.5%,大大提高了降解率。Jazi等[25]通过发酵处理,发酵7 d后棉粕中粗蛋白含量增加了7.92%。李海新[22]用米酒曲酶发酵构树叶,粗蛋白含量增加了5.29%。本实验中经发酵构树叶中粗蛋白含量为20.80%,差异性显著(P<0.05),粗蛋白含量提高了23.59%,汽爆后发酵和球磨后发酵粗蛋白含量分别增加了10.28%和7.84%,本实验大大提高了粗蛋白的增加量。
-
表 1 汽爆条件优化设计
Table 1 Optimization design of steam explosion conditions
编号 汽爆发酵时间(s) 汽爆发酵压强(MPa) 1 90 1.3 2 120 1.3 3 150 1.3 4 90 1.4 5 120 1.4 6 150 1.4 7 90 1.5 8 120 1.5 9 150 1.5 表 2 Box-Behnken实验因素水平表及编码
Table 2 Box-Behnken experimental factor level table and coding
因素 水平 −1 0 1 A发酵温度(℃) 30 33 36 B发酵时间(d) 3 4 5 C含水量(%) 50 60 70 表 3 响应面试验设计与结果
Table 3 Design and results of response surface experiment
实验号 发酵时间(d) 含水量(%) 发酵温度(℃) 单宁含量(%) 1 3 50 33 2.58 2 4 60 33 1.25 3 5 60 30 2.17 4 5 50 33 2.47 5 4 60 33 1.39 6 4 50 30 2.13 7 4 60 33 1.42 8 3 60 36 2.39 9 5 70 33 2.43 10 3 60 30 2.01 11 4 70 36 2.46 12 4 70 30 2.32 13 5 60 36 2.25 14 4 50 36 2.52 15 4 60 33 1.42 16 3 70 33 2.35 17 4 60 33 1.28 表 4 回归模型方差分析
Table 4 Variance analysis of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 3.75 9 0.42 61.73 <0.0001 *** A 0 1 0 0.002 0.9669 B 0.002 1 0.002 0.36 0.5657 C 0.12 1 0.12 18.17 0.0037 ** AB 0.009 1 0.009 1.34 0.2853 AC 0.023 1 0.023 3.34 0.1105 BC 0.016 1 0.016 2.32 0.1718 A2 0.96 1 0.96 141.77 <0.0001 *** B2 1.67 1 1.67 247.03 <0.0001 *** C2 0.6 1 0.6 88.51 <0.0001 *** 残差 0.047 7 0.007 失拟项 0.021 3 0.007 1.06 0.4584 不显著 纯误差 0.026 4 0.007 总回归 3.79 16 注:***差异高度显著(P<0.001);**差异极显著(P<0.01);*差异显著(P<0.05);R2=0.9876,RAdj2=0.9716。 表 5 常规营养成分表(%,干基)
Table 5 Table of conventional nutrients (%, dry basis)
类别 原料 原料发酵 汽爆发酵 球磨发酵 单宁 2.1±0.05a 1.34±0.03b 1.27±0.02b 0.85±0.02c 粗蛋白 16.83±0.15b 20.80±0.25a 18.56±0.01b 18.15±0.21b 粗灰分 16.26±0.29d 16.32±0.26c 16.43±0.13a 16.20±0.29b 粗纤维 15.66±0.29a 13.26±0.13b 13.73±0.44b 14.43±0.34ab 粗脂肪 2.37±0.05 2.36±0.04 2.36±0.03 2.45±0.04 磷 0.29±0.01 0.31±0.02 0.32±0.01 0.32±0.02 钙 2.70±0.05b 2.78±0.10b 3.33±0.03a 3.30±0.22a 注:同行相比,肩标不同的小写字母表示差异性显著(P<0.05),肩标相同的小写字母表示差异性不显著(P>0.05)。 表 6 构树叶发酵过程中的益生菌计数结果
Table 6 Probiotic counting results during fermentation of Broussonetia papyrifera leaves
项目 发酵时间(d) 酵母菌
(CFU·g−1)枯草芽孢杆菌
(CFU·g−1)乳酸菌
(CFU·g−1)原料发酵 1 9.5×105 9.5×105 7.5×105 2 1.5×106 7.5×106 2.25×106 3 6.0×107 1.1×108 3.0×106 4 2.0×107 4.0×107 9.5×104 球磨发酵 1 1.1×105 4.0×105 2.7×105 2 2.5×106 8.0×106 7.5×105 3 2.25×107 1.1×108 5.5×106 4 2.5×105 2.0×106 9.0×104 汽爆发酵 1 1.55×105 8.0×105 7.0×105 2 3.5×105 9.0×106 1.5×106 3 2.0×107 9.0×107 2.5×106 4 1.5×105 1.0×106 9.5×105 -
[1] 李兰海, 王自蕊, 游金明, 等. 构树叶在畜禽生产中的研究进展[J]. 饲料工业,2018,39(1):24−26. [Li L H, Wang Z R, You J M. Research advances on the application of Broussonetia papyrifera leaves for livestock and poultry[J]. Feed Industry,2018,39(1):24−26. [2] Mei C J, Wang Q C, Gui J C, et al. Molecular identification of ‘Candidatus phytoplasma asteris’ related strain (16SrI-B) associated with Broussonetia papyrifera in Nanjing, China[J]. European Journal of Plant Pathology,2016,145(1):203−207. doi: 10.1007/s10658-015-0808-3
[3] 李艳芝. 构树叶对蛋鸡生产性能、蛋品质、血液生化指标及免疫功能的影响[D]. 保定: 河北农业大学, 2011. Li Y Z. Effect of leaves of Broussonetia on production performance, egg quality, serum biochemical parameters and immunity of laying hens[D]. Baoding: Hebei Agriculture University, 2011.
[4] Huang Q Q, Liu X L, Zhao G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition,2018,4(2):137−150. doi: 10.1016/j.aninu.2017.09.004
[5] Espinosa-Gómez F C, Serio-Silva J C, Santiago-García J D, et al. Salivary tannin-binding proteins are a pervasive strategy used by the folivorous/frugivorous black howler monkey[J]. American Journal of Primatology,2018:e22737.
[6] Frazier R A, Deaville E R, Creen R J, et al. Interacyions of tea tannins and condensed tannins with proteins[J]. Journal of Phannaceutical and Biomedical Analysis,2010,51:490−495. doi: 10.1016/j.jpba.2009.05.035
[7] 李海庆, 吴跃明. 饲料中单宁对动物的影响[J]. 饲料研究,2006,17:26−29. [Li H Q, Wu Y M. Effect of tannin in feed on animals[J]. Feed Research,2006,17:26−29. doi: 10.3969/j.issn.1002-2813.2006.02.009 [8] Teixeira L, Pinto C F D, Kessler A D M, et al. Effect of partial substitution of rice with sorghum and inclusion of hydrolyzable tannins on digestibility and postprandial glycemia in adult dogs[J]. Plos One,2019,14(5):1−14.
[9] Omnes M, Goasduff J R, Delliou H L, et al. Effects of dietary tannin on growth, feed utilization and digestibility, and carcass composition in juvenile European seabass (Dicentrarchus labrax L.)[J]. Aquaculture Reports,2017,6:21−27. doi: 10.1016/j.aqrep.2017.01.004
[10] Shang Y F, Cao H, Ma Y L, et al. Effect of lactic acid bacteria fermentation on tannins removal in Xuan Mugua fruits[J]. Food Chemistry,2019,274:118−122. doi: 10.1016/j.foodchem.2018.08.120
[11] 蔡淑娟. 产单宁酶酵母菌株的筛选[D]. 淄博: 齐鲁工业大学, 2012. Cai S J. A thesis submitted for the application of the master’s degree of engineering[D]. Zibo: Qilu University of Technology, 2012.
[12] 赵亮. 发酵改性降低秸秆成型能耗及提高成型耐水性机理研究[D]. 北京: 华北电力大学, 2016. Zhao L. Research on the mechanism of decreasing the energy consumption and improving the water resistance of straw briquetting by anaerobic fermentation pretreatment[D]. Beijing: North China Electric Power University, 2016.
[13] 杨华, 李建仓, 赵富善, 等. 秸秆汽爆饲料化利用自动化生产线研制[J]. 农业开发与装备,2020(7):141−145. [Yang H, Li J C, Zhao F S, et al. Development of automatic production line for straw steam explosion feed utilization[J]. Agricultural Development and Equipment,2020(7):141−145. doi: 10.3969/j.issn.1673-9205.2020.07.105 [14] 王全杰, 任方萍, 高龙. 植物单宁的含量测定方法[J]. 西部皮革,2010,32(23):26−31. [Wang Q J, Ren F P, Gao L. Testing methods of the vegetable tannin content[J]. West Leather,2010,32(23):26−31. doi: 10.3969/j.issn.1671-1602.2010.23.009 [15] 李淑颖. 单宁降解菌筛选及其降解木本饲料中单宁的研究[D]. 长春: 吉林农业大学, 2017. Li S Y. Screening and isolation of tannic acid degrading microorganisms and the study about the reduction of tannic acid in Woody forage[D]. Changchun: Jilin Agricultura University, 2017.
[16] 张雷. 基于蒸汽爆破技术生产无抗化豆粕饲料的研究[D]. 郑州: 河南农业大学, 2017. Zhang L. Study on manufacturing technique of antinutritional factors-free soybean meal feed based on steam explosion[D]. Zhengzhou: Henan Agricultural University, 2017.
[17] 林益明, 黄舒静, 黄玉杰, 等. 不同温度处理对两种木麻黄单宁提取的影响[J]. 厦门大学学报(自然科学版),2007(4):583−586. [Lin Y M, Huang S J, Huang Y J, et al. Effect of different temperature on estimates effect of different temperature on estimates[J]. Journal of Xiamen University (Natural Science),2007(4):583−586. [18] Al-Ashen S, Duvnjak Z. Phytase production and decrease of phytic acid content in canola meal by Aspergillus in solid-state fermentation[J]. Word Journal of Microbiology and Biotechnology,1995,11:228−231. doi: 10.1007/BF00704655
[19] Naushad M E, John R T. Sorghum kafirin interaction with various phenolic compounds[J]. Journal of the Science of Food and Agriculture,2010,83:402−407.
[20] 王晓东, 麦康森, 张彦娇, 等. 双低菜粕中植酸和单宁的黑曲霉发酵降解及条件优化[J]. 中国海洋大学学报(自然科学版),2013,43(2):15−22. [Wang S D, Mai K S, Zhang Y J, et al. Degradation of tannins and phytic acid in double-low rapeseed meal by Aspergillusniger in solid fermentation and optimization of fermenting condition[J]. Periodical of Ocean University of China (Natural Science),2013,43(2):15−22. [21] 周梦佳, 李涛, 曾燕, 等. 含水率对发酵饲料品质的影响[J]. 中国饲料,2013(7):12−14. [Zhou M J, Li T, Zeng Y, et al. Effects of moisture content on fermentation feed quality[J]. China Feed,2013(7):12−14. [22] 李海新. 发酵构树叶对生长猪营养物质消化率、肥育性能、屠宰性能及肉质的影响[D]. 湛江: 广东海洋大学, 2010. Li H X. Influence of ferment Broussonetia papyrifera leaf on nutrients, growing performance, carcass characteristics and meat quality[D]. Shenjiang: Guangdong Ocean University, 2010.
[23] 管维, 兰时乐, 詹逸舒, 等. 复合微生物固态发酵菜籽饼粕对抗营养因子去除条件的研究[J]. 安徽农业科学,2020,48(2):189−191, 196. [Guan W, Lan S L, Zhan Y S, ey al. Study on the removal conditions of anti-nutrients study on the removal conditions of anti-nutrients[J]. Journal of Anhui Agricultural Sciences,2020,48(2):189−191, 196. doi: 10.3969/j.issn.0517-6611.2020.02.055 [24] 叶添梅, 李霞, 李飞鸣, 等. 桑叶粉饲料生物发酵工艺试验[J]. 四川蚕业,2020,48(2):33−36. [Ye T M, Li X, Li F M, et al. Experimental study on biological fermentation technology of mulberry leaf powder feed[J]. Sichuan Sericulture,2020,48(2):33−36. [25] Jazi V, Boldaji F, Dastar B, et al. Effects of fermented cottonseed meal on the growth performance, gastrointestinal microflora population and small intestinal morphology in broiler chickens[J]. British Poultry Science,2017,58(4):402−408. doi: 10.1080/00071668.2017.1315051





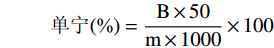
 下载:
下载:
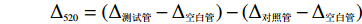










 下载:
下载:
