Purification of Calycosin from Astragalusme mbranceus with Macroporous Resins by Response Surface Analysis
-
摘要: 为优化大孔树脂纯化黄芪毛蕊异黄酮提取物的最佳工艺条件,比较七种不同类型大孔树脂(H103、D101、AB-8、DM130、HPD-400、DM301、HPD-600)的静态吸附-洗脱性能,筛选合适树脂型号后,采用单因素与响应面试验确定最佳纯化工艺条件。结果表明,HPD-400树脂对毛蕊异黄酮的吸附纯化效果最佳。随着温度的升高,树脂吸附量下降,吸附过程符合二级动力学模型特征。大孔树脂纯化黄芪毛蕊异黄酮的最佳工艺为:质量浓度为2.97 mg/mL,pH4.9的毛蕊异黄酮提取液60 mL以1 mL/min流速上样至HPD-400树脂后,经140 mL体积分数为79.8%乙醇溶液,以1 mL/min流速洗脱,产物中毛蕊异黄酮含量由2.17%提高至10.36%,约为纯化前4.8倍。因此,该工艺条件适于黄芪毛蕊异黄酮纯化。Abstract: To optimize the technical condition for purification of calycosin of Astragalus membranceus with macroporous resin, the static adsorption and desorption performance of macroporous resin of seventy types (H103, D101, AB-8, DM130, HPD-400, DM301, HPD-600) were compared for select the best type resin. The optimum process condition was obtained by single factor experiments and response surface experiment. The results showed that HPD-400 macroporous resin was the best macroporous resin for purification of calycosin of Astragalus membranceus, and the adsorption quantity of the resin was gradual decreasing with temperature increasing, and the adsorption process fitted characteristic of second-order kinetics model. The optimum process condition were as follows: The initial concentration of sample solution was 2.97 mg/mL, the volume was 60 mL with loading speed of 1.0 mL/min, the pH of sample solution was 4.9, and the volume fraction of ethanol was 79.8%, the eluent volume was 140 mL with flow rate of 1.0 mL/min. The contents of calycosin in product increased from 2.17% to 10.36%, which was about 4.8 times of that before purification. Therefore, the HPD-400 macroporous resin had good performance for separation and purification of calycosin from extracts, the purification process obtained in this study was suitable for the purification of Astragalus membranceus calycosin.
-
黄芪是豆科黄芪属膜夹黄芪(Astragalus membranceus(Fisch.) Bge.)或蒙古黄芪(Astragalus membranceus(Fisch.) Bge. Var mongholicus Bge)的根,因具有补气固表、利尿脱毒之功效,而常添加在保健食品中[1-2]。
现代分析测试研究表明,黄芪中富含多糖、黄酮、蛋白质、维生素等营养成分,其中毛蕊异黄酮作为黄芪的主要活性成分之一,其含量大小常作为黄芪的品质参考,具有抗炎、抗肿瘤、增强机体免疫力等活性[3-4]。赵竞业与Li等曾利用毛蕊异黄酮在两相溶剂中具有不同的分配系数的特性,采用高速逆流色谱法对其分离纯化,但该方法需配备高速逆流色谱仪,成本较高[5-6]。
由于大孔树脂吸附分离具有操作简便、吸附量大、选择性好、成本低和可反复使用等特点[7-8],已被广泛用于多数天然化合物的分离纯化[9-10],且目前鲜有大孔树脂纯化黄芪毛蕊异黄酮的研究。为此,本研究通过静态吸附-洗脱试验,筛选合适的树脂型号,并采用单因素与响应面试验考察不同工艺条件对毛蕊异黄酮的纯化效果的影响,从而为该物质的后续深入研究提供理论与实验基础。
1. 材料与方法
1.1 材料与仪器
黄芪 云南东骏大药房经广西药用植物园,宋志军老师鉴定为黄芪的干燥根;毛蕊异黄酮对照品 上海阿拉丁试剂有限公司;甲醇、甲酸、乙醇、乙酸乙酯 均为色谱纯,国药集团化学试剂有限公司;试验用水 纯化水。
FW100型粉碎机 永康市云达机械设备厂;U3000型高效液相色谱仪 赛默飞-世尔科技公司;ME 104型电子天平 梅特勒-特利多公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;TG18G-II型台式高速离心机 盐城凯特实验仪器有限公司;SHA-C型恒温振荡器 国华(常州)仪器制造有限公司;AB-8、H103型大孔树脂 天津波鸿树脂科技有限公司;D101、DM130型大孔树脂 天津浩聚树脂科技有限公司;DM 301、HPD-600、HPD-400型大孔树脂 合肥四峰生物科技有限公司。
1.2 实验方法
1.2.1 提取物制备
黄芪完全粉碎后过60目筛,称取一定质量粉末,以8倍质量的体积分数为50%的乙醇溶液加热回流提取3次,合并提取溶剂后减压回收,所得浸膏溶于50 ℃水,加入乙酸乙酯萃取后,回收溶剂,即得毛蕊异黄酮粗提物[11]。
1.2.2 毛蕊异黄酮含量测定
采用高效液相色谱法测定样品中毛蕊异黄酮含量[12]。色谱条件:乙腈-水作流动相;柱温:40 ℃;流速:1.0 mL/min;检测波长:254 nm。准确称取毛蕊异黄酮对照品10.0 mg置于10 mL容量瓶内,加入流动相稀释至刻度摇匀后,分别准确移取0.5、1.0、2.0、3.0、5.0 mL于容量瓶内,加入流动相稀释至刻度,摇匀。随后,分别以毛蕊异黄酮对照品浓度为横坐标,相应的峰面积为纵坐标,绘制标准曲线,得到标准曲线方程:y=12769.2x+12.79 (r=0.9992),另将纯化后的洗脱液减压蒸发,浓缩干燥后称重,根据下式计算纯化产物的毛蕊异黄酮含量。
1.2.3 静态吸附-洗脱性能比较
经预处理后的5.0 g七种型号树脂(H103、D101、AB-8、DM130、HPD-400、DM301、HPD-600)置于锥形瓶内,分别加入60 mL 3 mg/mL提取液,于25 ℃振荡12 h达到吸附平衡后,过滤,测得溶液中毛蕊异黄酮浓度[13]。饱和吸附的树脂经纯水清洗后,加入100 mL体积分数为80%的乙醇溶液,于相同条件振荡解吸至平衡[14],照下列公式计算不同类型大孔树脂的吸附量、吸附率、洗脱率及回收率。
(1) (2) (3) (4) 式中:c0为提取液中毛蕊异黄酮浓度,mg/mL;ce为饱和吸附后溶液中毛蕊异黄酮浓度,mg/mL;V0为提取液体积,mL;Vd为洗脱液体积,mL;m为树脂干重,g;cd为洗脱液中毛蕊异黄酮浓度,mg/mL;
1.2.4 吸附等温曲线
配制体积60 mL浓度分别为0.5、1、2、3、4 mg/mL的提取液,加入装有5.0 g HPD-400型树脂的锥形瓶内,置于25、30、35 ℃恒温摇床中,振荡至饱和吸附后,测得滤液中毛蕊异黄酮的浓度,计算各自饱和吸附量,绘制吸附等温曲线,同时利用Langmuir、Freundlich模型线性拟合,以描述溶质与树脂的相互作用[15]。
1.2.5 吸附动力学曲线
准确称取5.0 g大孔树脂置于锥形瓶内,加入60 mL质量浓度为3 mg/mL提取液,于25 ℃振荡吸附,分别于不同吸附时间测定溶液中毛蕊异黄酮浓度,以吸附量为纵坐标,吸附时间为横坐标,绘制静态吸附动力学曲线,采用不同动力学模型阐明HPD-400型树脂对毛蕊异黄酮的吸附机制[16]。
1.2.6 树脂吸附条件考察
1.2.6.1 上样液pH考察
配制五份60 mL、3mg/mL的上样溶液,分别调节溶液pH至3、4、5、6、7,以1 mL/min流速上样至HPD-400树脂柱内,考察不同上样液pH对树脂吸附率影响。
1.2.6.2 泄漏曲线绘制
配制3mg/mL、pH为5的不同体积上样溶液,分别以1、2、3 mL/min流速上样至HPD-400树脂柱内,分段收集流出液,检测毛蕊异黄酮浓度,绘制泄露曲线,当流出液浓度达到上样液浓度10%时,为树脂泄漏点;当流出液浓度达到上样液浓度100%时,为饱和吸附点[17]。
1.2.7 树脂解吸条件考察
1.2.7.1 洗脱液浓度考察
分别采用体积分数为55%、65%、75%、85%、95%的乙醇溶液作洗脱液,以1 mL/min流速,洗脱饱和吸附后的HPD-400树脂,分段收集流出液,检测毛蕊异黄酮浓度,考察不同体积分数的乙醇溶液对毛蕊异黄酮洗脱率的影响。
1.2.7.2 洗脱曲线绘制
采用体积分数为80%的乙醇溶液,分别以1、2、3 mL/min流速,洗脱饱和吸附后的HPD-400树脂,分段收集流出液,检测毛蕊异黄酮浓度,绘制洗脱曲线。
1.2.8 响应面试验设计
在单因素实验基础上,固定上样流速1 mL/min、上样液体积60 mL、洗脱流速1 mL/min、洗脱液体积140 mL,以上样浓度(A)、上样液pH(B)和洗脱液浓度(C)为响应因素,回收率为响应值(Y),设计三因素三水平响应面试验,利用Design-Expert软件的Box-Behnken试验设计原理,确定最佳工艺条件,试验因素水平见表1所示。
表 1 响应面试验因素水平Table 1. Factors and levels in response surface design水平 A上样浓度(mg/mL) B上样液pH C洗脱液浓度(%) −1 2 4 75 0 3 5 80 1 4 6 85 1.3 数据处理
相关实验数据进行方差分析,检验水准α=0.05,当P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异。
2. 结果与分析
2.1 树脂型号筛选
由于不同型号大孔树脂的孔径、比表面积与极性差异较大,因此比较不同类型树脂对毛蕊异黄酮的吸附与解吸性能,结果见表2。H103、HPD-400树脂的静态吸附率与洗脱率分别最高,而HPD-400树脂对样品中毛蕊异黄酮的回收率最高,推测是因为H103树脂的比表面积较大,吸附作用较强[18],而HPD-400树脂的比表面积适中,且与黄酮化合物具有适当氢键作用,因此采用HPD-400大孔树脂纯化黄芪毛蕊异黄酮提取物。
表 2 大孔吸附树脂静态吸附性能Table 2. Static adsorption properties of macroporousresin树脂型号 极性 比表面积(m2/g) Qe (%) Dd (%) R (%) H103 非极性 ≥900 86.2 81.1 69.9 D101 非极性 ≥550 84.2 83.5 70.3 AB-8 弱极性 ≥480 81.5 85.1 69.4 DM130 弱极性 ≥500 83.1 82.9 68.9 HPD-400 中极性 ≥550 83.3 90.5 75.4 DM301 中极性 ≥330 79.6 88.6 70.5 HPD-600 极性 ≥550 62.8 85.7 53.8 2.2 树脂吸附等温线
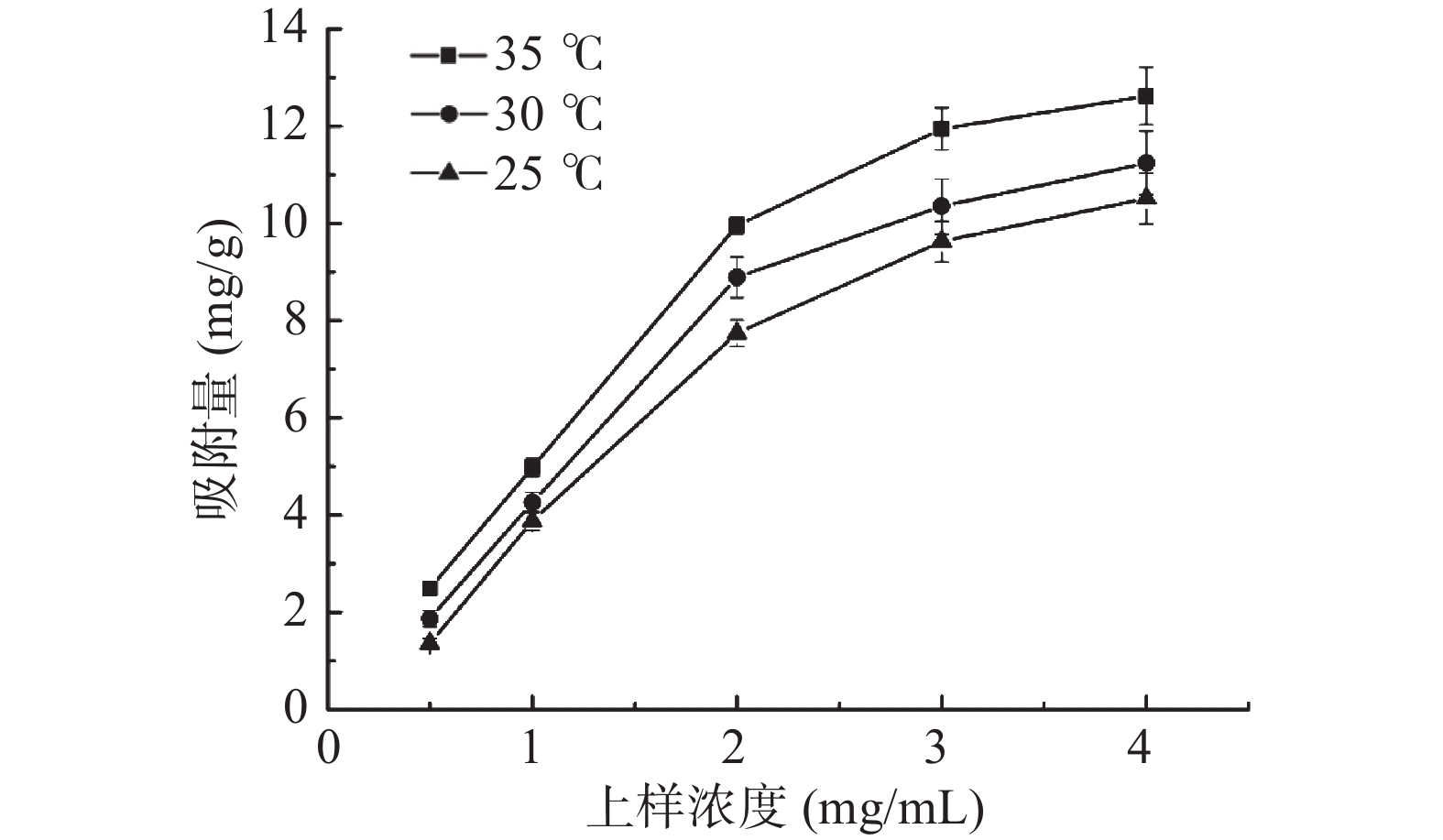
图1为HPD-400树脂对提取物中毛蕊异黄酮的吸附等温曲线。在相同吸附温度下,随着上样浓度的逐渐升高,吸附量逐渐增大,但随着吸附温度的升高,树脂吸附量不断增大,表明该吸附过程为吸热过程。在25 ℃下,当上样浓度增大至3 mg/mL时,HPD-400树脂吸附基本达到饱和,因此确定上样浓度2、3、4 mg/mL作为响应面因素考察水平。同时为便于实际应用,后续试验均选择在25 ℃下进行。
表3为不同温度下,Langmuir与Freundlich模型对吸附等温线的拟合参数,两种模型拟合方程的相关系数均较大(r>0.97),因此两种模型均能描述在该浓度范围内的样品溶液吸附过程,另从Freundlich方程可知,不同温度的拟合方程中1/n均小于0.5,表明目标化合物较易被吸附于HPD-400大孔树脂内[19]。
表 3 不同温度的Langmuir与Freundlich模型拟合参数Table 3. Fitting parameters of Langmuir and Freundlich models at different temperatures吸附温度 (℃) Langmuir方程 r Freundlich方程 r 1/n 25 Ce/=0.072 Ce+0.005 0.9872 =14.81Ce0.263 0.9885 0.263 30 Ce/=0.081 Ce+0.003 0.9935 =13.61Ce0.224 0.9891 0.224 35 Ce/=0.088 Ce+0.009 0.9763 =12.54 Ce0.195 0.9952 0.195 2.3 树脂吸附动力学曲线
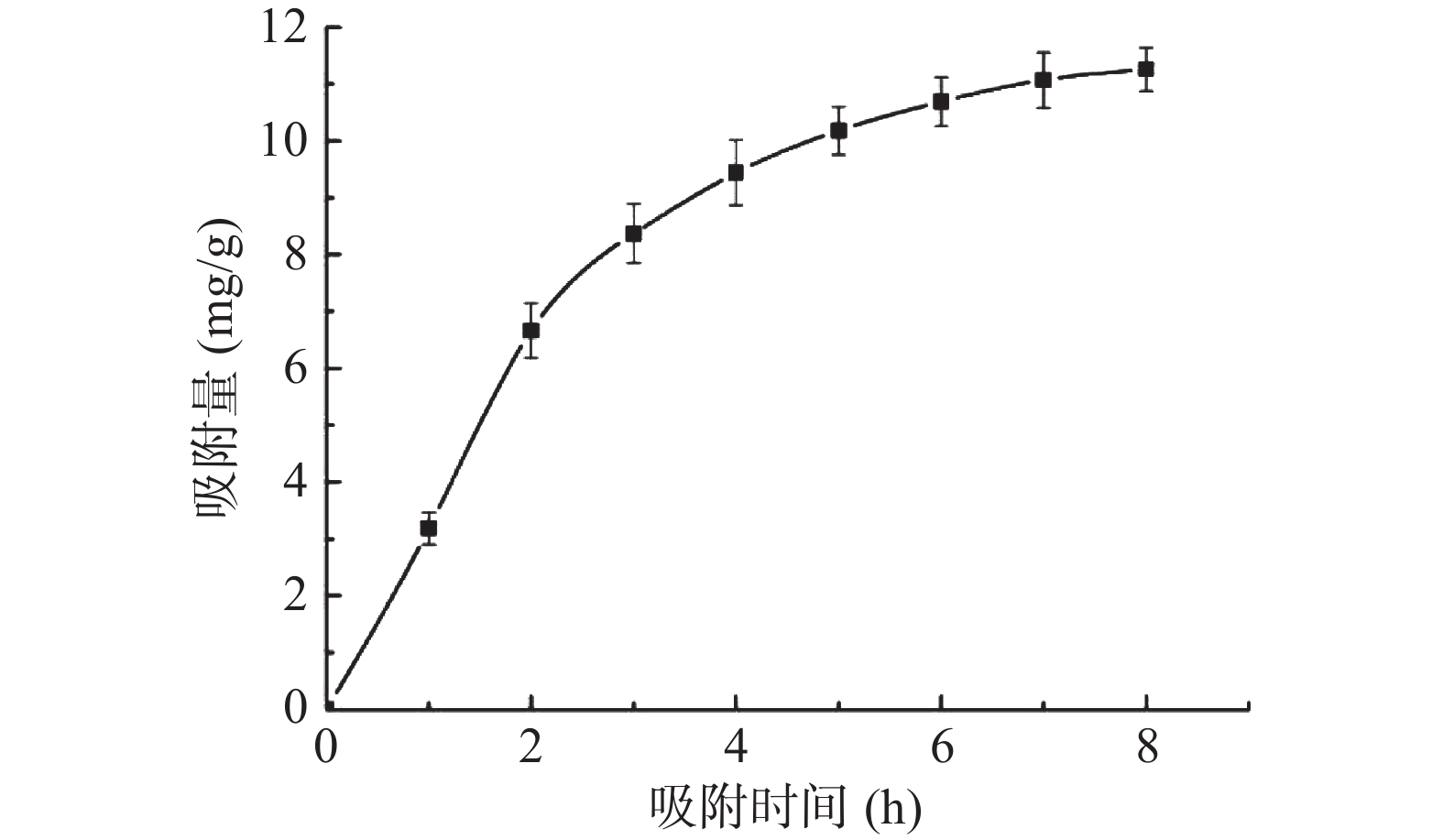
图2为HPD-400树脂对毛蕊异黄酮的吸附动力学曲线。随着吸附时间的延长,树脂对其吸附量逐渐增大,在2 h内吸附速率较快,随后放缓,并于7 h达到平衡。分别采用一级和二级动力学模型拟合上述吸附过程,结果见表4。采用二级动力学模型拟合方程后,其相关系数较大,因此该吸附过程更接近于二级动力学模型特征,吸附过程可能受到外部扩散、边界层扩散或颗粒内扩散控制[20]。
表 4 吸附动力学模型拟合参数Table 4. Fitting parameters of adsorption kinetics models拟合模型 拟合方程 r 一级动力学 In (−)=2.7929−0.5862t 0.9756 二级动力学 t/= 0.0609t+0.1999 0.9695 2.4 动态吸附条件优化
2.4.1 上样液pH对树脂吸附率的影响
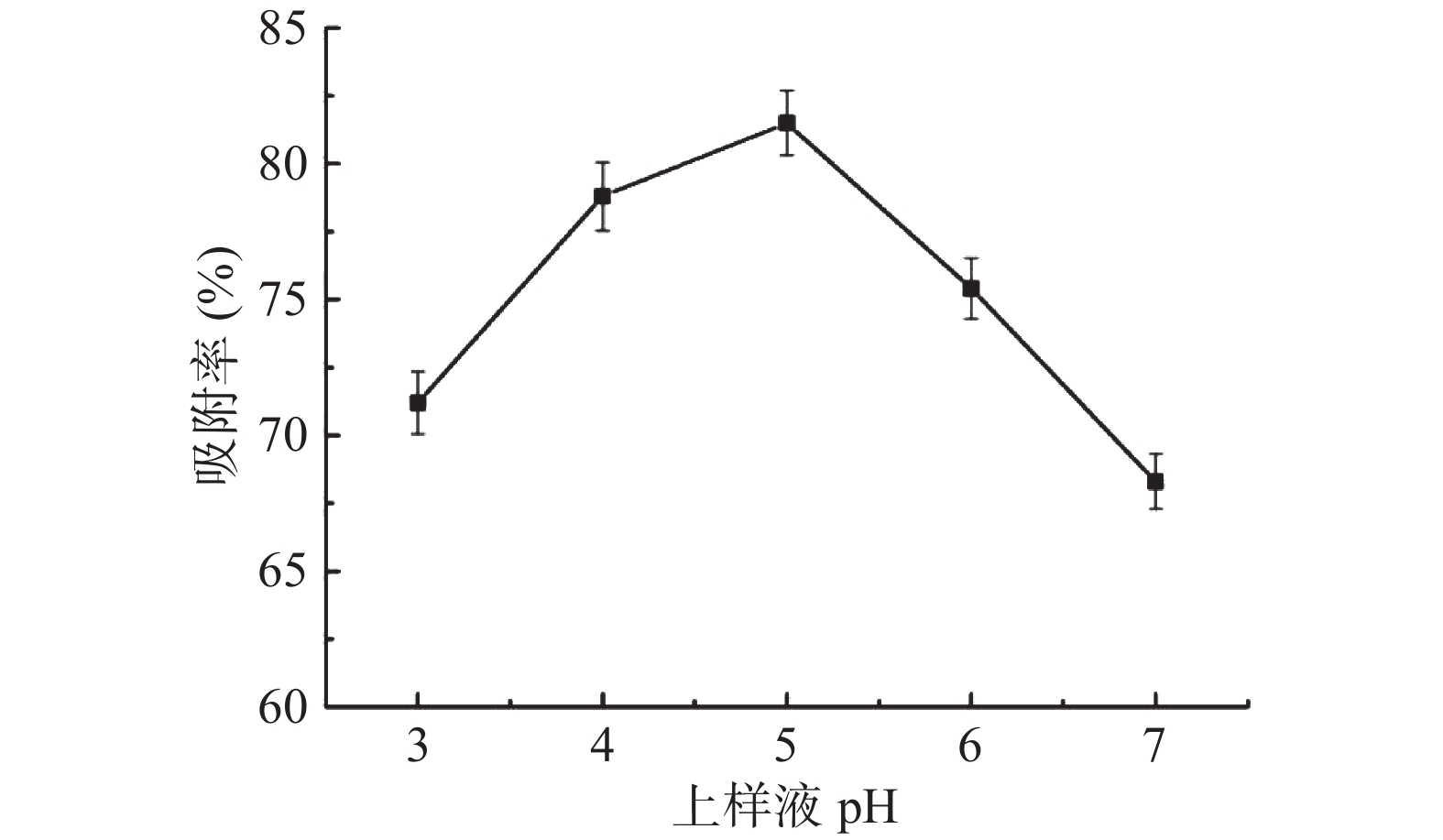
上样液pH控制提取液中毛蕊异黄酮的离子化程度,进而影响其吸附作用。图3为不同上样液pH对树脂的吸附率影响,随着上样液pH的增大,树脂对目标化合物的吸附率先升高后降低,这归因于当溶液pH较低时,过量的氢离子与目标化合物竞争吸附树脂上的活性位点,而溶液pH较高时,毛蕊异黄酮游离出的阴离子减弱与树脂的氢键作用[21],因此确定上样液pH 4、5、6作为响应面因素考察水平。
2.4.2 泄漏曲线
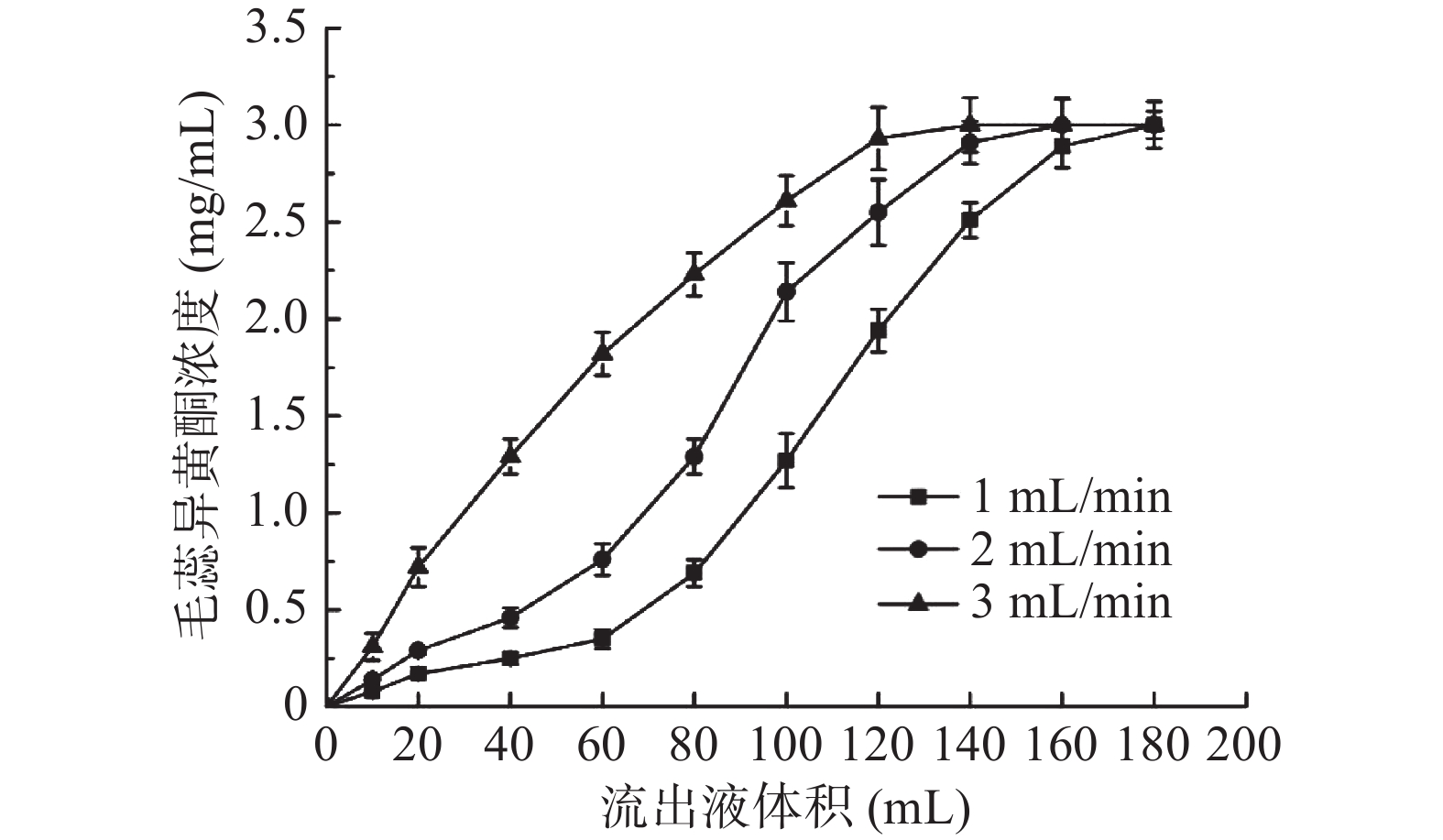
随着上样液体积的增加,树脂的吸附位点逐渐饱和,吸附能力下降,流出液中目标化合物的浓度逐渐增大,同时上样流速过快,使得目标化合物与树脂的接触时间较短,可能造成树脂泄漏点的提前,因此考察不同上样流速的树脂泄漏曲线,结果见图4。当上样流速分别为1、2、3 mL/min时,树脂泄漏点对应的上样体积约为60、40、10 mL,树脂饱和吸附点则分别约为180、160、140 mL,为了保证上样液中目标化合物被大孔树脂尽可能吸附完全,因此确定最佳上样流速为1 mL/min,上样液体积为60 mL。
2.5 动态洗脱条件优化
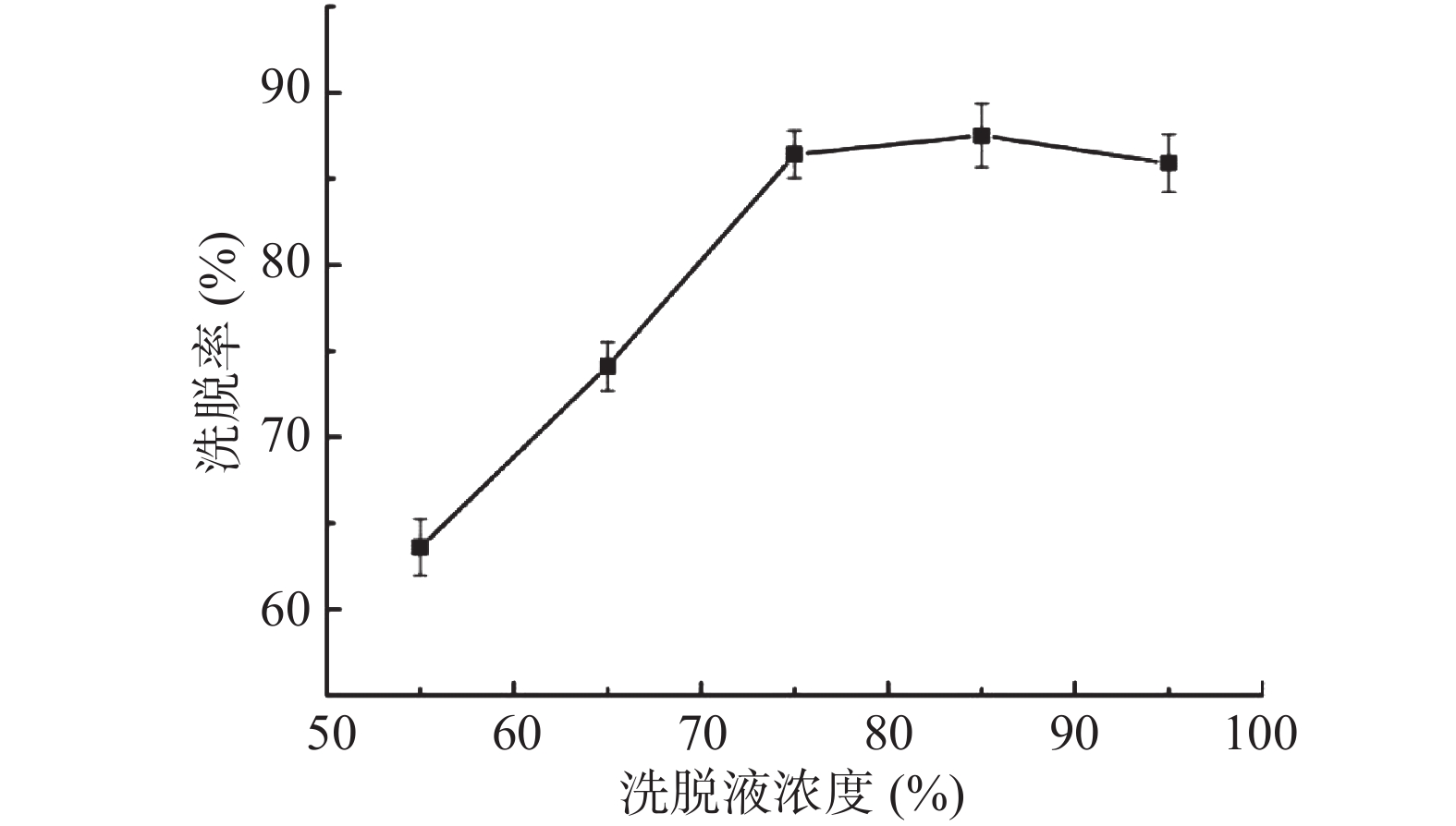
2.5.1 洗脱液浓度对解吸率影响
图5为不同体积分数的乙醇溶液对目标化合物的洗脱率影响,当乙醇溶液的体积分数增大至85%后,洗脱率开始缓慢下降,这归因于毛蕊异黄酮具有糖苷键和多酚结构,极性较弱,易被乙醇从吸附树脂内洗脱,但乙醇体积分数过大,部分吸附杂质也会竞争脱附[22],因此确定洗脱液浓度75%、80%、85%作为响应面因素考察水平。
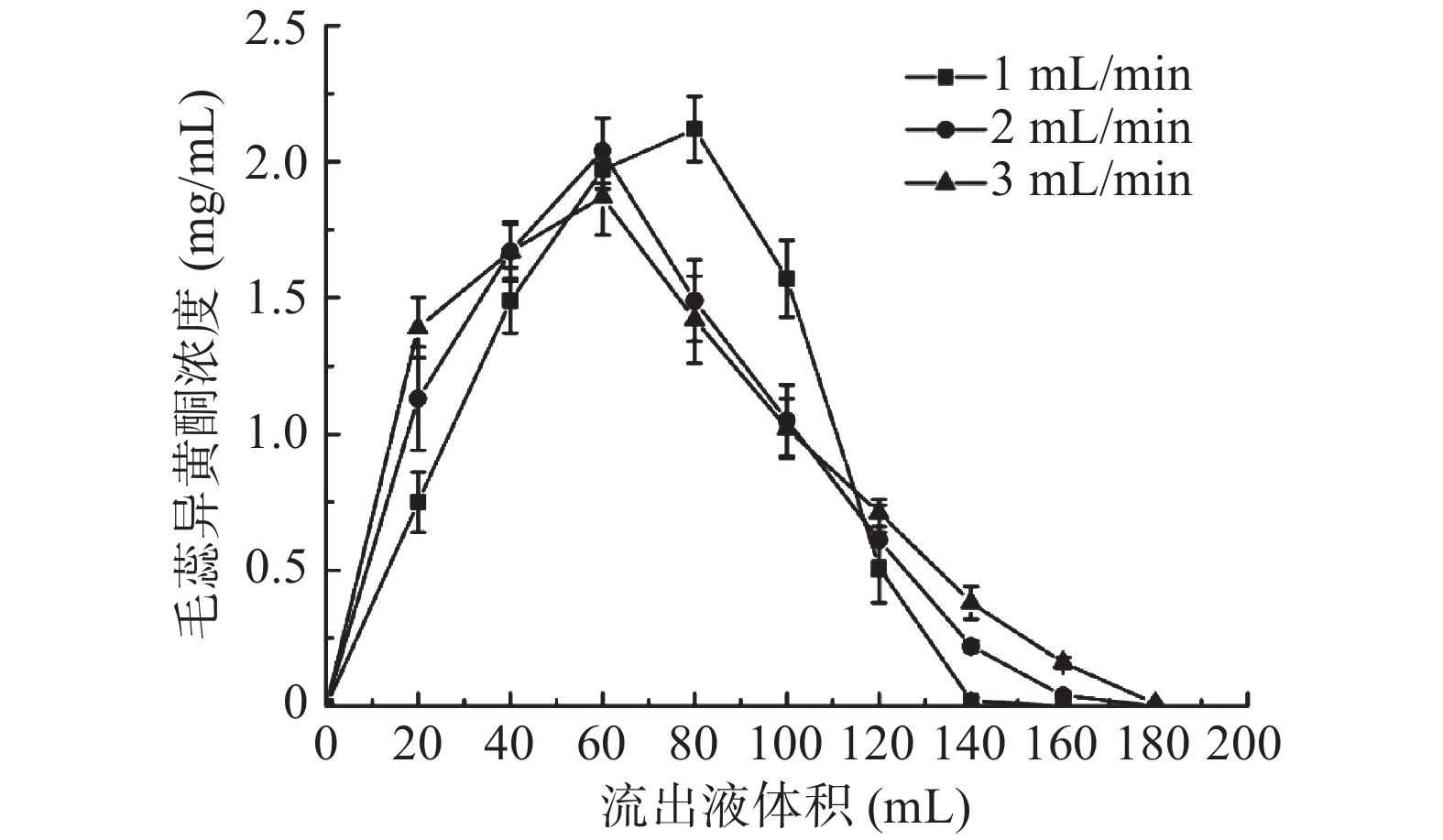
2.5.2 洗脱曲线
图6为不同洗脱流速下饱和吸附后树脂的洗脱曲线,从图6可知,洗脱流速越快,洗脱曲线峰形愈宽、拖尾现象越明显,且洗脱液消耗增多,而采用体积分数为80%乙醇溶液以1.0 mL/min流速洗脱时,洗脱曲线单一、对称、无明显拖尾,且对目标物的洗脱集中,因此确定最佳洗脱流速为1 mL/min,洗脱液用量140 mL。
2.6 响应面试验优化分析
2.6.1 响应面试验结果
根据单因素实验结果,采用Box-Behnken中心组合设计原理,进行三因素三水平的 RSM 分析试验,考察上样浓度(A)、上样液pH (B)和洗脱液浓度(C)对毛蕊异黄酮的回收率(Y)影响,结果见表5。
表 5 响应面试验结果Table 5. Results of the response surface experiments实验号 A上样浓度 B上样液pH C洗脱液浓度 Y回收率(%) 1 0 1 −1 68.4 2 0 0 0 72.4 3 0 −1 −1 68.1 4 −1 −1 0 66.6 5 0 −1 0 68.3 6 −1 0 1 67.4 7 0 0 0 72.8 8 1 0 1 67 9 0 0 0 71.7 10 0 1 1 67.9 11 −1 0 −1 67.2 12 1 −1 0 66.7 13 1 1 0 65.5 14 0 0 0 71.5 15 1 0 −1 67.6 16 −1 1 0 67.1 17 0 0 0 72.1 2.6.2 响应曲面方差分析
采用多元回归拟合上述试验结果,得到以回收率为目标函数,各参数编码值的二次多项回归模型:Y=72.10−0.19A−0.10B−0.087C−0.43AB−0.20AC−0.18BC−3.25A2−2.38B2−1.55C2,对其进行显著检验与方差分析,结果见表6。
表 6 响应面方差分析Table 6. Variance analysis of response surface experiment来源 平方和 自由度 均方 F值 P值 显著性 模型 87.96 9 9.77 47.93 < 0.0001 ** A 0.28 1 0.28 1.38 0.2786 B 0.080 1 0.080 0.39 0.5510 C 0.061 1 0.061 0.30 0.6007 AB 0.72 1 0.72 3.54 0.1018 AC 0.16 1 0.16 0.78 0.4051 BC 0.12 1 0.12 0.60 0.4637 A2 44.47 1 44.47 218.08 < 0.0001 ** B2 23.75 1 23.75 116.46 < 0.0001 ** C2 10.12 1 10.12 49.60 0.0002 ** 残差 1.43 7 0.20 失拟项 0.33 3 0.11 0.40 0.7631 误差项 1.10 4 0.27 总和 89.39 16 9.77 注:**表示极显著(P<0.01);*表示显著(0.01<P<0.05)。 从表6可知,该回归模型P< 0.01,表明该模型回归效果显著,R2=0.9840表明模型拟合值与实际结果高度相关,而失拟项P=0.7631>0.05表明该回归方程拟合度较高,误差对试验结果影响较小,模型可靠。在所有作用因素中,仅二次项A2、B2、C2对目标化合物的回收率影响极显著(P<0.01)。从表中F值可知,各因素对黄芪毛蕊异黄酮的纯化影响大小顺序为:上样浓度(A)>上样液pH (B)>洗脱液浓度(C)。
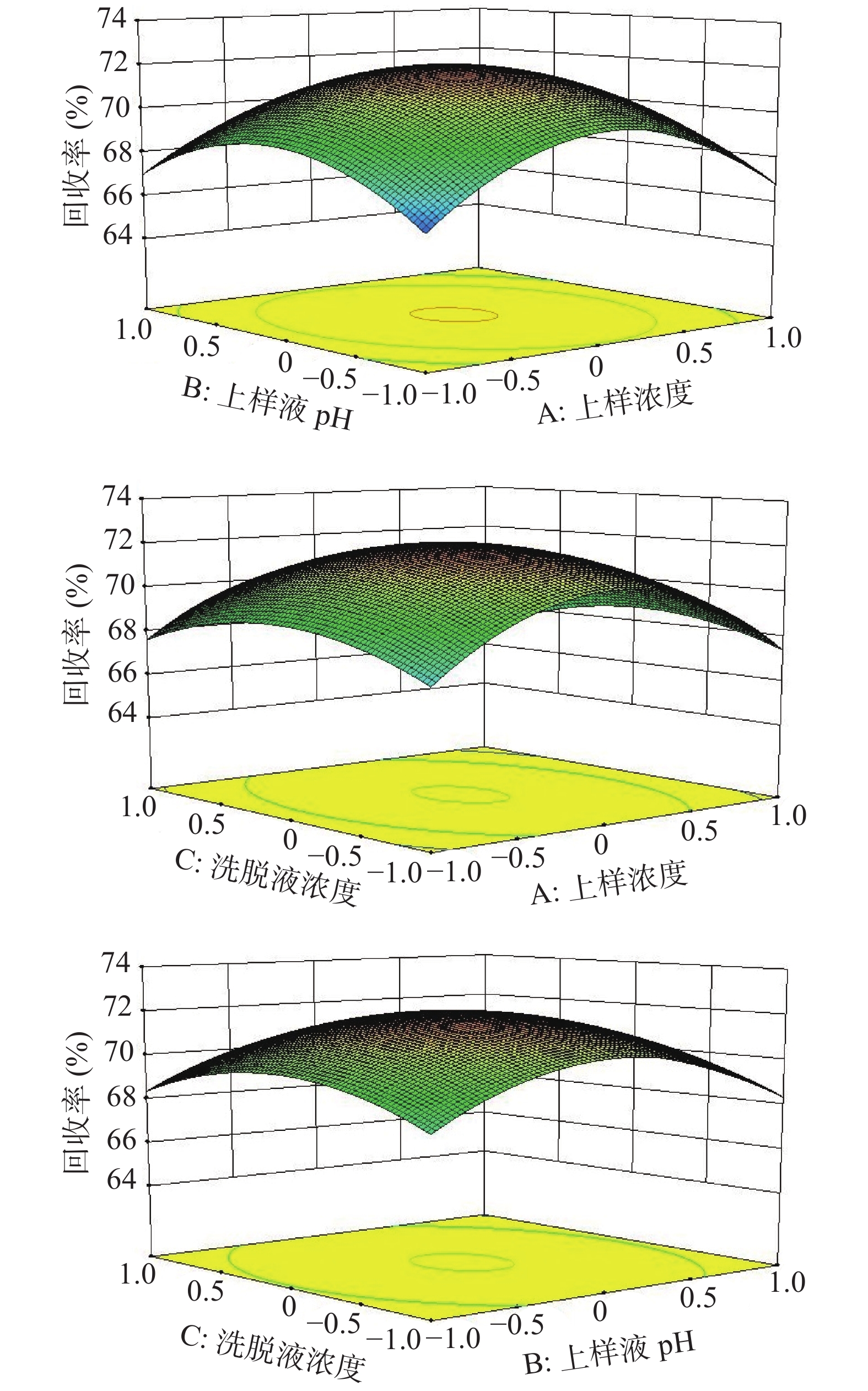
2.6.3 两因素间的交互作用
图7为不同因素的交互作用对回收率的影响,响应曲面越陡峭,表明该因素对回收率的影响越大[23],从图7可知,回收率的响应曲面开口朝下,与三个影响因素均呈明显二次抛物关系,且随着上样浓度、上样液pH和洗脱液浓度的增大,回收率逐渐升高,并出现极大值,随后呈不同斜率的下降,另从方差分析结果与响应曲面观察可知,AB曲线变化最为密集陡峭,其次为AC,影响最小为BC。
2.7 验证试验
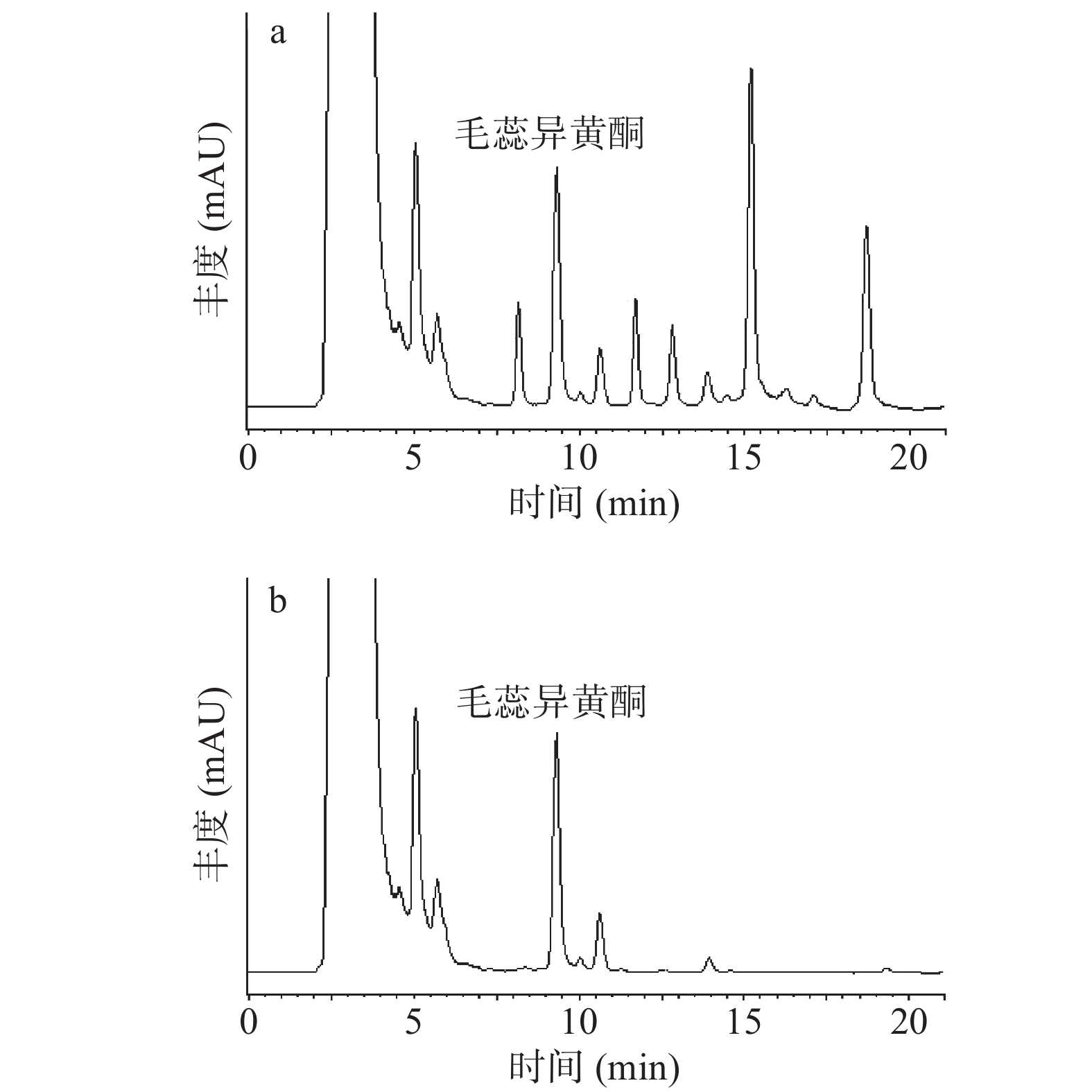
利用Design-Expert 8.0软件对二次抛物线函数模型进行极值分析,得到HPD-400大孔树脂纯化毛蕊异黄酮提取物的最佳工艺条件:体积为60 mL,浓度为2.97 mg/mL,pH为4.9的毛蕊异黄酮提取液以1 mL/min流速上样至HPD-400型大孔树脂后,经体积分数为79.8%乙醇溶液,以1 mL/min流速洗脱,对毛蕊异黄酮的理论回收率为72.9%,实际回收率为73.2%,与模型预测值较接近,表明该二次多项回归模型可预测各因素与响应值间的影响关系。纯化后样品溶液的色谱图,见图8所示,产物中目标化合物的含量由2.17%提高至10.36%,约为纯化前4.8倍。
3. 结论
由于黄芪毛蕊异黄酮提取物中存在的色素、蛋白质等杂质,可能影响其活性作用,因此以黄芪毛蕊异黄酮提取物为原料,通过比较不同类型树脂的静态吸附-洗脱性能,筛选出合适树脂后,采用单因素实验与三因素三水平响应面试验,确定大孔树脂纯化黄芪毛蕊异黄酮的最佳工艺条件为:体积为60 mL,浓度为2.97 mg/mL,pH为4.9的毛蕊异黄酮提取液以1 mL/min流速上样至HPD-400型大孔树脂后,经体积分数为79.8%乙醇溶液,以1 mL/min流速洗脱,产物中毛蕊异黄酮的含量由2.17%提高至10.36%,约为纯化前4.8倍,该纯化工艺操作简便,目标化合物回收率较高,适于推广使用。
-
表 1 响应面试验因素水平
Table 1 Factors and levels in response surface design
水平 A上样浓度(mg/mL) B上样液pH C洗脱液浓度(%) −1 2 4 75 0 3 5 80 1 4 6 85 表 2 大孔吸附树脂静态吸附性能
Table 2 Static adsorption properties of macroporousresin
树脂型号 极性 比表面积(m2/g) Qe (%) Dd (%) R (%) H103 非极性 ≥900 86.2 81.1 69.9 D101 非极性 ≥550 84.2 83.5 70.3 AB-8 弱极性 ≥480 81.5 85.1 69.4 DM130 弱极性 ≥500 83.1 82.9 68.9 HPD-400 中极性 ≥550 83.3 90.5 75.4 DM301 中极性 ≥330 79.6 88.6 70.5 HPD-600 极性 ≥550 62.8 85.7 53.8 表 3 不同温度的Langmuir与Freundlich模型拟合参数
Table 3 Fitting parameters of Langmuir and Freundlich models at different temperatures
吸附温度 (℃) Langmuir方程 r Freundlich方程 r 1/n 25 Ce/=0.072 Ce+0.005 0.9872 =14.81Ce0.263 0.9885 0.263 30 Ce/=0.081 Ce+0.003 0.9935 =13.61Ce0.224 0.9891 0.224 35 Ce/=0.088 Ce+0.009 0.9763 =12.54 Ce0.195 0.9952 0.195 表 4 吸附动力学模型拟合参数
Table 4 Fitting parameters of adsorption kinetics models
拟合模型 拟合方程 r 一级动力学 In (−)=2.7929−0.5862t 0.9756 二级动力学 t/= 0.0609t+0.1999 0.9695 表 5 响应面试验结果
Table 5 Results of the response surface experiments
实验号 A上样浓度 B上样液pH C洗脱液浓度 Y回收率(%) 1 0 1 −1 68.4 2 0 0 0 72.4 3 0 −1 −1 68.1 4 −1 −1 0 66.6 5 0 −1 0 68.3 6 −1 0 1 67.4 7 0 0 0 72.8 8 1 0 1 67 9 0 0 0 71.7 10 0 1 1 67.9 11 −1 0 −1 67.2 12 1 −1 0 66.7 13 1 1 0 65.5 14 0 0 0 71.5 15 1 0 −1 67.6 16 −1 1 0 67.1 17 0 0 0 72.1 表 6 响应面方差分析
Table 6 Variance analysis of response surface experiment
来源 平方和 自由度 均方 F值 P值 显著性 模型 87.96 9 9.77 47.93 < 0.0001 ** A 0.28 1 0.28 1.38 0.2786 B 0.080 1 0.080 0.39 0.5510 C 0.061 1 0.061 0.30 0.6007 AB 0.72 1 0.72 3.54 0.1018 AC 0.16 1 0.16 0.78 0.4051 BC 0.12 1 0.12 0.60 0.4637 A2 44.47 1 44.47 218.08 < 0.0001 ** B2 23.75 1 23.75 116.46 < 0.0001 ** C2 10.12 1 10.12 49.60 0.0002 ** 残差 1.43 7 0.20 失拟项 0.33 3 0.11 0.40 0.7631 误差项 1.10 4 0.27 总和 89.39 16 9.77 注:**表示极显著(P<0.01);*表示显著(0.01<P<0.05)。 -
[1] Han J, Guo D, Sun X Y, et al. Comparison of the adhesion and endocytosis of calcium oxalate dihydrate to HK-2 cells before and after repair by Astragalus polysaccharide[J]. Int J Nanomed,2019,20(1):1164−1177.
[2] 张蔷, 高文远, 满淑丽, 黄芪中有效成分药理活性的研究进展[J]. 中国中药杂志, 2012, 37(21): 3203-3207. [3] Gai Q Y, Jiao J, Wang X, et al. Chitosan promoting formononetin and calycosin accumulation inAstragalus membranaceus hairy root cultures via mitogen-activated protein kinase signaling cascades[J]. Sci Rep,2019,9(1):1275−1283. doi: 10.1038/s41598-018-37987-5
[4] Gao J Q, Liu Z J, Chen T, et al. Pharmaceutical properties of calycosin, the major bioactive isoflavonoid in the dry root extract of Radix astragali [J]. Pharm Biol,2014,52(9):1217−1222. doi: 10.3109/13880209.2013.879188
[5] Li Y H, Wang C X, Li H Y, et al. Simultaneous determination of formononetin, calycosin and rhamnocitrin from Astragalus complanatus by UHPLC-MS-MS in rat plasma: application to a pharmacokinetic study[J]. J Chromatogr Sci,2016,40(3):702−708.
[6] 赵竞业, 容蓉, 巩丽丽, 等. 高速逆流色谱法分离纯化黄芪中毛蕊异黄酮苷和芒柄花苷[J]. 山东中医药大学学报,2017,41(2):178−181. [7] 任汐月, 陈可妍, 戴京, 等. 花生芽中酚类物质的大孔树脂纯化工艺研究[J]. 食品研究与开发,2020,41(11):108−112. [8] 葛水莲, 陈建中, 刘娜, 等. 响应面优化大孔树脂纯化太行菊总黄酮及其降糖活性[J]. 食品工业,2020,41(5):107−111. [9] 段宙位, 陈婷, 何艾, 等. 大孔树脂纯化沉香叶黄酮工艺优化及纯化前后抗氧化性比较[J]. 食品工业科技,2020,41(17):161−166. [10] 王秋阳, 赵欣锐, 王超, 等. 大孔树脂纯化红松松仁膜衣黄酮的抗氧化活性研究[J]. 食品科技,2019,44(9):223−227. [11] 陈彩云. 黄芪中毛蕊异黄酮和芒柄花素的富集、分离纯化及抗氧化活性研究[D]. 哈尔滨: 东北林业大学, 2012. [12] 马晓丰, 屠鹏飞, 陈英杰, 等. 高速逆流色谱法分离纯化黄芪中的芒柄花素和毛蕊异黄酮[J]. 色谱,2005,23(3):299−301. [13] 张沛, 宋志军, 邰正福. 响应面法优化大孔树脂纯化黄精总皂苷提取物工艺[J]. 食品工业,2019,40(10):136−141. [14] 栾朝霞. 肉苁蓉总多酚纯化工艺及其抗运动性疲劳作用研究[J]. 食品工业科技,2020,41(15):59−64. [15] Bai Y D, Ma J, Zhu W F, et al. Highly selective separation and purification of chicoric acid from Echinacea purpurea by quality control methods in macroporous adsorption resin column chromatography[J]. J Sep Sci,2019,42(5):1027−1036.
[16] Zhang L, Zheng D, Zhang Q F. Purification of total flavonoids from Rhizoma smilacis Glabrae through cyclodextrin-assisted extraction and resin adsorption[J]. Food Sci Nutr,2019,7(2):449−456. doi: 10.1002/fsn3.809
[17] 刘琦. 大孔树脂对短梗五加多酚的纯化效果及多酚的抗疲劳作用研究[J]. 保鲜与加工,2020,20(4):171−177. [18] 吴婕, 吴学慧, 徐高. 大孔树脂纯化甜茶叶总黄酮及其纯化前后的抗氧化性[J]. 江苏农业科学,2019,47(16):190−193. [19] Chen C Y, Zu Y G, Fu Y J, et al. Preparation and antioxidant activity of Radix Astragali residues extracts rich in calycosin and formononetin[J]. Biochem Eng J,2011,56(1-2):84−93. doi: 10.1016/j.bej.2011.04.015
[20] 朱晓亚. 天门冬总皂苷提取物的纯化及体内抗疲劳作用研究[J]. 食品科技,2019,44(9):263−269. [21] Kong Y, Yan M M, Liu W, et al. Preparative enrichment and separation of astragalosides from Radix Astragali extracts using macroporous resins[J]. J Sep Sci,2015,33(15):2278−2286.
[22] 王小明, 陈碧, 张鹏, 等. 甜茶叶中总黄酮大孔树脂纯化工艺及抗氧化活性研究[J]. 食品工业科技,2019,40(24):28−33. [23] 李慧敏, 牛东攀, 陈丹阳, 等. 响应面法优化大孔树脂纯化杜仲绿原酸工艺研究[J]. 食品研究与开发,2018,39(13):40−46.





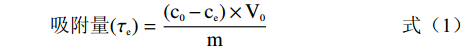
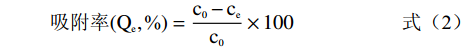
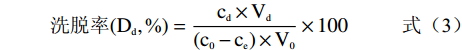
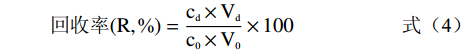

 下载:
下载:
 下载:
下载:
