Inhibitory Effect of Genkwanin on α-Glucosidase
-
摘要: 为研究芫花素对α-葡萄糖苷酶的抑制作用及其机理,本文以芫花素为研究对象,运用紫外光谱法和荧光光谱法测定了芫花素对α-葡萄糖苷酶的抑制作用,主要包括抑制活性、抑制类型和荧光猝灭特性。结果显示:芫花素对α-葡萄糖苷酶有显著的抑制作用,该抑制类型为竞争性抑制,芫花素与α-葡萄糖苷酶主要通过氢键和范德华力的作用自发地结合,其结合位点数在温度291和310 K时分别约为2.8和2.2。芫花素和α-葡萄糖苷酶复合物的形成使得α-葡萄糖苷酶的荧光产生静态猝灭,最终导致芫花素对α-葡萄糖苷酶产生抑制作用。Abstract: To investigate the inhibitory activity and mechanism of genkwanin on α-glucosidase, the inhibitory activity was determined by ultraviolet and fluorescence spectroscopy, including the inhibitory activity, inhibitory type of genkwanin on α-glucosidase and the fluorescence quenching properties. The results showed that the genkwanin had a significant inhibitory effect on α-glucosidase in a competitive manner. Genkwanin interacted with α-glucosidase was mainly driven by hydrogen bond and Van der Waals force with the binding sites of 2.8 and 2.2 at 291 and 310 K, respectively. The formation of genkwanin and α-glucosidase complexes resulted in fluorescence quenching of α-glucosidase and thereby inhibited the activity of α-glucosidase.
-
Keywords:
- genkwanin /
- α-glucosidase /
- inhibitory effect /
- fluorescence quenching
-
前期糖尿病也被称为中度高血糖症,主要包括葡萄糖耐量损伤和空腹血糖损伤,是处于正常人群和糖尿病人群之间的一种中间状态。据2018年统计,全球的前期糖尿病患者约有四亿七千万人[1]。研究显示,前期糖尿病患者因心血管疾病、肾脏疾病和全因死亡率要远远高于血糖正常的人[2]。前期糖尿病在后期会发展为糖尿病,糖尿病属于一种代谢性疾病,是由胰岛素分泌受损或胰岛素功能障碍所致,它对人类身体造成的危害仅次于心血管疾病和癌症[3]。上世纪八十年代,世界上只有1.08亿的糖尿病患者,截止到2015年,糖尿病人口数量已接近约4.22亿,2011年联合国非传染性疾病问题高级别会议后设定的全球防控目标之一是到2025年,将成人糖尿病年龄标准化患病率的上升控制在2010年的水平,推测到2025年仅少数国家可达到该防控目标[4]。2017年对中国糖尿病的发生率和相关死亡率进行了统计,结果表明中国的糖尿病发生率已从上世纪80年代的1%提高到现在约11%[5];截止到2017年,国内糖尿病患者数量已接近约1.1亿人,患病率居世界第一[6]。由此可见,糖尿病已经威胁到了全球的公共健康。抑制α-葡萄糖苷酶活性在治疗糖尿病中起着重要作用,α-葡萄糖苷酶是与餐后寡糖分解有关的一种关键酶。目前,市场上还缺乏安全有效的降糖或预防糖尿病的功能性成分,如阿卡波糖等常见合成的α-葡萄糖苷酶抑制剂就具有腹胀、腹泻以及皮肤过敏等副作用[7],所以,现在亟需在天然产物中寻找和开发更加安全有效的降糖的功能性成分。
芫花素(Genkwanin,5,4'-二羟基-7-甲氧基黄酮)属于黄酮类化合物[8],来源丰富。我国天然药物化学家曾广方从瑞香科植物芫花的干燥花蕾中首次分离出芫花素[9]。此后,研究人员从迷迭香、益母草和黄芩等药食两用植物中分离得到芫花素[10-12]。根据研究结果显示[13-14],芫花素对调节免疫、缓解疼痛、抗炎和抗肿瘤等方面具有一定的作用。由此可以看出,研究芫花素在开发功能性分子方面具有一定的前景。但是,目前关于芫花素对预防糖尿病或前期糖尿病的研究还未见报道。
在本研究中,以芫花素为研究对象,研究其对α-葡萄糖苷酶的抑制作用和机理。前期采用体外酶活实验法和酶动力学法检测芫花素对α-葡萄糖苷酶的抑制作用及抑制类型,后期采用荧光猝灭法进一步探究芫花素与α-葡萄糖苷酶之间的相互作用机理。为将芫花素开发为降糖功能性成分提供一定的理论依据,也为功能性食品和医药领域提供一定的参考。
1. 材料与方法
1.1 材料与仪器
芫花素(纯度≥98%) 普菲德生物有限公司;α-葡萄糖苷酶(10 U/mg)、4-硝基苯基-α-D-吡喃葡萄糖苷(PNPG,99%) 美国Sigma公司;阿卡波糖 98%,TCI化成工业发展有限公司;二甲亚砜 分析纯,重庆川东化工有限公司;磷酸二氢钠、磷酸氢二钠 分析纯,成都市科龙化工试剂厂。
ALC-210.4电子天平 赛多利斯科学仪器有限公司;YP502N电子天平 上海舜宇恒平科学仪器有限公司;PHSJ-3F实验pH计 宁波新芝生物科技股份有限公司;GZX-DH500-S-II电热恒温箱 上海跃进医疗器械厂;VORTEX-5震荡机 海门市其林贝尔仪器制造厂;SB-5200D超声波清洗机 上海仪电科学仪器股份有限公司;Infinite M2000酶标仪 帝肯贸易有限公司;F-2500全波长扫描式式多功能读数仪、Finnpipette F3微型移液器 赛默飞世尔仪器有限公司。
1.2 实验方法
1.2.1 体外α-葡萄糖苷酶抑制活性的测定
α-葡萄糖苷酶抑制活性的测定参照Guilin等[15]的方法并加以改进。将100 μL不同浓度(0.0625、0.125、0.25、0.5、0.75 mg/mL)的芫花素溶液与50 μL 0.5 U/mL α-葡萄糖苷酶溶液混合,然后分别加入50 μL 0.6 mg/mL底物(PNPG),混合物于37 ℃下孵育30 min,空白对照组使用磷酸缓冲液(0.01 mol/L pH=6.8)与二甲亚砜以1:1体积比混合的溶液替代样品。吸光度值在405 nm下被检测。以阿卡波糖作为阳性对照。实验设置3个平行。抑制率计算如下:
抑制率(\%)=A空白−A样品A空白×100 (1) 式中:A空白表示不加芫花素的紫外吸光度值;A样品表示加入芫花素反应后体系的紫外吸光度值。
1.2.2 酶促反应动力学分析
酶促反应动力学的测定根据郭时印等[16]的方法并加以改进。固定α-葡萄糖苷酶的浓度为0.5 U/mL,选择芫花素0、0.1、0.3 mg/mL三个浓度梯度,分别加入不同质量浓度(0.20、0.25、0.30、0.35、0.40 mg/mL)的底物(PNPG),其中α-葡萄糖苷酶、芫花素和底物添加量分别为50、100和50 μL,反应温度为37 ℃,反应时间为30 min,使用酶标仪在405 nm处测定吸光度值。将反应速率的倒数(1/V)对底物质量浓度的倒数(1/[S])作图,根据Lineweaver-Burk双倒数作图法研究芫花素对α-葡萄糖苷酶的抑制类型。
1.2.3 芫花素对α-葡萄糖苷酶的荧光猝灭作用
采用杨丽珍等[17-18]的方法并加以改进。分别移取0.5 U/mL α-葡萄糖苷酶溶液180 μL和2.6384×10−3 mol/L芫花素溶液0、10、20、30、40、50、60、70、80 μL,使芫花素溶液终浓度为0、1.0148×10−4、2.0296×10−4、3.0443×10−4、4.0591×10−4、5.0739×10−4、6.0887×10−4、7.1035×10−4、8.1185×10−4 mol/L,最后用磷酸缓冲液(0.01 mol/L pH=6.8)与二甲亚砜以1:1体积比混合的溶液将反应体积补足至260 μL,作为α-葡萄糖苷酶-芫花素混合体系。在291、310 K两个温度下孵育30 min。将280 nm作为激发波长,狭缝宽度设定为2 nm。扫描各样品在298~370 nm处的荧光光谱。
1.2.4 α-葡萄糖苷酶荧光猝灭类型的推断
荧光猝灭包括静态猝灭和动态猝灭两种[19]。芫花素和α-葡萄糖苷酶相互作用后,α-葡萄糖苷酶的荧光强度变化可以由Stern-volmer方程说明:
F0F=1+Kqτ0[Q]=1+Ksv[Q] (2) 式中:F0表示α-葡萄糖苷酶在不加芫花素的情况下的荧光强度;F表示α-葡萄糖苷酶在加入芫花素后的荧光强度;Kq表示在猝灭过程中的速率常量,L/(mol·s);τ0表示当芫花素不存在时,荧光分子的平均寿命(10−8 s);[Q]表示芫花素的浓度,mol/L;Ksv表示荧光猝灭常量,L/mol。
1.2.5 荧光猝灭中结合常数与结合位点数的计算
荧光猝灭时,假设酶上面有n个独立的结合位点和小分子相互作用,则其结合常数、荧光强度、猝灭剂浓度和结合位点数之间的关系能用双对数方程表示为:
lg(F0F−1)=lgKA+nlg[Q] (3) 式中:KA表示复合物形成的结合常数;n表示猝灭过程中的结合位点数。
1.2.6 芫花素与α-葡萄糖苷酶相互作用力类型的确定
静电力、疏水作用力、范德华力和氢键等作用力能够使酶与小分子或者生物大分子结合,从而形成复合物。Rahman等[20]研究表明不同的小分子药物和生物大分子之间的主要作用力类型也不尽相同。因此两分子之间的主要作用力类型可以根据两者间相互作用的吉布斯自由能ΔG、焓变ΔH和熵变ΔS等热力学参数来确定。相关计算如下:
ΔG=−2.303RTlnK=ΔH−TΔS (4) lnK2K1=(1T1−1T2)ΔH(1R) (5) 式中:R为气体常数(8.314 J/(mol·K));T1、T2分别为291、310 K;K1、K2分别291、310 K下的KA。
1.3 数据处理
采用Excel 2019进行统计学处理,图表使用 Origin 8.0绘制,并用平均值±标准差表示实验结果。
2. 结果与分析
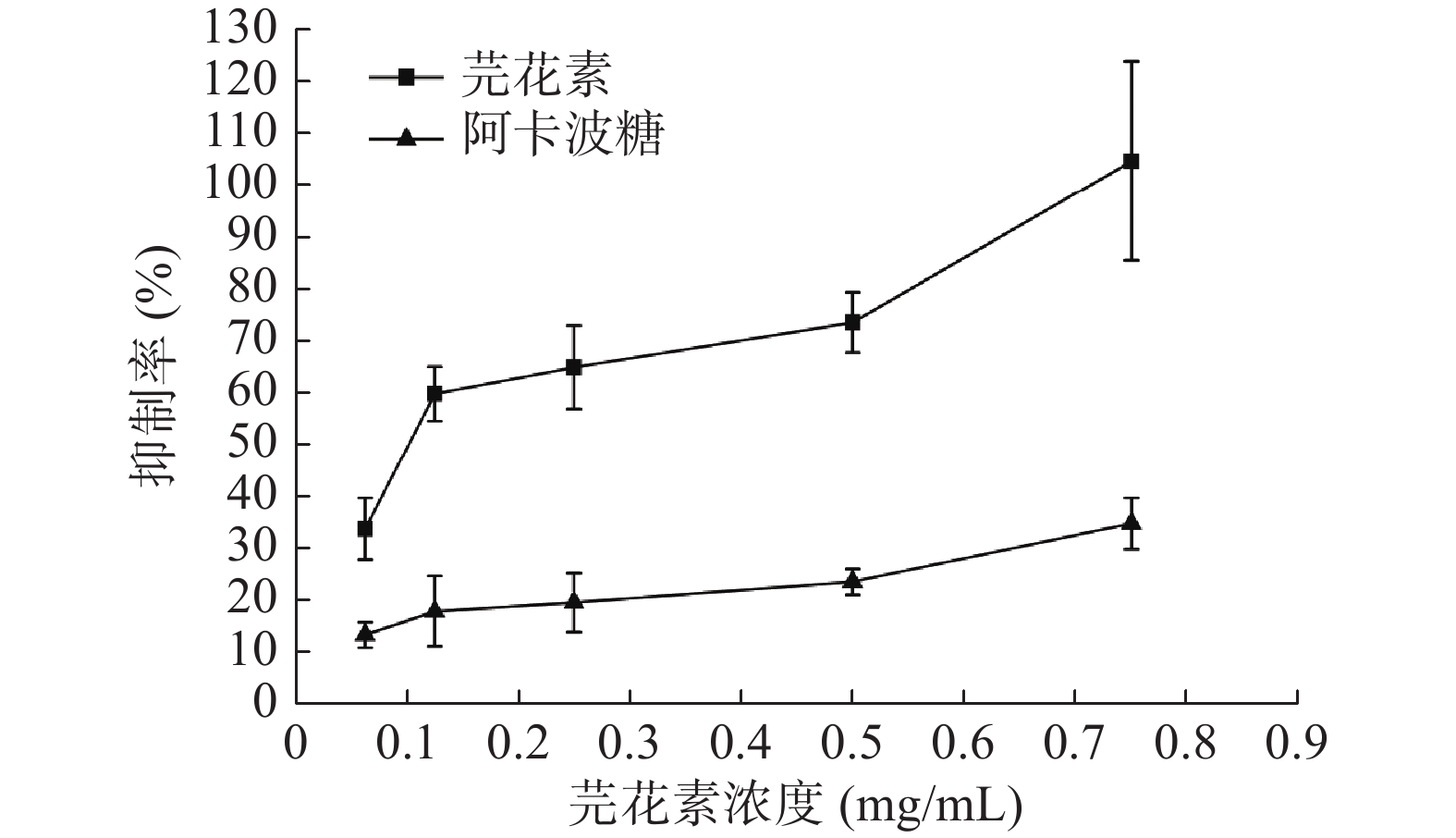
2.1 体外α-葡萄糖苷酶的抑制活性
如图1所示,芫花素对α-葡萄糖苷酶的抑制作用随着芫花素浓度的增加而明显增强,并呈现出剂量依赖性。在0.0625~0.75 mg/mL浓度范围内,芫花素对α-葡萄糖苷酶的抑制作用远远强于阳性对照阿卡波糖。
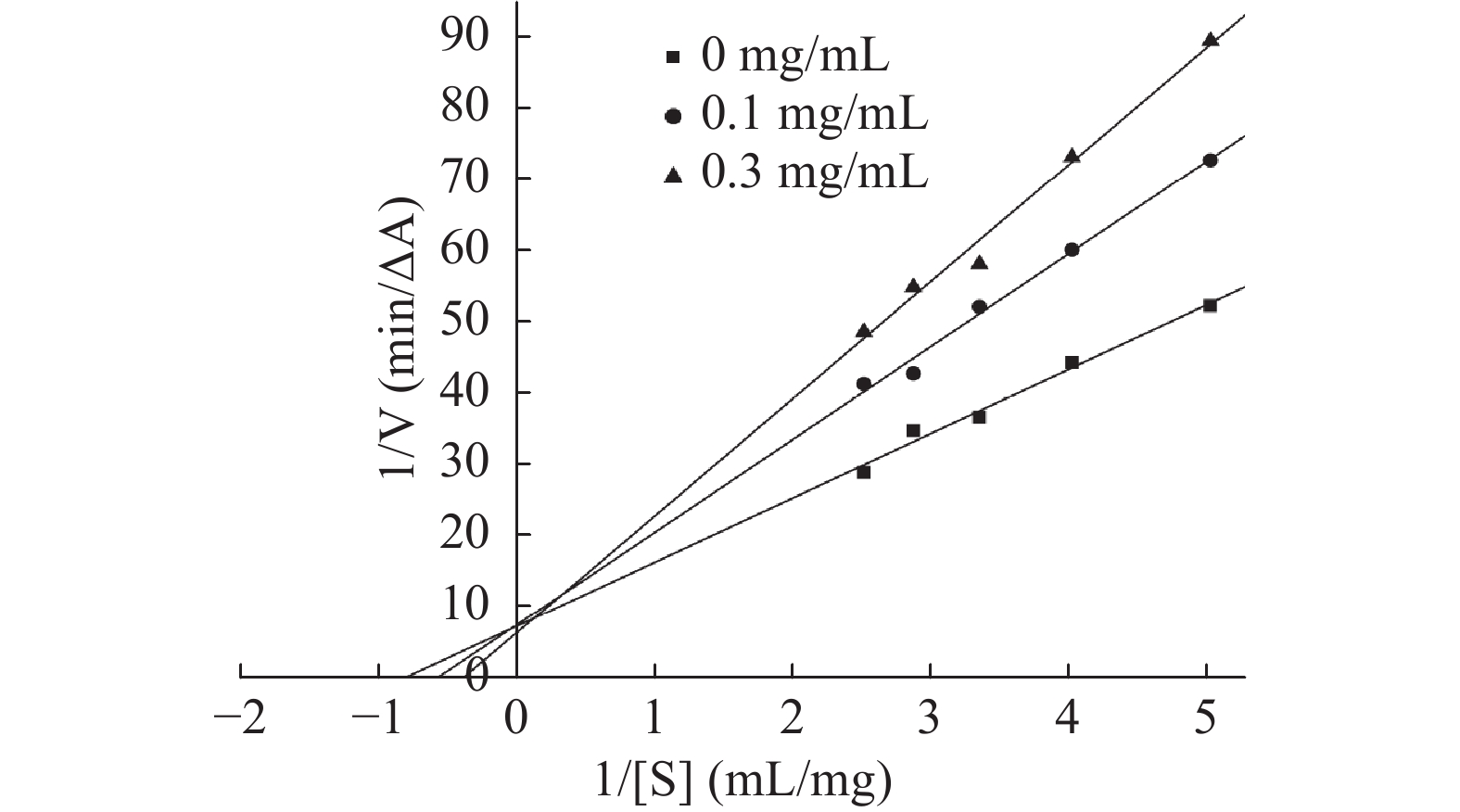
2.2 芫花素对α-葡萄糖苷酶的酶促反应动力学分析结果
竞争性抑制类型的动力学方程见式(6),其动力学特征主要为Km增大,Vmax不变,而由双倒数图可以得到Km和Vmax值,其中1/Vmax=纵轴截距,Km/ Vmax =斜率[21],如图2所示,随着芫花素质量浓度的增加,反应速率的倒数与底物浓度的倒数呈线性关系,三条线相交于纵轴,即Vmax基本不变;斜率随着芫花素浓度的增加而增大,即Km逐渐增大,故可判定芫花素对α-葡萄糖苷酶的抑制类型为竞争性抑制。
1V=KmVmax1[S]+1Vmax (6) 式中:V表示酶促反应的速率,ΔA/min;Vmax表示酶促反应的最大速率,ΔA/min;Km表示米氏常数,mol/L;[S]表示底物浓度,mg/mL。
2.3 荧光猝灭光谱分析
2.3.1 芫花素对α-葡萄糖苷酶的荧光猝灭作用
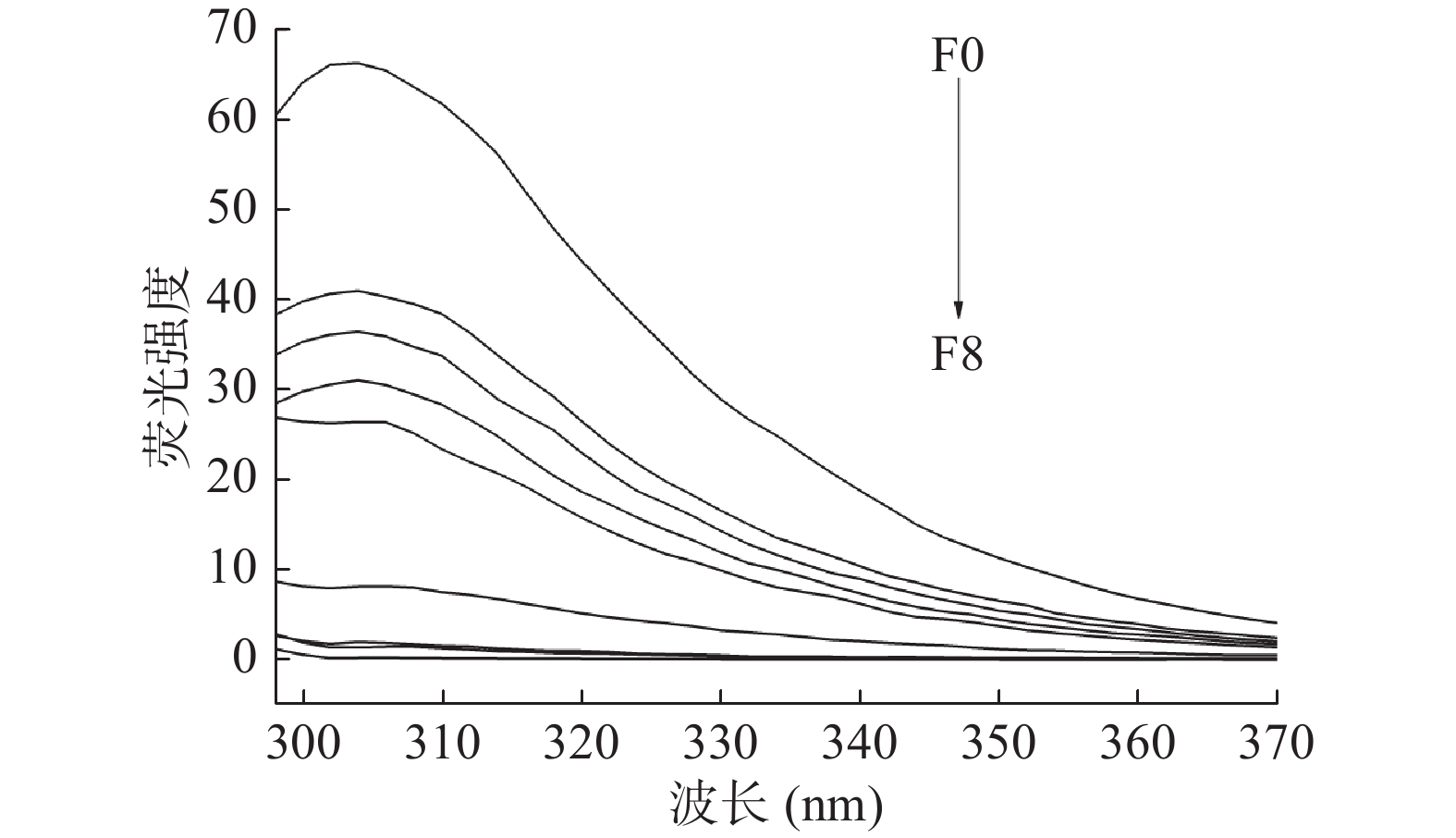
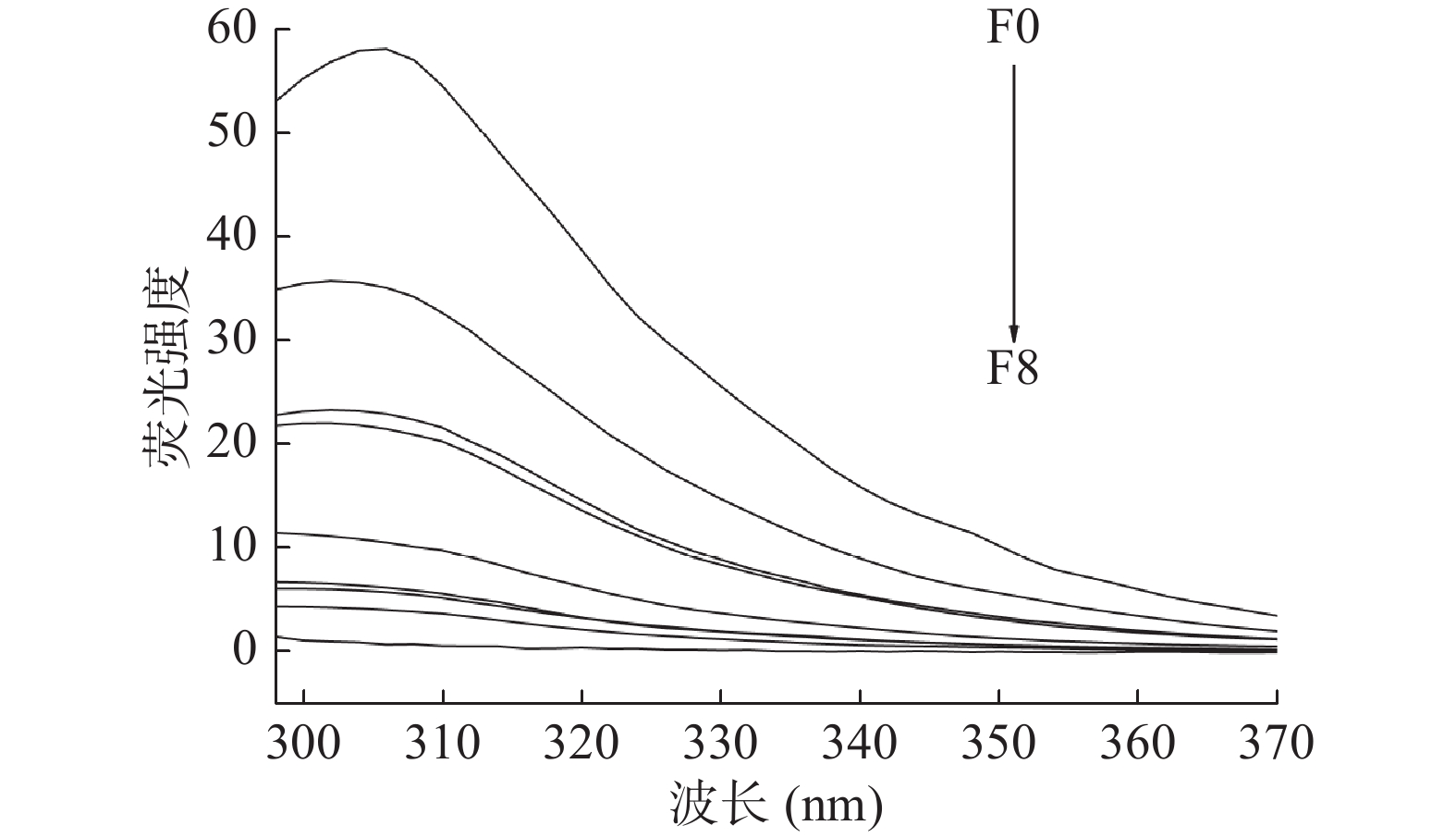
图3和图4分别为温度为291和310 K时,不同浓度的芫花素存在时,0.5 U/mL α-葡萄糖苷酶的荧光光谱变化情况。由图3和图4可知,当芫花素的浓度低于8.1185×10−4 mol/L时,α-葡萄糖苷酶的荧光强度随着芫花素浓度的增加而逐渐降低,说明当芫花素的浓度增加时,体系中α-葡萄糖苷酶的荧光产生了规律性的猝灭[22],因此从另一方面也证实了芫花素对α-葡萄糖苷酶具有抑制作用[23-24]。加入了不同浓度的芫花素后,α-葡萄糖苷酶的最大发射波长约为308 nm,不同浓度体系的最大发射峰都没有发生明显的红移或蓝移[25],这说明了不同浓度的芫花素与α-葡萄糖苷酶在相互作用时,仅仅影响了能发生荧光猝灭的α-葡萄糖苷酶残基的微环境,表明芫花素与α-葡萄糖苷酶之间可能无明显的共价键生成,从而使其最大发射波长没有发生明显的位移[26]。
![]() 图 3 291 K时芫花素对α-葡萄糖苷酶荧光光谱的影响注:F0~F8分别对应芫花素浓度为0、1.0148×10−4、2.0296×10−4、3.0443×10−4、4.0591×10−4、5.0739×10−4、6.0887×10−4、7.1035×10−4、8.1185×10−4 mol/L,图4同。Figure 3. Effect of genkwanin on the fluorescence spectrum of α-glucosidase at 291 K
图 3 291 K时芫花素对α-葡萄糖苷酶荧光光谱的影响注:F0~F8分别对应芫花素浓度为0、1.0148×10−4、2.0296×10−4、3.0443×10−4、4.0591×10−4、5.0739×10−4、6.0887×10−4、7.1035×10−4、8.1185×10−4 mol/L,图4同。Figure 3. Effect of genkwanin on the fluorescence spectrum of α-glucosidase at 291 K2.3.2 荧光猝灭机理的推断
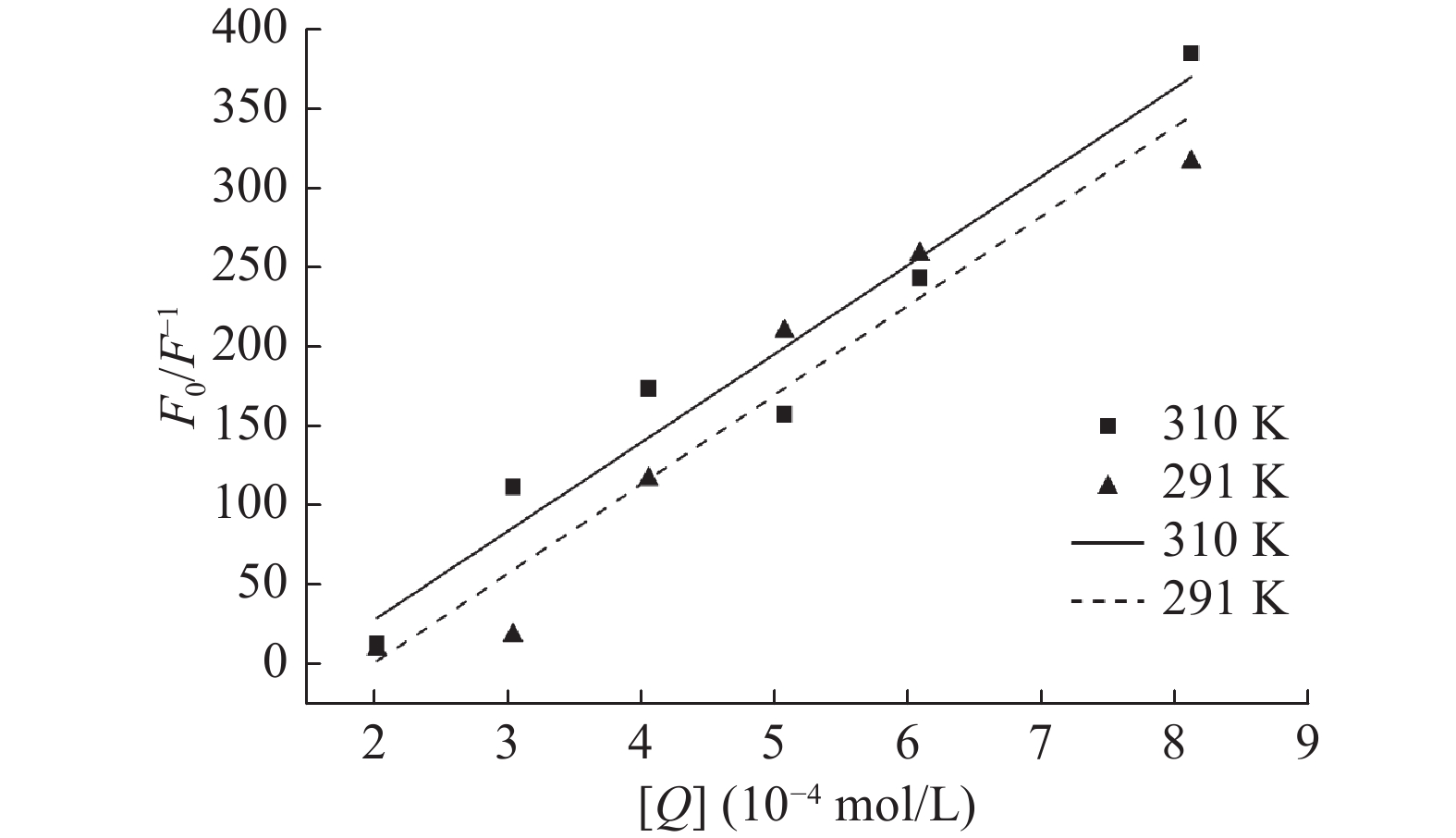
将不同浓度(2.0296×10−4、3.0443×10−4、4.0591×10−4、5.0739×10−4、6.0887×10−4、8.1185×10−4 mol/L)的芫花素对α-葡萄糖苷酶的荧光F0/F−1作图,由图5可知,F0/F−1和芫花素的终浓度呈现出良好的线性关系。Stern-volmer方程见1.2.4中的式(2),其中直线的斜率即为猝灭常量Ksv,直线的斜率也为Kqτ0,荧光分子的平均寿命τ0为10−8 s,根据Stern-volmer方程计算的相关参数见表1。由表1可知,当温度升高时,猝灭常数Ksv有减小的趋势,由此可以判断出在芫花素的作用下,α-葡萄糖苷酶的荧光产生了静态猝灭[16]。与此同时,291和310 K下对应的猝灭过程中的速率常数Kq分别为5.630×1013和5.582×1013 L/(mol·s),远远大于生物分子的最大碰撞扩散速率常数(2.0×1010 L/(mol·s)),而文献报道当速率常数Kq大于最大碰撞扩散速率常数时为静态猝灭[27],因此可以进一步判定芫花素和α-葡萄糖苷酶形成了无荧光或者荧光信号较弱的复合物而导致α-葡萄糖苷酶的荧光产生了静态猝灭。
表 1 不同温度下芫花素与α-葡萄糖苷酶作用的相关参数Table 1. Reaction kinetic parameters between genkwanin and α-glucosidase at different temperaturesT/K R2 Ksv/(105 L/mol) Kq/(1013 L/(mol·s)) 291
3100.92865
0.936245.630
5.5825.630
5.5822.3.3 芫花素与α-葡萄糖苷酶的结合常数与结合位点数
在不同的温度下,以芫花素的终浓度(2.0296×10−4、3.0443×10−4、4.0591×10−4、5.0739×10−4、6.0887×10−4、8.1185×10−4 mol/L)对应α-葡萄糖苷酶荧光光谱的lg[Q]对lg(F0/F−1)做双对数图(如图6),并进行线性回归,直线方程见1.2.5的式(3),其中斜率=结合位点数,纵轴截距=lgKA,方程的相关参数见表2,由表2可知,在温度291和310 K时,芫花素与α-葡萄糖苷酶的结合位点数n分别约为2.8和2.2。同时,随着温度升高,芫花素与α-葡萄糖苷酶之间的结合常数KA值随之减小,说明温度的升高不利于芫花素和α-葡萄糖苷酶之间所形成的复合物的稳定性。
表 2 芫花素与α-葡萄糖苷酶作用双对数方程参数Table 2. Double logarithmic equation parameters of genkwanin interacted with α-glucosidaseT/K R2 KA/(L/mol) n 291
3100.80503
0.887462.06×1011
2.34×1092.78641
2.159312.3.4 芫花素与α-葡萄糖苷酶相互作用力类型
根据图6求得291、310 K下的结合常数K1、K2以及通过方程可求得各项热力学参数(结果见表3)。由表3可知在291、310 K下芫花素与α-葡萄糖苷酶的吉布斯自由能ΔG都为负数,说明芫花素与α-葡萄糖苷酶复合物的形成是一个自发进行的过程。焓变ΔH为负值,熵变ΔS为负值,说明芫花素与α-葡萄糖苷酶之间所形成的复合物主要是通过氢键和范德华力相结合。
表 3 芫花素与α-葡萄糖苷酶作用体系热力学参数Table 3. Thermodynamic parameters of genkwanin interacted with α-glucosidaseT/K ΔH(J/mol) ΔS(J/mol/K) ΔG(J/mol) 291
310−1.76×105
−1.76×105−106.53
−154.84−1.45×105
−1.28×1053. 结论
本研究探讨了芫花素对α-葡萄糖苷酶的抑制作用,体外酶活抑制实验表明了芫花素对α-葡萄糖苷酶有显著的抑制作用,抑制类型为竞争性抑制,在0.0625~0.75 mg/mL之间,芫花素抑制α-葡萄糖苷酶较阳性对照阿卡波糖更明显。芫花素在氢键和范德华力为主要作用力下自发地与α-葡萄糖苷酶进行结合,在温度291和310 K时,结合位点数分别约为2.8和2.2,该复合物的形成使α-葡萄糖苷酶的荧光产生静态猝灭。
综上所述,芫花素可以较好地抑制α-葡萄糖苷酶的活性,具有较大的应用潜力,该研究期望为降糖功能性成分研究提供理论基础,同时也为功能性食品和医药等领域的研究提供参考依据。在实验中我们发现芫花素的水溶性较差,所以想要充分开发利用芫花素,其生物利用度方面有待于进一步探讨。
-
图 3 291 K时芫花素对α-葡萄糖苷酶荧光光谱的影响
注:F0~F8分别对应芫花素浓度为0、1.0148×10−4、2.0296×10−4、3.0443×10−4、4.0591×10−4、5.0739×10−4、6.0887×10−4、7.1035×10−4、8.1185×10−4 mol/L,图4同。
Figure 3. Effect of genkwanin on the fluorescence spectrum of α-glucosidase at 291 K
表 1 不同温度下芫花素与α-葡萄糖苷酶作用的相关参数
Table 1 Reaction kinetic parameters between genkwanin and α-glucosidase at different temperatures
T/K R2 Ksv/(105 L/mol) Kq/(1013 L/(mol·s)) 291
3100.92865
0.936245.630
5.5825.630
5.582表 2 芫花素与α-葡萄糖苷酶作用双对数方程参数
Table 2 Double logarithmic equation parameters of genkwanin interacted with α-glucosidase
T/K R2 KA/(L/mol) n 291
3100.80503
0.887462.06×1011
2.34×1092.78641
2.15931表 3 芫花素与α-葡萄糖苷酶作用体系热力学参数
Table 3 Thermodynamic parameters of genkwanin interacted with α-glucosidase
T/K ΔH(J/mol) ΔS(J/mol/K) ΔG(J/mol) 291
310−1.76×105
−1.76×105−106.53
−154.84−1.45×105
−1.28×105 -
[1] 曾通旭, 杨波, 徐倩, 等. 糖尿病的发生与免疫指标的相关性研究[J]. 甘肃农业大学学报,2019,5(42):32−39. [2] Lydia E. The need for international consensus on prediabetes[J]. The Lancet Diabetes & Endocrinology,2017,5(1):5−7.
[3] 张莹. 生活方式干预助力2型糖尿病预防与缓解[J]. 医学综述,2020,26(21):4161−4164. doi: 10.3969/j.issn.1006-2084.2020.21.001 [4] Zhou B, Bentham J, Di Cesare, M, et al. Worldwide trends in blood pressure from 1975 to 2015: A pooled analysis of 1479 population-based measurement studies with 19·1 million participants[J]. Lancet,2017,389(10064):37−55. doi: 10.1016/S0140-6736(16)31919-5
[5] Bragg F, Holmes Michael V, Iona A, et al. Association between diabetes and cause-specific mortality in rural and urban areas of China[J]. JAMA,2017,317(3):280−289. doi: 10.1001/jama.2016.19720
[6] 王芬, 刘鹭, 李函彤, 等. 具有α-葡萄糖苷酶抑制作用益生菌的筛选及特性分析[J]. 食品科学,2018,39(16):192−200. doi: 10.7506/spkx1002-6630-201816028 [7] He K, Shi J C, Mao X M. Safety and efficacy of acarbose in the treatment of diabetes in Chinese patients[J]. Therapeutics & Clinical Risk Management. 2014, 10: 505−511.
[8] 赖正权, 廖慧君, 胡震, 等. 不同产地芫花质量标准研究[J]. 按摩与康复医学,2020,11(14):4−7. [9] 樊江波, 张格林. 芫花素对流产大鼠出血量、激素水平及子宫内膜修复的影响[J]. 西北药学杂志,2019,34(1):61−65. doi: 10.3969/j.issn.1004-2407.2019.01.015 [10] 樊江波, 黄琳红. 益母草活性成分芫花素对小鼠凝血及抗炎作用的研究[J]. 西安交通大学学报(医学版),2019,40(1):158−161. [11] 许艺凡, 刘普, 刘佩佩, 等. HPLC-DAD法测定迷迭香茎和叶中11种抗氧化活性成分[J]. 中草药,2018,620(9):174−178. [12] 王宏伟, 尹志峰, 李洪波, 等. 黄芩茎叶中的化学成分[J]. 中国实验方剂学杂志,2016(22):41−44. [13] Wang X, Song Z J, He X, et al. Antitumor and immunomodulatory activity of genkwanin on colorectal cancer in the APC(Min/+) mice[J]. International Immunopharmacology,2015,29(2):701−707. doi: 10.1016/j.intimp.2015.09.006
[14] Ao H, Li Y, Li H, et al. Preparation of hydroxy genkwanin nanosuspensions and their enhanced antitumor efficacy against breast cancer[J]. Drug Delivery,2020,27(1):816−824. doi: 10.1080/10717544.2020.1770372
[15] Guilin C, Mingquan G. Rapid screening for α-glucosidase inhibitors from gymnema sylvestre by affinity ultrafiltration-HPLC-MS[J]. Frontiers in Pharmacology,2017:8.
[16] 郭时印, 李林, 周虹, 等. 1-脱氧野尻霉素对α-葡萄糖苷酶的抑制作用机制[J]. 食品科学,2019,40(5):45−50. doi: 10.7506/spkx1002-6630-20180808-081 [17] Dou Z M, Chen C, Fu X. The effect of ultrasound irradiation on the physicochemical properties and α-glucosidase inhibitory effect of blackberry fruit polysaccharide[J]. Food Hydrocolloids,2019,96:568−576. doi: 10.1016/j.foodhyd.2019.06.002
[18] 杨丽珍. 荔枝壳多酚抑制α-葡萄糖苷酶和α-淀粉酶的作用及其机制研究[D]. 广州: 华南农业大学, 2017. [19] Ciotta E, Prosposito P, Pizzoferrato R. Positive curvature in Stern-Volmer plot described by a generalized model for static quenching[J]. Journal of Luminescence. 2019, 206: 518−522.
[20] Rahman M H, Maruyama T, Okada T, et al. Study of interaction of carprofen and its enantiomers with human serum albuminâ I: Mechanism of binding studied by dialysis and spectroscopic methods[J]. Biochemical Pharmacology,1993,46(10):1721−1731. doi: 10.1016/0006-2952(93)90576-I
[21] 张静, 米佳, 禄璐, 等. 黑果枸杞花色苷提取物对胰脂肪酶活性的影响[J]. 食品科学,2020,41(5):8−14. doi: 10.7506/spkx1002-6630-20190620-234 [22] Chai W M, Wei M K, Wang R, et al. Avocado proanthocyanidins as a source of tyrosinase inhibitors: Structure characterization, inhibitory activity, and mechanism[J]. Journal of Agriculture & Food Chemistry,2015,63(33):73−81.
[23] Wang Y Q, Zhang H M, Zhou Q H. Investigation of the interaction between pentachlorop henol and human serum albumin using spectral methods[J]. Journal of Molecular Structure,2009,932(1-3):31−37. doi: 10.1016/j.molstruc.2009.05.036
[24] 王春凤, 高雪. 两种火棘果实中脂溶性酪氨酸酶抑制剂的筛选及其与酪氨酸酶相互作用的研究[D]. 重庆: 重庆工商大学, 2016: 8−45. [25] Feng L C, Jing F, Jian P L, et al. Interactions between 1-benzoyl-4-p-chloropH-enyl thiosemicarbazide and serum albumin: investigation by fluorescence spectroscopy[J]. Bioorganic & Medicinal Chemistry,2004,12(1):151−157.
[26] 徐学涛, 张瑞瑞, 杜志云, 等. 荧光猝灭法研究单羰基姜黄素衍生物与酪氨酸酶间的相互作用[J]. 光谱实验室,2011,28(4):1862−1865. doi: 10.3969/j.issn.1004-8138.2011.04.070 [27] 屠洁, 刘冠卉, 朱淑云, 等. 5-二十一烷基间苯二酚抑制α-葡萄糖苷酶活性的分子机制[J]. 食品科学,2017,38(19):116−121. doi: 10.7506/spkx1002-6630-201719019





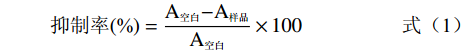
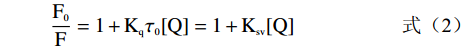
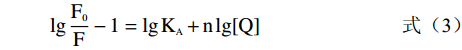

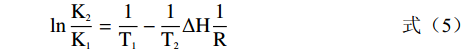
 下载:
下载:


 下载:
下载:
