Preparation and Properties of Anthocyanin Microcapsules from Passiflora edulis Rind by Complex Coacervation
-
摘要: 为提高花色苷稳定性,以西番莲果皮花色苷为芯材,明胶、阿拉伯胶为壁材,采用复凝聚法制备花色苷微胶囊。研究以包埋率为指标,采用响应面法优化西番莲果皮花色苷微胶囊最佳制备条件,进而以粒径、水分含量、形态及热稳定性研究了西番莲果皮花色苷微胶囊性质。结果表明:芯壁比1:4.7,壁材质量比(明胶: 阿拉伯胶质量比)6:7,壁材浓度1.5%,pH3.30,反应温度40 ℃,反应时间30 min,谷氨酰胺转氨酶25 U/g明胶,此时模型可靠性高,西番莲果皮花色苷包埋率最高为96.83%。最佳操作条件下所得微胶囊的粒径为12.15 μm,其水分含量为2.69%,微胶囊呈表面光滑的球形结构,熔融温度为82.51 ℃。此研究为西番莲果皮花色苷的应用提供了参考。Abstract: In order to improve the stability of anthocyanin, microcapsules of Passiflora edulis rind anthocyanin were prepared by complex coacervation using gelatin and gum Arabic as wall materials. In this study, the embedding efficiency of anthocyanin microcapsules was optimized by the Box-Behnken design. Meanwhile, properties of anthocyanin microcapsules were studied by droplet size, moisture content, morphology and thermal stability. The results showed that the optimum conditions of anthocyanin microcapsules were the core/wall ratio 1:4.7, gelatin/gum Arabi ratio 6:7, the wall material concentration 1.5%, pH value 3.30, reaction temperature 40 ℃, reaction time 30 min and transglutaminase dosage 25 U/g gelatin. Under these conditions, the model was reliable and the embedding efficiency of microcapsules was 96.83%. The particle size, moisture content, and the melting temperature of anthocyanin microcapsules were 12.15 μm, 2.69%, and 82.51 ℃, respectively. Microcapsules presented spherical structures with smooth surfaces. The research provides some references for the application of Passiflora edulis rind anthocyanin.
-
西番莲是一种营养丰富的热带水果,其在加工中产生的大量果皮造成了一定的环境污染。西番莲果皮富含花色苷,花色苷具有抗氧化、抗肿瘤,预防糖尿病和心血管疾病等功效[1],是一种优秀的天然可食用色素。以西番莲果皮为原料利用其花色苷,不仅可开发优秀的天然色素,还可解决废弃物的综合利用难题。
目前对西番莲果皮花色苷的研究以提取、分离纯化及对其稳定性的研究为主。如陈旭丹等[2]研究了西番莲果皮色素稳定性,揭示了西番莲果皮花色苷的稳定性较差。微胶囊技术可保护芯材,防止其被外界环境破坏,控制芯材释放[3],微胶囊技术可为西番莲果皮花色苷的稳定性提供保障[4]。微胶囊的制备方法有原位聚合法、喷雾干燥法、复凝聚法、界面聚合法等[5]。其中复凝聚法是用两种或多种水溶性高分子材料的溶液,在适当的条件下,电荷中和,材料在溶液中凝聚,并将芯材包埋形成微胶囊。复凝聚法制备微胶囊工艺简单、条件温和、成本低高产率等[6],在花色苷制备微胶囊技术中大量使用[7]。复凝聚法制备西番莲果皮花色苷微胶囊,可保障花色苷的稳定性,且为花色苷产品的多样化提供技术支撑。
基于此,以西番莲果皮花色苷为芯材,明胶和阿拉伯胶为壁材,采用复凝聚法制备西番莲果皮花色苷微胶囊,并分析了微胶囊的粒径、水分含量、形态及热稳定性等性质,以期为西番莲花色苷的应用提供参考。
1. 材料与方法
1.1 材料与仪器
西番莲 云南省景洪市;乙醇(纯度≥99.7%) 分析纯,广东光华科技股份有限公司;明胶 化学纯,国药集团化学试剂有限公司;阿拉伯胶 生化试剂,国药集团化学试剂有限公司;柠檬酸 分析纯,天津市风船化学试剂科技有限公司;盐酸 分析纯,成都金山化学试剂有限公司;冰乙酸(纯度≥99.5%) 分析纯,广东光华科技股份有限公司;100 U/g的谷氨酰胺转氨酶(TG酶) 泰兴市东圣食品科技有限公司。
HH-S4磁力搅拌水浴锅 常州朗越仪器制造有限公司;JRA-650超声波细胞破碎仪 无锡杰瑞安仪器设备有限公司;FJ200-SH数显高速分散均质机 上海沪析实业有限公司;B-290喷雾干燥机 瑞士Buchi公司;760CRT紫外分光光度计 上海精密科学仪器有限公司;Hydro 2000Mu激光粒度仪 英国Malvern仪器有限公司;SK2009光学显微镜 深圳赛克数码科技开发公司;SPX-150B恒温恒湿培养箱 天津泰斯特仪器有限公司;SC-4800扫描电镜 日本日立;DSC204F1差示量热扫描仪 德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 西番莲果皮花色苷的制备
参考杨宗玲[8]的方法制备西番莲果皮花色苷。选取新鲜、色泽一致的西番莲果皮。50 ℃干燥12 h,干燥果皮粉碎,过60目筛,取筛下样品,4 ℃密封保存。取干燥西番莲果皮粉,以液料比10 mL/g,加入86%酸性乙醇(0.054%盐酸+0.100%柠檬酸),以提取温度50 ℃、超声时间37 min、超声功率190 W提取花色苷,提取液5000 r/min离心10 min。取上层清液,浓缩,将浓缩液(即粗提物)于−18 ℃避光保存备用。
1.2.2 花色苷微胶囊制备
参考纪秀凤[9]的研究方法,略有修改。分别配制一定浓度的明胶和阿拉伯胶溶液,按比例将明胶溶液与西番莲果皮花色苷混匀,10000 r/min高速分散1 min,40 ℃水浴,加入一定比例阿拉伯胶溶液,混匀;10%冰乙酸调节反应pH,在一定反应温度下,200 r/min搅拌30 min;将溶液迅速冷却至15 °C,加入一定量TG酶固化3 h即得复凝聚微胶囊。取反应后底部微胶囊溶液进行喷雾干燥,得西番莲果皮花色苷微胶囊样品。喷雾干燥条件:进风温度180 °C,出风温度90 ℃,进料流速9 mL/min。
1.2.3 花色苷含量测定
微胶囊中总花色苷测定[10]:取0.50 g微胶囊样品溶于15.0 mL蒸馏水,振荡溶解;滤液分别用pH 1.00盐酸-柠檬酸缓冲液和pH 4.50柠檬酸-柠檬酸钠缓冲液稀释4倍[11];置于暗处平衡30 min,510 nm和700 nm测吸光值,利用公式(1)计算微胶囊中总花色苷含量。
微胶囊表面花色苷含量测定[12]:取0.50 g微胶囊样品,用15.0 mL振荡洗涤、过滤;滤液分别用pH1.00的盐酸-柠檬酸缓冲液和pH4.50的柠檬酸-柠檬酸钠缓冲液稀释4倍;置于暗处平衡30 min,510 nm和700 nm测定吸光值,利用公式(1)计算微胶囊表面花色苷含量。
采用pH示差法[13-14]测定花色苷含量,以式(1)计算:
花色苷含量(mg/100g)=ΔA×V×DF×M×100ϵ×1×m (1) 式中:ΔA-吸光度值之差,(A510–A700)pH1.00–(A510–A700)pH4.50;V-稀释最终体积,L;DF-稀释倍数,4;M-矢车菊素-3-葡萄糖苷相对分子质量,449.2;ε-矢车菊素-3-葡萄糖苷摩尔消光系数,26900;m-样品质量,g。
1.2.4 单因素实验
以包埋率为指标,固定条件为:芯壁比1:4、壁材质量比(明胶:阿拉伯胶质量比)1:1、壁材浓度1.5%、复凝聚pH 3.50、反应温度40 °C、反应时间30 min、TG酶25 U/g明胶。分别研究芯壁比1:2、1:3、1:4、1:5、1:6,壁材质量比2:1、3:2、1:1、2:3、1:2,壁材浓度0.5%、1.0%、1.5%、2.0%、2.5%,pH 2.50、3.00、3.50、4.00、4.50,反应温度20、30、40、50、60 ℃,反应时间15、30、45、60、75 min,TG酶添加量15、20、25、30、35 U/g明胶对西番莲果皮花色苷微胶囊包埋率的影响。
1.2.5 Box-behnken响应面优化试验
根据单因素实验结果,选择对微胶囊包埋率影响显著的芯壁比、壁材质量比和复凝聚pH为自变量,以包埋率为响应值,设计三因素三水平的响应面分析实验,优化工艺参数。因素和水平见表1。
表 1 Box-Behnken实验设计Table 1. Experiment design of Box-Behnken水平 因素 A:芯壁比 B:壁材质量比 C:复凝聚pH −1 1:4 3:2 3.0 0 1:5 1:1 3.5 1 1:6 2:3 4.0 1.2.6 性质的测定
1.2.6.1 包埋率
参考唐璐等[15]的方法,测定微胶囊包埋率,以式(2)计算:
包埋率(%)=(1−微胶囊表面花色苷微胶囊总花色苷)×100 (2) 1.2.6.2 粒径测定
将花色苷微胶囊在乙醇介质中分散均匀,采用激光粒度仪测定样品粒径。
1.2.6.3 水分含量
参考GB5009.3-2016《食品中水分的测定》直接干燥法测含水量。
1.2.6.4 形貌分析
将样品粘结在含导电胶的观测台,喷金,采用扫描电镜(SEM)在放大倍数3000倍条件下观察微胶囊形态。加速电压设定10 kV。
1.2.6.5 热稳定性
利用差示扫描量热仪(DSC)分析微胶囊的热稳定性。取5~10 mg微胶囊样品于铝制坩埚中,空坩埚为空白对照,扫描温度25~200 ℃,升温速度10 ℃/min,氮气流速20 mL/min[16]。
1.3 数据分析
实验数据均进行3次平行。利用软件Design-Expert.V8.0.6.1进行设计,软件IBM SPSS Statistics 20对数据进行显著性分析,软件Origin 2017对实验数据进行绘图。
2. 结果与分析
2.1 单因素实验
2.1.1 芯壁比对微胶囊包埋率影响
图1可见,随壁材增加,微胶囊包埋率呈先上升后下降趋势。芯壁比为1:5时,微胶囊包埋率达到最大,为96.00%,芯壁比为1:6时微胶囊包埋率显著(P<0.05)下降。原因为壁材用量较低时,溶液中壁材含量较少,复凝聚反应时形成的凝聚物较少[17],芯材未被完全包裹,造成芯材泄露附着在微胶囊表面,包埋率下降;当壁材过多时,微胶囊芯材相对较少,形成部分空囊,造成壁材浪费[18]。为确定适宜的芯壁比,选择1:4、1:5、1:6为响应面三水平。
2.1.2 壁材质量比对微胶囊包埋率影响
图2可见,随着阿拉伯胶用量增加,微胶囊包埋率呈先上升后下降的趋势。明胶:阿拉伯胶=1:1时,包埋率上升至最高,为94.25%;当壁材比小于1:1时,微胶囊包埋率显著(P<0.05)下降,在明胶与阿拉伯胶质量比为1:2时,包埋率下降到75.54%,下降了19.85%。明胶含量逐渐增加时,溶液中正电荷增多,正电荷与负电荷结合形成的复合物增加,当明胶:阿拉伯胶为1:1时,溶液中净电荷含量最低,故包埋率最大,明胶含量逐渐减少,体系正电荷减少,包埋率降低[19]。为确定适宜的壁材质量比,选择3:2、1:1、2:3为响应面三水平。
2.1.3 壁材浓度对微胶囊包埋率的影响
图3可见,壁材浓度0.5%~1.5%时,随壁材浓度的增加,微胶囊包埋率显著(P<0.05)增加,壁材浓度在1.5%时,出现峰值,包埋率为94.18%。因为壁材浓度过低,未能形成足够包裹芯材的微胶囊,存在空白复聚物,因此包埋率低。当壁材浓度大于1.5%时,微胶囊包埋率显著(P<0.05)下降。因为壁材浓度过大,囊壁变厚,离子浓度增加,壁材自身形成大块凝胶,使包埋率下降[20]。故壁材浓度1.5%为宜。
2.1.4 pH对微胶囊包埋率的影响
图4可见,当pH为3.50时,包埋率最大,为94.23%。pH<3.5时,与pH为3.5相比,微胶囊包埋率差异不显著(P>0.05)。因为阿拉伯胶分子结构上带有的-COOH使其水溶液呈弱酸性,在水溶液中带负电[21]。明胶属于两性天然高分子材料,适当降低pH,可以使明胶分子电离正离子,加入与其电荷相反的阿拉伯胶,使明胶溶解度下降,形成微胶囊[20]。pH>3.50时,微胶囊包埋率显著(P<0.05)下降,因为明胶所带净电荷较少,难以与阿拉伯胶反应,微胶囊难以形成[22],包埋率降低。为确定适宜的复凝聚pH,选择3.00、3.50、4.00为响应面三水平。
2.1.5 反应温度对微胶囊包埋率的影响
图5可见,在20~40 ℃时,随着反应温度的升高,微胶囊包埋率显著(P<0.05)上升。当反应温度在40 ℃时,包埋率最大,为94.18%。原因为较低温度使壁材分子运动减弱[23],不能形成完整微囊,芯材流出,包埋率下降。当温度大于40 ℃时,包埋率显著(P<0.05)下降,原因为温度过高,壁材稳定性下降,更易溶于溶液中,使壁材更易被破坏[24],造成包埋率下降。故反应温度选择40 ℃为宜。
2.1.6 反应时间对微胶囊包埋率的影响
图6可见,在15~30 min时,随着反应时间的延长,微胶囊包埋率显著(P<0.05)上升,在30 min时包埋率最大为94.23%,当时间超过30 min时,微胶囊包埋率显著(P<0.05)下降,在反应温度在75 min时,包埋率下降为79.87%,下降了14.36%。原因为适当延长反应时间有利于微胶囊形成,但时间过长,已形成微胶囊黏连聚集,导致囊壁有破裂[25],包埋率下降。故反应时间选择30 min为宜。
2.1.7 TG酶添加量对微胶囊包埋率的影响
图7可见,TG酶添加量在15~25 U/g明胶时,随着TG酶添加量增大,微胶囊包埋率显著(P<0.05)上升,当TG酶添加25 U/g明胶时,包埋率最高为94.19%。因为酶与蛋白质的作用位点充分结合,发生共价交联,微胶囊结构稳定[26],包埋率达到最高;TG酶添加量大于25 U/g明胶时,微胶囊包埋率显著(P<0.05)下降,因为TG酶添加量持续增加,酶添加量过高,使蛋白质交联过度,微胶囊粘连[27],包埋率降低。故TG酶添加量选择25 U/g明胶为宜。
2.2 响应面试验设计结果分析
2.2.1 模型建立与显著性分析
西番莲果皮花色苷微胶囊包埋率的响应分析实验根据Box-behnken设计得到17组实验,设计方案及结果见表2。利用软件Design-Expert.V8.0.6.1进行回归拟合,得出以包埋率为响应值的回归方程(3):
表 2 响应面设计方案及结果Table 2. Experimental design and results for response surface analysis序号 A B C Y:包埋率(%) 1 −1 0 1 87.61 2 1 0 1 82.35 3 1 0 −1 86.85 4 −1 −1 0 92.30 5 0 1 −1 83.57 6 1 −1 0 87.33 7 0 0 0 95.46 8 −1 1 0 82.71 9 −1 0 −1 93.21 10 0 0 0 96.45 11 0 0 0 95.96 12 0 1 1 80.97 13 0 −1 1 86.77 14 0 0 0 96.02 15 1 1 0 78.21 16 0 0 0 95.03 17 0 −1 −1 92.89 Y=95.78−2.64A−4.23B−2.35C+0.12AB+0.27AC+0.88BC−4.60A2−6.05B2−3.68C2 (3) 式中,A为芯壁比,B为壁材比,C为复凝聚pH。
对模型进行方差分析,结果见表3。由表3可以看出,实验选用模型具有高度的显著性(P<0.0001),失拟项=0.1817>0.05,失拟项不显著,表明回归方程对实验拟合较好,无失拟因素存在,各因素之间存在较强的交互作用;决定系数R2=0.9858,实验误差非常小,表明该模型拟合程度好,可对复凝聚法制备西番莲果皮花色苷微胶囊工艺过程的分析及预测。
表 3 回归模型方差分析Table 3. Analysis of variance for the fitted regression equation方差来源 平方和 自由度 均方 F值 P值 显著性 模型 579.90 9 64.43 124.23 <0.0001 ** A 55.60 1 55.60 107.20 <0.0001 ** B 143.06 1 143.06 275.83 <0.0001 ** C 44.27 1 44.27 85.36 <0.0001 ** AB 0.055 1 0.055 0.11 0.7537 AC 0.30 1 0.30 0.58 0.4700 BC 3.10 1 3.10 5.97 0.0445 * A2 88.93 1 88.93 171.46 <0.0001 ** B2 154.15 1 154.15 297.22 <0.0001 ** C2 57.12 1 57.12 110.13 <0.0001 ** 残差 3.63 7 0.52 失拟 2.43 3 0.81 2.69 0.1817 误差 1.20 4 0.30 总和 583.53 16 R2=0.9858 注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。 该模型可以看出A、B、C、A2、B2、C2对西番莲果皮花色苷微胶囊包埋率影响极显著(P<0.01),BC影响显著(P<0.05),AB、AC不显著。
2.2.2 响应面交互作用分析
通过Design-Expert.V8.0.6.1软件分析,各因素对西番莲果皮花色苷微胶囊包埋率影响的大小可通过响应面3D图曲面图陡峭程度判断,曲面越陡峭,影响越大,反之则越小。由图8(a)响应面最为平滑,说明A、B交互作用最小;图8(b)响应面较平滑,说明A、C交互作用较弱;图8(c)响应面较陡峭,说明B、C之间的交互作用最大。响应面结果与表3中方差分析结果相吻合。根据表3的分析结果,各交互因素对西番莲果皮花色苷微胶囊包埋率影响程度排序为:BC>AC>AB。
2.2.3 验证试验
在壁材浓度1.5%、反应温度40 °C、反应时间30 min、 TG酶25 U/g明胶时,响应面实验结果表明,复凝聚法制备西番莲果皮花色苷微胶囊优化工艺参数为:芯壁比1:4.7,壁材质量比6:7,复凝聚pH 3.31,微胶囊预测包埋率为97.43%。
验证实验中,pH取3.30作为较佳的工艺参数。三次验证实验的微胶囊包埋率为96.83%±0.21%,与预测值相比,包埋率减小0.6%,结果基本一致,表明采用响应面法优化工艺获得的参数可靠,具有一定的实用价值。
2.3 西番莲果皮花色苷微胶囊的性质
2.3.1 微胶囊的基本性质
研究中西番莲果皮花色苷微胶囊的包埋率为96.83%±0.21%。微胶囊平均粒径为12.15±0.85 μm。Mahdavi等[28]研究指出,微胶囊产品的水分对微胶囊的流动性、黏性及贮存期都有较大影响,本实验测得微胶囊水分含量仅为2.69%±0.35%,低于食品应用中粉末最低要求(4.00%)[29]。低水分能有效防止产品结块,使其具有良好的储藏稳定性。
2.3.2 表面形态分析
图9可见,西番莲果皮花色苷微胶囊呈球形和椭圆球形,表面存在凹陷,褶皱较多,因为喷雾干燥过程中,水分快速蒸发,壁材不均匀收缩[30]。从图9中分散的微胶囊可以看出,表面无裂痕、孔洞,结构完整,表明壁材对西番莲果皮花色苷具有良好的保护作用。
2.3.3 热稳定性分析
温度对微胶囊的稳定性有重要的影响。有研究表明西番莲果皮花色苷适宜在50 ℃以下保存[8]。图10可见,微胶囊熔融温度为82.51 ℃,高于普通储藏温度(25 ℃),也高于西番莲果皮花色苷的适宜储藏温度(50 ℃)。研究表明微胶囊技术可以保护芯材,确保花色苷贮藏过程中的热稳定性,对西番莲果皮花色苷起到更好的保护作用。
3. 结论
本文通过Box-Behnken响应面法优化西番莲果皮花色苷微胶囊的制备工艺,以包埋率为指标,建立的工艺为:芯壁比1:4.7,壁材质量比6:7,壁材浓度1.5%,复凝聚pH3.30,反应温度40 ℃,反应时间30 min,TG酶25 U/g明胶,此条件下,微胶囊的包埋率为96.83%。其粒径为12.15 μm、水分含量为2.69%,扫描电镜分析显示该微胶囊的表面光滑且呈球形结构、其熔融温度为82.51 ℃,常温下利于保存。
-
表 1 Box-Behnken实验设计
Table 1 Experiment design of Box-Behnken
水平 因素 A:芯壁比 B:壁材质量比 C:复凝聚pH −1 1:4 3:2 3.0 0 1:5 1:1 3.5 1 1:6 2:3 4.0 表 2 响应面设计方案及结果
Table 2 Experimental design and results for response surface analysis
序号 A B C Y:包埋率(%) 1 −1 0 1 87.61 2 1 0 1 82.35 3 1 0 −1 86.85 4 −1 −1 0 92.30 5 0 1 −1 83.57 6 1 −1 0 87.33 7 0 0 0 95.46 8 −1 1 0 82.71 9 −1 0 −1 93.21 10 0 0 0 96.45 11 0 0 0 95.96 12 0 1 1 80.97 13 0 −1 1 86.77 14 0 0 0 96.02 15 1 1 0 78.21 16 0 0 0 95.03 17 0 −1 −1 92.89 表 3 回归模型方差分析
Table 3 Analysis of variance for the fitted regression equation
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 579.90 9 64.43 124.23 <0.0001 ** A 55.60 1 55.60 107.20 <0.0001 ** B 143.06 1 143.06 275.83 <0.0001 ** C 44.27 1 44.27 85.36 <0.0001 ** AB 0.055 1 0.055 0.11 0.7537 AC 0.30 1 0.30 0.58 0.4700 BC 3.10 1 3.10 5.97 0.0445 * A2 88.93 1 88.93 171.46 <0.0001 ** B2 154.15 1 154.15 297.22 <0.0001 ** C2 57.12 1 57.12 110.13 <0.0001 ** 残差 3.63 7 0.52 失拟 2.43 3 0.81 2.69 0.1817 误差 1.20 4 0.30 总和 583.53 16 R2=0.9858 注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。 -
[1] Barbalho S M, Otoboni A M, Marinelli P, et al. Brazilian peach (Prunus persica) and passion fruit (Passiflora Edulis) nectars: Good source of vitamin c and anthocyanins[J]. Journal of Food Research,2016,2(5):50−57.
[2] 陈旭丹, 王金霞, 张琳, 等. 西番莲果皮色素Ⅰ稳定性研究[J]. 食品科学,2008,29(4):94−97. [Chen X D, Wang J X, Zhang L, et al. Study on pigment Ⅰ stability from passionflower seedcase[J]. Food Science,2008,29(4):94−97. doi: 10.3321/j.issn:1002-6630.2008.04.014 [3] 薛露, 彭珍, 关倩倩, 等. 不同壁材对β胡萝卜素微胶囊性质的影响[J]. 食品研究与开发,2020,41(14):47−54. [Xue L, Peng Z, Guan Q Q, et al. Effects of different wall materials on the characteration of β-carotene microcapsulation[J]. Food Research and Development,2020,41(14):47−54. [4] 毛莹, 帅晓艳, 王惠玲, 等. 基于内源乳化法和喷雾干燥优化制备花色苷微胶囊及其稳定性分析[J]. 食品科学,2020,41(2):267−275. [Mao Y, Shuai X Y, Wang H L, et al. Preparation and stability evaluation of anthocyanin microcapsules by emulsification/internal gelation with optimized spray drying[J]. Food Science,2020,41(2):267−275. doi: 10.7506/spkx1002-6630-20181228-330 [5] 耿凤, 邵萌, 魏健, 等. 微胶囊技术在保护天然活性成分中的应用研究进展[J]. 食品与药品,2020,22(3):250−255. [Geng F, Shao M, Wei J, et al. Progress in application of microcapsule technology in protection of natural active ingredients[J]. Food and Drug,2020,22(3):250−255. doi: 10.3969/j.issn.1672-979X.2020.03.018 [6] 倪张根, 王秋萍, 张瑞萍, 等. 复合凝聚法制备芳香微胶囊[J]. 纺织科学与工程学报,2020,37(3):25−32. [Ni Z G, Wang Q P, Zhan R P, et al. Preparation of aromatic microcapsules by complex coacervation method[J]. Journal of Textile Science and Engineering,2020,37(3):25−32. [7] Dong D, Qi Z L, Hua Y F, et al. Microencapsulation of flaxseed oil by soya proteins-gum arabic complex coacervation[J]. International Journal Food Science Technology,2015,50(8):1785−1791. doi: 10.1111/ijfs.12812
[8] 杨宗玲, 马馨, 张蕊, 等. 超声波提取西番莲果皮色素工艺优化及稳定性[J]. 食品科技,2020,45(2):251−257. [Yang Z L, Ma X, Zhang R, et al. Optimization of ultrasonic-assisted extraction process and stability for pigment from Passiflora Edulis peel[J]. Food Science and Technology,2020,45(2):251−257. [9] 纪秀凤. 红树莓籽中低聚原花青素纯化鉴定及其微胶囊化研究[D]. 锦州: 渤海大学, 2019. Ji X F. Purification, identification and microencapsulation of oligomeric proanthocyanidins from red raspberry seed[D]. Jinzhou: Bo Hai University, 2019.
[10] 马雪松. 紫甘薯色素的微乳化和微胶囊化[D]. 天津: 天津科技大学, 2015. Ma X S. Microemulsion and microencapsulation of the purple sweet potato colorant[D]. Tianjin: Tianjin University of Science & Technology, 2015.
[11] 彭彬. 西番莲果皮色素提取分离及其结构的研究[D]. 福州: 福建农林大学, 2012. Peng B. Study on the extraction, isolation and structure analysis of pigment from Passiflora Edulis skin[D]. Fuzhou: Fu Jian Agriculture and Forestry University, 2012.
[12] 高霄. 黑提果渣中花色苷的提取、纯化及微胶囊化研究[D]. 杭州: 浙江工商大学, 2017. Gao X. Study on extraction, purification and microencapsulation of black grape pomace anthocyanins[D]. Hangzhou: Zhe Jiang Gong Shang University, 2017.
[13] 杜超, 王金华, 黄于富, 等. 紫薯皮中花色苷提取工艺研究[J]. 贵阳学院学报(自然科学版),2017,12(1):1−4. [Du C, Wang J H, Huang Y F, et al. Research on extraction technology of anthocyanins from purple potato skin[J]. Journal of Guiyang University (Natural Sciences),2017,12(1):1−4. [14] 杨萍, 李哲. pH示差法测定黑枸杞花青素技术的研究[J]. 中国食品添加剂,2017(10):107−111. [Yang P, Li Z. The determination of anthocyanin in black wolfberry by pH differential method[J]. China Food Additives,2017(10):107−111. doi: 10.3969/j.issn.1006-2513.2017.10.012 [15] 唐璐, 李延辉, 薛晓丽. 黑果腺肋花楸花色苷微胶囊化的研究[J]. 食品研究与开发,2020,41(5):121−126. [Tang L, Li Y H, Xue X L. Study on microencapsulation of anthocyanins from aronia melanocarpa[J]. Food Research and Development,2020,41(5):121−126. [16] Alves M R, Martins C P M, Sartório B É, et al. Maltodextrin and gum arabic-based microencapsulation methods for anthocyanin preservation in jucara palm (Euterpe edulis martius) fruit pulp[J]. Plant Foods for Human Nutrition,2018,7(3):209−215.
[17] 石岳, 张秀玲, 邹阳. pH示差法测定黑莓残渣中花青素含量的研究[J]. 中国食品工业,2007(12):56−57. [Shi Y, Zhang X L, Zou Y. Determination the anthocyanin differential content in blackberry pomace by pH spectrophotometry[J]. For China Food Industry,2007(12):56−57. doi: 10.3969/j.issn.1006-6195.2007.12.024 [18] 方芳, 程翎, 张志兴, 等. 喷雾干燥法制备白术挥发油微胶囊[J]. 中国粮油学报,2019,34(7):73−77. [Fang F, Cheng L, Zhang Z X, et al. Microencapsulation of volatile oil from atractylodes macrocephala koidz produced by spray-drying method[J]. Journal of the Chinese Cereals and Oils Association,2019,34(7):73−77. doi: 10.3969/j.issn.1003-0174.2019.07.013 [19] 郝丽萍, 申铉日. 复凝聚法制备鱼油微胶囊[J]. 食品科技,2019,44(10):153−159. [Hao L P, Shen X R. Preparation of fish oil microcapsules by complex coacervation[J]. Food Science and Technology,2019,44(10):153−159. [20] 谢艳丽, 蒋敏, 陈鸿雁. 复凝聚法制备明胶/阿拉伯胶含油微胶囊工艺过程的研究[J]. 化学世界,2010,51(1):33−37. [Xie Y L, Jiang M, Chen H Y. Study of the process of complex coacervation encapsulation for oil core materials[J]. Chemical World,2010,51(1):33−37. doi: 10.3969/j.issn.0367-6358.2010.01.010 [21] Shaddel R, Hesari J, Azadmard-Damirchi S, et al. Use of gelatin and gum Arabic for encapsulation of black raspberry anthocyanins by complex coacervation[J]. International Journal of Biological Macromolecules,2018,107:1800−1810. doi: 10.1016/j.ijbiomac.2017.10.044
[22] 倪悦. 苦瓜籽油的复凝聚微胶囊化技术研究[D]. 无锡: 江南大学, 2010. Ni Y. Study on Microcapsulation technology of bitter gourd seeds oil by complex coacervation method[D]. Wuxi: Jiangnan University, 2010.
[23] 李艳南, 宋菲, 王挥, 等. 复合凝聚法制备天然椰子油微胶囊[J]. 中国油脂,2018,43(1):94−98, 120. [Li Y N, Song F, Wang H, et al. Preparation of virgin coconut oil microcapsules by complex coacervation[J]. China Oil and Fats,2018,43(1):94−98, 120. doi: 10.3969/j.issn.1003-7969.2018.01.024 [24] 康彬彬, 张金梁, 王祥, 等. 山茶油微胶囊的复合凝聚制备工艺参数及其热氧稳定性研究[J]. 热带作物学报,2020,41(9):1889−1896. [Kang B B, Zhang J L, Wang X, et al. Preparation and thermal-oxidative stability of camellia oil microcapsules by complex coacervation[J]. Chinese Journal of Tropical Crops,2020,41(9):1889−1896. doi: 10.3969/j.issn.1000-2561.2020.09.024 [25] 郭阳, 包怡红, 赵楠. 复凝聚法制备松籽油微胶囊工艺优化及其氧化稳定性分析[J]. 食品科学,2017,38(18):229−236. [Guo Y, Bao Y H, Zhao N. Preparation and oxidative stability of microcapsules containing pine nut oil by complex coacervation[J]. Food Science,2017,38(18):229−236. doi: 10.7506/spkx1002-6630-201718036 [26] 徐幸莲, 程巧芬, 周光宏. 转谷氨酰胺酶对蛋白质凝胶性能的影响[J]. 食品科学,2003,24(10):38−43. [Xu X L, Cheng Q F, Zhou G H. Gelling properties of proteins modified by transglutaminase[J]. Food Science,2003,24(10):38−43. doi: 10.3321/j.issn:1002-6630.2003.10.006 [27] 徐真真, 肖军霞, 黄国清, 等. 复凝聚辣椒红色素微胶囊酶法固化工艺的研究[J]. 中国食品添加剂,2015(12):135−139. [Xu Z Z, Xiao J X, Huang G Q, et al. Study on the enzymatic solidifying of coacervatedpaprika red pigment microcapsules[J]. China Food Additives,2015(12):135−139. doi: 10.3969/j.issn.1006-2513.2015.12.016 [28] Mahdavi S A, Jafari S M, Assadpoor E, et al. Microencapsulation optimization of natural anthocyanins with maltodextrin, gum arabic and gelatin[J]. International Journal of Biological Macromolecules,2016,85(7):379−385.
[29] Edris A E, Kalemba D, Adamiec J, et al. Microencapsulation of nigella sativa oleoresin by spray drying for food and nutraceutical applications[J]. Food Chemistry,2016,204:326−333. doi: 10.1016/j.foodchem.2016.02.143
[30] Hou X B, Xue Z X, Xia Y Z, et al. Effect of SiO2 nanoparticle on the physical and chemical properties of eco-friendly agar/sodium alginate nanocomposite film[J]. International Journal of Biological Macromolecules,2019,125(15):1289−1298.





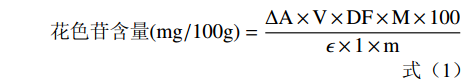
 下载:
下载:
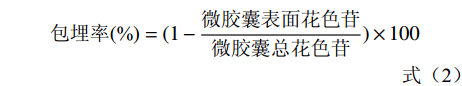







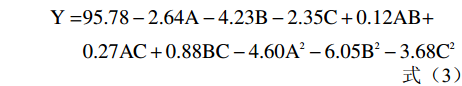



 下载:
下载:
