Construction of Engineering Bacteria for Transforming Phytosterol to 22-hydroxy-23, 24-bisnorchola-1, 4-diene-3-ketone(HPD) and Optimization of Fermentation Medium
-
摘要: 22-羟基-23, 24-双降甾-1, 4-二烯-3-酮(HPD)作为一种重要的甾体药物中间体,是合成很多皮脂类药物的原材料。通过在分枝杆菌(Mycobacterium neoaurum DSM 1381)体内过表达3-甾酮-Δ1脱氢酶(KstD)基因,Mycobacterium neoaurum DSM 1381Z菌株发酵液中HPD的产量由71%提高到84%。在单因素选择的基础上,以产物HPD的产量作为衡量指标,利用响应面方法优化发酵培养基,建立各个因素之间变化的二次回归方程。结果表明,最合适的发酵培养基组成条件是玉米浆9 g/L、硝酸钠1.8 g/L、葡萄糖6 g/L、磷酸氢二钾2 g/L。此条件下5 g/L的植物甾醇,HPD的产量可达3.73 g/L,HPD的产量比原始菌株提高了大约2.7倍,具备潜在的工业化应用价值。
-
关键词:
- 22-羟基-23,24-双降甾-1,4-二烯-3-酮 /
- 3-甾酮-Δ1脱氢酶 /
- 菌株构建 /
- 发酵培养基 /
- 植物甾醇 /
- 微生物转化
Abstract: As an important steroid intermediate, 22-hydroxy-23, 24-bisnorchola-1, 4-diene-3-ketone (HPD) was the raw material for the synthesis of many Sebaceous drugs.We overexpressed 3-ketosteroid-Δ1-dehydrogenase (KstD) gene in Mycobacterium neoaurum DSM 1381, the purity of HPD in fermentation product was increased from 71% to 84%. On the basis of single factor selection, the yield of product HPD was taken as the measurement index, response surface method was used to optimize the fermentation medium, the quadratic regression equation for the change of each influencing factor was established. The final results showed that the most suitable fermentation medium composition conditions were corn steep liquor 9 g/L, NaNO3 1.8 g/L, glucose 6 g/L, and K2HPO4 2 g/L.Under this condition, the yield of HPD could reach 3.73 g/L when the concentration of phytosterol was 5 g/L, and the yield of HPD was nearly 2.7 times higher than Mycobacterium neoaurum DSM 1381, it had potential industrial application value. -
甾体药物广泛应用于各类疾病治疗和健康保健等,如消炎、抗菌、抗肿瘤等[1],全球每年市场总销售额超过100亿美元[2-3],是除了抗生素外的第二大类药物。22-羟基-23,24-双降甾-1,4-二烯-3-酮(HPD)作为植物甾醇的侧链不完全降解产物,可以作为重要的甾体药物中间体[4],而植物甾醇主要来源于食品中,所有植物性的食物中都包含植物甾醇,它对人体健康很有好处,食品中植物甾醇摄入量越高,人们患心脏病和其他慢性疾病的危险相对越低,此外它还有降低胆固醇、抗癌等功效,植物甾醇以及植物甾醇的某些中间代谢产物也可以应用在食品、医药等领域[5],如用于油脂、面包主食、食物色拉和可口可乐等,利用HPD可以合成1-脱氢孕酮等孕激素、氢化可的松、地塞米松等皮质类激素[6-9],可以缓解类风湿性关节炎[10]等症状。传统孕激素和皮质类激素以化学合成法合成,但是化学合成法存在很多问题,严重限制了甾体药物在药学领域的发展[11-12],随着甾体药物市场需求不断扩大,利用微生物转化植物甾醇来生产重要的甾体药物中间体受到了越来越多的关注[13]。
3-甾酮-Δ1脱氢酶(KstD)是微生物转化植物甾醇过程中一个关键酶[14],能够催化22-羟基-23,24-双降甾-4-烯-3-酮(4-HP)的A环C1,2脱氢形成双键而制得HPD[15],比如皮质醇和可的松的1号位脱氢衍生物比其本身可表现出更强的抗风湿和抗过敏活性[16]。KstD不但可以催化4-HP上A环C1,2脱氢形成HPD,并且在植物甾醇代谢和其他甾体药物合成中也起着重要的作用[17-18],Zhang等[19]在大肠杆菌异源表达KstD基因,直接将4-HP转化成HPD。但是以4-HP为底物通过酶法转化合成HPD的工艺,由于底物成本较高、酶催化工艺复杂[20-22],所以该路线并不适合工业化生产;Xu等[23]通过基因编辑改造获得了能转化植物甾醇产HPD的菌株,但摩尔产率较低,同时含有4-HP、ADD等副产物,需要进一步提高产量。而通过对菌株改造以植物甾醇为底物直接得到HPD,工艺简单且成本很低,极具工业化生产的潜力,如何获得可以直接转化植物甾醇生产HPD的优良菌株,目前成为HPD产业化过程中研究的重点和难点。
为了提高HPD的产量,在一株基因突变菌株Mycobacterium neoaurum DSM 1381[24]中过表达KstD基因构建一株3-甾酮-Δ1脱氢酶过表达的菌株;再通过单因素筛选和响应面试验来优化发酵培养基,进一步提高生产HPD的能力,实现生产HPD工艺的优化和产量的提升。
1. 材料与方法
1.1 材料与仪器
新金分枝杆菌Mycobacterium neoaurum DSM 1381(DSM 1381)、大肠杆菌Escherichia coli DH5α、整合表达质粒pMV306-Psmyc实验室−80 ℃保藏;Phanta Max Master Mix、限制性内切酶EcoRI和SaIl TaKaRa公司;吐温−80、卡那霉素 上海麦克林有限公司;质粒提取试剂盒、4-HP、HPD标品 Axygen公司;玉米浆 山东佳达生物饲料有限公司;植物甾醇 云南生物制品有限公司;乙酸乙酯、正己烷等 国药集团化学试剂有限公司;葡萄糖、蛋白胨、牛肉膏等 上海生工生物工程有限公司。
BSA 224S-CW型电子天平、PB-10型pH计 德国Sartorius;LC-2010型高效液相色谱仪 日本岛津公司;HWS-12型恒温水浴锅 上海一恒公司;Centrifuge5430低温离心机 德国Eppendorf公司;EPS300型电泳仪 上海天能有限公司;DU730型紫外分光光度计 德国BecKman;MLS-3780型高压蒸汽灭菌锅 日本三洋;S1000TM型PCR仪 美国Thermal BIO-RAD公司。
1.2 实验方法
1.2.1 培养基及植物甾醇母液配制
LB培养基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH7.0,115 ℃,灭菌30 min;种子培养基:NH4NO3 15 g/L,Glu 10 g/L,K2HPO4 1.0 g/L,NaNO3 2.0 g/L,吐温−80 2 g/L,pH7.5~8.0,115 ℃,灭菌30 min;初始培养基:(NH4)2SO4 10 g/L,Glu 10 g/L,MgSO4·7H2O 1.0 g/L,K2HPO41.0g/L,吐温−80 2 g/L,植物甾醇5 g/L,pH7.5-8.0,115 ℃,灭菌30 min;植物甾醇母液:称取5 g的植物甾醇,加入1 g吐温−80和20 g羟丙基-β-环糊精,用水定容至100 mL配成50 g/L,搅拌60 min,200 W超声溶解20 min,115 ℃,灭菌30 min备用。
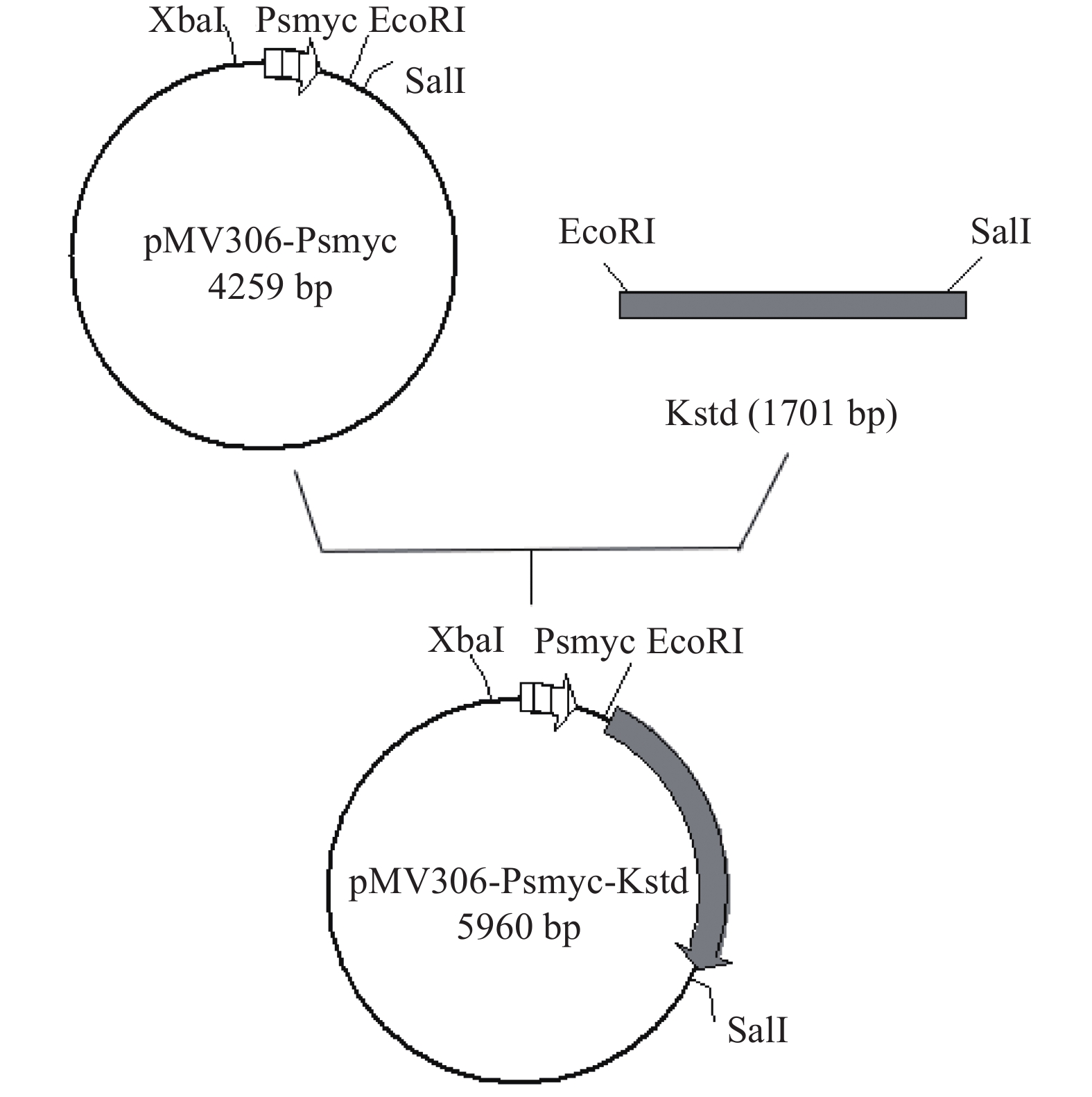
1.2.2 过表达整合质粒pMV306-Psmyc-KstD的构建
以实验室构建pMV306-Psmyc质粒为模板;然后根据本实验室测序得到的DSM 1381基因组上的KstD1基因序列为模板设计扩增引物KstD1-F/R(tatgggatccgaattcGTGTTCTACATGACTGCCCA/tagttaactacgtcgacTCAGGCCTTTCCAGCGAGAT)扩增KstD1基因,将它同源重组到pMV306-Psmyc整合质粒的EcoRI和SalI位点之间,构建过表达质粒pMV306-Psmyc-KstD,过表达质粒构建方法如图1所示,然后用pMV306质粒上的位点设计引物进行实验,并送上海杰李测序公司测序验证。
1.2.3 新金分枝杆菌电转及阳性菌株筛选
将构建好的过表达质粒pMV306-Psmyc-KstD电入新金分枝杆菌的感受态中[26],涂入含50 μg/mL的卡那霉素抗性的LB平板上,3~4 d后挑取单克隆进行PCR验证,PCR扩增条件为:95 ℃,5 min,95 ℃,30 s,58 ℃,30 s,72 ℃,1 kb/min,35循环;72 ℃,5 min,16 ℃,5 min,PCR产物经过测序得到阳性菌株即构建的菌株。
1.2.4 重组菌株生长曲线
将重组菌株单克隆划线于固体LB培养基,30 ℃恒温培养箱培养3~5 d后挑取单克隆接种于10 mL种子培养基,30 ℃、200 r/min培养至对数后期(约60 h),得到液体菌种,然后以1:10体积的接种量接入50 mL种子培养基,30 ℃、200 r/min恒温箱振荡培养,每过4 h取样检测菌液的吸光度值OD600,然后以培养时间h为横坐标,吸光度值OD600为纵坐标绘制菌株的生长曲线,每组做三个平行。
1.2.5 菌株培养和植物甾醇转化条件过表达
菌和野生菌株液体种子培养方法如1.2.4,发酵培养基中接入10%体积的液体菌种;放置30 ℃、200 r/min恒温振荡箱培养120 h时取样检测产物。
1.2.6 产物检测方法
具有共轭结构的甾体化合物4-HP和HPD在UV254 nm下有吸收值可以利用高效液相色谱检测,然后比对标品建立的标准曲线,可以测定产物的相对含量[27-29],
HPD的标准曲线y=56.237X−0.139,R2=0.99914,4-HP的标准曲线y=44.398X−0.101,R2=0.99412,具有极好的线性关系。
高效液相色谱(HPLC)检测条件[30]:采用C18反相层析柱(Agilent XDB-C18,4.6 mm×250 mm,5 μm);流动相为甲醇80%:水20%(V/V),流速0.8 mL/min;进样体积为20 μL;紫外检测波长为254 nm。
1.2.7 发酵培养基优化
1.2.7.1 有机氮源的选择
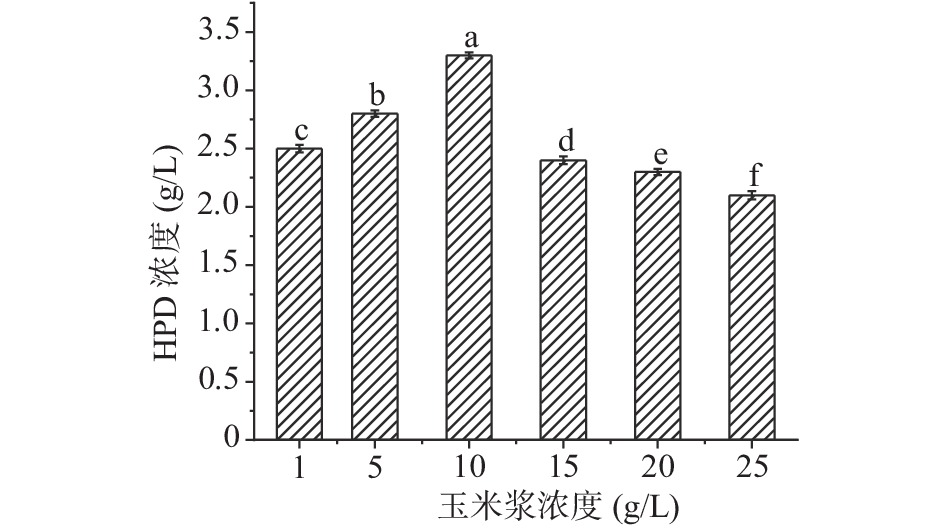
根据预实验[31-32]选择玉米浆为有机氮源,HPD的产量作为指标,设置1、5、10、15、20、25 g/L的浓度梯度,其他条件都保持不变,筛选出最优的玉米浆浓度。
1.2.7.2 无机氮源的选择
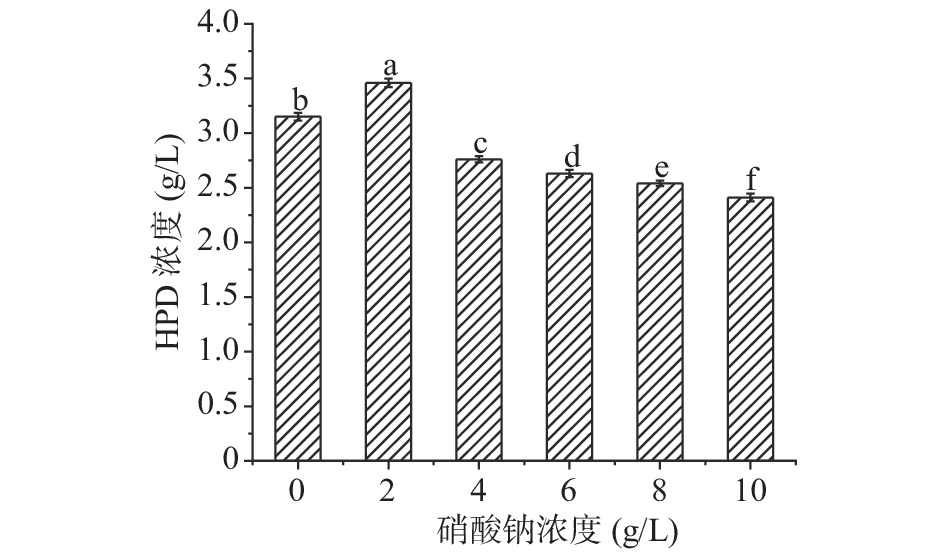
在最优的玉米浆浓度条件下添加无机氮源硝酸钠,并设置0、2、4、6、8、10 g/L的浓度梯度,筛选出最适宜的硝酸钠浓度,每组实验做三组平行。
1.2.7.3 碳源的选择
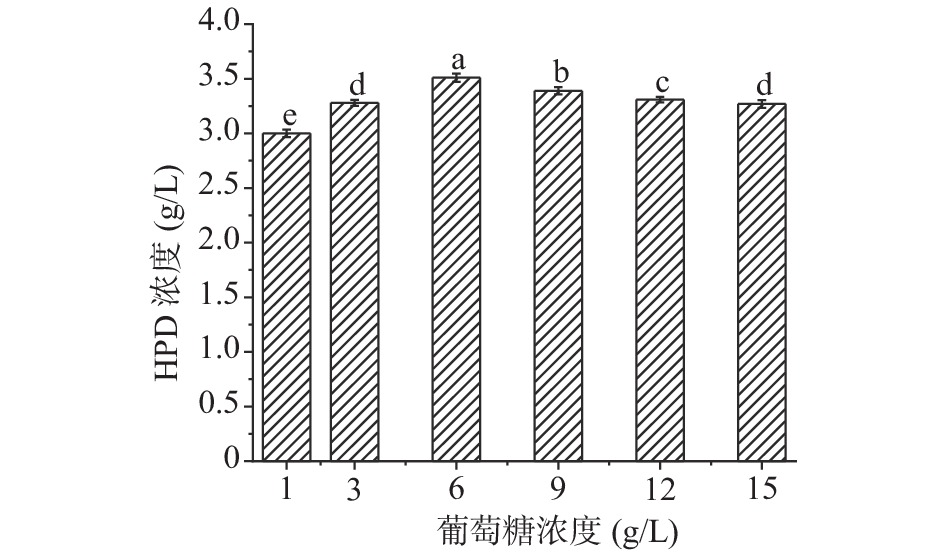
根据预实验选择葡萄糖为碳源,HPD的产量作为指标,设置1、3、6、9、12、15 g/L的浓度梯度,筛选出最适宜的葡萄糖浓度,其他条件都保持不变,每组实验做三组平行。
1.2.7.4 磷酸盐的选择
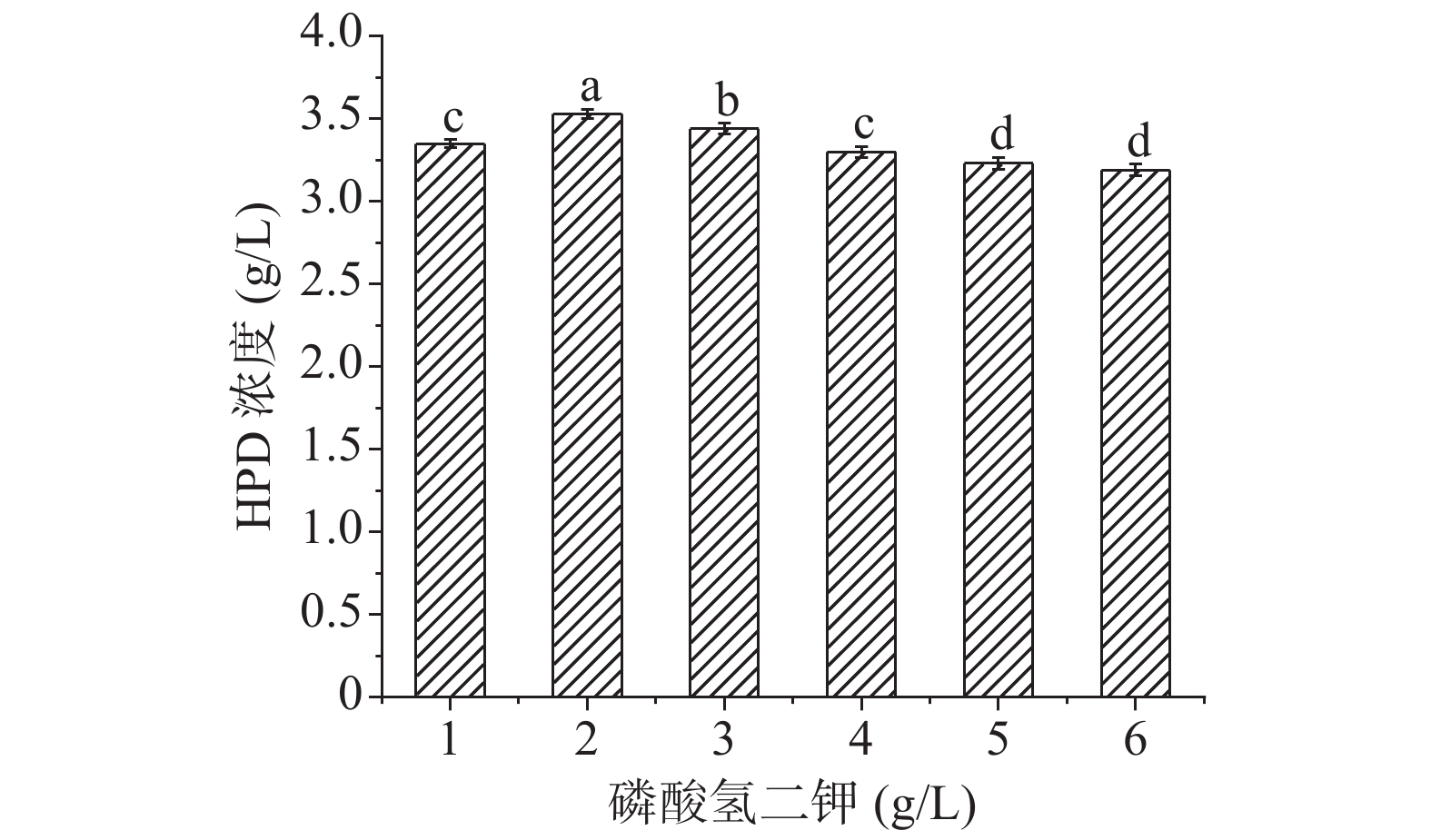
根据预实验选择磷酸氢二钾为磷酸源,HPD的产量作为指标,设置它的浓度梯度为1、2、3、4、5、6 g/L,筛选最适宜的磷酸盐浓度,其他条件都保持不变,每组实验做三组平行。
1.2.7.5 响应面设计
根据前面单因素实验的结果,选择玉米浆、磷酸氢二钾、硝酸钠和葡萄糖的浓度作为考察因素,HPD的产量作为指标,利用Design-Expert 8.0.6.1软件设计出4因素3水平的响应面试验,试验因素和编码水平如表1所示。
表 1 响应面试验的因素水平设计Table 1. Factor levels for response surface experiments因素 水平 −1 0 1 A 玉米浆(g/L) 5 10 15 B磷酸氢二钾(g/L) 1 2 3 C 硝酸钠(g/L) 0.5 2 3.5 D 葡萄糖(g/L) 3 6 9 1.3 数据整理
本实验中每个样品做三组平行,使用Design-Expert 8.0.6.1软件进行响应面优化试验的设计以及数据分析,并预测出最优结果,使用Origin 2018软件进行数据处理及作图并进行显著性分析,标有相同小写字母者表示组间差异不显著(P>0.05),反之表示组间差异显著(P<0.05)。
2. 结果与分析
2.1 过表达质粒的验证与重组菌株筛选
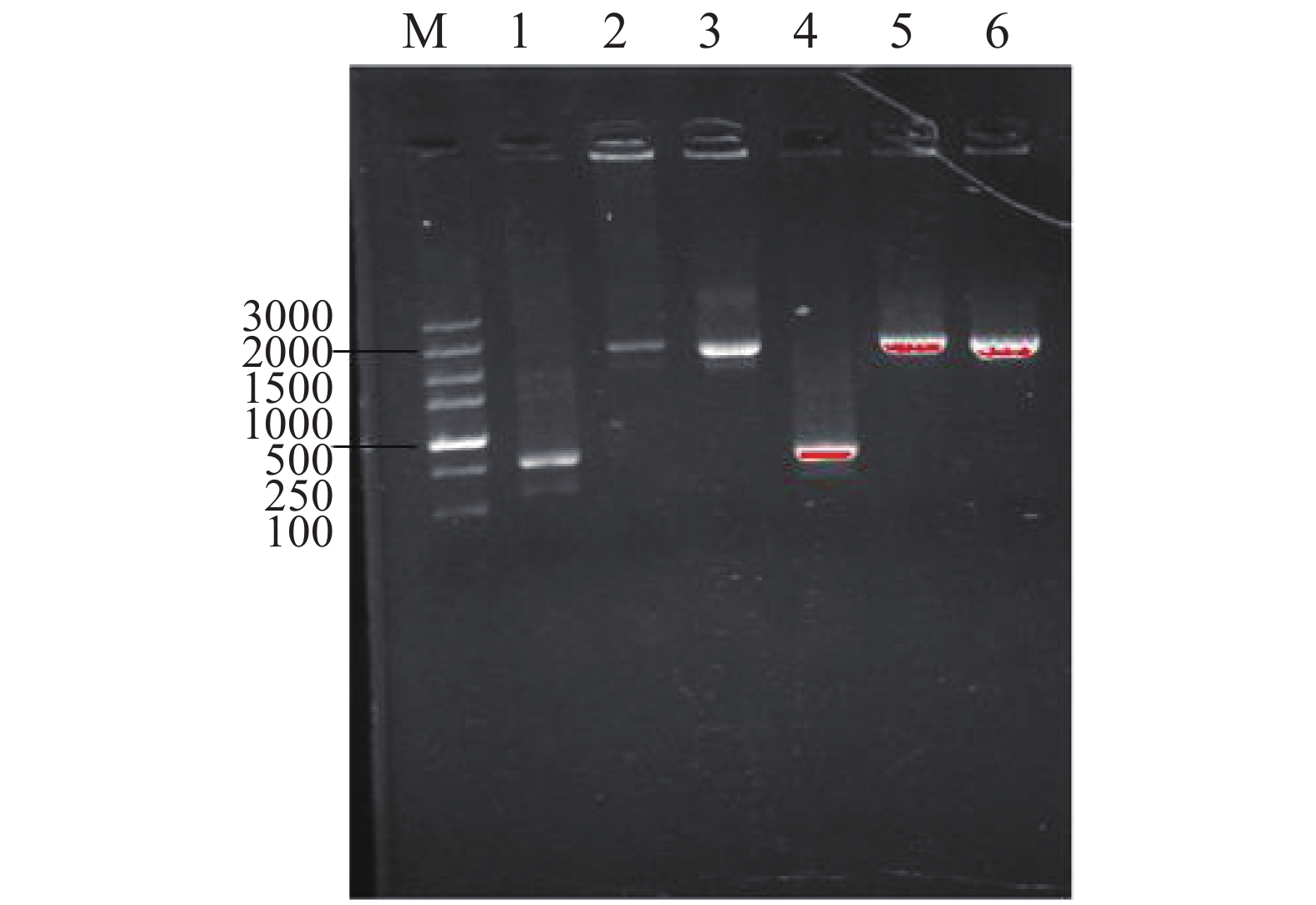
使用pMV306的专用引物p306-F(ggcggagcctatggaaaaac)/p306-R(gcgttcgccctgtcgttcac)对pMV306-Psmyc-KstD进行PCR验证,结果如图2所示,1,4条带为空载即空白对照,2,5条带为阳性对照,3,6为构建质粒,结果送测验证正确。
2.2 过表达菌株和原始菌株的生长状况
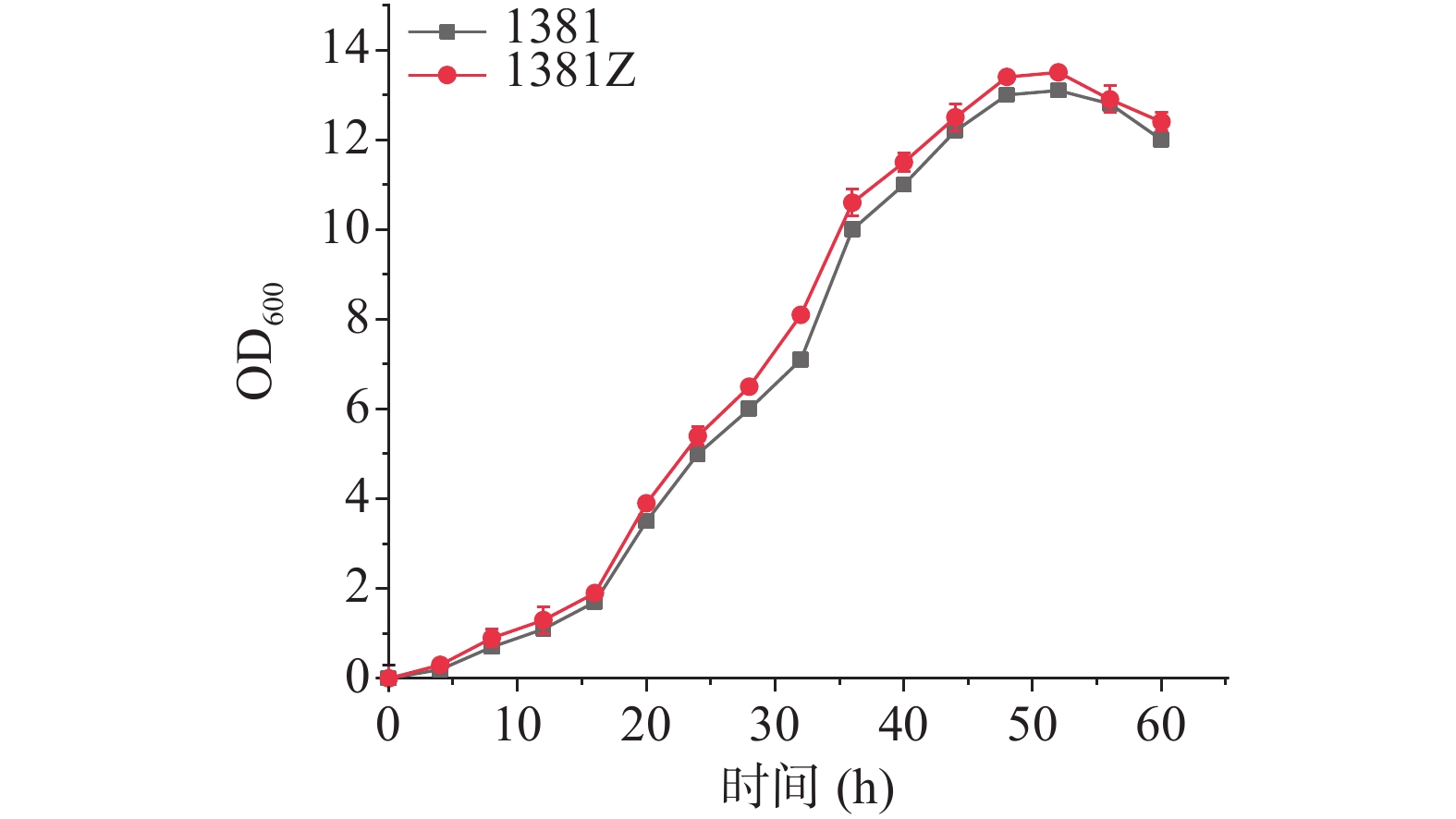
KstD过表达菌株为Mycobacterium neoaurum DSM 1381Z(DSM 1381Z)与初始菌DSM 1381的生长情况如图3所示,可以看出转入3-甾酮-Δ1脱氢酶的DSM 1381Z菌株和初始菌株DSM 1381的生长状况大致相同,0~16 h缓慢生长期,16~40 h为对数生长期,40~55 h稳定生长期之后进入衰退期,两株菌株生长情况大致相同,说明过表达质粒pMV306-Psmyc-KstD的转入不会对过表达菌株DSM 1381Z的生长产生负面影响。
2.3 过表达菌株植物甾醇转化
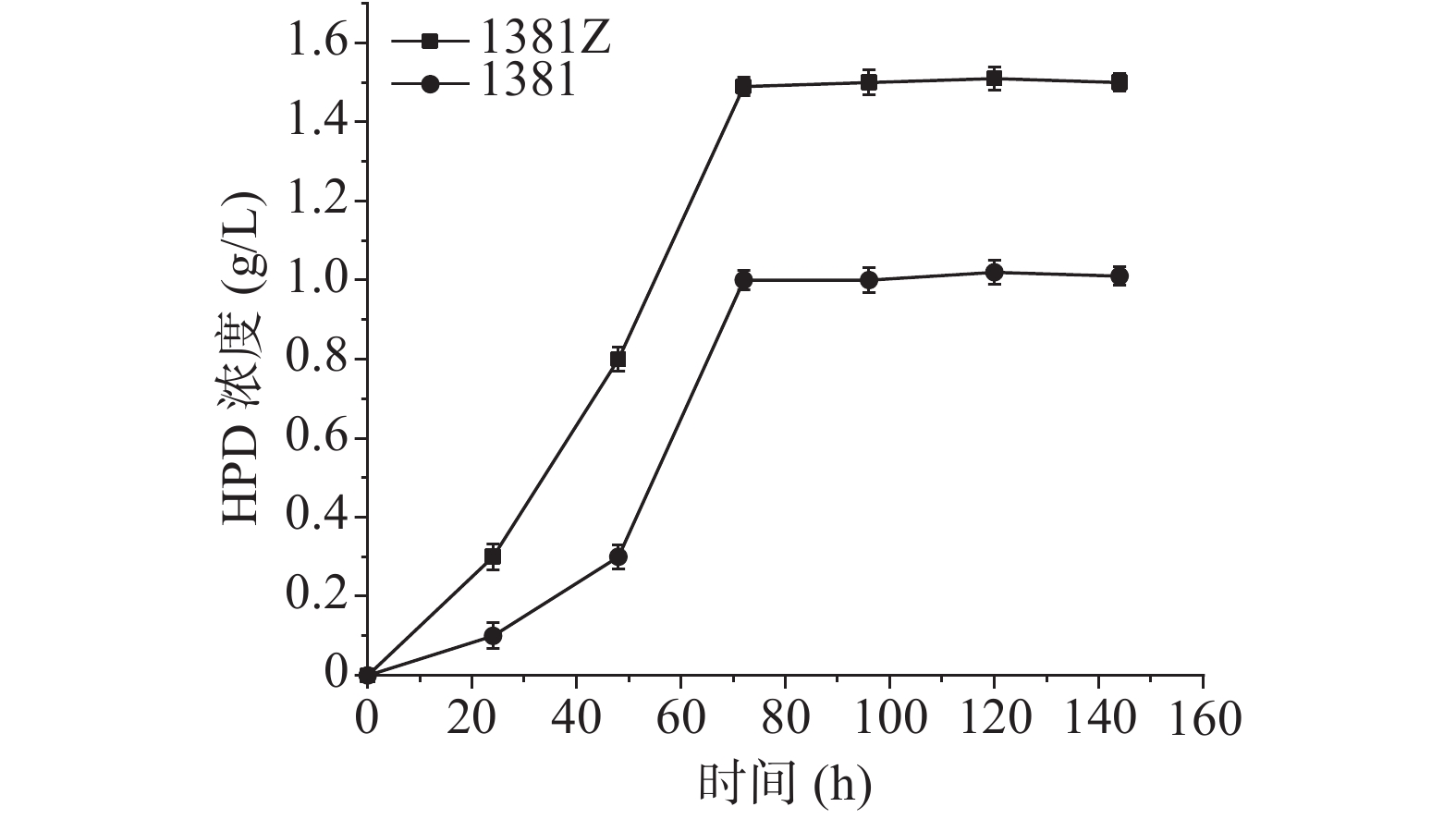
过表达菌株DSM1381Z和初始菌株DSM 1381对植物甾醇的转化结果如图4所示,横坐标代表时间,纵坐标代表产量,DSM 1381Z菌株发酵液中比DSM 1381菌株HPD产量提高了约50%,说明过表达菌株构建成功。
2.4 单因素实验筛选
2.4.1 有机氮源的选择
氮源是微生物生长需求量非常大的元素,适当的氮源水平对微生物生物量的积累以及甾醇转化有着非常重要的影响。预实验中多种有机氮源的存在下,DSM 1381Z都可以生成HPD,在几种有机氮源中以玉米浆时HPD浓度最高,可能是因为玉米浆中含有丰富的营养物质,有利于植物甾醇转化,后续实验在对它的浓度进行优化。
如图5所示,随着玉米浆浓度不断增加,产物HPD的产量也逐渐增加,当玉米浆浓度达到10 g/L时,HPD的产量最高3.2 g/L;但随着浓度继续增加,HPD积累量逐渐降低,可能是因为营养过剩导致转化甾醇不充分,接下来选择10 g/L的玉米浆继续实验。
2.4.2 无机氮源的选择
预实验中几种无机氮源中以硝酸钠时HPD浓度最高,微生物转化植物甾醇中既要有机氮源又要无机氮源,在玉米浆10 g/L浓度时,筛选出硝酸钠浓度对产物的影响。
由图6可以看到在硝酸钠2 g/L时,HPD产量最高3.4 g/L,随着硝酸钠浓度逐渐增加,HPD产量降低,可能是因为少量的硝酸根离子可以促进代谢,从而提高产量,而高浓度时可能会影响微生物生长从而抑制微生物的代谢,因此玉米浆作为主要有机氮源时,再加入一些无机氮源硝酸钠会促进植物甾醇转化,接下来选择玉米浆10 g/L和硝酸钠2 g/L作为合适的氮源浓度继续后续实验。
2.4.3 碳源的选择
碳源作为培养基必不可少的基本成分,可以为微生物的生长及代谢提供必要的能量,选择适宜的碳源有助于促进某些酶的合成,增强微生物的某些生物活性[33],预实验中DSM 1381Z可以利用不同的碳源,当葡萄糖为碳源时,HPD的产量最高,可能因为葡萄糖是单糖,DSM1381Z相对更容易利用,故选用葡萄糖作为DSM 1381Z发酵培养基的最佳碳源,然后再对其浓度进行优化。
如图7所示,随着葡萄糖浓度的增加HPD积累量先增加后减少,当浓度为6 g/L时,产物浓度达到最大3.3 g/L,后续选择6 g/L的葡萄糖作为碳源继续研究。
2.4.4 磷酸盐的选择
磷作为核酸、蛋白质的主要成分,可以改变菌体的能荷状态,还是培养基中重要的缓冲盐,对维持发酵培养基中pH稳定有重要作用[34]。预实验中选择磷酸氢二钾作为最适合磷酸盐,对其浓度进行优化,结果如下图8,当磷酸氢二钾浓度为2 g/L的发酵液中HPD的积累量最大。
2.5 响应面试验优化结果
2.5.1 模型的建立和显著性分析
使用软件Design-Expert 8.0.6.1对表2进行分析,方差的分析结果如表3所示。对得到的数据进行多元回归拟合,得到DSM 1381Z转化植物甾醇产HPD浓度(Y)对玉米浆(A)、磷酸氢二钾(B)、硝酸钠(C)、葡萄糖(D)的多项回归方程:
表 2 响应面分析结果Table 2. Results of response surface analysis试验号 A B C D HPD浓度(g/L) 1 −1 1 0 0 1.3846 2 0 1 1 0 1.8135 3 0 0 −1 1 2.2512 4 0 −1 −1 0 2.0815 5 0 0 −1 −1 2.8876 6 1 1 0 0 1.0211 7 0 −1 0 −1 1.8364 8 1 0 1 0 1.4587 9 0 0 0 0 3.5172 10 −1 0 1 0 2.2134 11 0 0 1 1 2.5658 12 0 1 0 1 1.9254 13 0 0 0 0 3.5824 14 −1 −1 0 0 1.8563 15 0 0 0 0 3.4915 16 1 0 0 −1 1.4576 17 1 0 0 1 1.1295 18 0 0 0 0 3.6012 19 0 1 −1 0 1.8245 20 0 0 0 0 3.6312 21 −1 0 −1 0 2.5976 22 1 0 −1 0 1.4324 23 1 −1 0 0 0.6452 24 −1 0 0 1 2.2763 25 0 1 0 −1 2.0453 26 −1 0 0 −1 1.9658 27 0 −1 1 0 2.0153 28 0 −1 0 1 1.8719 29 0 0 1 −1 1.8503 表 3 HPD产量多项式回归模型方差分析Table 3. Analysis of variance(ANOVA)of HPD yield polynomial regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 18.08 14 1.29 84.40 < 0.0001 极显著 A 2.21 1 2.21 144.42 < 0.0001 极显著 B 7.115E-03 1 7.115E-03 0.46 0.5064 不显著 C 0.11 1 0.11 7.30 0.0172 显著 D 4.370E-05 1 4.370E-05 2.856E-03 0.9581 不显著 AB 0.18 1 0.18 11.74 0.0041 显著 AC 0.042 1 0.042 2.75 0.1193 不显著 AD 0.10 1 0.10 6.66 0.0218 显著 BC 7.618E-04 1 7.618E-04 0.050 0.8267 不显著 BD 6.037E-03 1 6.037E-03 0.39 0.5400 不显著 CD 0.46 1 0.46 29.86 < 0.0001 极显著 A2 9.38 1 9.38 613.32 < 0.0001 极显著 B2 7.74 1 7.74 505.99 < 0.0001 极显著 C2 1.68 1 1.68 109.69 < 0.0001 极显著 D2 2.53 1 2.53 165.47 < 0.0001 极显著 残差 0.21 14 0.015 失拟项 0.20 10 0.020 5.86 0.0515 纯误差 0.014 4 3.421E-03 总回归 18.30 28 Y=3.56−0.43A−0.024B−0.096C−1.908E−003D+0.21AB+0.10AC−0.16AD+0.014BC−0.039BD+0.34CD−1.20A2−1.09B2−0.51C2−0.62D2
由表3可知,本试验的回归模型极显著(P<0.001),失拟项P=0.0515>0.05不是很显著,说明模型较正确,拟合度较高,复决定系数R2=0.9883,表明预测值和实测值具有较好的相关性;调整性决定系数
2.5.2 响应面优化与分析
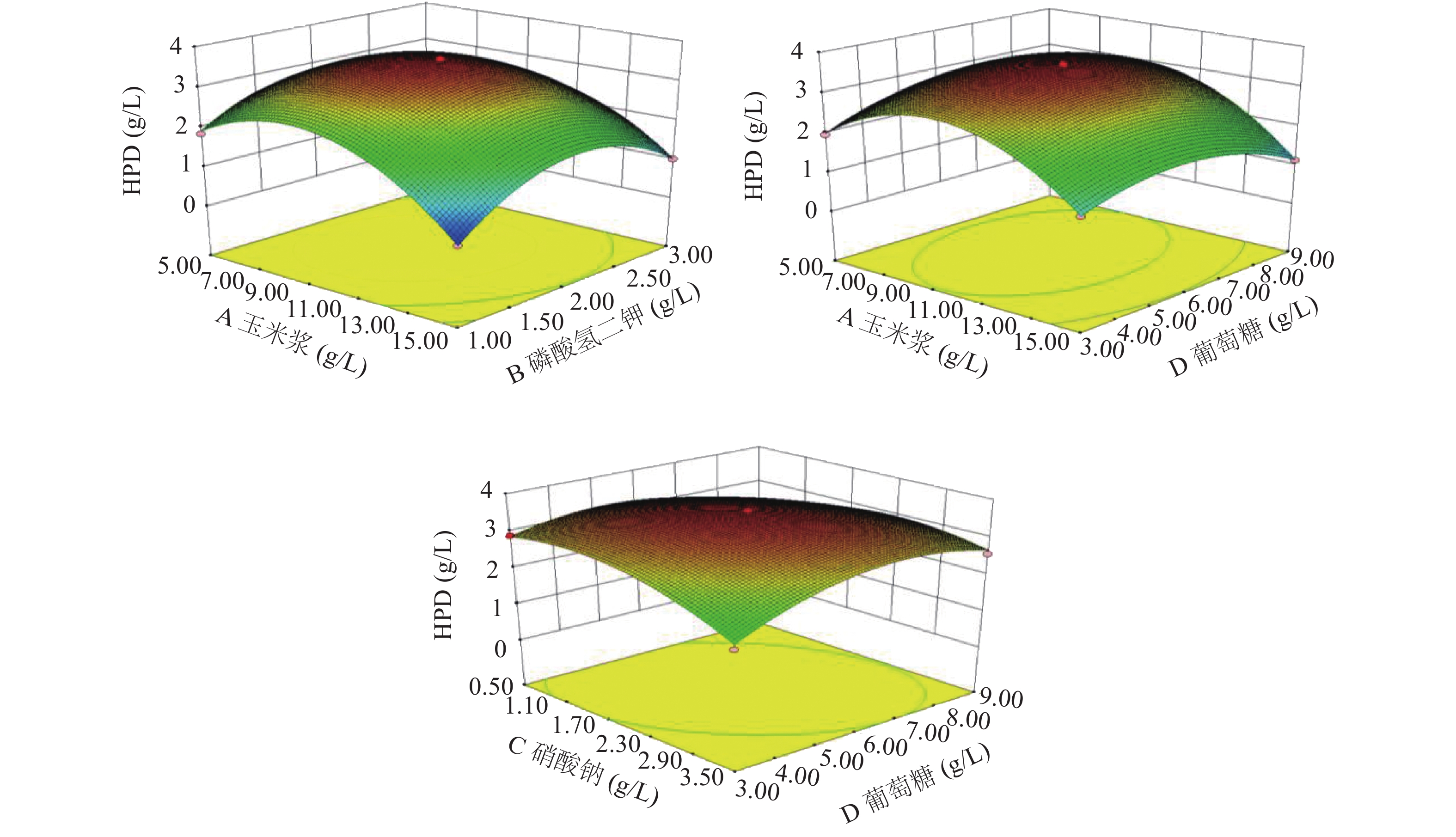
根据回归模型做出响应面图,考察各个因素之间的交互作用[35]对HPD产量的影响,交互作用的大小可由等高线的形状来反映,两因素的交互作用越显著形状越椭圆,若呈圆形则相反,并且响应面曲线较陡也能说明两因素交互作用显著,结果如图9所示。
通过Design-Expert 8.0.6.1软件对响应面结果分析计算,得到Mycobacterium neoaurum DSM 1381Z转化植物甾醇产HPD的最佳发酵培养基配方:玉米浆9.08 g/L、硝酸钠1.82 g/L、葡萄糖5.98 g/L、磷酸氢二钾1.97 g/L,此条件下HPD的产量预测值可达3.61 g/L。
2.5.3 响应面优化结果验证
考虑到实际操作情况,将响应面优化结果校正为玉米浆9 g/L、硝酸钠1.8 g/L、葡萄萄糖6 g/L、磷酸氢二钾2 g/L,在此条件下进行验证(3组平行实验),发酵120 h后得到实际HPD的积累量最大值为(3.73±0.12) g/L,与软件预测值3.61 g/L的误差约为3.22%,说明上述方程和实际的拟合度较好,很好的验证了模型,与原始菌株DSM 1381相比,HPD产量提高了约2.7倍,为提高甾体药物中间体的生产提供了一定的工业基础。
3. 结论
本实验通过在出发菌株Mycobacterium neoaurum DSM 1381中过表达高活性的3-甾酮-Δ1-脱氢酶基因KstD获得一株直接转化植物甾醇高产HPD的菌株Mycobacterium neoaurum DSM 1381Z。为了进一步提高其产量,通过单因素筛选出Mycobacterium neoaurum DSM 1381Z发酵培养基成分;然后利用响应面优化设计实验,得到最优发酵培养基玉米浆9 g/L、葡萄糖6 g/L、硝酸钠1.8 g/L、磷酸氢二钾2 g/L。此条件下HPD预测产3.61 g/L,对优化后的培养基进行验证得到实际结果为(3.73±0.12) g/L,与理论预测值接近,说明模型比较合适。通过培养基响应面优化,比初始菌DSM 1381的HPD产量提高了约2.7倍,产量由原来的71%提高到92%左右,具有一定的工业化应用价值。
目前利用微生物直接转化植物甾醇生产HPD的研究较少[36],本研究通过在DSM 1381体内过表达3-甾酮-Δ1脱氢酶,进一步获得更多的HPD,发酵过程中植物甾醇几乎都被微生物所利用,但是还有少量杂质,因此下一步工作应通过代谢工程等手段进一步改造菌种,减少杂质生成,提高HPD的纯度和产量。
-
表 1 响应面试验的因素水平设计
Table 1 Factor levels for response surface experiments
因素 水平 −1 0 1 A 玉米浆(g/L) 5 10 15 B磷酸氢二钾(g/L) 1 2 3 C 硝酸钠(g/L) 0.5 2 3.5 D 葡萄糖(g/L) 3 6 9 表 2 响应面分析结果
Table 2 Results of response surface analysis
试验号 A B C D HPD浓度(g/L) 1 −1 1 0 0 1.3846 2 0 1 1 0 1.8135 3 0 0 −1 1 2.2512 4 0 −1 −1 0 2.0815 5 0 0 −1 −1 2.8876 6 1 1 0 0 1.0211 7 0 −1 0 −1 1.8364 8 1 0 1 0 1.4587 9 0 0 0 0 3.5172 10 −1 0 1 0 2.2134 11 0 0 1 1 2.5658 12 0 1 0 1 1.9254 13 0 0 0 0 3.5824 14 −1 −1 0 0 1.8563 15 0 0 0 0 3.4915 16 1 0 0 −1 1.4576 17 1 0 0 1 1.1295 18 0 0 0 0 3.6012 19 0 1 −1 0 1.8245 20 0 0 0 0 3.6312 21 −1 0 −1 0 2.5976 22 1 0 −1 0 1.4324 23 1 −1 0 0 0.6452 24 −1 0 0 1 2.2763 25 0 1 0 −1 2.0453 26 −1 0 0 −1 1.9658 27 0 −1 1 0 2.0153 28 0 −1 0 1 1.8719 29 0 0 1 −1 1.8503 表 3 HPD产量多项式回归模型方差分析
Table 3 Analysis of variance(ANOVA)of HPD yield polynomial regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 18.08 14 1.29 84.40 < 0.0001 极显著 A 2.21 1 2.21 144.42 < 0.0001 极显著 B 7.115E-03 1 7.115E-03 0.46 0.5064 不显著 C 0.11 1 0.11 7.30 0.0172 显著 D 4.370E-05 1 4.370E-05 2.856E-03 0.9581 不显著 AB 0.18 1 0.18 11.74 0.0041 显著 AC 0.042 1 0.042 2.75 0.1193 不显著 AD 0.10 1 0.10 6.66 0.0218 显著 BC 7.618E-04 1 7.618E-04 0.050 0.8267 不显著 BD 6.037E-03 1 6.037E-03 0.39 0.5400 不显著 CD 0.46 1 0.46 29.86 < 0.0001 极显著 A2 9.38 1 9.38 613.32 < 0.0001 极显著 B2 7.74 1 7.74 505.99 < 0.0001 极显著 C2 1.68 1 1.68 109.69 < 0.0001 极显著 D2 2.53 1 2.53 165.47 < 0.0001 极显著 残差 0.21 14 0.015 失拟项 0.20 10 0.020 5.86 0.0515 纯误差 0.014 4 3.421E-03 总回归 18.30 28 -
[1] Donova MV, Egorova OV. Microbial steroid transformations: current state and prospects[J]. Applied Microbiology and Biotechnology,2012,94(6):1423−1447. doi: 10.1007/s00253-012-4078-0
[2] Nassiri KN, Faramarzi MA. Recent developments in the fungal transformation of steroids[J]. Biocatal Biotransfor,2015,33(1):1−28.
[3] Fernandez CL, Galan B, Garcia J. New insights on steriod biotechnology[J]. Frontiers in Microbiology,2018,9(958):1−15.
[4] He XJ, Liu B, Wang GH, et al. Microbial metabolism of methyl protodioscin by Aspergillus niger culture-A new androstenedione producing way from steroid[J]. Journal of Steroid Biochemistry and Molecular Biology,2006,100(1):87−94.
[5] 王欣, 王枫. 植物固醇的研究新进展[J]. 国外医学,2007(2):98−101. [6] 张娜, 郭庆启, 张岭. 植物固醇/固烷醇(酯)作为降低胆固醇功能性食品的研究进展[J]. 中国调味品,2010,35(10):45−47+51. [Zhang N, Guo Q Q, Zhang L. Research Progress of Phytosterols/Stanols (Esters) as Functional Foods for Lowering Cholesterol[J]. China Condiment,2010,35(10):45−47+51]. doi: 10.3969/j.issn.1000-9973.2010.10.006 [7] 金俊, 卢梦瑶, 厉秋岳, 等. 以甾醇为底物微生物法合成甾体类化合物的研究进展[J]. 食品研究与开发,2018,39(10):205−209. doi: 10.3969/j.issn.1005-6521.2018.10.038 [8] 杨顺楷, 杨亚力, 吴中柳, 等. 微生物发酵降解植物甾醇侧链生产17-酮甾体研究进展[J]. 生物加工过程,2010,8(5):69−77. doi: 10.3969/j.issn.1672-3678.2010.05.015 [9] Yao K, Xu LQ, Wang FQ, et al. Characterization and engineering of 3-ketosteroid-delta (1)-dehydrogenase and 3-ketosteroid-9 alpha-hydroxylase in Mycobacterium neoaurum ATCC 25795 to produce 9 alpha-hydroxy-4-androstene-3, 17-dione through the catabolism of sterols[J]. Metabolic Engineering,2014,24:181−91. doi: 10.1016/j.ymben.2014.05.005
[10] Boland E W. The effects of cortisone and adrenocorticotropic hormone (ACTH) on certain rheumatic diseases[J]. Calif Med,1950,72(6):405−14.
[11] Toro A and Ambrus G. Oxidative decarboxxylation of 17(20)-dehydro-23, 24-dinorcholanoic acids[J]. Tetrahedron Letters,1990,31(24):3475−3476. doi: 10.1016/S0040-4039(00)97426-4
[12] Chen DJ, Zhu BQ. Application of microbial transformation in modern pharmaceutical industry[J]. Chinese Journal of Antibiotics,2006,31(2):112−118.
[13] 徐慧静, 刘萍, 崔立迁, 等. 甾体激素药物的生物转化研究进展[J]. 生物加工过程,2019,17(5):542−550. doi: 10.3969/j.issn.1672-3678.2019.05.016 [14] Zhang W, Shao M, Rao Z, et al. Bioconversion of 4-androstene-3, 17-dione to androst-1, 4-diene-3, 17-dione by recombinant Bacillus subtilis expressing ksdd gene encoding 3-ketosteroid-Delta1-dehydrogenase fromMycobacterium neoaurum JC-12[J]. Journal of Steroid Biochemistry and Molecular Biology,2013,135:36−42. doi: 10.1016/j.jsbmb.2012.12.016
[15] Rohman A, Oosterwijk NV, Dijkstra BW. Purification, crystallization and preliminary X-ray crystallographic analysis of 3-ketosteroid Δ1-dehydrogenase from Rhodococcus erythropolis SQ1[J]. Acta Crystallographica Section F-Structural Biology Communications,2012,68(5):551−556. doi: 10.1107/S1744309112011025
[16] Choi KP, Yamashita M, Murooka Y, et al. Purification and Characterization of the 3-Ketosteroid-Δ1-Dehydrogenase ofArthrobacter simplex Produced in Streptomyces liuidans[J]. Journal of Biochemistry,1995,117(5):1043−1049. doi: 10.1093/oxfordjournals.jbchem.a124804
[17] Molnár I, Choi KP, Yamashita M, et al. Molecular cloning, expression in Streptomyces livdans, and analysis of a gene cluster from Arthrobacter simplex encoding 3-ketosteroid-Δ1-dehydrogenase, 3-ketosteroid-Δ5-isomerase and a hypothetical regulatory protein[J]. Molecular microbiology,1995,15(5):895−905. doi: 10.1111/j.1365-2958.1995.tb02359.x
[18] Geize RVD, Hessels GI, Gerwen RV, et al. Targeted disruption of the KstD gene encoding a 3-ketosteroid-Δ1-dehydrogenase isoenzyme of Rhodococcus erythropolis strain SQ1[J]. Applied and Environmental Microbiology,2000,66(5):2029−2036. doi: 10.1128/AEM.66.5.2029-2036.2000
[19] Zhang RJ, Liu XC, Wang YS, et al. Identification, function, and application of 3-ketosteroid Δ1-dehydrogenase isozymes in Mycobacterium neoaurum DSM 1381 for the production of steroidic synthons[J]. Microb Cell Fact,2018,17(1):77−93. doi: 10.1186/s12934-018-0916-9
[20] Sonomoto K, Usui N, Tanaka A, et al. 9α-Hydroxylation of 4-androstene-3, 17-dione by gel-entrappedCorynebacterium sp. cells[J]. Applied Microbiology and Biotechnology,1983,17(4):203−210. doi: 10.1007/BF00510416
[21] Geize Rvd, Hessels GI, Gerwen RV, et al. Molecular and functional characterization of kshA andkshB, encoding two components of 3-ketosteroid 9α-hydroxylase, a class IA monooxygenase, in Rhodococcus erythropolis strain SQ1[J]. Molecular Microbiology,2002,45(4):1007−1018. doi: 10.1046/j.1365-2958.2002.03069.x
[22] Sarmah U, Roy MK, Singh HD. Steroid transformations by a strain of Arthrobacter oxydans incapable of steroid ring degradation[J]. Journal of Basic Microbiology,1989,29(2):85−92. doi: 10.1002/jobm.3620290206
[23] Xu LQ, Liu YJ, Yao K, et al. Unraveling and engineering the production of 23, 24-bisnorcholenic steroids in sterol metabolism[J]. Scientific Reports,2016,6(1):269−293.
[24] Imada Y T K. Process for producing steroidal alcohols: US, 4223091[P]. 1980.
[25] Liu XC, Zhang RJ, Bao ZW, et al. Biotransformation of Phytosterols to Androst-1, 4-Diene-3, 17-Dione by Mycobacterium sp ZFZ Expressing 3-Ketosteroid-∆1-Dehydrogenase[J]. Catalysts,2020,10(6):663−673. doi: 10.3390/catal10060663
[26] 张乐乐. Mycobacterium neoaurum高效表达载体的构建及其在合成雄甾-1, 4-二烯-3, 17-二酮中的应用[D]. 无锡: 江南大学, 2015. [27] 姚抗. 分枝杆菌甾醇转化机制的解析及其代谢工程改造应用于制备重要甾药中间体的研究[D]. 上海: 华东理工大学, 2014. Y
[28] 冯建勋, 陈瑞, 高兴强, 等. Tween-80和羟丙基-β-环糊精对分枝杆菌转化植物甾醇代谢途径的影响[J]. 中国医药工业杂志,2016,47(1):25−30. [29] 李珍柱. 三种类黄酮纯度标准物质的研制[D]. 重庆: 西南大学, 2018. [30] 曹慧锦, 马治国, 刘相岑, 等. 降解植物甾醇9α-羟基雄烯二酮工程菌株构建及发酵工艺优化[J]. 食品工业科技,2020,41(14):101−107. [31] 柳相鹤, 张瑞婕, 赵树欣, 等. Mycobacterium sp. BFZ304转化植物甾醇产9α-羟基雄烯二酮培养基的响应面优化[J]. 食品工业科技,2017,37(16):172−177. [32] 刘相岑, 郝晓蔚, 张瑞婕, 等. 降解植物甾醇产雄甾-1, 4-二烯-3, 17-二酮工程菌株的构建及转化培养基优化[J]. 食品工业科技,2018,39(18):110−116. [33] 刘波, 邬应龙, 张霞, 等. 红曲霉固态发酵产木聚糖酶培养基的响应面优化[J]. 食品工业科技,2014,35(1):254−258. [34] 杨英. 徽生物转化植物甾醇制备甾体药物关健中间体研究[D]. 合肥: 合肥工业大学, 2009: 64−67. [35] 欧阳薇, 乐龙, 王志祥, 等. 超声波优化栀子苷提取的工艺研究[J]. 中国药物警戒,2011(3):154−157. doi: 10.3969/j.issn.1672-8629.2011.03.008 [36] Xiong L B, Liu H H, Xu L Q, et al. Improving the production of 22-hydroxy-23, 24-bisnorchol-4-ene-3-one from sterols in Mycobacterium neoaurum by increasing cell permeability and modifying multiple genes[J]. Microbial Cell Factories,2017,16(1):89. doi: 10.1186/s12934-017-0705-x





 下载:
下载:
 下载:
下载:
