Interaction of Flavor Nucleotides with EGCG and Their Protein Complexes by UV Absorption Spectrometry and Fluorescence Spectrometry
-
摘要: 为了探究IMP、GMP是否与EGCG及其蛋白络合物发生相互作用从而影响呈味特性,利用紫外分光光度法和荧光光谱法测定光谱的变化,结果表明: IMP、GMP与EGCG会发生相互作用,改变EGCG的光谱特性,且只存在一种结合方式,GMP与EGCG相互作用的效应强于IMP与EGCG的相互作用,两种呈味核苷酸1:1混合时对EGCG影响最大;IMP、GMP均不单独与BSA发生相互作用,但两者同时存在时会对BSA产生静态荧光淬灭,结合常数为0.6634,结合位点数为0.88;与EGCG蛋白络合物相互作用中,GMP单独存在时只与EGCG反应,IMP、GMP同时存在时以与蛋白的相互作用为主,结合常数为1.1054,结合位点数为1.49。此研究可更清晰地了解茶汤的呈味机制,为茶叶品质提高及茶饮料风味改善提供理论基础。Abstract: In order to explore whether IMP and GMP interact with EGCG and its protein complexes to affect the taste characteristics, UV absorption spectrometry and fluorescence spectrometry were used to determine the changes in the spectrum. The results showed that: IMP, GMP interacted with EGCG and changed the spectral characteristics of EGCG, and there was only one binding mode; The interaction between GMP and EGCG was stronger than that between IMP and EGCG, and the two flavor nucleotides had the greatest interactions with EGCG when they were mixed in 1:1.IMP, GMP neither interacted with BSA alone, but when the two existed at the same time, it would produce static fluorescence quenching of BSA, the binding constant was 0.6634, and the number of binding sites was 0.88. In the interaction with EGCG protein complex, GMP existed alone. It only reacted with EGCG. When IMP and GMP coexisted, it mainly interacted with protein. The binding constant was 1.1054 and the number of binding sites was 1.49. This study can provide a clearer understanding of the taste mechanism of tea soup and provide a theoretical basis for the improvement of tea quality and the improvement of tea beverage flavor.
-
呈味核苷酸在食品鲜味方面有着重要贡献,其中以肌苷-5'-磷酸二钠(Inosine 5'-monophosphate,IMP)和鸟苷-5'-磷酸二钠(Guanosine 5'-monophosphate, GMP)为代表。IMP在肉类和水产品的鲜味呈现中有重要作用[1],GMP广泛存在于植物中,对菌类鲜味有明显提升效果[2]。Fuke等[3]发现IMP、GMP鲜味阈值分别为0.025%、0.0125%,两者1:1混合后阈值降低至0.0063%且与谷氨酸存在协同增鲜效应。(-)-表没食子儿茶素没食子酸酯( (-)-Epigallocatechin gallate, EGCG)是茶叶中主要的涩味物质,与口腔中富脯氨酸蛋白(PRPs,salivary proline-richproteins)通过氢键或疏水作用可产生收敛感觉[4-5]。
滋味是茶叶品质的重要影响因素,是茶叶中水溶性物质相互作用的结果,其中涩味和鲜味对整体滋味的影响最大。现普遍认为,茶叶涩味主要来源于(-)-表没食子儿茶素没食子酸酯((-)-epigallcatechin 3-gallate,EGCG),鲜味主要来源于氨基酸类物质,但在实际研究中,生化成分含量与感官审评结果之间存在一定矛盾,较多茶叶中EGCG含量较高却无明显涩味,游离氨基酸含量较高强却无明显鲜味[6-8]。有研究显示,白茶萎凋过程中呈味核苷酸含量大幅增加且参与了白茶鲜味呈现,但其在茶叶中呈味机理鲜有报道[9-10]。鲜味会增加人们对食物的摄取,苦涩味则相反[11]。在茶叶产业中,一定程度上降低茶汤涩味、增加鲜味会提高茶叶品质[12]。因此,探究茶叶中EGCG及其蛋白络合物是否会与呈味核苷酸发生反应,从而降低涩味对全面了解茶汤滋味有重要意义。
本研究通过紫外分光光度法和荧光光谱法对茶叶中呈味核苷酸与EGCG及其蛋白络合物的相互作用研究,探究其相互作用产生的机理,进一步了解茶汤中鲜味和涩味来源,从而对全面解释茶叶滋味提供新的角度,为茶叶加工提供理论支持和新的发展思路,在茶风味食物与饮料的研发过程中对EGCG涩味的掩盖提供新的方法。
1. 材料与方法
1.1 材料与仪器
EGCG 纯品 纯度>98%,上海Macklin;肌苷-5’-磷酸二钠盐 纯度99%,上海Aladdin;鸟苷-5’-单磷酸二钠盐 纯度≥99%,上海Sigma;牛血清蛋白 纯度97%,北京Solarbio。
FA1004A分析天平 上海精天电子仪器有限公司;Cary Eclipse荧光分光光度仪 美国Varian公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;UV-2600紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 溶液的配制
1.2.1.1 Tris-HCl缓冲液的配制
称取6.056 g三羟甲基氨基甲烷置于1 L烧杯中,加入800 mL超纯水,充分溶解后,用盐酸调节溶液pH7.4。将溶液定容至1 L,放置于4 ℃冰箱中保存备用。
1.2.1.2 标准品溶液母液配制
BSA(分子量67000)溶液:浓度 6.0×10−5 mol/L,用0.05 mol/L Tris-HCl缓冲溶液(pH7.4)配制;
EGCG、IMP、GMP 溶液:浓度均为1.0×10−3 mol/L,用超纯水配制,用时稀释至合适浓度。
1.2.2 呈味核苷酸与EGCG的相互作用
1.2.2.1 呈味核苷酸与EGCG单体及相互作用的紫外吸收光谱
紫外-可见吸收光谱法是研究两个物质相互作用最简单常用的方法[13],通过吸收峰位置和吸收强度的改变可判断两者是否发生相互作用[14]。
将EGCG、IMP、GMP溶液分为A、B、C三组,母液稀释10倍,每组在一系列10 mL容量瓶中按梯度依次加入0~4.0 mL的单一稀释液,用0.05 mol/L Tris-HCl缓冲液(pH7.4)定容至刻度,在室温下作用30 min,选取光谱范围为220~300 nm,在紫外光谱吸收光谱仪上记录吸收图谱。
在一系列10 mL容量瓶中,均加入2 mL EGCG溶液,然后依次加入不同浓度的呈味核苷酸溶液,混合均匀,用0.05 mol/L Tris-HCl缓冲液(pH7.4)定容至刻度,在室温下作用30 min,选取光谱范围为220~300 nm,在紫外光谱吸收光谱仪上记录吸收图谱。
1.2.2.2 呈味核苷酸与EGCG相互作用结合常数的计算
根据Stephanos等[15-16]描述的方法计算结合常数K的值。假设水溶液中呈味核苷酸和EGCG之间只有一种相互作用,方程(1)和(2)可以成立:
呈味核苷酸+EGCG⇌呈味核苷酸:EGCG (1) K=(EGCG):(呈味核苷酸)(EGCG)(呈味核苷酸) (2) 假设
(EGCG:呈味核苷酸)=CB K=CB(CEGCG−CB)(C呈味核苷酸−CB) (3) C呈味核苷酸和CEGCG是相对应物质在溶液中的浓度
根据Beer–Lambert定律
C呈味核苷酸=A0ε呈味核苷酸⋅ι (4) C呈味核苷酸=A−A0εEGCG⋅ι (5) 其中A0和A分别是呈味核苷酸不存在和存在时278 nm处的EGCG吸光值。ε呈味核苷酸和εEGCG分别是呈味核苷酸和EGCG的摩尔消光系数。ι为吸收厚度。
将式(4)、(5)带入(3),可得式(6)
A0A−A0=ε EGCGε B+ε EGCGεB⋅K⋅1C呈味核苷酸 (6) 因此,1/(A-A0)与1/C呈味核苷酸呈线性关系,结合常数(K)可由截距与斜率之比估算得出。
1.2.3 呈味核苷酸与EGCG蛋白络合物的相互作用
1.2.3.1 呈味核苷酸与EGCG蛋白络合物相互作用的光谱测定
多酚与蛋白质的相互作用是近年来食品领域的研究重点, 在食品加工、包装等方面已取得较多成果[17-19]。BSA常作为蛋白质模型来研究小分子与蛋白质的相互作用[20],BSA有色氨酸和甘氨酸残基,存在荧光特性,可利用光谱法探究 IMP、GMP与EGCG蛋白络合物的相互作用。
在一系列10 mL容量瓶中,均加入2 mL EGCG溶液(浓度为2×10−5 mol/L),2 mL BSA溶液(浓度为2×10−6 mol/L),然后依次加入不同浓度的呈味核苷酸溶液,混合均匀,用0.05 mol/L Tris-HCl缓冲液(pH7.4)定容至刻度,在室温下作用30 min,在紫外光谱吸收仪和荧光光谱仪上记录吸收图谱和荧光发射光谱。
1.2.3.2 呈味核苷酸与EGCG蛋白络合物相互作用荧光淬灭类型的计算
根据Steam-Volmer方程判断淬灭类型[21-22]。
F0F=Ksv[Q]+1=Kqτ0[Q]+1 (7) 式中,F0与F分别为不存在与存在淬灭剂时体系的荧光强度;Ksv为淬灭常数;[Q]为淬灭剂浓度;Kq为双分子荧光淬灭速率常数;τ0为不存在淬灭剂时物质的荧光平均寿命, 一般生物大分子的荧光平均寿命为1×10−8 s。当荧光体为生物大分子时, 其最大扩散常数Kq为2 ×1010 ( mol/L ) −1s−1。
根据公式(7)计算所得Kq值与之比较, 若 Kq>2 ×1010 ( mol/L ) −1s−1,则属于静态淬灭,若Kq<2 ×1010 ( mol/L ) −1s−1,则属于动态淬灭。
1.2.3.3 呈味核苷酸与EGCG蛋白络合物相互作用结合常数和结合位点的计算
对于静态淬灭,可采用公式(8)计算结合常数KA和结合位点数n。
log[(F0−F)]F=logKA+nlog[Q] (8) 式中:F0和F分别是不存在和存在淬灭剂时溶液的荧光强度;KA为表观结合常数;n为结合位点数;[Q]为淬灭剂浓度。通过log[(F0-F)/F]和log[Q]作图可求出结合常数KA和结合位点数n[23]。
1.3 数据处理
运用Excel进行数据分析与处理;Origin 2021作图。
2. 结果与分析
2.1 各滋味物质单体的紫外吸收光谱
如图1所示,各滋味物质(EGCG、IMP、GMP)单体的紫外吸收特性良好,且紫外吸收强度随物质浓度的增加而增大。EGCG、IMP、GMP的最大吸收峰分别在278、249、253 nm附近,GMP在280 nm处显示有一个副峰。此结果与丁奇[24]、王婧[25]的结果一致。
2.2 呈味核苷酸与EGCG的相互作用
2.2.1 呈味核苷酸与EGCG相互作用的紫外吸收光谱图
以固定EGCG的浓度(2.0×10−5 mol/L)为背景,添加不同浓度的呈味核苷酸下紫外吸收图谱如图2所示,由图1(A)可知,此浓度下EGCG的紫外吸收值为1.77,三个混合体系的吸收值均远远低于EGCG的吸收值。EGEG-IMP混合体系的紫外吸收值集中在0.3附近且只在278 nm处存在一个吸收峰;EGCG-GMP混合体系中,随着GMP明度的增加,250 nm处的峰谷处吸收值逐渐升高,当GMP浓度为1.2×10−5 mol/L时,峰谷变得平直,GMP浓度再增大时开始产生副峰,峰的位置在255 nm处,GMP浓度为3.2×10−5 mol/L时,副峰高度超过主峰;EGCG-IMP-GMP混合体系中,主、副峰位置不变,但副峰吸收值均低于主峰,也均低于EGCG-GMP体系。以最大混合浓度为例,拟合EGCG与IMP、GMP、IMP-GMP相互作用的紫外吸收值(图D虚线)与实际紫外吸收值(图D实线)发现,EGCG与呈味核苷酸相互作用后吸收值与峰形均发生改变,EGCG特征峰仍然存在但吸收值明显小于两者简单相加,且相互作用后的图谱在250 nm处的特征峰明显。
2.2.2 呈味核苷酸与EGCG相互作用的结合位点
根据公式(6)得呈味核苷酸浓度和混合溶液吸收值的双倒数图如图3所示,结合常数K分别为0.01086、0.10835、0.03915,线性关系良好。图A中忽略三个较高浓度(cIMP=3.2×10−5、3.6×10−5、4.0×10−5 mol/L)后线性关系良好,结合紫外吸收图谱,三种混合方式均与EGCG存在一种相互作用,值得一提的是IMP只在较低浓度下与EGCG存在此种关系。
2.3 呈味核苷酸与EGCG蛋白络合物的相互作用
2.3.1 呈味核苷酸与EGCG蛋白络合物相互作用的紫外吸收光谱图
以固定BSA浓度(2.0×10−6 mol/L)为背景, 添加不同浓度的呈味核苷酸后吸收值的变化如图4所示,此系列紫外光谱中均只存在一个吸收峰,位置在278 nm处,BSA-IMP混合体系紫外吸收值聚集在0.7左右;BSA-GMP混合体系紫外吸收值聚集在0.5左右;BSA-IMP-GMP混合体系紫外吸收值随呈味核苷酸浓度增加呈现梯度上升的趋势。
以固定EGCG浓度2.0×10−5 mol/L ,BSA浓度(2.0×10−6 mol/L)为背景,添加不同浓度的呈味核苷酸的紫外吸收光谱如图5所示,BSA-EGCG-IMP混合体系和BSA-EGCG-GMP混合体系的紫外吸收图谱均呈现集中趋势,BSA-EGCG-IMP-GMP混合体系的紫外吸收值明显增大且在250 nm处吸收值的变化幅度较大,280 nm处的峰形随呈味核苷酸浓度的增加有变缓趋势。
![]() 图 5 EGCG-BSA络合物与呈味核苷酸相互作用的紫外吸收光谱图注: EGCG浓度为2.0×10−5 mol/L ;BSA浓度为2.0×10−6 mol/L ;a~k:表示呈味核苷酸的浓度为: 0、0.4×10−5、0.8×10−5、1.2×10−5、1.6×10−5、2.0×10−5、2.4×10−5、2.8×10−5、3.2×10−5、3.6×10−5和4.0×10−5 mol/L。Figure 5. Ultraviolet absorption spectrum of the interaction between EGCG-BSA complex and taste nucleotide
图 5 EGCG-BSA络合物与呈味核苷酸相互作用的紫外吸收光谱图注: EGCG浓度为2.0×10−5 mol/L ;BSA浓度为2.0×10−6 mol/L ;a~k:表示呈味核苷酸的浓度为: 0、0.4×10−5、0.8×10−5、1.2×10−5、1.6×10−5、2.0×10−5、2.4×10−5、2.8×10−5、3.2×10−5、3.6×10−5和4.0×10−5 mol/L。Figure 5. Ultraviolet absorption spectrum of the interaction between EGCG-BSA complex and taste nucleotide2.3.2 呈味核苷酸与EGCG蛋白络合物相互作用的荧光发射图
EGCG的酚羟基可与BSA的酰胺基团生成氢键使荧光强度降低,IMP、GMP的加入使其发生不同变化,可证明呈味核苷酸会与EGCG蛋白络合物发生反应,使其稳定性发生改变从而影响荧光特性。
如图6结果显示,添加不同浓度的IMP、GMP对BSA的荧光强度无明显影响,说明两种呈味核苷酸均不与BSA发生相互作用;但当两者混合加入后,荧光强度随浓度的升高有规律地淬灭而不改变峰形,表明IMP-GMP混合后会与BSA发生相互作用,荧光淬灭效应是由荧光复合物形成引起的;D、E、F三图结果显示,BSA-EGCG-GMP混合体系中随着GMP浓度的增加,荧光强度上升,峰的位置也向短波长方向移动;BSA-EGCG-IMP-GMP混合体系中,随着IMP-GMP浓度的增加,荧光强度却呈现规律性淬灭。
2.3.3 呈味核苷酸与EGCG蛋白络合物相互作用荧光淬灭类型,结合常数及结合位点
根据Steam-Volmer方程对混合物的淬灭类型进行判断,呈味核苷酸对BSA荧光淬灭图的斜率校正后分别为2.5303×1014、2.5611×1014和6.7996×1013;呈味核苷酸对EGCG蛋白络合物荧光淬灭图的斜率校正后分别为1.4570×1014、−1.94140×1014和4.8194×1013。BSA-EGCG-GMP混合体系中斜率出现负数的原因可从图6(E)中得到,由于GMP的加入,破坏了BSA与EGCG的络合,BSA与EGCG结合变小,恢复了部分荧光强度。除上述情况外,Kq均大于2 ×1010 ( mol/L ) −1s−1,属于静态猝灭。通过图7、图8也可知,在两种核苷酸同时存在时,不论其与BSA还是与BSAE-GCG络合物,拟合度都更高,说明当IMP、GMP同时存在时反应更为明显。基于以上结论,计算IMP、GMP同时存在时混合物的结合常数KA及结合位点数n(如表1),BSA+IMP+GMP的结合常数为0.66388,结合位点数n约为0.88;BSA+EGCG+IMP+GMP的结合常数为1.10536,结合位点数n约为1.49。
表 1 结合常数KA及结合位点数nTable 1. Binding constant KA and number of binding sites n类型 KA/(L·mol−1) n R2 BSA+IMP+GMP 0.66388±0.0362 0.8793±0.0860 0.97869 BSA+EGCG+IMP+GMP 1.10536±0.0711 1.49316±0.0338 0.97564 3. 讨论与结论
一定程度的涩味被认为是高品质茶叶的表现[26],但茶多酚含量过高则会降低茶汤的适口性[27]。本文通过光谱法探究呈味核苷酸与EGCG及EGCG蛋白络合物的相互作用。紫外可见光谱结果显示: IMP、GMP、IMP-GMP均可改变EGCG的紫外吸收特性,GMP的作用效应强于IMP,两者混合对EGCG的作用效果最明显。混合体系只存在一种结合方式,结合常数分别为0.01086、0.10835、0.03915,线性关系良好。推测此结果是EGCG的酚羟基与呈味核苷酸的双键氧形成氢键,增加了芳香环上的π电子云的强度,导致增色效应。
呈味核苷酸对EGCG的蛋白络合物也存在不同的相互作用:首先,IMP、GMP均不与BSA发生反应,但当两者同时存在时,BSA荧光强度规律性淬灭,说明两种呈味核苷酸同时存在时增大了荧光基团环境的疏水性,极性变小,随浓度增大,BSA荧光强度规律淬灭,结合常数为0.66388,结合位点数约为0.88,小檗淫羊藿甙与清蛋白分子间的相互作用也存在相似结论[28]。在EGCG与BSA的络合反应中,除发现随着GMP浓度的增大,荧光强度增大且发生蓝移外,其余均为静态淬灭。结合紫外吸收光谱的结论,是由于GMP与EGCG相互作用后使得EGCG与BSA复合物解体,释放出部分BSA,使得荧光强度恢复;当两种呈味核苷酸同时存在时,随着浓度增大,混合体系的荧光强度呈现规律性淬灭,说明在与EGCG蛋白络合物的反应中,IMP-GMP对BSA的荧光淬灭作用为主要作用,混合体系的结合常数为1.10536,结合位点数约为1.49。
光谱法结论证明:IMP、GMP与EGCG会发生相互作用,改变EGCG的光谱特性,且只存在一种结合方式,GMP与EGCG相互作用的效应强于IMP与EGCG的相互作用,两种呈味核苷酸1:1混合时对EGCG影响最大。
茶汤作为一个复杂体系,本研究结果只能解释呈味核苷酸会与EGCG及其蛋白络合物发生相互作用,但其混合体系中具体发生反应的部位尚未清楚,在茶汤中是否会与其他物质发生其他相互作用也不得而知,本实验只是对茶叶中呈味核苷酸的初步探究,而且由于光谱法对于复杂体系、多种物质的相互作用还无法全面解释,今后的研究中应当继续引入新的研究方法,解释存在的疑问,为解释茶叶的滋味提供理论基础,为茶叶品质提升、茶饮料风味改善有重要作用。
-
图 5 EGCG-BSA络合物与呈味核苷酸相互作用的紫外吸收光谱图
注: EGCG浓度为2.0×10−5 mol/L ;BSA浓度为2.0×10−6 mol/L ;a~k:表示呈味核苷酸的浓度为: 0、0.4×10−5、0.8×10−5、1.2×10−5、1.6×10−5、2.0×10−5、2.4×10−5、2.8×10−5、3.2×10−5、3.6×10−5和4.0×10−5 mol/L。
Figure 5. Ultraviolet absorption spectrum of the interaction between EGCG-BSA complex and taste nucleotide
表 1 结合常数KA及结合位点数n
Table 1 Binding constant KA and number of binding sites n
类型 KA/(L·mol−1) n R2 BSA+IMP+GMP 0.66388±0.0362 0.8793±0.0860 0.97869 BSA+EGCG+IMP+GMP 1.10536±0.0711 1.49316±0.0338 0.97564 -
[1] 邱伟强, 谢晶, 陈舜胜, 等. 虾类冷藏期间ATP关联产物含量的变化及其降解途径的研究[J]. 现代食品科技,2015,31(10):103−108. [QIU W Q, XIE J, CHEN S S, et al. Changes of ATP-related compounds contents and its degradation pathways in shrimps during chilled storage[J]. Modern Food Science and Technology,2015,31(10):103−108. [2] 于文清, 彭艳芳, 许迎迎, 等. 五种野生食用菌干品营养及鲜味成分分析和评价[J]. 天然产物研究与开发,2015,27(2):271−276. [YU W Q, PENG Y F, XU Y Y, et al. Analysis and evaluation of nutritional and flavor components of five wild dried edible fungi[J]. Natural Product Research and Development,2015,27(2):271−276. [3] FUKE S, UEDA Y. Interactions between umami and other flavor characteristics[J]. Trends in Food Science & Technology,1996,7(12):407−411.
[4] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β -lactoglobulin complexes with tea polyphenols[J]. Food Chemistry,2011,127(3):1046−1055. doi: 10.1016/j.foodchem.2011.01.079
[5] NICOLA J B, TERENCE H L, EDWIN H, et al. Multiple Interactions between polyphenols and a salivary proline-rich protein[J]. Complexation and Precipitation Biochemistry,1997,36(18):5566−5577.
[6] 宋亚赛. 绿茶苦涩味的化学成分及其相互作用研究[D]. 合肥: 安徽农业大学, 2016. SONG Y S, Analysis on chemical components of bitterness and astringency in green tea & interation between taste-active components[D]. Hefei: Anhui Agricultural University, 2016.
[7] 岳翠男. 绿茶滋味物质研究及审评参考物模型的建立[D]. 重庆: 西南大学, 2017. YUE C N, Establishment of reference material model of green tea based on its taste material research[D]. Chongqing: Southwestern University, 2017.
[8] 张春花, 单治国, 满红平, 等. 对相同鲜叶加工的不同类茶品化学成分含量的差异性研究[J]. 现代园艺,2020,43(9):22−24. [ZHANG C H, SHAN Z G, MAN H P, et al. Study on the difference of chemical composition content of different tea products processed from the same fresh leaves[J]. Xiandai Horticulture,2020,43(9):22−24. doi: 10.3969/j.issn.1006-4958.2020.09.010 [9] YANG C, HU Z, LU M, et al. Application of metabolomics profiling in the analysis of metabolites and taste quality in different subtypes of white tea[J]. Food Research International,2018,106:909. doi: 10.1016/j.foodres.2018.01.069
[10] 陈翔, 田月月, 张丽霞. 基于亲水相互作用液相色谱-三重四极杆质谱法研究白茶萎凋过程中代谢物的变化[J]. 茶叶科学,2020,40(2):238−249. [CHEN X, TIAN Y Y, ZHANG L X. The changes of metabolites during the withering process of white tea based on HILIC LC-QqQ MS method[J]. Journal of Tea Science,2020,40(2):238−249. doi: 10.3969/j.issn.1000-369X.2020.02.010 [11] PRIYADARSHINI C, ABHI P, BHATTACHARYYA D K, et al. Quality appraisal of Labeo rohita Roe protein concentrate and characterization of the roe protein concentrate-based extruded munchies[J]. Aquatic Food Product Technology,2020,29(9):871−885. doi: 10.1080/10498850.2020.1818017
[12] BEHRENS M, MEYERHOF W, HELLFRITSCH C, et al. Sweet and umami taste: Natural products, their chemosensory targets, and beyond[J]. Chemistry of Taste,2011,50:2220−2242.
[13] 王珂雯, 廖小军, 徐贞贞. 多酚-蛋白质相互作用分析技术研究进展[J]. 食品工业科技,2021,42(14):371−379. [WANG K W, LIAO X J, XU Z Z. Advances in analytical techniques of polyphenol-protein interaction[J]. Modern Food Science and Technology,2021,42(14):371−379. [14] 孟丽艳, 屈凌波, 杨冉, 等. 紫外吸收光谱和荧光光谱法研究大黄酚与牛血清白蛋白相互作用机制[J]. 理化检验(化学分册),2009,45(10):1169−1173. [MENG L Y, QU L B, YANG R, et al. Study on the interaction mechanism between chrysophanol and bovine serum albumin by ultraviolet absorption spectroscopy and fluorescence spectroscopy[J]. Physical Testing and Chemical Analysis(Part B:Chemical Analysis),2009,45(10):1169−1173. [15] JOSEPH J S. Drug-protein interactions: Two-site binding of heterocyclic ligands to a monomeric hemoglobin[J]. Inorganic Biochemistry,1996,62(3):155−169. doi: 10.1016/0162-0134(95)00144-1
[16] HUANG R, VIVEKANANDAN S, BRENDER J R, et al. NMR Characterization of monomeric and oligomeric conformations of human calcitonin and its interaction with EGCG[J]. Molecular Biology,2012,416(1):108−120. doi: 10.1016/j.jmb.2011.12.023
[17] 赵钜阳, 姚恒喆, 石长波. 多酚与蛋白质相互作用及其对蛋白质影响[J]. 食品与生物技术学报,2020,39(12):14−20. [ZHAO J Y, YAO H J, SHI C B. The interaction between polyphenols and proteins and their effects on proteins[J]. Journal of Food Science and Biotechnology,2020,39(12):14−20. doi: 10.3969/j.issn.1673-1689.2020.12.003 [18] SUI X, SUN H, QI B, et al. Functional and conformational changes to soy proteins accompanying anthocyanins: Focus on covalent and non-covalent interactions[J]. Food Chemistry,2018,245:871−878. doi: 10.1016/j.foodchem.2017.11.090
[19] 姚其凤, 吴正奇, 陈小强, 等. 茶多酚-蛋白质相互作用的研究进展[J]. 食品工业科技,2019,40(8):337−342. [YAO Q F, WU Z Q, CHEN X Q, et al. Research progress on tea polyphenol-protein interaction[J]. Science and Technology of Food Industry,2019,40(8):337−342. [20] 王进. 绿茶中EGCG提取纯化方法及其与牛血清蛋白相互作用的研究[D]. 泰安: 山东农业大学, 2009. WANG J. Purification of EGCG from green tea and its interaction with bovine serum albumin[D]. Tai’an: Shandong Agricultural University, 2009.
[21] LI S, YAO D, BIAN H, et al. Interaction between plumbagin and human serum albumin by fluorescence spectroscopy[J]. Journal of Solution Chemistry,2011,40(4):709−718. doi: 10.1007/s10953-011-9666-6
[22] 张冰卫, 李博, 夏文水, 等. 用荧光光谱法研究分子间结合常数和结合位点数时的公式选择[J]. 药学进展,2011,35:296−303. [ZHANG B W, LI B, XIA W B, et al. Selection of models in the calculation of binding constants in the study of interaction between molecules by fluorescence spectroscopy[J]. Progress in Pharmaceutical Sciences,2011,35:296−303. [23] ZHANG H, HUANG X, ZHANG M. Spectral diagnostics of the interaction between pyridoxine hydrochloride and bovine serum albumin in vitro[J]. Molecular Biology Reports,2008,35(4):699−705. doi: 10.1007/s11033-007-9143-x
[24] 丁奇. 鸡汤及鸡肉酶解液中鲜味成分的测定与对比分析[D]. 北京: 北京工商大学, 2017. DING Q. Determination and analysis of umami components from chicken soup and chicken enzymatic hydrolysate[D]. Beijing: Beijing Technology and Business University, 2017.
[25] 王婧. 多酚类化合物与牛血清蛋白相互作用的研究[D]. 杭州: 浙江工业大学, 2013. WANG J. The study of the interaction of polyphenolic compounds with bovine serum protein[D]. Hangzhou: Zhejiang University of Technology, 2013.
[26] 金孝芳, 罗正飞, 童华荣. 绿茶茶汤中主要滋味成分及滋味定量描述分析的研究[J]. 食品工业科技,2012,33(7):343−346. [JIN X F, LUO Z F, TONG H R. Study on main taste compounds and quantitative descriptive analysis of taste in green tea infusion[J]. Science and Technology of Food Industry,2012,33(7):343−346. [27] YAMAGUCHI S, NINOMIYA K. Umami and food palatability[J]. Journal of Nutrition,2000,130(4):921−926. doi: 10.1093/jn/130.4.921S
[28] 赵晓雪, 郭明, 王燕. 荧光光谱法及物理模建分析小檗淫羊藿甙与清蛋白的分子间作用[J]. 光谱学与光谱分析,2018,38(11):3420−3427. [ZHAO X X, GUO M, WANG Y. Study on the intermolecular interaction of icarrin with human serum albumin based on fluorescence spectrometry and physical modeling[J]. Spectroscopy and Spectral Analysis,2018,38(11):3420−3427.





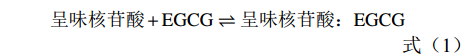

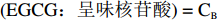
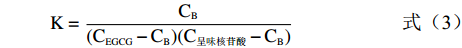
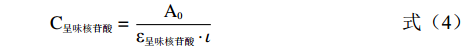

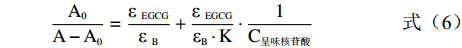
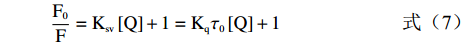
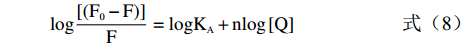

 下载:
下载:







 下载:
下载:
