Study on Mutation Breeding of High-Yield Bacteriocin Lactobacillus plantarum by Heavy Ion Beam Irradiation
-
摘要: 采用重离子束12C6+对产细菌素植物乳杆菌Lp1进行辐照选育,分析比较了不同辐照剂量下致死率和突变率,并通过双层琼脂扩散法筛选高产细菌素突变菌株。在辐照剂量300 Gy时,出发菌株植物乳杆菌Lp1的致死率和正突变率分别为86.3%和28.28%。在300 Gy辐照菌悬液中,分离筛选出高产细菌素突变菌株Lp092、Lp085,以大肠埃希氏菌为指示菌抑菌圈直径比出发菌株Lp1分别扩大了20.64%、19.36%,以金黄色葡萄球菌为指示菌抑菌圈直径比出发菌株Lp1分别扩大了17.16%、14.14%,经过连续传代5次实验,2株菌株Lp092、Lp085均具有良好的产细菌素遗传稳定性。Abstract: The heavy ion beam of 12C6+ was used to irradiate the original strain Lactobacillus plantarum Lp1 of bacteriocin-producing. The lethality and mutation rate of theoriginal strain Lp1 at different irradiation doses were analyzed and compared, and the mutant strains with high bacteriocin production were screened by double layer agar diffusion method. At the irradiation dose of 300 Gy, the lethality rate and positive mutation rate of the original strain Lp1 were 86.3% and 28.28%, respectively.In the 300 Gy irradiation bacterial suspension, mutant strains Lp092 and Lp085 with high bacteriocin production were isolated and screened, the diameters of inhibition zones of Escherichia coli as the indicator bacteria were increased by 20.64%, 19.36%, the diameters of inhibition zones of staphylococcus aureus as the indicator bacteria were increased by 17.16%, 14.14% than the original strain Lp1, respectively.After 5 times successive generations, 2 strains Lp092 and Lp085 have good genetic stability for bacteriocin production.
-
Keywords:
-
Lactobacillus plantarum
- bacteriocin /
- heavy ion beam /
- irradiation /
- mutation breeding
-
Lactobacillus plantarum
-
乳酸菌是国内外公认的对人类健康有益的食品级微生物,被广泛应用于食品、医药、农业等领域[1-3]。乳酸菌细菌素是乳酸菌通过核糖体途径产生的具有抗菌活性的肽和蛋白类物质,具有高效、安全无毒、无残留、无抗药性等优点,可以防止食品中腐败菌和病原菌的生长[4-7],已商品化的乳酸菌细菌素十分有限,仅限于Nisin和Pediocin PA-1等[8],生物合成量低也是细菌素应用受限的主要原因之一[9]。国内外许多实验室正致力于从不同原料中筛选高产菌株、发酵培养基和发酵条件优化、诱变育种、原生质体融合、基因工程方法、群体感应系统调控等方面提高乳酸菌细菌素合成量,开展乳酸菌细菌素的研究、开发与利用[10-13],大范围的收集、筛选乳酸菌株,挖掘广谱、高效的乳酸菌细菌素已经成为生物防腐剂研究领域中正在研究的热点[14-17]。甘肃牧区具有独特的生态环境,当地少数民族牧民沿用传统制作方法制作的发酵乳品,作为自然长期驯化乳酸菌的载体,含有丰富的乳酸菌资源[18-19]。
针对从传统发酵乳制品中初步分离筛选的乳酸菌细菌素产量偏低、基因工程菌公众接受度低等商业化瓶颈,本研究以甘肃牧区传统发酵乳制品中分离筛选出的产细菌素植物乳杆菌Lp1作为出发菌株,应用相比传统诱变源具有高突变率、广突变谱的重离子束辐照微生物育种技术[20-24],开展产细菌素植物乳杆菌重离子束辐照诱变育种及其突变株产细菌素性能遗传稳定性研究,解决前期分离筛选的乳酸菌产细菌素量偏低的问题,建立和优化产细菌素植物乳杆菌重离子束辐照诱变育种研究方法,为选育高产细菌素植物乳杆菌提供一定的参考依据。
1. 材料与方法
1.1 材料与仪器
出发菌:植物乳杆菌Lp1(Lactobacillus plantarum Lp1) 分离自甘南牧区牦牛酸奶,指示菌:大肠埃希氏菌(Escherichia coli)ATCC25922、金黄色葡萄球菌(Staphylococcus aureus)CMCC26003 甘肃省科学院生物研究所食品生物技术室保藏;MRS肉汤、MRS琼脂、营养肉汤(NB)、营养琼脂(NA)培养基 青岛海博生物技术有限公司。
JA2003N 电子天平 上海精密仪器有限公司;DELTA 320 pH计 梅特勒-托利多(METTLER TOLEDO)集团;DG-1 多功能培养箱 上海医疗器械修造厂;LDZF-75L-II 立式高压蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-2D 超净工作台 苏州净化设备有限公司;BH-2 显微镜 日本奥林巴斯(中国)有限公司;HiCC-S1型全自动菌落计数及抑菌圈测量仪 杭州万深检测科技有限公司;动菌落计数及抑菌圈测量仪 杭州万深检测科技有限公司。
1.2 实验方法
1.2.1 重离子束12C6+辐照诱变
将甘油法保藏的出发菌株植物乳杆菌Lp1接种于MRS肉汤培养基,37 ℃恒温活化、扩大培养后,在无菌条件下将待辐照菌悬液1.5 mL置于35 mm无菌塑料平皿中,利用中科院近代物理所重离子加速器浅层辐照终端提供的80 MeV/u,剂量率20 Gy/min 的12C6+重离子束进行辐照处理[25],辐照剂量分别为 0(CK)、50、100、150、200、300 Gy,每个剂量设置3个平行。
1.2.2 重离子束12C6+辐照致死率及正、负突变率测定
1.2.2.1 辐照致死率测定
将不同剂量辐照后的菌悬液10倍系列稀释后,选择适宜稀释度,采用平板倾注法,用MRS琼脂进行菌落计数,每个稀释度3个平行,37 ℃恒温倒置培养48 h。菌落计数参照GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定。
辐照致死率(%)=(1−辐照处理组菌液活菌数对照组菌液活菌数)×100 1.2.2.2 辐照正、负突变率测定
将不同剂量辐照后的菌悬液10倍系列稀释后,选择适宜稀释度的稀释匀液,采用涂布平板法,在MRS琼脂平板37 ℃恒温倒置培养24~48 h,挑选出所有单菌落,分别接入装有10 mL MRS肉汤培养基的试管中,37 ℃恒温静置培养24 h后,4 ℃静置24 h。以大肠埃希氏菌为指示菌对分离菌株发酵上清液进行抑菌试验,统计分离得到菌株总数和与出发菌株抑菌圈直径比较变化大于10%的分离菌株数,进行正负突变率计算。
辐照正突变率(%)=突变株抑菌圈直径大于出发菌株抑菌圈直径10%的菌株数分离得到总菌株数×100 辐照负突变率(%)=突变株抑菌圈直径小于出发菌株抑菌圈直径10%的菌株数分离得到总菌株数×100 1.2.3 高产细菌素乳酸菌突变株筛选
1.2.3.1 初筛
将重离子束辐照后菌悬液,稀释一定浓度,采用涂布平板法,在MRS琼脂平板37 ℃培养24~48 h,无菌条件下挑出单个菌落,接入装有10 mL MRS 肉汤培养基的试管中,37 ℃恒温培养24 h后,4 ℃静置24 h,取发酵上清液以大肠埃希氏菌为指示菌进行抑菌试验,测量抑菌圈直径,挑选正突变株进行保藏[26]备用。
1.2.3.2 复筛
初筛的正突变株用MRS 肉汤培养基于37 ℃培养24 h,8000 r/min离心10 min,收集上清液。上清液用1 mol/L NaOH调pH至5.5,排除有机酸的干扰;再在80 ℃保温10 min,排除过氧化氢的干扰;最后经0.22 μm滤膜过滤除菌[27]备用。以大肠埃希氏菌和金黄色葡萄球菌为指示菌对上述处理后上清液分别进行抑菌试验,测量抑菌圈直径,挑选对2种指示菌抑菌圈直径均大于出发菌抑菌圈直径的突变株为复筛菌株进行保藏。
1.2.3.3 高产细菌素乳酸菌突变株遗传稳定性测试
将复筛的高产细菌素乳酸菌突变株接种于MRS肉汤培养基,37 ℃恒温培养24 h,连续传代5次,对每一代菌株发酵液按1.2.4的方法处理后进行抑菌实验,测定抑菌圈直径,评价突变株遗传稳定性[28]。
1.2.4 抑菌实验
采用双层琼脂扩散法[29],在水平放置的无菌培养皿中先加入10 mL灭菌后冷却至50 ℃左右的1%琼脂水溶液,至完全凝固后均匀摆放6个牛津杯,再加入15 mL含大肠埃希氏菌或金黄色葡萄球菌约106 CFU/mL的48 ℃左右的营养琼脂培养基,等完全凝固后取出牛津杯,在形成的圆孔内,3个孔分别滴加分离菌株待测样液100 μL,其余3个孔分别滴加出发菌株待测样液100 μL,37 ℃培养20 h,用HiCC-S1型全自动菌落计数及抑菌圈测量仪测定抑菌圈直径。
1.3 数据处理
所有数据采用Micorsoft Excel 2019软件进行统计分析,数据以平均值±标准偏差表示。
2. 结果与分析
2.1 辐照剂量对致死率的影响
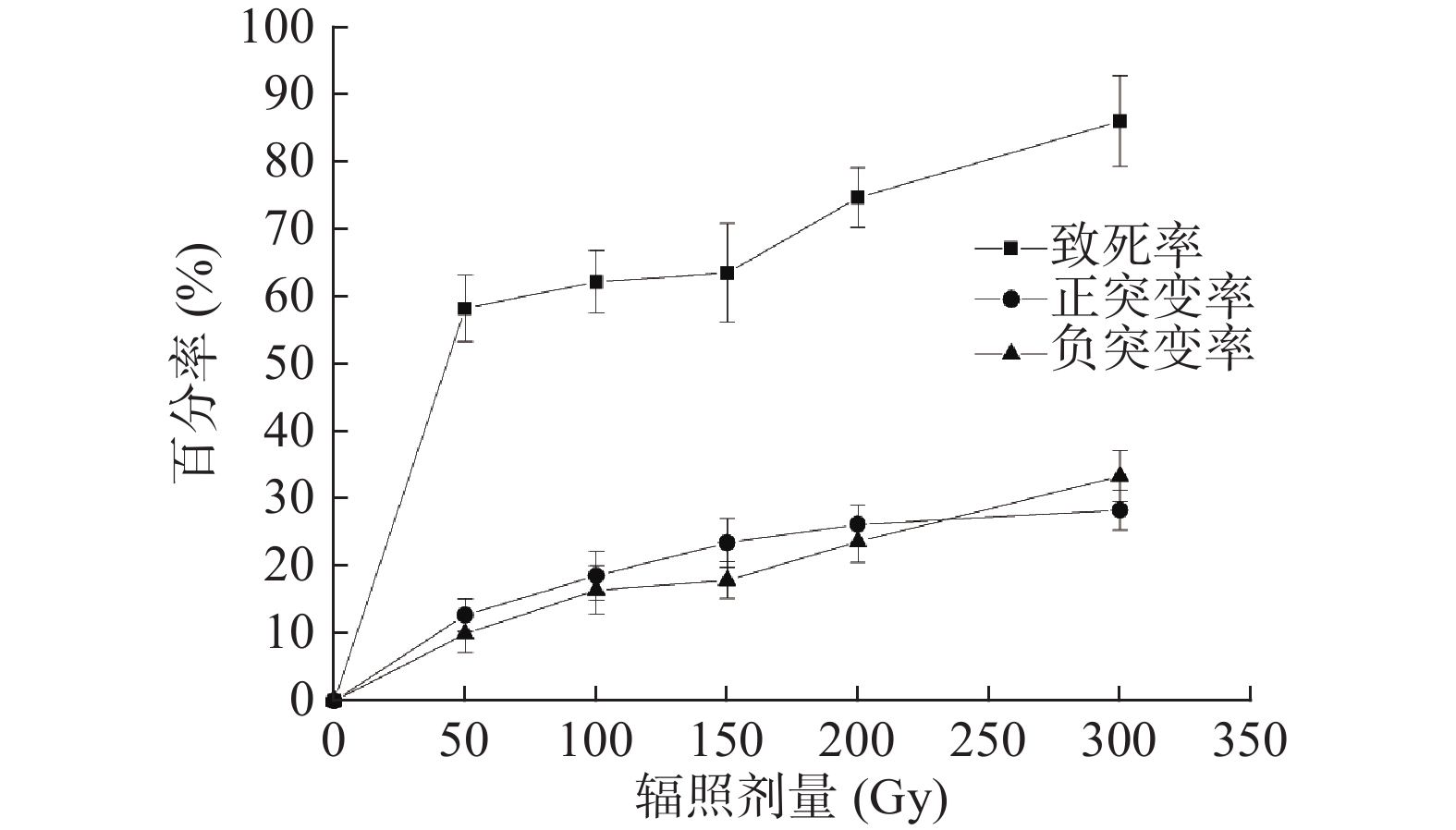
对重离子束12C6+不同剂量辐照后的植物乳杆菌Lp1菌悬液,采用倾注平板法菌落计数,计算出各个辐照剂量致死率,以辐照剂量为横坐标,致死率为纵坐标,绘制致死率曲线。结果如图1所示,出发菌株植物乳杆菌Lp1对重离子束的辐照较为敏感,通过不同剂量的重离子束12C6+辐照后,随着重离子束辐照剂量的增大,诱变致死率不断升高。在整个辐照试验中,当辐照剂量从50 Gy升高至300 Gy时,出发菌株植物乳杆菌Lp1的致死率从58.62%上升至86.3%,致死率提高了27.68%。其中,当辐照剂量从50 Gy升高至150 Gy时致死率提高了5.83%,剂量从150 Gy升高至300 Gy时致死率提高了21.85%。本次研究最大辐照剂量为300 Gy,植物乳杆菌Lp1的致死率达到了86.3%,如果想得到更高致死率剂量,可以在大于300 Gy的重离子束辐照剂量下再进一步增大辐照剂量来研究[30-31]。
2.2 辐照剂量对正负突变率的影响
在分离菌株发酵上清液抑菌试验中,将与出发菌株抑菌圈直径比较变化大于10%的菌株定义为突变菌株,抑菌圈直径比较变化在10%内的菌株定义为非突变菌株,统计分离的正负突变株菌株数和总菌数。以辐照剂量为横坐标,正、负突变率为纵坐标,绘制正、负突变率随辐照剂量的变化曲线。正、负突变率曲线如图1所示,菌株的正突变率随着辐照剂量的增大逐步提升,当辐照剂量为 300 Gy时,正突变率达到28.28%,相比其它辐照剂量可筛选得到较多正突变菌株,试验结果表明在本次研究设置辐照剂量下,重离子束12C6+辐照最佳剂量为300 Gy。菌株的负突变率也随着辐照剂量的增加而升高,辐照剂量为300 Gy时,负突变率达到33.33%。在 300 Gy时,正、负突变率均达到最高,同时致死率也达到86.3%。根据相关诱变研究得到的现代育种理论表明,当被诱变微生物致死率为 70%~80%时,所采用的辐照剂量下,菌株更容易出现较高的正突变菌株,当在更高的致死率下,虽然突变率可能较高,但在此情况下,正、负突变率都会较高[32-33]。
2.3 高产细菌素乳酸菌突变菌株筛选
2.3.1 初筛
对重离子束12C6+ 300 Gy剂量辐照后的出发菌株Lp1菌悬液稀释液涂布平板,分离单菌落,以大肠埃希氏菌为指示菌,对分离菌株发酵上清液进行抑菌试验,分离出了抑菌圈直径大于出发菌株抑菌圈直径10%的正突变株28株。出发菌株Lp1的平均抑菌圈直径为(15.57±0.41)mm,从正突变菌株中再选出抑菌圈直径大于出发菌株抑菌圈直径15%的菌株9株,结果见表1。由表1可知,初筛的9株菌株其抑菌圈直径较出发菌株抑菌圈直径提高了16.83%~20.55%,均与出发菌株Lp1对大肠埃希氏菌的平均抑菌圈直径差异极显著(P<0.01)。
表 1 重离子辐照诱变植物乳杆菌Lp1初筛突变株Table 1. Positve mutation strains of Lactobacillus plantarum Lp1 of preliminary screening菌株编号 抑菌圈直径(mm) Lp1 15.57±0.41 L001 18.32±0.53** L002 18.25±0.51** L028 18.25±0.54** L045 18.19±0.08** L057 18.39±0.93** L058 18.37±0.54** L066 18.48±0.48** L085 18.77±0.47** L092 18.50±0.62** 注:**:表示差异极显著,P<0.01;表2同。 2.3.2 复筛
对初筛出的9株菌株进行复筛,9株菌株发酵液经除有机酸、过氧化氢、菌体处理后,以大肠埃希氏菌、金黄色葡萄球菌分别为指示菌,进行抑菌圈试验,结果见表2。由表2 可知,初筛的9株突变株发酵液排除有机酸、过氧化氢、菌体干扰后,仍有明显抑菌效果。复筛出2株抑菌圈较大菌株,L092菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径分别为(16.95±0.53)、(17.48±0.54)mm,比出发菌株Lp1对大肠埃希氏菌和金黄色葡萄球菌的抑菌圈直径提高20.64%和17.16%。L085菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径分别为(16.77±0.23)、(17.03±0.23)mm,比出发菌株Lp1对大肠埃希氏菌和金黄色葡萄球菌的抑菌圈直径提高19.36%和14.14%。L092、L085菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径与出发菌株抑菌圈直径差异极显著(P<0.01)。
表 2 重离子辐照诱变植物乳杆菌Lp1复筛突变株Table 2. Positve mutation strains of Lactobacillus plantarum Lp1 of secondary screening菌株编号 抑菌圈直径(mm) 大肠埃希氏菌 金黄色葡萄球菌 Lp 1 14.05±0.22 14.92±0.41 L001 15.85±0.24 16.65±0.22 L002 15.25±0.21 16.79±0.27 L028 16.17±0.55 16.71±0.25 L045 16.01±0.37 16.36±0.22 L057 16.59±0.21 16.77±0.23 L058 16.17±0.33 16.76±0.15 L066 16.61±0.39 16.87±0.15 L085 16.77±0.28** 17.03±0.14** L092 16.95±0.17** 17.48±0.50** 2.4 高产细菌素突变菌株遗传稳定性
为了验证复筛高产细菌素突变菌株遗传稳定性,对复筛菌株Lp085、Lp092进行遗传稳定性试验,37 ℃恒温,MRS 肉汤培养基的试管中培养24 h,连续传代5次,菌株每一代发酵液均经除有机酸、过氧化氢、菌体处理后进行抑菌圈试验,结果如表3所示,2株复筛菌株Lp085、Lp092连续传代5次,Lp092菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径分别在 16.41~16.95、16.66~17.48 mm,Lp085菌株对大肠埃希氏菌、金黄色葡萄球菌待抑菌圈直径分别在 16.01~16.77、16.36~17.03 mm,连续传代5次,各代的抑菌圈直径变化均在5%之内,说明菌株Lp085、Lp092具有较稳定的产细菌素遗传特性。
表 3 复筛突变株突的遗传稳定性研究Table 3. Genetic stability of mutant strain of secondary screening传代次数 L085菌株抑菌圈直径(mm) L092菌株抑菌圈直径(mm) 大肠埃希氏菌 金黄色葡萄球菌 大肠埃希氏菌 金黄色葡萄球菌 1 16.77±0.28 17.03±0.14 16.95±0.17 17.48±0.50 2 16.85±0.31 16.65±0.51 16.73±0.32 17.15±0.53 3 16.25±0.34 16.79±0.44 16.55±0.21 16.79±0.11 4 16.17±0.44 16.71±0.53 16.23±0.23 16.81±0.45 5 16.01±0.25 16.36±0.23 16.41±0.42 16.66±0.27 3. 结论
采用重离子束12C6+对产细菌素乳酸菌出发菌株植物乳杆菌Lp1进行辐照选育,辐照剂量在50~300 Gy时,致死率呈上升趋势,出发菌株植物乳杆菌Lp1的致死率从58.62%上升至86.3%。在辐照剂量300 Gy时,出发菌株植物乳杆菌Lp1的正突变率为28.28%,负突变率为33.33%。在辐照剂量300 Gy菌悬液中选育出高产细菌素突变菌株Lp085、Lp092,Lp092对大肠埃希氏菌、金黄色葡萄球菌待抑菌圈直径分比出发菌株Lp1抑菌圈直径提高21.40%、18.9%;Lp085对大肠埃希氏菌、金黄色葡萄球菌待抑菌圈直径比出发菌株Lp1抑菌圈直径提高 20.27%、16.91%。经过连续传代5次试验,2株菌株Lp085、Lp092均具有良好的产细菌素遗传稳定性。本研究表明,利用重离子束12C6+辐照产细菌素乳酸菌可以得到高产细菌素的突变菌株,可用于高产细菌素乳酸菌种的选育,为高产细菌素乳酸菌选育提供了一定理论依据和试验基础。
-
表 1 重离子辐照诱变植物乳杆菌Lp1初筛突变株
Table 1 Positve mutation strains of Lactobacillus plantarum Lp1 of preliminary screening
菌株编号 抑菌圈直径(mm) Lp1 15.57±0.41 L001 18.32±0.53** L002 18.25±0.51** L028 18.25±0.54** L045 18.19±0.08** L057 18.39±0.93** L058 18.37±0.54** L066 18.48±0.48** L085 18.77±0.47** L092 18.50±0.62** 注:**:表示差异极显著,P<0.01;表2同。 表 2 重离子辐照诱变植物乳杆菌Lp1复筛突变株
Table 2 Positve mutation strains of Lactobacillus plantarum Lp1 of secondary screening
菌株编号 抑菌圈直径(mm) 大肠埃希氏菌 金黄色葡萄球菌 Lp 1 14.05±0.22 14.92±0.41 L001 15.85±0.24 16.65±0.22 L002 15.25±0.21 16.79±0.27 L028 16.17±0.55 16.71±0.25 L045 16.01±0.37 16.36±0.22 L057 16.59±0.21 16.77±0.23 L058 16.17±0.33 16.76±0.15 L066 16.61±0.39 16.87±0.15 L085 16.77±0.28** 17.03±0.14** L092 16.95±0.17** 17.48±0.50** 表 3 复筛突变株突的遗传稳定性研究
Table 3 Genetic stability of mutant strain of secondary screening
传代次数 L085菌株抑菌圈直径(mm) L092菌株抑菌圈直径(mm) 大肠埃希氏菌 金黄色葡萄球菌 大肠埃希氏菌 金黄色葡萄球菌 1 16.77±0.28 17.03±0.14 16.95±0.17 17.48±0.50 2 16.85±0.31 16.65±0.51 16.73±0.32 17.15±0.53 3 16.25±0.34 16.79±0.44 16.55±0.21 16.79±0.11 4 16.17±0.44 16.71±0.53 16.23±0.23 16.81±0.45 5 16.01±0.25 16.36±0.23 16.41±0.42 16.66±0.27 -
[1] Moradi M, Kousheh S, Almasi H, et al. Postbiotics produced by lactic acid bacteria: The next frontier in food safety[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(6):3390−3415. doi: 10.1111/1541-4337.12613
[2] Lübeck M, Lübeck PS. Application of lactic acid bacteria in green biorefineries[J]. FEMS Microbiol Lett,2019,366(3):1−8.
[3] 杜兰威, 单蕊, 赵蕾, 等. 乳酸菌的功能及其在食品工业中的应用[J]. 食品研究与开发,2019,40(13):221−224. [4] 彭书东, 李键, 刘士健, 等. 乳酸菌细菌素生物合成机制、抑菌机制及应用研究进展[J]. 食品与发酵工业,2019,45(6):236−242. [5] Ołdak A, Zielińska D. Bacteriocins from lactic acid bacteria as an alternative to antibiotics[J]. Postepy Hig Med Dosw,2017,71(1):328−338.
[6] Chikindas ML, Weeks R, Drider D, et al. Functions and emerging applications of bacteriocins[J]. Current Opinion in Biotechnology,2018,49:23−28. doi: 10.1016/j.copbio.2017.07.011
[7] Alvarez-Sieiro P, Montalbán-López M, Mu D, et al. Bacteriocins of lactic acid bacteria: Extending the family[J]. Applied Microbiology and Biotechnology,2016,100(7):2939−2951. doi: 10.1007/s00253-016-7343-9
[8] Le Blay G, Lacroix C, Zihler A, et al. In vitro inhibition activity of nisin A, nisin Z, pediocin PA-1 and antibiotics against common intestinal bacteria[J]. Letters in Applied Microbiology,2007,45(3):252−257. doi: 10.1111/j.1472-765X.2007.02178.x
[9] 章检明, 任璐雅, 易华西, 等. 乳酸菌细菌素的高效表达方法研究[J]. 中国酿造,2014,33(7):29−33. doi: 10.11882/j.issn.0254-5071.2014.07.006 [10] Kaur G, Singh TP, Malik RK, et al. Antibacterial efficacy of nisin, pediocin 34 and enterocin FH99 against L. monocytogenes, E. faecium and E. faecalis and bacteriocin cross resistance and antibiotic susceptibility of their bacteriocin resistant variants[J]. Journal of Food Science and Technology,2014,51(2):233−244. doi: 10.1007/s13197-011-0500-3
[11] Amortegui J, Rodríguez-López A, Rodríguez D, et al. Characterization of a new bacteriocin from Lactobacillus plantarum LE5 and LE27 isolated from ensiled corn[J]. Applied Biochemistry and Biotechnology,2014,172(7):3374−3389. doi: 10.1007/s12010-014-0757-x
[12] Sidooski T, Brandelli A, Bertoli SL, et al. Physical and nutritional conditions for optimized production of bacteriocins by lactic acid bacteria - a review[J]. Crit Rev Food SciNutr(Critical Reviews in Food Science and Nutrition),2019,59(17):2839−2849. doi: 10.1080/10408398.2018.1474852
[13] 王刚, 朱慧越, 俞赟霞, 等. 乳酸菌合成细菌素及对肠道菌群的影响[J]. 食品与发酵工业,2019,45(21):264−271. [14] Yang E, Fan L, Jiang Y, et al. Antimicrobial activity of bacteriocin-producing lactic acid bacteria isolated from cheeses and yogurts[J]. AMB Express,2012,2(1):48. doi: 10.1186/2191-0855-2-48
[15] LIM S M. Cultural conditions and nutritional components affecting the growth and bacteriocin production of Lactobacillus plantarum KC21[J]. Food Science and Biotechnology,2010,19(3):793−802. doi: 10.1007/s10068-010-0111-1
[16] Zendo T. Screening and characterization of novel bacteriocins from lactic acid bacteria[J]. Bioscience Biotechnology & Biochemistry,2013,77(5):893−899.
[17] De Vuyst L, Leroy F. Bacteriocins from lactic acid bacteria: Production, purification, and food application[J]. Journal of Molecular Microbiology & Biotechnology,2007,13(4):194−199.
[18] 文鹏程, 曹磊, 马瑞娟, 等. 甘南牧区牦牛曲拉中乳酸菌的分离、鉴定及性能研究[J]. 食品工业科技,2020,41(13):112−117. [19] 邵建宁, 张文齐, 麻和平, 等. 甘肃牧区传统发酵乳制品中优良乳酸菌的分离筛选[J]. 中国酿造,2017,36(3):75−79. doi: 10.11882/j.issn.0254-5071.2017.03.016 [20] 胡伟, 陈积红, 张珍, 等. 重离子辐照柠檬酸菌株的诱变选育[J]. 辐射研究与辐射工艺学报,2012,30(1):53−57. [21] 缪建顺, 杨建设, 张苗苗, 等. 重离子辐照微生物效应及诱变育种进展[J]. 辐射研究与辐射工艺学报,2014,32(2):3−10. [22] 陈积红, 胡伟, 李文建. 重离子束辐照在优良工业微生物新菌株创建中的应用实践[J]. 生物产业技术,2017(1):46−50. [23] 韩鹏军, 李冰, 李书至, 等. 重离子束辐照诱变及高通量筛选金霉素高产菌株[J]. 国抗生素杂志,2018,43(8):1031−1033. [24] Li RM, Wang JF Li WJ. Application of heavy ion beams to microbial mutation breeding and exploitation of biological energy[J]. Nuclear Physics Review,2007,24(3):234−237.
[25] 王雨辰, 王曙阳, 董妙音, 等. 重离子束辐照选育高产植物乳酸菌[J]. 辐射研究与辐射工艺学报,2017,35(1):52−58. [26] 王娜, 李慧, 戴伶俐, 等. 产细菌素乳酸菌的筛选与鉴定[J]. 中国食品学报,2020,20(12):248−255. [27] 任世英, 丁沈利, 王玲, 等. 产蛋白质类抑菌物质乳酸菌的分离鉴定与抑菌特性研究[J]. 生物学杂志,2018,35(3):34−38. doi: 10.3969/j.issn.2095-1736.2018.03.034 [28] 缪建顺, 曹国珍, 张苗苗, 等. 重离子束诱变选育谷氨酸高产菌株[J]. 辐射研究与辐射工艺学报,2015,33(5):39−45. [29] Eva Rodríguez, Juan L. Arqués, Raquel Rodríguez, et al. Arqués, Raquel Rodríguez, et al. Antimicrobial properties of probiotic strains isolated from breast-fed infants[J]. Journal of Functional Foods,2012,4(2):542−551. doi: 10.1016/j.jff.2012.02.015
[30] 宋道军, 姚建铭, 邵春林, 等. 离子注入微生物产生“马鞍型”存活曲线的可能作用机制[J]. 核技术,1999,2(3):129−132. doi: 10.3321/j.issn:0253-3219.1999.03.001 [31] 余增亮. 离子束与生命科学——一个新的研究领域[J]. 物理,1997,21(6):241−246. [32] 蔡聪, 姜婷, 郑兆娟, 等. 等离子体诱变凝结芽孢杆菌提高木糖利用能力高产L-乳酸[J]. 食品科学,2014,35(1):125−129. doi: 10.7506/spkx1002-6630-201401024 [33] 庞锐, 潘丽军, 姜绍通, 等. N+注入诱变选育混合糖发酵L-乳酸高产菌株[J]. 食品科学,2010,31(21):248−253.








 下载:
下载:
 下载:
下载:
