Study on Anti-aging Activity of Peptide from Antarctic Krill
-
摘要: 本文以昆明小鼠为对象,研究南极磷虾肽对光老化皮肤损伤的保护作用。将昆明小鼠随机分为空白对照组、模型对照组、南极磷虾肽P-1组及P-2组,建立光老化小鼠模型,观察小鼠造模部位的表观特征并测定相关生化指标。结果显示,与模型对照组对比,P-1及P-2组小鼠皮肤较光滑,弹性大,红斑少,更接近正常组;P-1及P-2组可以极显著抑制光老化小鼠皮肤水分流失(P<0.01),糖胺聚糖(GAG)含量增高(P<0.01),胶原含量(P<0.05)及脂质含量(P<0.05)的降低;P-1及P-2组可以显著提高小鼠血清中总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)的活力(P<0.05),显著降低丙二醛(MDA)的含量(P<0.05)。表明南极磷虾肽对小鼠光老化皮肤有显著的保护作用,为南极磷虾肽在化妆品领域的应用提供理论基础。Abstract: The objective of this study was to explore the anti-aging effects of peptide from Antarctic krill on the skin of Kunming mice. The mice were randomly set as follows: Normal control group, model control group, group of Antarctic krill peptide (P-1), group of Antarctic krill peptide (P-2). Then characteristics and biochemical criterion analyzing were measured after mice were executed. The results showed that the skin of animals in P-1 and P-2 groups was similar to that of animals in model control group, showing elastic light wrinkled. Compared with the model group, the P-1 and P-2 groups significantly reduced water loss (P<0.01), significantly decreased levels of GAG, collagen breakdown of photoaging skin and lipid loss (P<0.05); the P-1 and P-2 groups significantly enhanced activity of T-SOD, CAT, GSH-Px and decreased levels of MDA in serum (P<0.05). This study showed that peptide from Antarctic Krill could protect skin against UV irradiation-induced photodamage. It provided a theoretical basis for the application of peptide from Antarctic Krill in the field of cosmetics.
-
南极磷虾储藏量巨大,且未大规模开发。由于其特殊的生存环境,南极磷虾富含多种生物活性物质,其中氨基酸含量较高[1]。南极磷虾蛋白作为人类储量最丰富的动物蛋白库,具有巨大的应用价值及开发价值[2]。已有研究表明南极磷虾肽具有抗疲劳、耐缺氧以及抗衰老、提高免疫力等功效[3]。虽然南极磷虾肽被证实有多种功效,但目前南极磷虾肽仍然主要作为水产动物饵料应用[4],存在巨大浪费,尚需进行深度开发利用。南极磷虾主要存在于紫外线较强的南极洲,对紫外线辐射有天然的抵抗能力,但有关南极磷虾来源的活性物质抗紫外线辐射方面研究较少,尤其是南极磷虾蛋白及南极磷虾肽。海洋动物来源的蛋白肽类在抗紫外线辐射方面研究较多,如王春波等发现扇贝多肽具有抗紫外线UVA对无毛小鼠皮肤氧化损伤的作用[5];研究表明鱼皮中得到水解胶原三肽,并证明其具有促进人皮肤成纤维细胞胶原和透明质酸的生成、改善皮肤弹性的作用[6];陶宇等相关研究表明沙蛰胶原蛋白肽对光老化小鼠皮肤具有较好的保护作用[7];刘治东等发现鱿鱼皮胶原蛋白多肽对紫外线诱导的光老化模型小鼠皮肤具有防护作用等[8],这些研究均为本文提供研究基础。
衰老是生物界最基本的自然规律之一,而皮肤衰老是机体衰老最直观的表现。皮肤衰老是由内源性和外源性等多种因素引起的复杂生理过程。内源性因素往往不可避免并且机制复杂。外源性因素主要由环境因素如紫外线辐射、吸烟、风吹、日晒及接触有害物质等引起[9-10]。其中紫外线(UV)的作用是最主要,也是最突出的,称为光老化[11]。日光中产生光老化的紫外线主要包括长波(UVA)和中波(UVB)[12]。以小鼠为受试动物,通过UVA和UVB光源照射建立小鼠光老化模型,该模型应用广泛,具有一定的理论基础[13-15]。因此,本试验采用小鼠皮肤光老化模型,研究南极磷虾肽对光老化小鼠皮肤的防护作用。
1. 材料与方法
1.1 材料与仪器
南极磷虾肽粉(P-1及P-2蛋白质含量均在98%以上,由不同酶解工艺获得,其中P-1分子量为200~500 Da,P-2分子量为500~1000 Da) 青岛海洋生物医药研究院功能制品平台提供;羟脯氨酸(HYP)测试盒、糖胺多糖(GAG)测试盒、超氧化物歧化酶(T-SOD)测试盒、过氧化氢酶(CAT)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测定测试盒、丙二醛(MDA)测定试剂盒 南京建成生物工程研究所;脱毛膏 市售;试验用的昆明雌性小鼠(小鼠,KM, SPF级,体重20~25 g,伦理号MBRI21031502) 济南朋悦实验动物繁育有限公司提供;其他试剂 均为市售分析纯。
UVA(波长320~420 nm)、UVB(波长280~320 nm)紫外灯管 南京华强电子有限公司;紫外可见分光光度计 尤尼克(上海)仪器有限公司;TS-1涡旋振荡器 海门市其林贝尔仪器制造有限公司;高速冷冻离心机 上海安亭实验仪器厂;SY21-NI4V恒温水浴锅 北京长风仪器仪表公司。
1.2 实验方法
1.2.1 动物分组
试验小鼠经适应性喂养(温度20±2 ℃,相对湿度50%~60%),随机分为模型组、空白对照组、南极磷虾肽(P-1)组及南极磷虾肽(P-2)组,每组10只。实验期间控制进食每天5 g/只,自由饮水。
1.2.2 光老化小鼠模型的建立[16~18]
除空白对照组外,其余各组小鼠用脱毛膏将背部脱毛,使其背部暴露2 cm×2 cm方形区域。模拟UV长期照射。其中UVA灯80 W,UVB灯160 W,照射时小鼠距离灯源40 cm。第一周每天9:00开始照射一次,每次1 h,第二周开始9:00、15:00照射,每天二次,每次40 min,累积照射剂量UVA 304.5 J/cm2,UVB 6.3 J/cm2。
1.2.3 试验小鼠给药方法
空白对照组小鼠剃毛后不进行紫外照射,同时不进行任何涂抹;模型组小鼠进行紫外照射,并在背部暴露的受试部位涂抹蒸馏水;实验P-1组小鼠进行紫外照射,并在受试部位均匀涂抹含10%南极磷虾肽P-1的水溶液;实验P-2组小鼠进行紫外照射,并在受试部位均匀涂抹含10%的南极磷虾肽P-2的水溶液。小鼠每天进行紫外照射并涂抹蒸馏水或相应样品,每周称重。
1.2.4 皮肤组织的处理及指标测定
紫外照射试验进行结束后,取小鼠受试部位皮肤组织1 cm×1 cm,用预冷的生理盐水进行漂洗,除去皮下多余的脂肪及其他结缔组织,滤纸滤干后称重备用。将备用皮肤剪碎,按质量比1:9与预冷生理盐水混匀,冰浴匀浆。10000 r/min低温冷冻离心10 min,取上清备用[19]。皮肤组织中羟脯氨酸(HYP)含量及糖胺多糖(GAG)含量的测定,严格按照南京建成生物工程公司试剂盒说明书进行。水分及脂质含量测定分别按照GB 50093-2010及GB/T 5009.6-2003进行[20]。
HE染色:取试验小鼠暴露部位处皮肤组织,浸泡在4%的甲醛溶液中,然后通过乙醇梯度洗脱,脱水结束后石蜡包埋,连续切片,切片厚度4 μm,脱蜡,复水,HE染色,显微镜观察紫外射线照射后小鼠皮肤组织的变化。
1.2.5 血清中T-SOD、CAT、GSH-Px及MDA的测定[21]
建模结束后,将各组小鼠禁食12 h,摘除眼球取血。将血液置于37 ℃温水水浴1 h,然后取出,离心后将血清置于4 ℃冷藏备用。T-SOD、CAT、GSH-Px及MDA含量的测定严格按照南京建成生物工程公司试剂盒说明书进行。
1.3 数据分析
每组试验重复3次进行,所有数据采用SPSS17.0 软件进行数据处理,试验参数以
2. 结果与分析
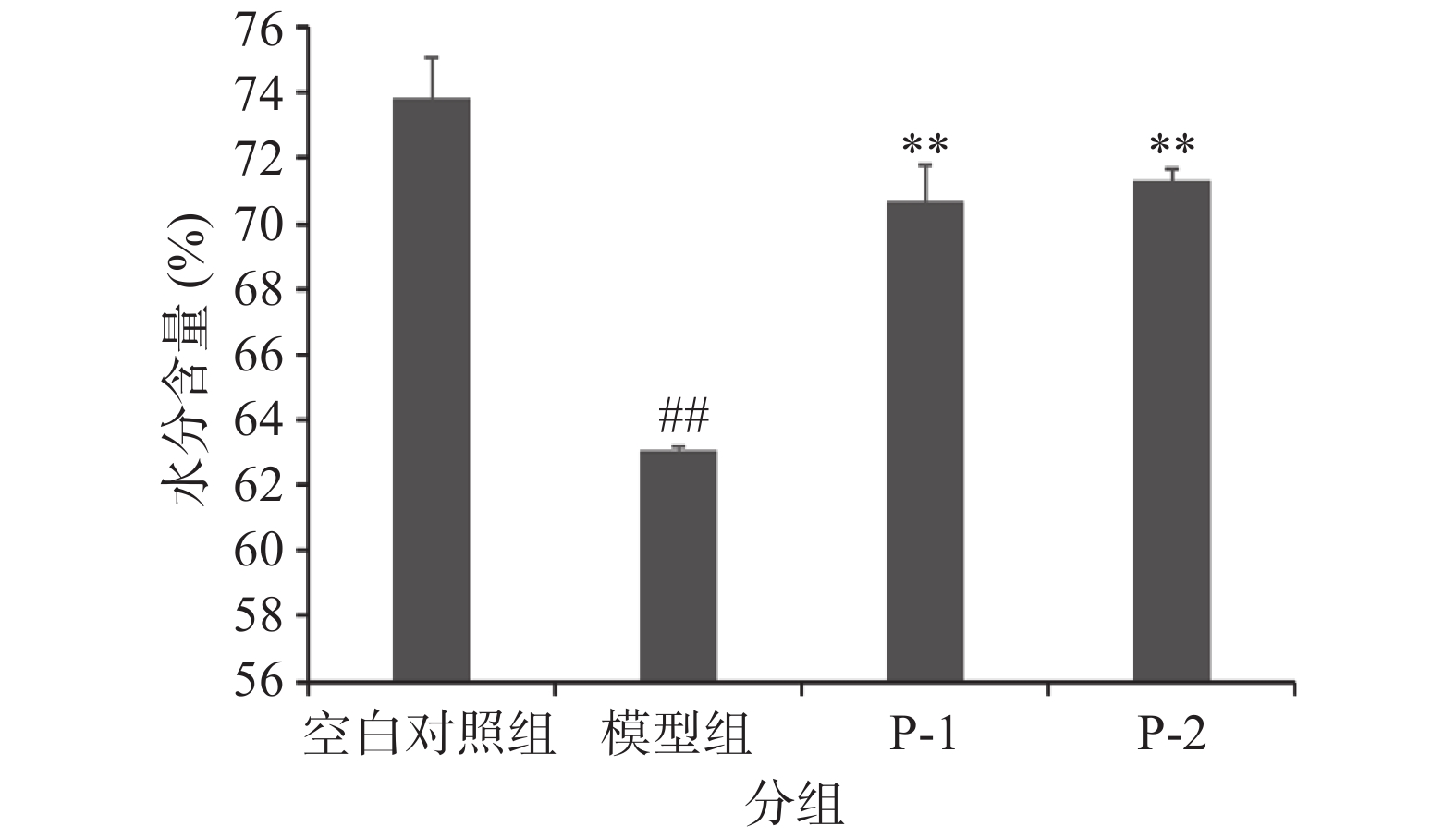
2.1 南极磷虾肽对光老化小鼠皮肤水分含量的影响
水分含量是皮肤维持光泽、饱满及弹性的重要因素之一[22]。皮肤水分流失会导致肌肤失去光泽,表面粗糙有细纹。皮肤水分含量试验结果如图1所示。
模型组与空白组相比,皮肤水分含量极显著降低(P<0.01),说明在建模过程中小鼠背部皮肤水分大量流失,与试验过程中小鼠背部皮肤表面干枯相符。南极磷虾肽组与模型组相比,皮肤水分含量极显著提高(P<0.01),其中P-1组小鼠皮肤水分含量较模型组小鼠皮肤水分含量高出12.12%,P-1组小鼠皮肤水分含量较模型组小鼠皮肤水分含量高出13.16%,表明在紫外照射过程中南极磷虾肽可以有效抑制皮肤水分流失,对小鼠皮肤起到一定的保护作用。该结果与庄永亮等[23]的研究结果趋势一致,表明多肽在抗皮肤光老化方面确实可以起到一定的保护作用。
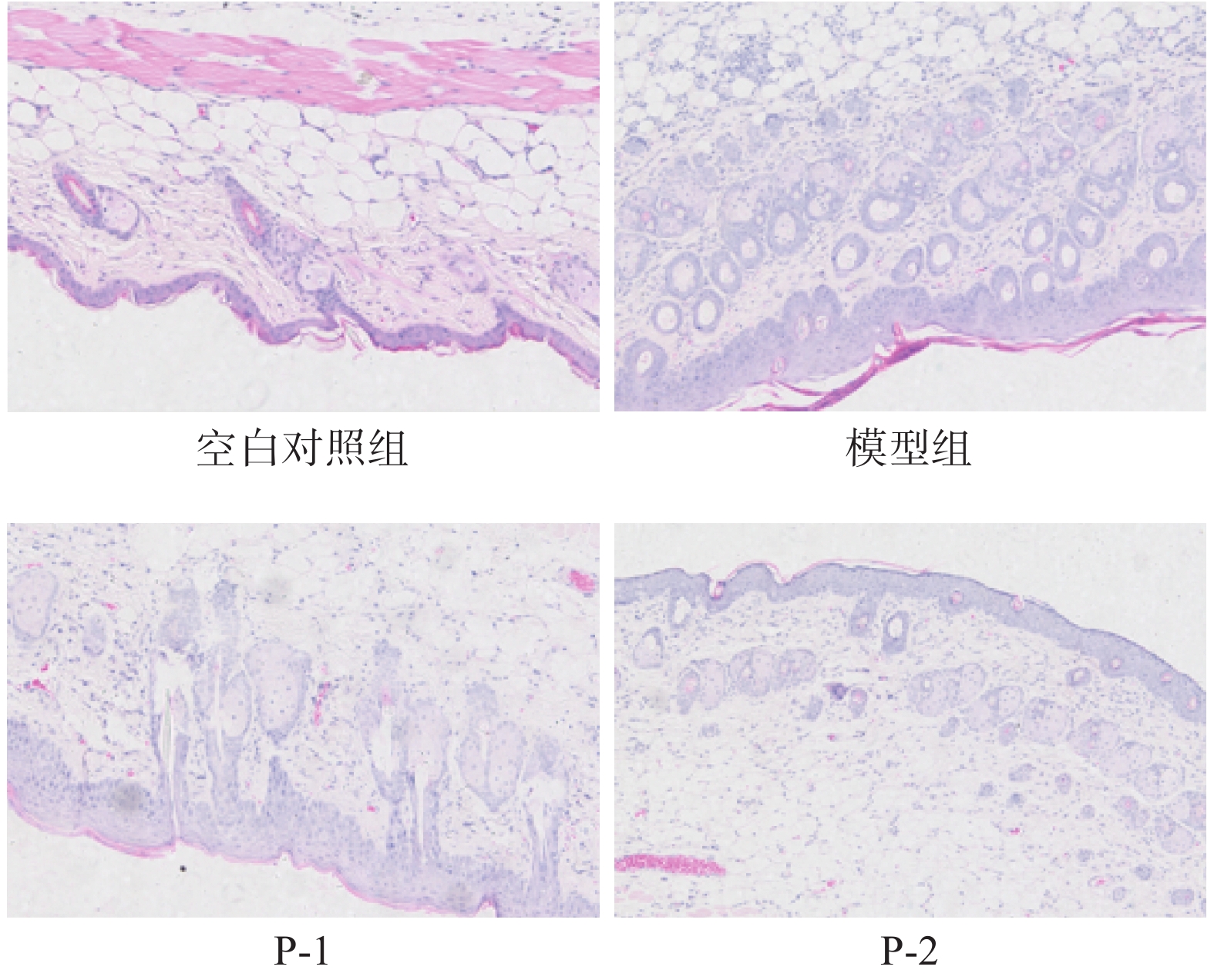
2.2 南极磷虾肽对光老化小鼠皮肤组织形态的影响
照射试验过程中观察小鼠背部皮肤变化。空白对照组小鼠外观正常,呈肉红色,皮肤光滑,无皱纹,表皮紧贴表面,皮肤有弹性。模型对照组小鼠皮肤表面无光泽,呈现暗红色,表皮与表面贴合不紧密,表面粗糙有较多褶皱,皮肤表面脱屑较多,红斑严重。南极磷虾肽P-1组皮肤较模型组情况有所改善,皮肤褶皱情况减少,但皮肤仍有脱屑情况,红斑较严重。P-2组小鼠皮肤表观特征较P-1组有所改善,皮肤表面仍有少量褶皱,表皮贴合程度有所改善,皮肤有一定弹性较光滑,有少量红斑。
紫外照射结束后,各组小鼠皮肤组织一般形态学变化如图2所示。根据HE染色结果,可知本试验中空白对照组小鼠表皮组织结构完整,细胞分层清晰,真皮层可见波浪状纤维组织,排列有序,分布均匀,疏密有致,基质均匀,间质散在分布均匀的纤维母细胞。模型对照组小鼠皮肤结构紊乱,分层模糊,表皮层厚度较空白对照组显著增厚,表皮与真皮的交界成直线状,真皮纤维数量减少,排列稀疏,且成团严重。P-1组小鼠表皮组织与模型组相比有所改善,表皮层厚度有所减少,真皮层仍有少量成团现象,但排列趋于整齐。P-2组小鼠皮肤较模型组改善较为明显,表皮厚度较模型组明显降低且厚度较均一,结构较完整,层次较清晰,真皮纤维有极少量成团现象,较P-1组更接近空白对照组小鼠皮肤。
2.3 南极磷虾肽对光老化小鼠皮肤中羟脯氨酸(HYP)、糖胺多糖(GAG)及脂质(Lipid)含量的影响
HYP是胶原蛋白的特征氨基酸,其含量高低直接对应皮肤中胶原蛋白含量,反映出皮肤弹性状态。胶原蛋白的流失一般对应GAG的聚积性升高。伴随GAG的增加通常会出现慢性或急性炎症,直接反映皮肤状态。皮肤总脂可以影响皮肤的结构和部分功能,严重缺失会导致肌肤失去光泽,粗糙程度增加[24]。试验结果如表1所示,紫外辐照可以引起光老化小鼠皮肤中羟脯氨酸的显著性流失(P<0.05),南极磷虾肽P-1及P-2可以起到显著抑制作用(P<0.05),南极磷虾肽P-1组小鼠皮肤中羟脯氨酸含量高出模型组小鼠9.07%,南极磷虾肽P-2组小鼠皮肤中羟脯氨酸含量高出模型组小鼠12.57%,表明南极磷虾肽可以通过抑制皮肤中羟脯氨酸的流失有效维持小鼠皮肤中胶原蛋白含量。通过紫外辐照光老化小鼠皮肤中的糖胺多糖含量较正常小鼠显著升高(P<0.01),南极磷虾肽P-1组小鼠皮肤中糖胺多糖含量低于模型组小鼠10.39%,南极磷虾肽P-2组小鼠皮肤中糖胺多糖含量低于模型组小鼠11.54%,根据试验结果可以看出南极磷虾肽P-1及P-2能够有效抑制小鼠皮肤中糖胺多糖的过度积累。模型组小鼠皮肤中脂质含量显著降低(P<0.01),南极磷虾肽组较模型组小鼠皮肤脂质显著增高(P<0.05),南极磷虾肽P-1组小鼠皮肤中脂质含量高出模型组小鼠17.95%(P<0.05),南极磷虾肽P-2组小鼠皮肤中脂质含量高出模型组小鼠30.15%(P<0.01),表明南极磷虾肽能够有效抑制光老化小鼠皮肤中脂质的过度流失。
表 1 南极磷虾蛋白肽对光老化小鼠皮肤内HYP、GAG及Lipid含量的影响(x±s, n=10)Table 1. Effects of peptide from Antarctic Krill on HYP, GAG, lipid content in anti-aging mouse skin (x±s, n=10)组别 HYP(μg·mg−1) GAG(μg·mg−1) 脂质(%) 空白对照组 19.57±2.67 17.84±1.64 11.64±2.09 模型组 15.11±1.09## 23.48±2.57## 7.13±1.97## P-1 16.48±3.01* 21.04±1.69** 8.41±2.73* P-2 17.01±2.49** 20.77±2.19** 9.28±1.14** 2.4 南极磷虾肽对光老化小鼠血清指标的影响
据自由基理论,超氧化物酶是超氧化物阴离子的清除剂,老化机体中的各种超氧化物酶的活力会下降[25-26]。从表2中可以看出,与正常组小鼠相比,光老化小鼠血清中总超氧化物歧化酶(T-SOD)以及谷胱甘肽过氧化物酶(GSH-Px)的含量极显著下降(P<0.05),过氧化氢酶(CAT)含量显著降低(P<0.05),说明建模成功。南极磷虾肽可以抑制光老化小鼠血清中过氧化物酶的降低,其中整体上P-2能有效提高血清过氧化物酶水平,使光老化小鼠血清过氧化物酶含量更接近正常小鼠。P-1对光老化小鼠血清过氧化物酶的降低也有一定的抑制作用。
表 2 南极磷虾蛋白肽对光老化小鼠血清内抗氧化能力的影响Table 2. Effect of peptide from Antarctic Krill on antioxidant ability of serum组别 T-SOD
(U·mL−1)CAT
(U·mL−1)GSH-Px
(U·mL−1)MDA
(nmol·mL−1)空白对照组 179.92±20.41 9.23±0.71 451.79±30.51 16.02±1.63 模型组 143.33±15.60## 6.05±0.24# 391.53±28.73# 21.82±2.07## P-1 151.64±5.71** 8.21±0.51** 421.34±19.40* 17.46±1.71** P-2 160.28±9.82** 7.89±0.37** 441.11±15.67** 18.04±2.55* 丙二醛(MDA)是脂质过氧化的最终产物,在一定程度上可以评估脂质过氧化对细胞的损伤程度[27-29]。经过紫外照射后,小鼠血清中MDA的含量升高,模型组同正常组相比MDA含量存在极显著差异(P<0.01)。由表2可以看出,南极磷虾肽可以在一定程度上抑制光老化小鼠血清中MDA含量的升高,其中南极磷虾肽P-1组小鼠血清中MDA含量低于模型组小鼠19.96%(P<0.01),南极磷虾肽P-2组小鼠血清中MDA含量低于模型组小鼠17.32%(P<0.05),说明南极磷虾肽可以抑制紫外辐照引起的小鼠血清中MDA含量的异常增多。
3. 结论
本研究以皮肤光老化自由基学说为理论基础,通过建立光老化小鼠模型考察南极磷虾肽对光老化小鼠皮肤的影响,结果表明:南极磷虾肽P-1及P-2可以抑制光老化小鼠皮肤水分的过量流失,维持皮肤光泽;南极磷虾肽P-1及P-2可以明显改善光老化小鼠皮肤损伤,维持皮肤表观正常形态;HE染色结果显示,南极磷虾肽P-1及P-2可以降低光老化对小鼠皮肤结构造成的损害,维持其正常的组织结构;南极磷虾肽P-1及P-2可以明显抑制光老化小鼠皮肤中HYP和Lipid的异常流失,以及GAG含量的异常增加;南极磷虾肽P-1及P-2可以提高光老化小鼠血清中T-SOD、GSH-Px、CAT的活性,降低MDA含量。因此,南极磷虾肽可以有效改善紫外辐射对小鼠皮肤的损伤程度,为南极磷虾肽在化妆品领域的应用提供一定的理论基础,但该研究未对南极磷虾肽抗光老化作用的机理进行深入探究,在后续研究中将继续探讨。
-
表 1 南极磷虾蛋白肽对光老化小鼠皮肤内HYP、GAG及Lipid含量的影响(x±s, n=10)
Table 1 Effects of peptide from Antarctic Krill on HYP, GAG, lipid content in anti-aging mouse skin (x±s, n=10)
组别 HYP(μg·mg−1) GAG(μg·mg−1) 脂质(%) 空白对照组 19.57±2.67 17.84±1.64 11.64±2.09 模型组 15.11±1.09## 23.48±2.57## 7.13±1.97## P-1 16.48±3.01* 21.04±1.69** 8.41±2.73* P-2 17.01±2.49** 20.77±2.19** 9.28±1.14** 表 2 南极磷虾蛋白肽对光老化小鼠血清内抗氧化能力的影响
Table 2 Effect of peptide from Antarctic Krill on antioxidant ability of serum
组别 T-SOD
(U·mL−1)CAT
(U·mL−1)GSH-Px
(U·mL−1)MDA
(nmol·mL−1)空白对照组 179.92±20.41 9.23±0.71 451.79±30.51 16.02±1.63 模型组 143.33±15.60## 6.05±0.24# 391.53±28.73# 21.82±2.07## P-1 151.64±5.71** 8.21±0.51** 421.34±19.40* 17.46±1.71** P-2 160.28±9.82** 7.89±0.37** 441.11±15.67** 18.04±2.55* -
[1] Zhao L, Yin B, Liu Q, et al. Purification of antimicrobial peptide from Antarctic Krill (Euphausia superba) and its function mechanism[J]. Journal of Ocean University of China,2013,12(3):484−490. doi: 10.1007/s11802-013-2180-2
[2] Matuda T G, Chevallier S, Filho P D A P, et al. Impact of guar and xanthan gums on proofing and calorimetric parameters of frozen bread dough[J]. Journal of Cereal Science,2008,48(3):741−746. doi: 10.1016/j.jcs.2008.04.006
[3] 徐恺, 刘云, 王亚恩, 等. 南极磷虾脱脂蛋白肽抗疲劳和耐缺氧实验研究[J]. 食品科学,2011,32(11):310−313. [Xu Kai, Liu Yun, Wang Yaen, et al. Anti-fatigue and anti-hypoxia functions of degreased peptides from Antarctic Krill in mice[J]. Food Science,2011,32(11):310−313. [4] Hatanaka A, Miyahara H, Suzuki K I, et al. Isolation and identification of antihypertensive peptides from Antarctic Krill tail meat hydrolysate[J]. Journal of Food Science,2010,74(4):H116−H120.
[5] 王春波, 姚如永, 刘占涛, 等. 扇贝多肽抗紫外线A对无毛小鼠皮肤的氧化损伤[J]. 中国药理学报: 英文版,2002(9):813−818. [Wang Chunbo, Yao Ruyong, Liu Zhantao, et al. Protective effect of polypeptide from Chlamys farreri on hairless mice damaged by ultraviolet A[J]. Acta Pharmacologica Sinica,2002(9):813−818. [6] Takeshi K, Jun-Ichi S, Hidetoshi Y, et al. Peptide-mediated suppression of experimental autoimmune uveoretinitis in mice: Development of a peptide vaccine[J]. International Immunology,1996(8):1229.
[7] 陶宇. 沙海蜇胶原蛋白肽对光老化小鼠皮肤的保护作用及体外透皮吸收研究[D]. 青岛: 中国海洋大学, 2012. Tao Yu. Study on the protective effects on the skin of photoaging-model mice and percutaneous experimenta of collagen polypeptides from jellyfish[D]. Qingdao: Ocean University of China, 2012.
[8] 刘治东, 王静凤, 王玉明, 等. 鱿鱼墨黏多糖对小鼠免疫调节作用的研究[J]. 中国海洋大学学报(自然科学版),2009(S1):147−150. [Liu Zhidong, Wang Jingfeng, Wang Yuming, et al. The effects of squid ink glycosaminoglycan on the immune function of mice[J]. Periodical of Ocean University of China,2009(S1):147−150. [9] Hana J, Eunjoo L, Tae L, et al. The methoxyflavonoid isosakuranetin suppresses UV-B-induced matrix metalloproteinase-1 expression and collagen degradation relevant for skin photoaging[J]. International Journal of Molecular Sciences,2016,17(9):1449. doi: 10.3390/ijms17091449
[10] Xue Z, Wen H, Zhai L, et al. Antioxidant activity and anti-proliferative effect of a bioactive peptide from chickpea
(Cicer arietinum L.)[J]. Food Research International,2015,77(Nov. PT. 2):75−81. [11] Chen T, Hou H. Protective effect of gelatin polypeptides from Pacific cod (Gadus macrocephalus) against UV irradiation-induced damages by inhibiting inflammation and improving transforming growth factor-β/Smad signaling pathway[J]. Journal of Photochemistry & Photobiology B Biology,2016,162:633−640.
[12] Kim J, Lee C W, Kim E K, et al. Inhibition effect of Gynura procumbens extract on UV-B-induced matrix-metalloproteinase expression in human dermal fibroblasts[J]. Journal of Ethnopharmacology,2011,137(1):427−433. doi: 10.1016/j.jep.2011.04.072
[13] Ying R, Zhang Z, Song W, et al. Protective effect of MAAs extracted from Porphyra tenera against UV irradiation-induced photoaging in mouse skin[J]. Journal of Photochemistry and Photobiology B: Biology,2019,192:26−33. doi: 10.1016/j.jphotobiol.2018.12.009
[14] 雷茜茜, 赵松林, 陈卫军, 等. 角鲨烯和维生素E抗皮肤衰老作用的比较研究[J]. 食品工业科技,2013(13):91−93. [Lei Xixi, Zhao Songlin, Chen Weijun, et al. Comparative study of squalene and on anti-aging effect vitamin E to skin[J]. Science and Technology of Food Industry,2013(13):91−93. [15] Ying R, Zhang Z, Zhu H, et al. The protective effect of mycosporine-like amino acids (MAAs) from Porphyra yezoensis in a mouse model of UV irradiation-induced photoaging[J]. Marine Drugs,2019,17(8):470. doi: 10.3390/md17080470
[16] Mai Y, Niu Z, He W, et al. The reparative effect of Dendrobium officinale protocorms against photodamage caused by UV-irradiation in hairless mice[J]. Biological & Pharmaceutical Bulletin,2019,42(5):728−735.
[17] Hou H, Li B, Zhao X, et al. The effect of pacific cod (Gadus macrocephalus) skin gelatin polypeptides on UV radiation-induced skin photoaging in ICR mice[J]. Food Chemistry,2012,115(3):945−950.
[18] Zhou Z Q, Sui Z F, Tian Y L, et al. Leptin alleviates ultraviolet-induced skin photoaging in human skin fibroblasts and mice[J]. International Journal of Clinical and Experimental Medicine,2016,9(2):1084−1094.
[19] Krutmann J, Merk H F. Environment and skin ||UV and skin: Photocarcinogenesis[J]. 2018(Chapter 8): 67-103.
[20] Wang X F, Huang Y F, Wang L, et al. Photo-protective activity of pogostone against UV-induced skin premature aging in mice[J]. Experimental Gerontology,2016:76.
[21] 初鑫, 宋韶乾, 司磊磊, 等. 鳕鱼皮胶原蛋白肽果汁饮料抗紫外线照射引起的皮肤光老化[J]. 食品工业科技,2018,39(22):293−298. [Chu Xin, Song Shaoqian, Si Leilei, et al. Effect of fruit juice drink containing collagen polypeptides from Pacific cod (Gadus macrocephalus) skin on UV irradiation-induced skin photoaging[J]. Science and Technology of Food Industry,2018,39(22):293−298. [22] 庄永亮. 海蜇胶原蛋白理化性质及其胶原肽的护肤活性研究[D]. 青岛: 中国海洋大学, 2009. Zhuang Yongliang. Study on the biochemical characterization of collagen and skin-care activity of collagen peptides extracted from jellyfish[D]. Qingdao: Ocean University of China, 2012.
[23] Chen T, Hou H. Protective effect of gelatin and gelatin hydrolysate from salmon skin on UV irradiation-induced photoaging of mice skin[J]. Journal of Ocean University of China,2016,4(v. 15):147−154.
[24] Chat O A, Najar M H, Mir M A, et al. Effects of surfactant micelles on solubilization and DPPH radical scavenging activity of Rutin[J]. J Colloid Interface,2011,355(1):140−149. doi: 10.1016/j.jcis.2010.11.044
[25] Zhang Q, Chen W, Zhao J, et al. Functional constituents and antioxidant activities of eight Chinese native goji genotypes[J]. Food Chemistry,2016,200(Jun. 1):230−236.
[26] Xing R, Song L, Guo Z, et al. Relevance of molecular weight of chitosan and its derivatives and their antioxidant activities in vitro[J]. Bioorg Med Chem,2005,13(5):1573−1577. doi: 10.1016/j.bmc.2004.12.022
[27] Li H B, Ma Y J, Miao J J, et al. The influence of the hemp seed oil on the related parameters of the skin in aging mice[J]. Chinese Journal of Experimental Traditional Medical Formulae,2012,18(9):201−205.
[28] Shang Y, Yao S, Qiao X, et al. Evaluations of marine collagen peptides from tilapia skin on experimental oral ulcer model of mice[J]. Materials Today Communications,2020:101893.
[29] Song H, Meng M, Cheng X, et al. The effect of collagen hydrolysates from silver carp (Hypophthalmichthys molitrix) skin on UV-induced photoaging in mice: Molecular weight affects skin repair[J]. Food & Function,2017,8(4):1538−1546.






 下载:
下载:
 下载:
下载:
