Effects of Maturation after Slaughter on Physicochemical Properties and Proteins Expression of Goats Meat
-
摘要: 为探讨山羊宰后48 h内成熟过程中的理化性质规律,分别对宰后0、12、24和48 h山羊背部最长肌的质构特性(TPA)、pH、保水性、肌浆(原)蛋白溶解度以及差异蛋白动态变化等指标进行测定,探讨不同成熟过程中的肉品质变化。结果表明:随着宰后时间点的延长,山羊肉的pH在48 h内显著下降(P<0.05),且在6.5~5.5之间;滴水流失率在宰后0~24 h显著增加(P<0.05),但蒸煮损失率却在12 h后下调(P<0.05);山羊肉成熟中前24 h红度(a*值)与亮度(L*值)显著升高(P<0.05),而黄度(b*值)却无显著差异(P>0.05);在宰后12 h内,肌原纤维蛋白溶解度显著下降(P<0.05),随后逐渐增加(P<0.05),而肌浆蛋白溶解度随着宰后时间延长逐渐增大(P<0.05);山羊肉宰后48 h内的糖原含量显著降低(P<0.05)。其中与0 h对比,12 h组的差异表达蛋白总共有13个,24 h共有26个差异表达蛋白,48 h有69个差异表达蛋白,且在0~48 h间能量代谢相关酶上调表达,24~48 h内影响羊肉气味的相关蛋白上调表达。山羊肉在宰后24~48 h的成熟期间,肉质的嫩度、颜色和口感较为优越,此时对山羊肉进行加工和储存,可以为山羊肉的品质提供基础保障。Abstract: In order to investigate the physical and chemical properties of goats during maturation process within 48 h after death, longissimus dorsi muscle of goats at 0, 12, 24 and 48 h after slaughter was taken respectively. The TPA, pH, water retention rate, sarcoplasmic protein solubility and differential expression proteins (DEPs) level were measured respectively to study the change of meat quality at different maturation stages. The results showed as follows: With the extension of post-mortem time point, the pH of goats meat decreased significantly within 48 h (P<0.05), and ranged from 6.5 to 5.5. Drip loss significantly increased from 0 to 24 h post-mortem (P<0.05), and the cooking loss significantly decreased after 12 h post-mortem (P<0.05). Redness (a* value) and brightness (L* value) were significantly increased (P<0.05) in the first 24 h of goat meat maturation, but there was no significant difference in yellowness (b* value) (P>0.05). Within 12 h after slaughter, the solubility of myofibrillar proteins in goat meat samples decreased significantly (P<0.05), and then increased gradually (P<0.05), solubility of sarcoplasmic fibers protein increased gradually with the prolongation of post-slaughter time (P<0.05). The glycogen content of Xinjiang goats within 48 h after slaughter significantly decreased (P<0.05). Compared with 0 h, there were 13 DEPs in the 12 h group, 26 DEPs in the 24 h group, and 69 DEPs in the 48 h group. The expression of enzymes related to energy metabolism was up-regulated from 0 to 48 h, and the expression of proteins related to lamb odor was up-regulated from 24 to 48 h. The tenderness, color and taste of Xinjiang goat meat were superior during the maturation period of 24~48 h after slaughter, the processing and storage during this period could provide basic guarantee for the quality of Xinjiang goats.
-
Keywords:
- goat meat /
- ripening time /
- tenderness /
- water-retaining property /
- protein stability
-
动物宰后的成熟过程又称排酸处理,在此过程会发生一系列生理生化反应。该反应够促使肉质变得柔软、多汁,美味[1],同时也能对肉类风味的前体物质产生影响[2-3],降低了山羊肉的膻味,改善羊肉口感和营养价值。宰后成熟过程对改善肉品质有很大帮助,宰后成熟会影响肌肉的剪切力、色泽、pH、蒸煮损失率、蛋白质含量和肌浆(原)蛋白溶解度的变化,继而影响肉质的嫩度、持水性、风味等理化指标[4]。肌肉在向优质肉转化中发生巨大的生化变化,这从根本上决定了生肉的大部分重要品质(颜色、保水能力和嫩度)[5-6]。前期项目组针对陕北横山羊对宰后48 h内不同部位的肉品质进行探索,得到背部最长肌的嫩度和蛋白质稳定性优于腹部肌肉[7]。
当动物被屠宰后,肌肉组织不会立即停止代谢,许多代谢能量系统(糖原分解、糖酵解和氧化磷酸化)试图在死后早期维持肌肉内ATP稳态[5]。由于糖酵解作用产生乳酸,促使H+的积累,导致肌肉的pH显著下降,通过调控宰后的能量代谢以及肌肉收缩反应来影响肉的品质[5]。适宜的成熟时间能够提高羊肉的嫩度和风味,同时参与宰后成熟过程的物质受到复杂的调控,对肉类品质的发展也起着重要的作用。
新疆山羊是一种绒肉奶兼用的山羊品种,常以瘦肉含量多、有嚼劲为优点,且肌纤维细嫩,营养价值较高,受到广大消费者的喜爱。鉴于不同成熟时间羊肉在嫩度、保水性、蛋白质结构都有明显差异,且目前对具有地方特色的新疆山羊研究以品种改良上居多,在肉品质方面变化机制方面的研究较少,本研究以1.5周岁的新疆公山羊为研究对象,通过研究宰后不同成熟时间下的肉质理化性质变化,探讨宰后成熟对山羊肉品质的影响作用,为优化羊肉储存方式以及合理改善羊肉品质提供参考依据。
1. 材料与方法
1.1 材料与仪器
羊肉样品 取自新疆乌鲁木齐市华凌畜牧屠宰基地。取三只1.5周岁左右健康的新疆山羊(公)的背部最长肌为研究对象;氯化钾、硼酸(99.8%)、海砂、氢氧化钠、95%乙醇、硫酸铜、硫酸钾、石油醚、硫酸、甲醇、盐酸 分析纯,乌鲁木齐科华伟业生物科技有限公司。
便携式pH计 济南欧莱博技术有限公司;H721型可见分光光度计 上海仪电科学仪器股份有限公司;HH-6数显恒温水浴锅 常州市亿能实验仪器厂;CR-400性便携式色差仪 日本Konica minolta公司;TA-XT2型质构仪 北京微讯超技仪器技术有限公司;JA2003N电子天平 北京海天友诚科技有限公司;KDN-04A凯式定氮仪 上海坤诚科学仪器有限公司。
1.2 实验方法
1.2.1 样品处理
在同一羊场选择1.5周岁左右的3只健康且未去势新疆山羊(屠宰率最高)为三组重复试验依据并带回实验室进行宰杀,尽量减少在屠宰过程的应激反应[8]。宰后取3只羊背部最长肌上少许肉样,作为宰后0 h样品。其余样品放置4 ℃冰箱进行宰后成熟过程,并分别在宰后前期(宰后12 h)、中期(宰后24 h)、后期(宰后48 h)不同时间点的羊肉进行取样。
1.2.2 pH测定
按照国标GB/T 5009.237-2016进行调整,称取去筋膜的碎肉样约4 g于烧杯中,加0.1 mol/L KCl溶液40 mL,温下放置30 min,用pH计测定,每组测量3次,结果取平均值。
1.2.3 质构特性(TPA)的测定
参照刘永峰等[9]的方法,取厚度约为1.5 cm×1.5 cm×0.5 cm长方体肉样,采用质构仪进行检测。参数设置:P36R探头;侧前、中、后的速度均为1.0 mm.s−1;检测触发力5 g;检测时间间隔5 s,测定内聚性、咀嚼性、回复性等5个质构特性指标。
1.2.4 保水性的测定
参照夏安琪等[10]方法测定滴水流失率,取宰后时间为0、12、24和48 h的肉样,称重并分别记下质量为W1,钩住肉样置于一个吹气膨胀的保鲜袋中,不与袋子接触并扎紧袋口,放在4 ℃恒温箱放置24 h,取出肉样称重质量为W2,羊肉滴水流失率计算公式:滴水流失率(%)=[(W1−W2)/W1]×100。
蒸煮损失测定方法参照Honikel等[11]的方法,分别取宰后时间为0、12、24和48 h的肉样称重并记下质量为G1,将肉样放入蒸煮袋中封口并80 ℃水浴45 min,随后冷却并在4 ℃过夜。吸干肉样表面汁液并再次称重,质量为G2。蒸煮损失率计算公式:蒸煮损失(%)=[(G1−G2)/G1]×100。
1.2.5 蛋白溶解度
参考相关文献[12]进行测定。在1.0 g碎肉样中加入0.025 mol/L预冷的磷酸钾缓冲液10 mL,在冰浴下匀浆3次。4 ℃摇动抽提12 h,然后离心20 min,上清液用BCA(Bicinchoninic acid)法测定的蛋白浓度即为肌浆蛋白溶解度。随后称取1.0 g碎肉样,加20 mL含1.1 mol/L碘化钾0.1 mol/L预冷的磷酸钾缓冲液,步骤同上,即为总可溶性蛋白溶解度。肌原纤维蛋白溶解度按式(1)计算。
(1) 式中:c-肌原蛋白溶解度,μg /μL;c1-全蛋白溶解度,μg/μL;c2-肌浆蛋白溶解度,μg/μL。
1.2.6 糖原测定
按照国标GB/T 9695.31-2008进行调整,取成熟后不同时间点肉样,用生理盐水漂洗并剪成碎末。然后精确称1000 mg肉样于试管中,加入3 mL 30% KOH并沸水煮2 h冷却至室温,后加入6 mL无水乙醇摇均匀静置1 min,在3000 r/min、4 ℃下离心15 min。沉淀加入6 mL 1 mol/L硫酸溶解。取1 mL样品加入5 mL蒽酮试剂,橡胶塞封闭试管,沸水浴加热15 min,冷却至室温,最后在分光光度计620 nm处测定OD值。
1.2.7 蛋白质提取与酶解
称取宰后不同成熟时间的样品,采用SDT(4%(w/v)SDS,100mmol/L Tris/HCl pH7.6,0.1 mol/L DTT)裂解法提取蛋白质,然后采用BCA法进行蛋白质定量。每个样品取适量蛋白质采用FASP(Filter aided proteome preparation)方法进行胰蛋白酶酶解[13]。
1.2.8 LC-MS/MS数据采集
每份样品采用HPLC液相系统Easy nLC进行分离。色谱柱以95%的0.1%甲酸水溶液平衡,样品经过分析柱分离,流速为300 nL/min。后用Q-Exactive质谱仪进行分析。检测方式为正离子,母离子扫描范围300~1800 m/z,一级质谱分辨率70000在质荷比200 m/z处,AGC (Automatic gain control) target为1e6,Maximum IT为50 ms,动态排除时间(Dynamic exclusion)为60.0 s。多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集20个碎片图谱(MS2 scan),MS2 Activation Type为HCD,Isolation window为2 m/z,二级质谱分辨率17500在200 m/z处,Normalized Collision Energy为30 eV,Underfill为0.1%。
1.3 数据处理
所有试验均设置3次重复,且所得数值采用平均值±标准差表示,采用Mascot2.2和Proteome Discoverer1.4进行查库鉴定及定量分析,并采用Excel及SPSS19.0分析软件进行统计分析。
2. 结果与分析
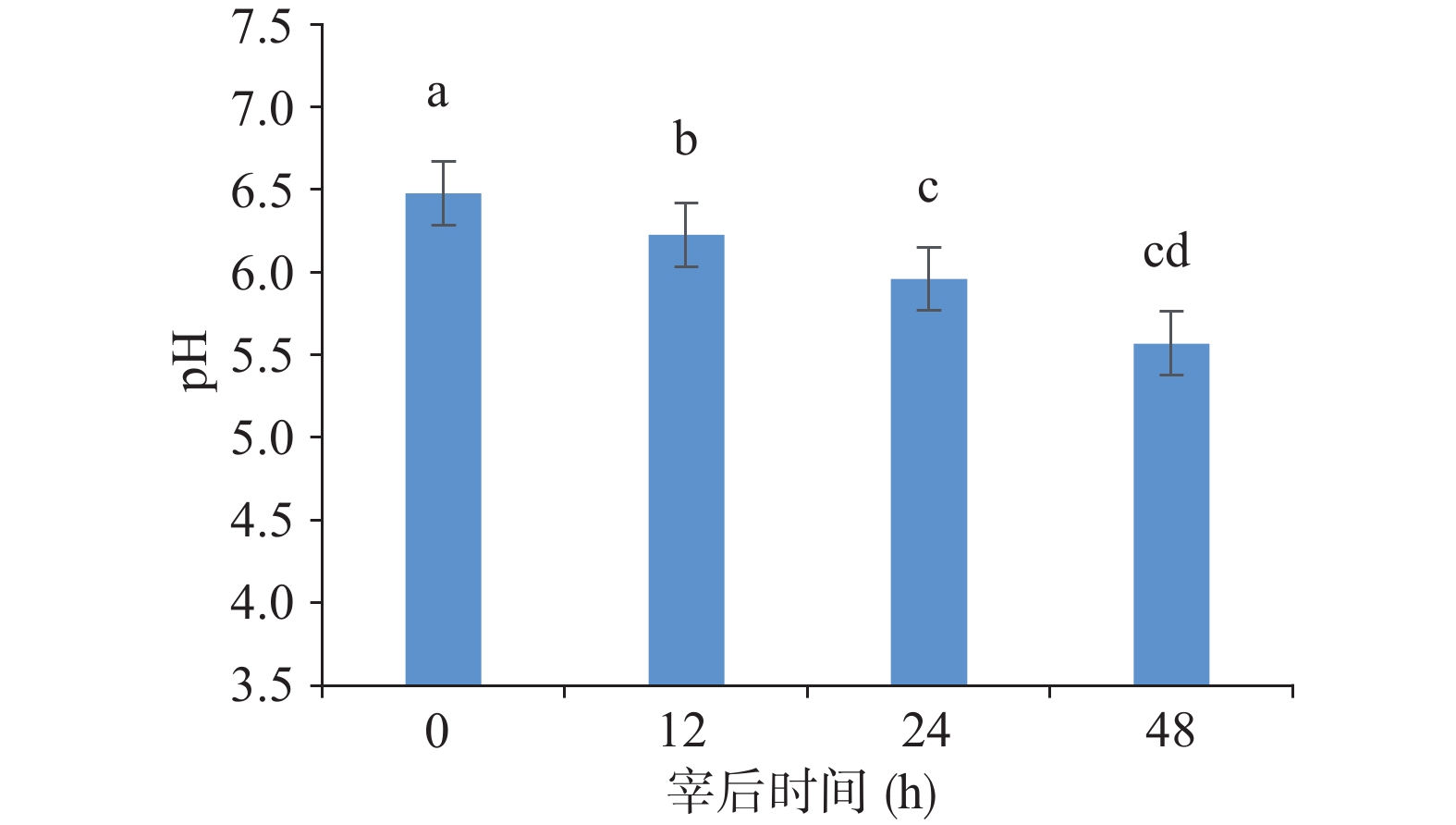
2.1 不同成熟时间的山羊肉pH的变化
宰后山羊肉成熟过程中的肌肉pH变化的大小和速度除了影响肌肉色泽、嫩度和多汁性外[14],同时也影响了宰后山羊肌糖元的酵解速度和强度。屠宰后,动物体内有氧呼吸停止,体内肌肉代谢变成糖酵解为主的无氧代谢,所以产生乳酸的速率加快,pH也随之发生改变[15]。选取放宰后不同成熟时间下的山羊肉的背部最长肌进行品质测定,结果显示不同宰后成熟时间下0、12、24和48 h的山羊肉差异显著(图1,P<0.05)。山羊宰后48 h内的pH变化呈均匀下降,其成熟过程中的pH在6.5~5.57之间,且仍有下降的趋势。这说明成熟过程中的山羊肉宰后早期pH较高;随着成熟时间延长,pH逐渐降低,且差异显著(P<0.05)。山羊在宰后0 h的pH较高可能是因山羊成长过程中的运动导致肌肉中的乳酸沉积和神经兴奋所致[16]。而宰后48 h内山羊肉的pH偏低则可能与宰后糖酵解有关[17]。
2.2 不同成熟时间的山羊肉质构特性(TPA)的变化
质构特性指标能够客观的反映食物品质,与感官性状间更有不可分割的关系,比感官评价更加客观、准确[18]。宰后成熟过程中山羊肉TPA变化结果如表1所示,硬度、回复力、咀嚼性在宰后48 h内的成熟过程中变化不明显(P>0.05)。宰后成熟12 h期间,内聚力显著下降(P<0.05),并且在24~48 h的成熟阶段又显著上升0.53左右(P<0.05),与宰后初期(0 h)相似。山羊肉背部最长肌的弹性,随着宰后时间的延长呈现降低的趋势,且在宰后0~48 h缓慢下降(P<0.05),从宰后初期的0.78下降到0.49左右。综上结果显示,在宰后24~48 h,山羊肉的TPA有较明显的变化,在孙天利[19]对牛肉的研究中,该现象出现在储存的第4 d,这一现象可能是因为肉类的品种不同。在48 h的成熟过程中,内聚性与弹性的变化明显,可能是与宰后成熟过程中的部分蛋白质水解,以及微生物的生长繁殖造成的肉质改变[20]。
表 1 宰后不同成熟时间山羊肉(TPA)的变化Table 1. Changes of TPA of goat meat at different maturation time after slaughter成熟时间/h 硬度 内聚性 弹性 回复力 咀嚼性 0 268.67±1.05a 0.54±0.05a 0.78±0.05a 0.51±0.19a 96.67±1.71a 12 255.00±2.15a 0.42±0.12b 0.74±0.21a 0.47±0.02a 101.67±2.42a 24 248.33±1.72a 0.45±0.03b 0.51±0.17b 0.47±0.12a 97.00±1.92a 48 243.67±1.51a 0.52±0.07a 0.49±0.12b 0.45±0.05a 93.00±2.72a 注:同一列的不同字母表示不同成熟时间之间存在差异显著(P<0.05);表2同。 2.3 不同成熟时间的山羊肉保水性变化
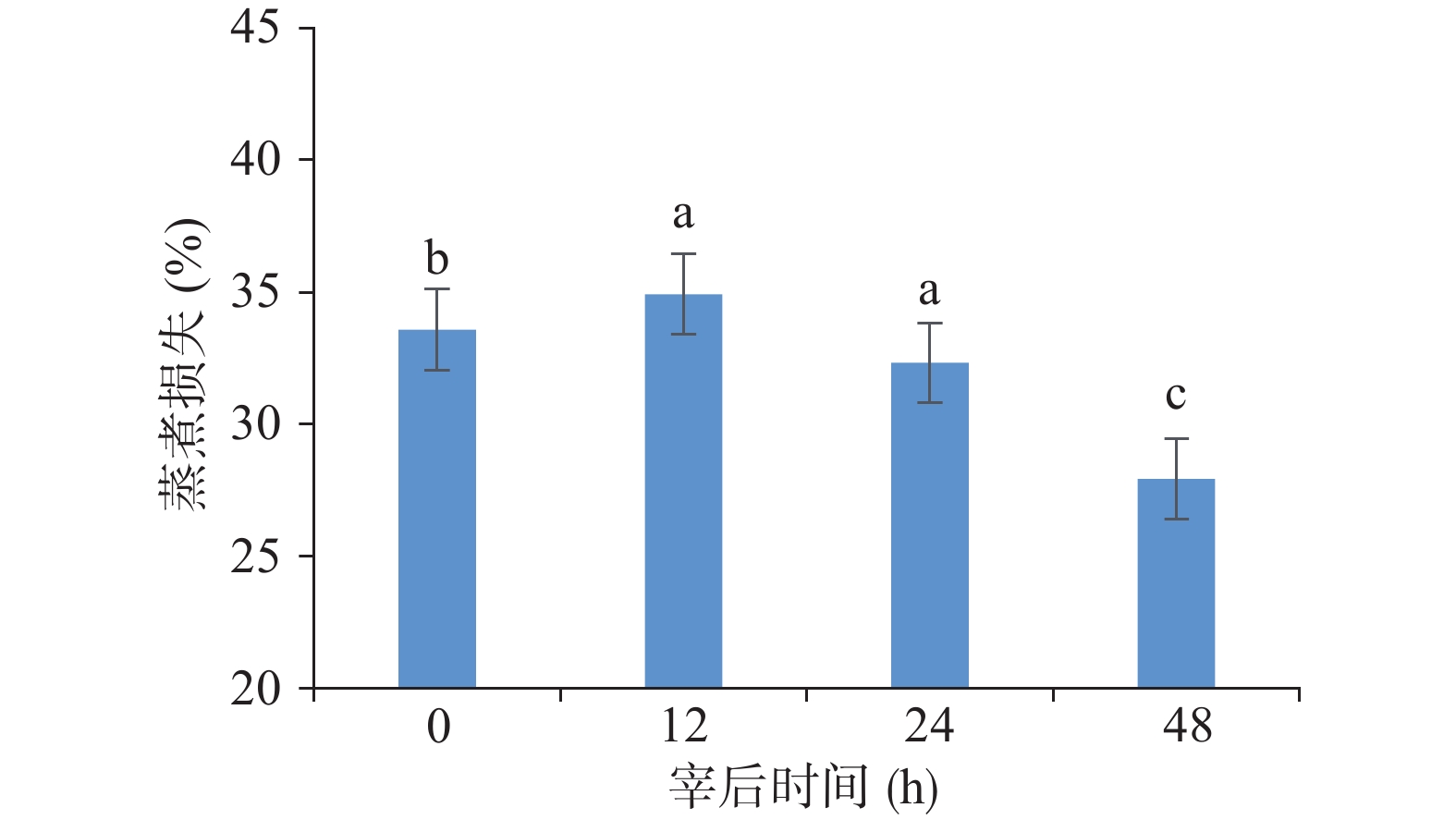
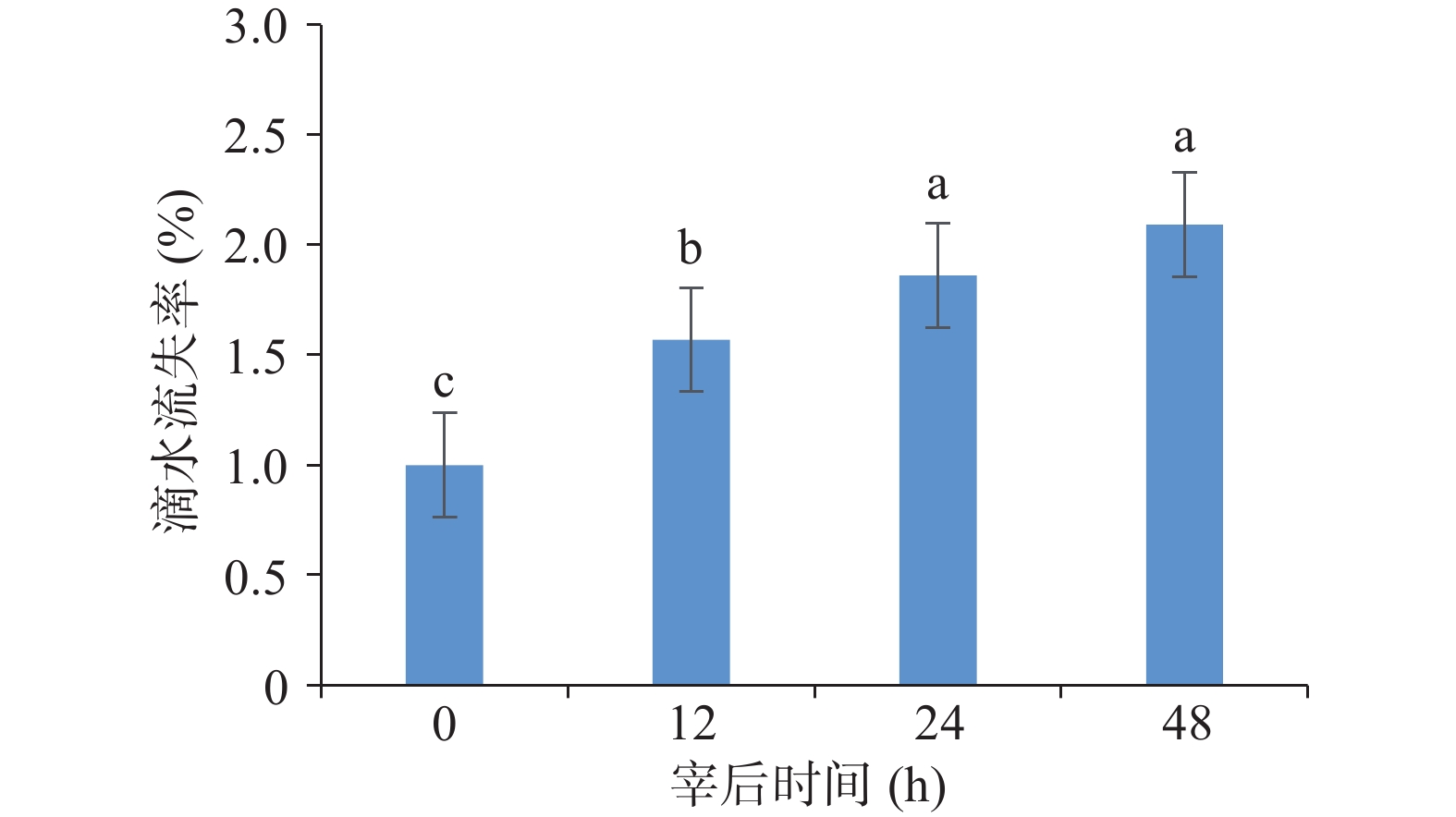
由图2可知,蒸煮损失率在山羊死后初期0~12 h缓慢上升到34.9%左右(P<0.05),但在宰后12 h后,均呈显著下降趋势(P<0.05),且约下降了20%。随着成熟时间的延长,山羊肉的滴水损失在宰后0~24 h显著增加(P<0.05),则在24~48 h的成熟阶段无显著差异,比宰后初期约上升了1倍(图3)。
屠宰后的保水性是指宰后肌肉在外力作用下仍能保持原有的水分与渗透水分的能力[21],又称为肉质的持水性,能够决定羊肉口感和肉食品质的优劣。研究表明,蒸煮损失率和滴水损失率两个指标共同决定了宰后肉质的保水性[22]。滴水损失越高说明肉的持水能力越差,对肉品质的影响较大。滴水损失升高可能是因为宰后肌原纤维蛋白和细胞膜链接在一起的蛋白发生降解,为肌肉汁液的流失提供了通道[23]。此外,也可能是由于成熟中乳酸的积累,pH下降到与主要蛋白质的等电点相时,此时蛋白质的正负电荷相互吸引,则肌原纤维之间的间隔减小,对水分的吸引力减小[14]。
2.4 不同成熟时间对山羊肉蛋白质溶解度的影响
蛋白的溶解度是反映蛋白降解程度的重要指标之一,如表2可知山羊肉肌原纤维蛋白溶解度在宰后12 h 内均显著下降(P<0.05),12 h后逐渐增加,且在48 h 时山羊肉样的肌原纤维蛋白溶解度显著小于最初的溶解度(P<0.05)。说明山羊肉的肌原纤维蛋白在宰后前12 h 无降解或降解程度较小,12 h 之后降解程度增加,肉质嫩度增加,所以宰后12 h是肉质变化的关键点。山羊肉宰后48 h内的肌浆蛋白溶解度逐渐增大(P<0.05)。结果说明随着宰后成熟时间的变化,山羊肉的肌浆蛋白降解程度较大。有研究表明,动物宰后的成熟快慢,能够通过影响肌肉的收缩、蛋白质降解度,进而改变肉品质[24],宰后肉样的肌浆蛋白溶解度受温度和pH影响。
表 2 宰后不同成熟时间山羊肉蛋白质溶解度的变化Table 2. Changes of proteins solubility of goat meat at different maturation time after slaughter成熟时间(h) 肌原纤维溶解度(mg/g) 肌浆纤维溶解度(mg/g) 0 83.06±1.05a 72.57±0.19d 12 59.01±1.31b 117.33±2.16c 24 68.41±1.29b 139.13±0.34b 48 78.40±0.49a 152.27±2.47a 肌浆与肌原蛋白之间存在着联系,肌浆钙离子激活因子中含硫氢基团的半胱氨酸残基易氧化,导致部分酶活性丧失,减弱肌原纤维蛋白的水解能力[25]。此外,山羊肉成熟过程中,肌原纤维蛋白降解与肉质的嫩度、持水性等也存在密切关系[26]。研究结果显示,山羊肉的肌原纤维蛋白溶解度在宰后12 h是一个转折点,导致该结果原因可能是在僵直期,μ-钙蛋白酶(μ-calpain)活性较低,抑制肌原纤维蛋白聚合和降解。解僵后,肌浆网中释放Ca2+活化μ-钙蛋白酶,进而促进肌原纤维蛋白聚合和降解[27]。也可能是肌原纤维蛋白中的肌动球蛋白被解离成小分子蛋白,通过增强与水分子相互作用,影响肌原纤维蛋白的溶解度[28]。
2.5 不同成熟时间的山羊肉糖原含量变化
宰后成熟过程中山羊肉背部最长肌糖原含量的变化见图4。从图4中可以看出,山羊肉在宰后0、12和24 h羊肉的糖原含量显著下降(P<0.05),48 h下降趋势缓慢。这可能由于宰后成熟过多消耗山羊体内的糖原,这可能由于成熟过程中的糖酵解作用,用来的维持pH和生理生化等方面的变化。
动物品种、肌纤维类型、动物营养状况和宰前进食情况都影响着糖原的含量[29],同时糖原作为糖酵解的底物,也受宰后成熟过程的影响。死后的动物肌肉中氧气供应中断,机体因无法适应外界条件而死亡,但此时的肌肉及各种细胞仍然进行着各种生化反应,为了保证这些生化反应的继续进行,糖原提供生化反应所需的能量。然而随着宰后成熟时间的延长,肌肉中的糖原含量经过糖酵解途径后就会变的越来越少。宰后肌肉成熟过程中,细胞以糖酵解的方式供能,糖酵解产生的乳酸和ATP降解产生的无机磷酸,会导致宰后肌肉中的H+积累、pH下降[24]。糖酵解酶主要由糖原磷酸化酶和糖原脱支酶组成[30],肌肉中H+的含量在一定程度上影响着这两种酶的活性,进而影响糖原的分解速率。
2.6 宰后不同成熟时间的差异蛋白质鉴定
为了展示不同成熟时间蛋白质的显著性差异,将比较组中蛋白质以表达差异倍数(Fold change)和P value(T-test)两个因素为标准绘制火山图,其中显著下调的蛋白质以蓝色标注(FC<0.833且P<0.05),显著上调的蛋白质以红色标注(FC>1.2且P<0.05),无差异的蛋白质为灰色,如图5所示。本研究中鉴定到的差异表达蛋白在不同成熟时间段,其表达能力不同。其中在0~12 h组差异表达蛋白总共有13个,上调表达蛋白有6个,下调表达蛋白有7个。0与24 h对比,共有26个差异表达蛋白,其中11个蛋白上调表达,15个蛋白下调表达。在0与48 h相比较时,有69个差异表达蛋白,其中上调30个上调表达,39个蛋白下调表达。且随着成熟时间的延长,参与糖酵解与三羧酸循环的差异蛋白均呈现上调表达,且表达量增加,这说明参与肌肉向肉转化过程中的蛋白质主要参与能量代谢调节。在宰后48 h中,检查出的差异表达蛋白中蛋氨酸-R-亚砜还原酶B2 (MSRB2)下调表达,该酶能催化蛋白质中甲硫氨酸亚砜的可逆氧化,还原为蛋氨酸。作为一种修复酶,它可以通过形成活性氧清除系统的一部分来保护蛋白质免受氧化应激,活性氧清除系统在细胞抗氧化防御中很重要[31]。该酶的过量表达可能为受损蛋白提供更多的修复过程,减轻活性氧(ROS)产生的氧化损伤,进而调节山羊肉的气味[32-33]。在山羊宰后48 h内,随着成熟时间的延长,许多参与调节肉品质的蛋白质活性有显著变化,且蛋白质的表达量也越来越多,这些蛋白质分别影响着山羊肉的嫩度、色泽、气味、口感等肉品质评价标准。也有研究表明,与山羊肉气味相关的蛋白质主要参与抗氧化活性[34]、半胱氨酸和蛋氨酸代谢[35-36]和活性氧代谢[37]等过程。
3. 结论
山羊在屠宰之后的48 h成熟过程中,其pH在6.5~5.57之间,宰后早期肌肉的pH较高,随着成熟时间的延长,pH逐渐降低,结合糖原含量的降低说明了主要参与糖酵解的反应完成宰后成熟的排酸过程。结合弹性,硬度和回复力等质构特性的变化,说明宰后成熟对肉品质起到嫩度优化的作用。滴水流失率下降的趋势和蒸煮损失率显著上升两个指标,反映出宰后山羊的保水性逐渐减弱。关于蛋白质溶解性的结果表明肌浆纤维溶解度显著升高,肌原纤维溶解度与宰后初期相差较小,说明蛋白质的稳定性逐渐减弱。综上所述,山羊在刚刚屠宰时的肉品质并不是最好的状态,通过宰后成熟过程,山羊的嫩度、色泽、口感都发生在变化。成熟后期,抗氧化相关蛋白(MSRB2)显著(P<0.05)下调表达,进而降低山羊肉的口感。因此,在山羊宰后24~48 h期间是肉质嫩化程度较为优越的阶段,此时对山羊肉进行加工和储存,有利于保持肉质的口感与品质。
-
表 1 宰后不同成熟时间山羊肉(TPA)的变化
Table 1 Changes of TPA of goat meat at different maturation time after slaughter
成熟时间/h 硬度 内聚性 弹性 回复力 咀嚼性 0 268.67±1.05a 0.54±0.05a 0.78±0.05a 0.51±0.19a 96.67±1.71a 12 255.00±2.15a 0.42±0.12b 0.74±0.21a 0.47±0.02a 101.67±2.42a 24 248.33±1.72a 0.45±0.03b 0.51±0.17b 0.47±0.12a 97.00±1.92a 48 243.67±1.51a 0.52±0.07a 0.49±0.12b 0.45±0.05a 93.00±2.72a 注:同一列的不同字母表示不同成熟时间之间存在差异显著(P<0.05);表2同。 表 2 宰后不同成熟时间山羊肉蛋白质溶解度的变化
Table 2 Changes of proteins solubility of goat meat at different maturation time after slaughter
成熟时间(h) 肌原纤维溶解度(mg/g) 肌浆纤维溶解度(mg/g) 0 83.06±1.05a 72.57±0.19d 12 59.01±1.31b 117.33±2.16c 24 68.41±1.29b 139.13±0.34b 48 78.40±0.49a 152.27±2.47a -
[1] 陈艳珍. 羊肉品质的评定指标及影响因素[J]. 黑龙江畜牧兽医,2011(14):53−54. [CHEN Y Z. Evaluation indexes and influencing factors of mutton quality[J]. Heilongjiang Animal Science and Veterinary Medicine,2011(14):53−54. [2] WANG L L, YU Q L, HAN L, et al. Study on the effect of reactive oxygen species-mediated oxidative stress on the activation of mitochondrial apoptosis and the tenderness of yak meat[J]. Food Chemistry,2018,244:394−402. doi: 10.1016/j.foodchem.2017.10.034
[3] PAREDI G, RABONI S, BENDIXEN E, et al. “Muscle to meat” molecular events and technological transformations: The proteomics insight[J]. Journal of Proteomics,2012,75(14):4275−4289. doi: 10.1016/j.jprot.2012.04.011
[4] SCHEFFLER T L, GERRARD D E. Mechanisms controlling pork quality development: The biochemistry controlling postmortem energy metabolism[J]. Meat Science,2007,77(1):7−16. doi: 10.1016/j.meatsci.2007.04.024
[5] ENGLAND E M. New aspects of meat quality perimortal muscle metabolism and its effects on meat quality[J]. New Aspects of Meat Quality,2017:63−89.
[6] 徐舶, 周光宏, 徐幸莲, 等. 不同部位鹿肉在成熟过程中化学成分和食用品质的变化[J]. 食品科学,2010,31(5):68−72. [XU B, ZHOU G H, XU X L, et al. Changes in chemical composition and edible quality of venison from different anatomical locations during postmortem aging[J]. Food Science,2010,31(5):68−72. [7] 魏燕超, 刘满顺, 刘永峰. 宰后成熟过程中羊肉食用品质及蛋白质稳定性的变化研究[J]. 食品与发酵工业,2018,44(6):205−210. [WEI Y C, LIU M S, LIU Y F. The change of quality and protein stability of mutton P-slaughter[J]. Food and Fermentation Industries,2018,44(6):205−210. [8] 黄帅, 孙旺斌, 高晔, 等. 陕北白绒山羊屠宰性能和器官发育的研究[J]. 中国农学通报,2018,34(2):84−88. [HUANG S, SUN W B, GAO Y, et al. Study on slaughter performance and organ development of Shanbei white cashmere goats[J]. Chinese Agricultural Science Bulletin,2018,34(2):84−88. doi: 10.11924/j.issn.1000-6850.casb16110108 [9] 刘永峰, 赵璐, 王娟, 等. 牛肉蒸制工艺及其质构、营养品质评价[J]. 陕西师范大学学报(自然科学版),2017,45(5):107−116. [LIU Y F, ZHAO L, WANG J, et al. Study of steamed beef processing and evaluation on their texture characteristics and nutritional quality[J]. Journal of Shaanxi Normal University (Natural Science Edition),2017,45(5):107−116. [10] 夏安琪, 李欣, 陈丽, 等. 不同宰前禁食时间对羊肉品质影响的研究[J]. 中国农业科学,2014,47(1):145−153. [XIA A Q, LI X, CHEN L, et al. Effects of different pre-slaughter fasting time on mutton quality[J]. Scientia Agricultura Sinica,2014,47(1):145−153. doi: 10.3864/j.issn.0578-1752.2014.01.015 [11] HONIKEL K O, KIM C J, HAMM R, et al. Sarcomere shortening of prerigor muscles and its influence on drip loss[J]. Meat Science,1986,16(4):267−282. doi: 10.1016/0309-1740(86)90038-0
[12] CHOI Y M, RYU Y C, KIM B C. Influence of myosin heavy-and light chain isoforms on early postmortem glycolytic rate and pork quality[J]. Meat Science,2007,76(2):281−288. doi: 10.1016/j.meatsci.2006.11.009
[13] WIŚNIEWSKI JACEK R, ZOUGMAN ALEXANDRE, NAGARAJ NAGARJUNA, et al. Universal sample preparation method for proteome analysis[J]. Nat Methods,2009,6(5):359−362. doi: 10.1038/nmeth.1322
[14] 陈韬. 宰后肌肉蛋白质和组织结构变化与冷却猪肉持水性的关系研究[D]. 南京: 南京农业大学, 2005. CHEN T. Study on relationship of muscle protein and structural changes postmortem and water-holding capacity of chilled pork[D]. Nanjing: Nanjing Agricultural University, 2005.
[15] 潘晓建, 文利, 彭增起, 等. 宰前热应激对肉鸡胸肉pH、氧化和嫩度、肉色及其关系的影响[J]. 江西农业学报,2007(5):91−95. [PAN X J, WEN L, PENG Z Q, et al. Effect of heat stress on pH, oxidative status, tenderness and color in broiler breast meat[J]. Acta Agriculturae Jiangxi,2007(5):91−95. doi: 10.3969/j.issn.1001-8581.2007.05.030 [16] SEN U, SIRIN E, ULUTAS Z, et al. Fattening performance, slaughter, carcass and meat quality traits of Karayaka lambs[J]. Tropical Animal Health and Production,2011,43(2):409−416. doi: 10.1007/s11250-010-9707-y
[17] LIANG J, YANG Q, ZHU M J, et al. AMP-activated protein kinase (AMPK) α2 subunit mediates glycolysis in postmortem skeletal muscle[J]. Meat Science,2013,95(3):536−541. doi: 10.1016/j.meatsci.2013.05.025
[18] 张婷, 吴燕燕, 李来好, 等. 咸鱼品质的质构与感官相关性分析[J]. 水产学报,2013,37(2):303−310. [ZHANG T, WU Y Y, LI L H, et al. Correlation analysis of sensory with instrumental texture measurement of salted fish[J]. Journal of Fisheries of China,2013,37(2):303−310. doi: 10.3724/SP.J.1231.2013.38218 [19] 孙天利. 冰温保鲜技术对牛肉品质的影响研究[D]. 沈阳: 沈阳农业大学, 2013. SUN T L. Tudy on the effect of freezing technology on the quality of beef[D]. Shenyang: Shenyang Agricultural University, 2013.
[20] 周梁, 卢艳, 周佺, 等. 猪肉冰温储藏过程中的品质变化与机理研究[J]. 现代食品科技,2011,27(11):1296−1302. [ZHOU L, LU Y, ZHOU Q, et al. Study on quality change and mechanism of pork during cold storage[J]. Modern Food Science and Technology,2011,27(11):1296−1302. [21] 路文敏, 张建国, 刘萍. 滴水损失与汁液流失关系的研究[J]. 肉类工业,2010(7):29−31. [LU W M, ZHANG J G, LIU P. Relationship between juices loss and drip loss[J]. Meat Industry,2010(7):29−31. doi: 10.3969/j.issn.1008-5467.2010.07.011 [22] LAWSON M A. The role of integrin degradation in postmortem drip loss in pork[J]. Meat Science,2004,68(4):559−566. doi: 10.1016/j.meatsci.2004.05.019
[23] REES M P, TROUT G R, WARNER R D. The influence of the rate of pH decline on the rate of ageing for pork. I: Interaction with method of suspension[J]. Meat Science,2003,65(2):791−804. doi: 10.1016/S0309-1740(02)00284-X
[24] 尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011: 379. YIN J D. Animal muscle biology and meat Science[M]. Beijing: China Agricultural University, 2011: 379.
[25] HUFF-LONERGAN S L. Mechanisms of water-holding capacity of meat: The role of postmortem biochemical and structural changes[J]. Meat Science,2005,71:194−204. doi: 10.1016/j.meatsci.2005.04.022
[26] 李鹏, 李沛然, 郭耀华, 等. pH变化对鲶鱼肌浆蛋白理化和功能特性的影响[J]. 食品研究与开发,2014(6):3−7. [LI P, LI P R, GUO Y H, et al. Physicochemical and functional characteristics changes of catfish sarcoplasmic proteins subjected to pH-shift method[J]. Food Research and Development,2014(6):3−7. doi: 10.3969/j.issn.1005-6521.2014.06.002 [27] 魏秀丽, 谢小雷, 张春晖, 等. 猪宰后肌肉体系中μ-calpain及肌原纤维蛋白理化特性的变化规律[J]. 中国农业科学,2015,48(12):2428−2438. [WEI X L, XIE X L, ZHANG C H, et al. The variations inμ-calpain and physico-chemical characteristics of myofibrillar proteins in postmortem porcine muscle[J]. Scientia Agricultura Sinica,2015,48(12):2428−2438. doi: 10.3864/j.issn.0578-1752.2015.12.016 [28] 陈琳. Caspase-3在鸡肉成熟过程中的作用以及与calpain的交互关系研究[D]. 南京: 南京农业大学, 2011. CHEN L. Study on the effects of casoase-3 as well as its relationship with calpain during postmortem ageing of chicken meat[D]. Nanjing: Nanjing Agricultural University, 2011.
[29] ZHEN S B, LIU Y R, LI X M, et al. Effects of lairage time on welfare indicators, energy metabolism and meat quality of pigs in Beijing[J]. Meat Science,2013,93(2):287−291. doi: 10.1016/j.meatsci.2012.09.008
[30] 刘佳东. 宰后牦牛肉成熟机理及肉用品质变化研究[D]. 兰州: 甘肃农业大学, 2011. LIU J D. Study on maturation mechanism and meat quality change of yak meat after slaughter[D]. Lanzhou: Gansu Agricultural University, 2011.
[31] VOUGIER S, MARY J, FRIGUET B. Subcellular localization of methioninesulphoxide reductase A (MsrA): Evidence for mitochondrial and cytosolic isoforms inrat liver cells[J]. Biochemical Journal,2003,373:531−537. doi: 10.1042/bj20030443
[32] WU W, YU Q Q, FU Y, et al. Towards muscle specific meat color stability of Chinese Luxi yellow cattle: A proteomic insight into post-mortem storage[J]. Journal of Proteomics,2016,147:108−118. doi: 10.1016/j.jprot.2015.10.027
[33] ZHAO D, CHEN L, QIN C, et al. A delta-class glutathione transferase from the Chinese mitten crab Eriocheir sinensis: cDNA cloning, characterization and mRNA expression[J]. Fish & Shellfish Immunology,2010,29(4):698.
[34] YU Q, WU W, TIAN X, et al. Comparative proteomics to reveal muscle-specific beef color stability of Holstein cattle during post-mortem storage[J]. Food Chemistry,2017,229:769−778. doi: 10.1016/j.foodchem.2017.03.004
[35] AHN D U, LEE E J, FENG X, et al. Mechanisms of volatile production from non-sulfur amino acids by irradiation[J]. Radiation Physics and Chemistry,2016,119:64−73. doi: 10.1016/j.radphyschem.2015.09.008
[36] ZHANG W, XIAO S, AHN D U. Protein oxidation: Basic principles and implications for meat quality[J]. Critical Reviews in Food Science Nutrition & Metabolism,2013,53(11):1191−1201.
[37] WEI J A, QS A, RONG Z A, et al. Unraveling proteome changes of irradiated goat meat and its relationship to off-flavor analyzed by high-throughput proteomics analysis[J]. Food Chemistry,2021:337.






 下载:
下载:


 下载:
下载:
