Acetylcholinesterase Inhibition Effect of Flavonoids from Flemigia philippinensis
-
摘要: 为研究蔓性千斤拔活性成分对乙酰胆碱酯酶(Acetylcholinesterase, AChE)的抑制作用,本文以蔓性千斤拔的根为研究对象,采用不同溶剂系统针对黄酮成分进行分级萃取,进一步分离纯化出四种黄酮化合物,采用可逆抑制动力学方法研究了不同溶剂提取物和四种黄酮化合物对AChE的抑制作用及相关抑制常数。结果表明,蔓性千斤拔根的不同溶剂提取物及四种黄酮化合物(Genistein、Philippin C、Philippin D和Flemiphilippinone A)对AChE有较强的抑制作用, 抑制类型为混合型抑制(Mix type),半抑制浓度(IC50)在(57.86±0.67)~(127.28±1.22)µmol/L之间,抑制常数Ki为(54.8±0.43)~(120.58±1.35)µmol/L。研究结果可为发现高效乙酰胆碱酯酶抑制剂先导化合物及千斤拔食品的开发和综合利用提供理论基础及试验依据。Abstract: In order to study the inhibitory effect of the active ingredients of the Flemigia philippinensis roots on acetylcholinesterase (AChE), the roots of the Flemigia philippinensis were used as raw materials, and different solvent systems were applied to fractionate and extract flavonoids, and then further separate and purify them. Reversible inhibition kinetics method were applied to study the inhibitory effect of different solvent extracts and four flavonoids on AChE and related constants. The results showed that the different solvent extracts and the four favonoids (Genistein, Philippin C, Philippin D and Flemiphilippinone A) from the roots of Flemigia philippinensis had a strong inhibitory effect on AChE. The inhibition type was mixed type inhibition, and the half inhibition concentration (IC50) was (57.86±0.67)~(127.28±1.22) µmol/L, the inhibition constant Ki was (54.8±0.43)~(120.58±1.35) µmol/L. The research results could provide a theoretical basis and experimental basis for the discovery of high-efficiency acetylcholinesterase inhibitor lead compounds and the development and comprehensive utilization of Flemigia philippinensis related foods.
-
Keywords:
- Flemigia philippinensis /
- acetylcholinesterase /
- inhibitor /
- flavonoids /
- inhibition kinetics
-
随着全球人口急剧老龄化,老年人面临着认知和记忆功能不断恶化,日常生活行为减退并伴有各种神经症状和行为障碍等困境[1]。造成这种现象的一个重要原因是大脑内的乙酰胆碱受到乙酰胆碱酯酶的分解[2]。乙酰胆碱酯酶是生物神经传导中的一种关键性的酶,催化乙酰胆碱水解为胆碱和乙酸,可引起大脑中乙酰胆碱水平降低,影响神经信号在生物体内的正常传导,造成记忆丧失,神经系统退化等严重后果,导致增加神经突触受体活化的时间,乙酰胆碱缺失,神经信号传导失败[3-4]。因此,抑制乙酰胆碱酯酶活性,提高乙酰胆碱浓度水平成为有效控制及改善阿尔兹海默症的主要对策之一[5]。为抑制乙酰胆碱酯酶的活性,依据酶结构特点,许多乙酰胆碱酯酶抑制剂被合成出来,其中包括吖啶类化合物他克林[6],哌啶类化合物多奈哌齐[7],氨基甲酸酯类化合物毒扁豆碱及其衍生物[8]等,这些有机合成的抑制剂存在着半衰期短,对外围胆碱能系统具有副作用等问题[9]。近年来,研究的热点领域是从天然产物中获取乙酰胆碱酯酶抑制剂,主要的活性物质包括姜黄素衍生物、黄酮类化合物和生物碱类等[10]。从天然植物中寻找抑制乙酰胆碱酯酶的活性成分具有选择范围广、半衰期长和副作用小等优点,成为目前先导化合物筛选的最主要方式。
豆科(Leguminosae)千斤拔属(Flemingia Roxb. ex W. T. Ait.)植物,主要分布于热带亚洲、非洲和大洋洲等地。在我国主要生长于西南、中南和东南部各省,主要为蔓性千斤拔(Flemigia philippinensis)和大叶千斤拔(Flemingia macrophylla)两个品种[11-13]。作为食材,千斤拔可与鸡脚,猪尾等材料混合,用于煲汤,有舒缓疲劳,健脑益智等作用[14-15]。研究表明,千斤拔的提取物表现出消炎镇痛[16]、免疫增强[17]、促进周围和感觉神经损伤修复[18]、类神经营养因子及对脑组织、血脑屏障保护[19]等作用。千斤拔化学组成研究结果表明黄酮化合物是千斤拔属植物最为主要的化学组成物质[20-21],其在生物体内或体外表现出抗炎症[22]、抗氧化[23]、抗肿瘤[24]和抗微生物[25]等生物活性作用。黄酮类化合物的上述活性构成了乙酰胆碱酯酶抑制活性的基础,有研究表明甘草苷、姜黄素、大豆异黄酮等黄酮类化合物都表现出较好的抑制效果,如姜黄素对乙酰胆碱酯酶的半抑制浓度达到67.69 µmol/L;甘草苷能够特异性的抑制乙酰胆碱酯酶活性,促进神经干细胞分化为胆碱能神经元等[26],黄酮化合物分子汇总的苯环、酮羰基等内在功能团可以与乙酰胆碱酯酶的双靶点结构,更易于抑制胆碱酯酶活性。
为进一步挖掘千斤拔植物的生物活性作用,本文以蔓性千斤拔根中黄酮化合物为目标分子。结合体外活性实验筛选,采用柱层析等分离技术手段,从蔓性千斤拔植物中快速、高效的发现抑制乙酰胆碱酯酶的黄酮类化合物。重点针对强效抑制剂,通过体外酶学动力学实验试验,进行构效关系分析研究,并对抑制动力学进行探讨。为发现新型乙酰胆碱酯酶抑制先导化合物及千斤拔植物的深层次利用提供理论和实验数据支持。
1. 材料与方法
1.1 材料与仪器
蔓性千斤拔 采购于广西省梧州市中药材市场,广西药用植物园赵以民博士,鉴定为豆科千斤拔属植物蔓性千斤拔(Flemingia philippinensis)的干燥根;电鳗乙酰胆碱酯酶(AChE)、碘化硫代乙酰胆碱、5,5′-二硫代双(2-硝基苯甲酸) 美国Sigma-Aldrich公司;二甲基亚砜、磷酸二氢钾、磷酸氢二钠 均来自于天津凯迪化学试剂厂;GF254薄层色谱硅胶 青岛海洋化工厂;所有分离用有机溶剂 均为国产分析纯。
FW177型中草药粉碎机 天津市泰斯特仪器有限公司;EL104电子分析天平 梅特勒-托利(上海)有限公司;AM500Hz核磁共振仪 德国Bruker公司;JMS-700高分辨率(HR)质谱仪 日本JEOL公司;LC Forte/R 100 中压色谱仪 日本YMC公司;SpectraMax M3多模式微孔板读数器 美国Molecular Devices 公司。
1.2 实验方法
1.2.1 千斤拔预处理
取蔓性千斤拔的根,利用粉碎机粉碎,过80目筛,在室温条件下避光干燥,贮存备用。
1.2.2 不同有机溶剂对千斤拔活性成分提取
采用宋庆等[27]的提取方法,略作调整,具体步骤如下:取干燥粉末状的千斤拔20 g,选用水、氯仿、乙酸乙酯、甲醇和正丁醇,以料液比为1:10 g/mL,提取温度60 ℃,回流提取2次,提取40 min,合并2次滤液,真空浓缩,得到不同溶剂系统的千斤拔提取物,备用。
1.2.3 总酚含量测定
采用福林酚法,参照文献[28]中的方法,略有改动。具体步骤如下:准确吸取没食子酸标准储备液0.0、0.2、0.4、0.6、1.0、1.5 mL分别置于10 mL容量瓶中,用60%乙醇溶液定容,得到没食子酸工作液。然后分别移取没食子酸工作液1.0 mL于10 mL比色管中,加入2.5 mL福林酚试剂,摇匀,加入2.5 mL,15% Na2CO3溶液,加水定容至刻度,摇匀。在40 ℃水浴60 min,静置冷却20 min。配制成浓度为0、4、8、12、20、30 mg/L的标准系列,测定其吸光度值。以浓度为横坐标,吸光度为纵坐标,得到标准曲线y=0.0153x−0.003, R2=0.9996。千斤拔总酚含量的测定按上述方法进行,将样品测得的吸光值代入标准曲线,计算得出的千斤拔根总酚含量用 mg GAE(gallic acid equivalent)/g 表示。
1.2.4 总黄酮含量测定
采用硝酸铝显色法[29],略作改动,具体过程如下:称取20 mg芦丁标准品,定容于100 mL容量瓶中,分别取1.0、2.0、3.0、4.0、5.0 mL于10 mL离心管中,加入0.3 mL,5% NaNO2摇匀,静置6 min后加入0.3 mL 10% AlCl3静置6 min。然后加入4.0 mL,10% NaOH,再用70 %乙醇定容至10 mL,静置15 min,然后在510 nm处测定反应液的吸光值,以吸光值为纵坐标,标准溶液中芦丁的质量为横坐标,得到标准曲线 y=0.755x+0.0073, R2=0.9997,根据曲线方程计算样品中的总黄酮含量。取1.0 mL样品溶液按照上述操作,对吸光度进行测定,测得的吸光值代入标准曲线,总黄酮含量以芦丁当量进行表达(RE, μg/mg)
1.2.5 乙酰胆碱酯酶活性的抑制作用测定
采用Ellmann光度法[30]检测,通过检测底物乙酰基硫代胆碱(Acetylthiocholine, AtCh)在乙酰胆碱酯酶(AChE)催化下水解,生成硫代胆碱(Thiocholine),硫代胆碱与显色剂DTNB(二硫二硝基苯甲酸)作用,产生黄色的5-硫-2-硝基苯甲酸(TNB),在412 nm测定其吸光度值,略作调整,具体操作过程如下。
在96孔酶标板中加入150 μL磷酸盐缓冲液(0.1 mol/L, pH8.04),然后加入不同稀释浓度的样品30 μL,再加入50 μL DTNB,然后加入20 μL稀释后的酶液(0.54 U/mL),阴性对照孔不加酶液,以磷酸盐缓冲液代替,在微孔振荡器上混合均匀,置于37 ℃培养箱中保温5 min,取出后在所有微孔中加入50 μL底物(AtCh, 3 mmol/L),用酶标仪测定样品动力学速率。条件为λ=405 nm,读数 10 s,间隔28 s,混合3 s。
抑制率(%)=[1−(A样品−A阴性A空白−A阴性)]×100 式中:A样品表示加入样品的吸光度;A阴性表示以磷酸盐缓冲代替酶液反应体系的吸光度;A空白表示正常底物的反应体系的吸光度
IC50值为抑制AChE活力50%所需要的样品提取液的浓度,mg/mL。IC50值越小,表明样品对AChE的抑制作用越强。
1.2.6 蔓性千斤拔中乙酰胆碱酯酶抑制剂分离纯化
蔓性千斤拔干燥的根600 g粉碎,采用甲醇回流提取,提取时间为40 min,料液比为1:10 g/mL,甲醇体积分数为70%,提取温度60 ℃,提取两次,合并滤液,真空浓缩,得到深红色胶状物(97 g)。
采用硅胶柱层析对提取物进行初次分离,使用正己烷和乙酸乙酯浓度梯度(50:1~1:1)洗脱,得到组分(A~E)。将组分B(2.8 g)通过中压反向C18硅胶柱进行分离,使用甲醇和水梯度洗脱(0~100%),在20 mL/min条件下洗脱,得到11个亚级组分(B1~B11)。其中B9~B10(126 mg)在Sephadex-LH色谱柱上使用甲醇~水(9:1)条件洗脱得到了化合物2(25 mg)。将组分D(2.6 g)通过中压反向C18色谱柱进行分离,使用甲醇和水(0~100%),在20 mL/min的流速下梯度洗脱,得到8个亚组分(D1~D8)。合并富含化合物1的D3~D4馏分(76 mg),并使用甲醇-水(4:1)在C18柱上进行洗脱分离,得到化合物1(28 mg);组分E(1.3 g),使用C18柱进行分离,甲醇和水溶液(0~80%),在20 mL/min的流速下梯度洗脱,得到亚级馏分(E1~E5)。合并富含3和4的亚级组分E1和E2(104 mg),并使用甲醇~水(85:15)通过C18柱进一步纯化,得到化合物3(13 mg)和4(9 mg),从而得到化合物1~4。
1.2.7 类黄酮结构鉴定方法
1.2.7.1 高分辨率质谱分析
质谱分析(ESI-MS):分别取1.2.6中分离纯化的少量化合物 1~4,用色谱纯甲醇进行充分溶解,通过 JMS-700高分辨率质谱仪进行分析,采用负离子扫描模式,雾化气和干燥气为高纯氮气,喷雾气压5 Psi,干燥气流速为4.0 L/min,干燥气温度为 180 ℃,毛细管电压为3000 V,扫描范围为质荷比 50~1000(m/z)。
1.2.7.2 核磁共振分析
分别称取1.2.6中分离纯化后的一定量化合物1~4,使用氘带甲醇或氯仿进行溶解,置于核磁管中,用 AM500Hz 超导核磁共振波谱仪进行测定,以四甲基硅烷(TMS)作内标,化学位移δ 和偶合常数 J 分别采用 ppm 以及 Hz 表示,1H-NMR 以及13C- NMR 的工作频率分别为 600、150 MHz。
1.2.8 乙酰胆碱酯酶的动力学特征
通过酶标仪测得产物(TNB)吸光度值A的变化反映了AChE催化反应产物硫代胆碱浓度的变化。在不同底物浓度下,在AChE最佳催化反应区间内,即Km值基本保持恒定,每间隔10 s,测定不同底物浓度(0.009、0.0045、0.0022 mmol/L)时反应产物硫代胆碱与显色剂DTNB生成产物的吸光度值A。用(AChE催化反应时间)~A(测得的吸光度值)作图,得到的直线斜率反映了AChE催化反应的速率1/Vmax,接着按照Lineweaver-Burk的双倒数作图法,可确定抑制作用的类型。
1.3 数据处理
所有试验重复3次,结果表示为平均值±标准差。采用SPSS 19.0和Origin 10.0软件对数据进行分析。
2. 结果与分析
2.1 不同溶剂提取物总酚含量
根据“相似相容”原理,不同溶剂对蔓性千斤拔根的总酚提取率有一定差距,结果如图1所示。提取物的总酚含量具有显著区别(P<0.05),其中甲醇提取物的总酚含量最高为(14.03 mg GAE/g DM),氯仿提取物的总酚含量为(6.09 mg GAE/g DM)、乙酸乙酯提取物总酚含量为(6.15 mg GAE/g DM)和正丁醇提取物总酚含量为(6.75 mg GAE/g DM)次之,水提取物总酚含量为(1.4 mg GAE/g DM)最低。多酚类物质属于中等极性物质,在极性相似的甲醇中溶解度最高。
2.2 不同溶剂提取物总黄酮含量
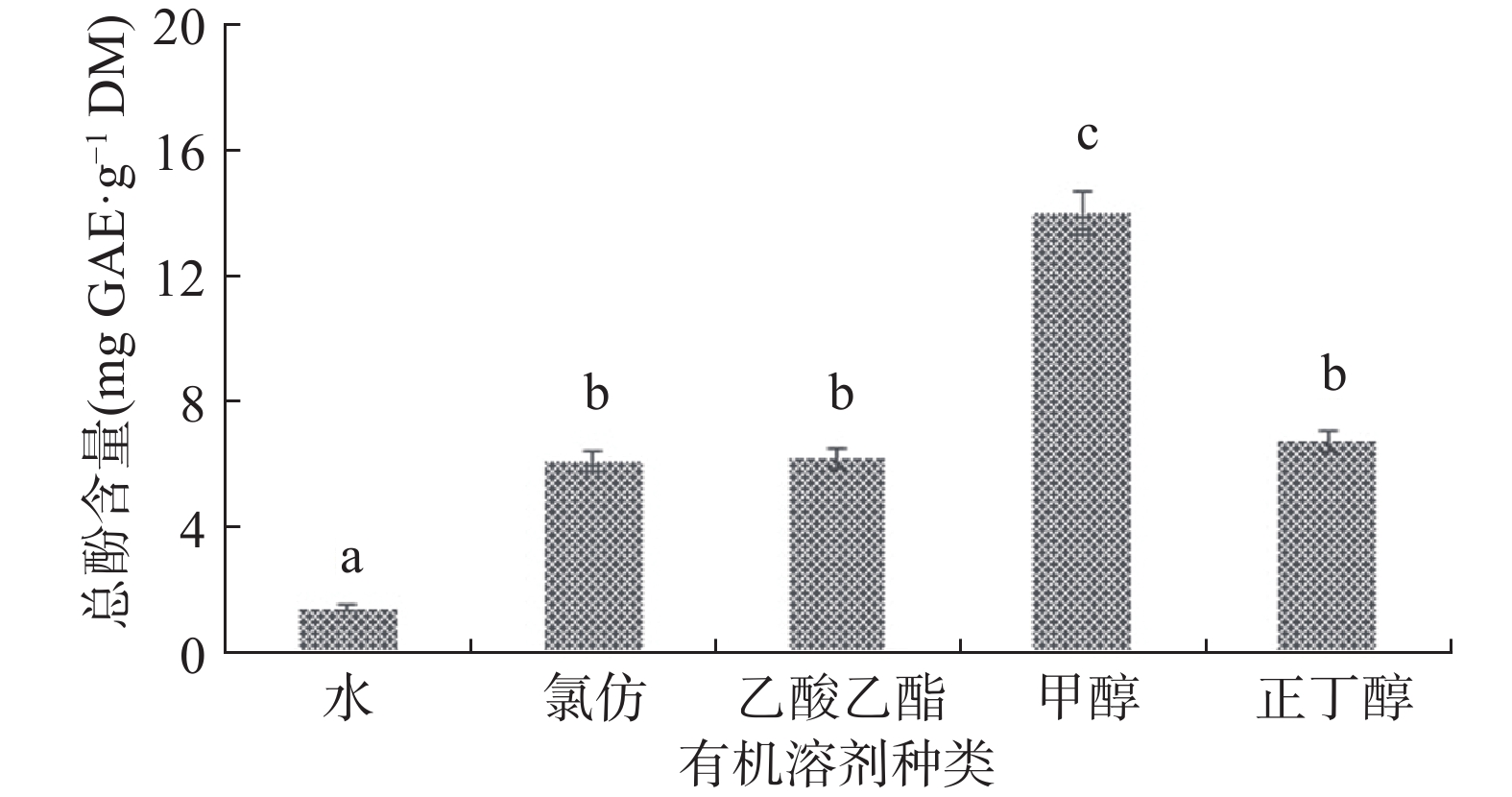
黄酮化合物作为多酚类化合物的一大类,具有和酚类相近的极性,因此总黄酮含量的提取率趋势与总酚含量具有相关性,结果如图2所示。由图2可得到不同有机溶剂提取物的总黄酮含量大小顺序依次为:甲醇提取物总黄酮含量>氯仿提取物总黄酮含量>乙酸乙酯提取物总黄酮含量>正丁醇提取物总黄酮含量>水提取物总黄酮含量,含量趋势和总酚含量相似,根据研究报道,千斤拔属植物中类黄酮化合物含量最为丰富,生物活性最为多样[13-14,17]。
2.3 不同溶剂提取物对乙酰胆碱酯酶的抑制能力
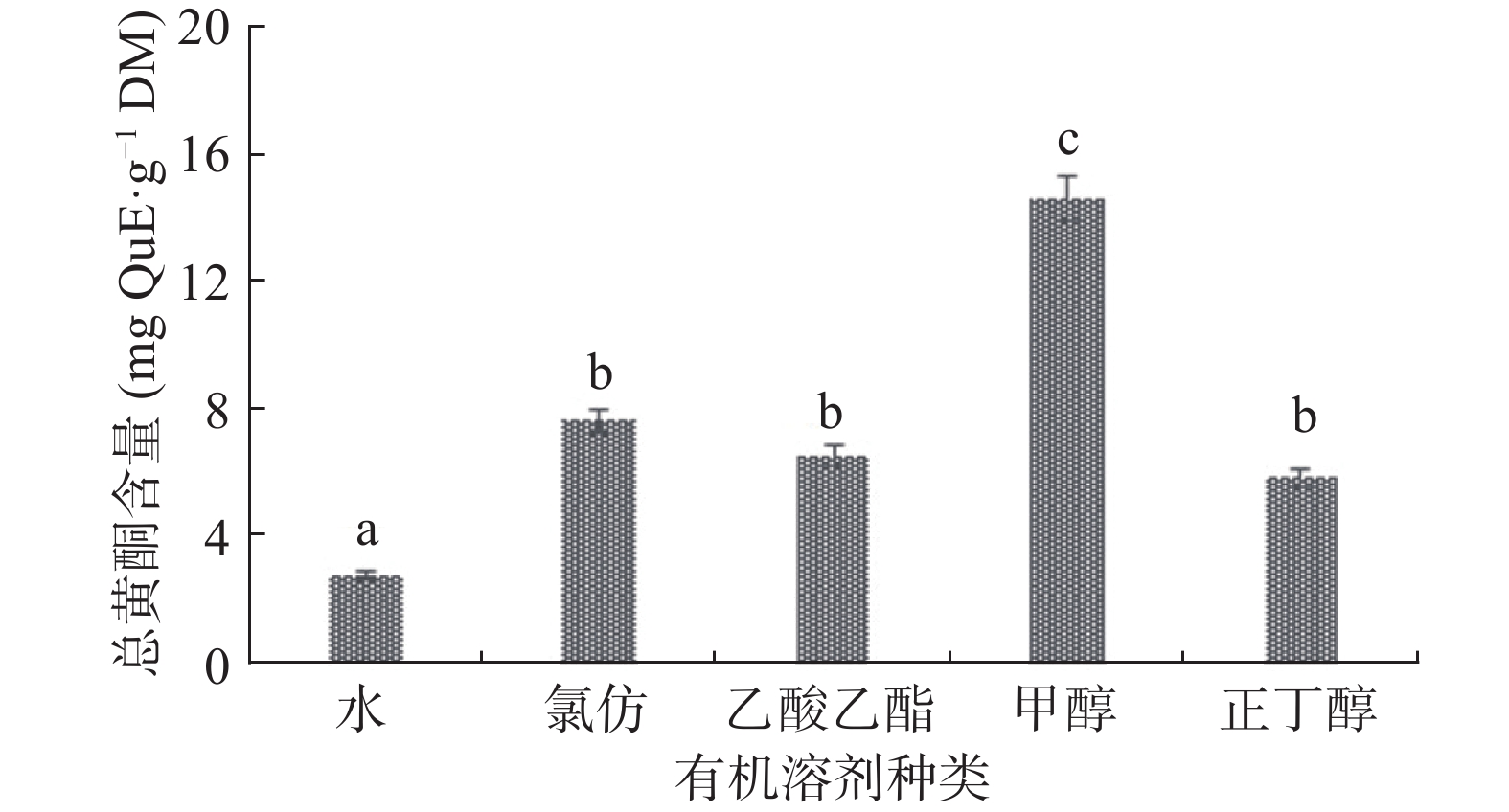
提取物总酚和总黄酮含量的差距是造成不同溶剂系统提取物抑制能力差别的主要原因,实验结果如图3所示。由图3所示,可以看出不同溶剂的提取物对乙酰胆碱酯酶的抑制能力存在一定差异,其中抑制效果由强到弱,分别为甲醇提取物半抑制率为(IC50=12 μg/mL)、正丁醇提取物半抑制率为(IC50=18 μg/mL)、氯仿提取物半抑制率为(IC50=29 μg/mL)、乙酸乙酯提取物半抑制率为(IC50= 31 μg/mL)和水提取物半抑制率为(IC50=45 μg/mL)。
2.4 分离纯化类黄酮的结构鉴定
通过分离纯化得到4种黄酮化合物如图4所示,它们的核磁共振氢谱、碳谱和质谱的相关信息如下。
2.4.1 化合物1
白色粉末,ESI-MS: m/z 271 [M+H]+,分子式为C15H10O5, 1H-NMR(500 MHz, CDCl3), δ: 8.05(1H, s, H-2), 6.22(1H, s, H-5), 6.33(1H, s, H-8), 7.38(1H, d, J = 8.5, H-2′), 7.38(1H, d, J = 8.5, H-3′), 6.86(1H, d, J = 8.5, H-5′), 6.86(1H, d, J = 8.5, H-6′). 13C-NMR(CDCl3)δ:181.62(C-4), 165.04(C-7), 163.94(C-5), 159.03(C-9), 158.40(C-4′), 154.27(C-2), 131.16(C-2′, C-6′), 124.01(C-3), 123.04(C-1′), 115.95(C-3′, C-5′), 106.12(C-10), 99.84(C-6),94.47(C-8)。与文献[31]对照,其波谱数据基本一致,故确定该化合物为染料木黄酮(Genistein)。
2.4.2 化合物2
黄色油状物,ESI-MS: m/z 491 [M+H]+,分子式为C31H38O5, 1H-NMR(CDCl3, 500 MHz), δ:1.25(3H, s, H-13), 1.39(3H, s, H-18), 1.48(3H, s, H-12), 1.53(3H, s, H-17), 1.61(3H, s, H-23), 1.68(3H, s, H-22), 2.30(1H, m, H-14β), 2.48(1H, m, H-14α), 2.82(2H, m, H-11), 3.00(1H, m, H-19β), 3.08(1H, m, H-19α), 3.20(2H, m, H-10), 3.71(3H, s, -OCH3), 4.80(1H, t, J = 8.0 Hz, H-15), 5.00(1H, t, J = 7.1 Hz, H-20), 5.69(1H, d, J = 10.3 Hz, H-3), 6.18(1H, d, J = 10.3 Hz, H-4), 6.75(1H, d, J = 8.6 Hz, H-3′), 6.75(1H, d, J = 8.6 Hz, H-5′), 7.13(1H, d, J = 8.6 Hz, H-2′), 7.13(1H, d, J = 8.6 Hz, H-6′), 18.8(1H, s, 7-OH). 13C-NMR(CDCl3)δ: 18.1(C-18), 18.3(C-22),21.6(C-19 α and β), 26.1(C-23), 26.3(C-17),29.1(C-12),29.9(C-13), 30.6(C-11), 42.1(C-10), 45.0(C-14 α and β),53.2(C-4a), 55.7(4′-OCH3),82.7(C-2), 108.5(C-6), 114.2(C-3′), 114.2(C-5′),115.6(C-8), 117.7(C-15), 123.3(C-20),123.7(C-4), 129.9(C-6′),129.9(C-2′), 132.0(C-3), 132.1(C-21), 133.8(C-1′), 137.2(C-16),158.3(C-4′),168.6(C-8a),190.0(C-7),193.9(C-5),202.4(C-9),与文献[32]对照,其波谱数据基本一致,故确定该化合物为Philippin C。
2.4.3 化合物3
黄色油状物,ESI-MS: m/z 491 [M+H]+,分子式为C31H38O5,1H-NMR(CDCl3, 500 MHz), δ: 1.35(3H, s, H-12), 1.35(3H, s, H-13), 1.58(3H, s, H-17), 1.58(3H, s, H-18), 1.58(3H, s, H-22), 1.58(3H, s, H-23), 1.74(2H, t, J = 6.7 Hz, H-3), 2.41(2H, t, J = 6.7 Hz, H-4), 2.66(2H, m, H-14α and β), 2.66(2H, m, H-19α and β), 2.95(2H, m, H-11), 3.23(2H, m, H-10), 3.82(3H, s, 4′-OCH3), 4.81(1H, m, H-15), 4.81(1H, m, H-20), 6.86(1H, d, J = 8.4 Hz, H-3′), 6.86(1H, d, J= 8.4 Hz, H-5′), 7.15(1H, d, J = 8.4 Hz, H-2′), 7.15(1H, d, J = 8.4 Hz, H-6′), 18.3(1H, s, 7-OH). 13C-NMR(CDCl3)δ: 21.6(C-17 and 23), 29.3(C-12 and 13),32.3(C-18 and 22), 33.8(C-11), 41.2(C-14 and 19),45.5(C-10),58.9(4′-OCH3), 60.6(C-8), 84.8(C-2), 109.7(C-4a),111.4(C-6), 117.4(C-3′ and 5′),118.1(C-4), 121.7(C-15 and 20), 126.8(C-3), 133.0(C-2′ and 6′),137.0(C-1′), 138.3(C-16 and 21), 161.4(C-4′),176.0(C-8a), 189.7(C-5),198.8(C-7), 205.5(C-9),与文献[33]对照,其波谱数据基本一致,故确定该化合物为Philippin D。
2.4.4 化合物4
黄色油状物,ESI-MS: m/z 509 [M+H]+,分子式为C31H40O6,1H-NMR signals at δ 3.10(1H, m, H-19),3.00(1H, dd, J = 7.5, 14.5 Hz, H-19), 5.11(1H, t, J = 7.5 Hz, H-20), 1.72(3H, s, H-22)and 1.68(3H, s, H-23),δ 2.50(1H, dd, J =8.0, 14.0 Hz, H-14), 2.39(1H, dd, J = 7.5, 14.0 Hz, H-14), 4.96(1H, t, J = 7.5 Hz, H-15), 1.66(3H, s, H-17)and 1.52(3H, s, H-18),4.51(1H, dd, J = 6.5, 10.0 Hz, H-2). 13C-NMR(CDCl3)δ: 17.8(C-18), 21.5(C-19), 23.8(C-13), 25.6(C-23),25.8(C-17), 26.6(C-12), 30.6(C-3), 31.0(C-10),40.0(C-9), 55.2(4′-OCH3), 60.6(C-3a), 71.2(C-11), 90.5(C-2), 106.5(C-7),107.3(C-5), 113.7(C-2′), 113.8(C-6′), 117.1(C-15), 129.4(C-3′), 129.4(C-5′), 132.1(C-21),133.3(C-1′), 137.0(C-16), 158.0(C-4′), 175.1(C-4), 192.3(C-6),与文献[34]对照,其波谱数据基本一致,故确定该化合物为Flemiphilippinone A。
2.5 四种黄酮化合物对乙酰胆碱酯酶的抑制活性
黄酮类化合物对AChE抑制作用主要由苯环、酮羰基及和苄基等官能团决定,且分子量要与典型化合物相似,能同时与AChE中心和外周两个活性位点发生结合,才可拥有较强的抑制活性。而常见的生物碱AChE抑制剂如多奈哌齐、利伐司替明等抑制剂仅可结合乙酰胆碱酯酶的一个活性位点,黄酮化合物对乙酰胆碱酯酶的抑制活性具有一定的结构优势。
为研究蔓性千斤拔中黄酮化合物抑制乙酰胆碱酯酶的机理,在整个实验过程中,始终保持酶浓度的恒定,选择不同底物浓度,将得到反应过程的吸光度随时间变化曲线,得到米氏方程曲线如图5所示。由图5可以看出,在相同底物浓度条件下,化合物3的反应速率>化合物2 的反应速率>化合物4的反应速率>化合物1的反应速率,原因可能在于异戊二烯基团在空间的同侧更易于与酶结合,使得抑制活性增强。同时,所有化合物参与的酶促反应速率提高的原因是底物浓度非线性增加,这种趋势,符合米氏方程规律,因此可以通过米氏方程相关的酶动力学试验,对蔓性千斤拔根中黄酮化合物对AChE的抑制类型进行测定。
2.6 四种黄酮化合物对乙酰胆碱酯酶抑酶动力学分析
蔓性千斤拔黄酮化合物对乙酰胆碱酯酶抑制过程中,整个酶促反应符合米氏方程,可通过双倒数作图法(Lineveaver-Burk),以四种黄酮化合物在不同浓度下测得AChE催化反应倒数对底物浓度倒数关系作图。
在抑制剂可逆抑制类型中,根据底物、酶和抑制剂的关系可分为竞争性抑制、非竞争性抑制、反竞争性抑制和混合型抑制四种不同类型。可通过双倒数曲线判断抑制类型[35]。利用双倒数作图法,以不同浓度的化合物1~4测得AChE催化反应速率倒是(1/[v])对底物浓度的倒数(1/[s])作图,如图6~图9所示。
由图6~图9可知,在无抑制剂和加入不同浓度的抑制剂(化合物1~4)条件下,几条直线均相交于第二象限,且在X坐标轴和Y坐标轴交点都不同,乙酰胆碱酯酶的表观米氏常数(Km)随着类黄酮浓度的增加而增加,而最大的酶促反应速率在减小,根据以上实验结果,从抑制剂可逆抑制动力学特征得出,从蔓性千斤拔中分离的化合物1~4,对乙酰胆碱酯酶的抑制行为是混合型抑制,表明类黄酮既可以和酶单独结合,也可以与酶和底物复合物结合,抑制酶的催化活性[35]。抑制常数Ki可通过双倒数曲线求得,且化合物1~4的半抑制浓度(IC50),如表1所示。
表 1 分离的化合物1~4对乙酰胆碱酯酶的抑制作用Table 1. Inhibitory effect of isolated compounds 1~4 on acetylcholinesterase化合物 IC50a(µmol/L) 动力学模式(Kib, µmol/L) 1 127.28±1.22 混合型(120.58±1.35) 2 68.54±0.72 混合型(62.42±0.62) 3 57.86±0.67 混合型(54.8±0.43) 4 97.65±1.03 混合型(86.24±0.76) 注:a.每组实验重复三次;b.抑制常数值。 3. 结论
通过不同溶剂系统富集蔓性千斤拔的主要化学成分总酚和总黄酮,结果表明甲醇作为溶剂对于总酚和总黄酮提取率最高,正丁醇、氯仿和乙酸乙酯提取物无明显差别,水提取物提取率最低。再利用不同溶剂提取物对乙酰胆碱酯酶的抑制作用进行试验,实验结果与提取试验呈正相关趋势,甲醇提取物抑制效果最佳。
将甲醇提取物通过柱层析等分离手段进行系统纯化,利用NMR和EI-MS等分析手段,鉴定出4种类黄酮化合物,并对四种类黄酮对乙酰胆碱酯酶抑制作用进行深入研究,结果表明,四种化合物对乙酰胆碱酯酶的抑制类型为混合型,半抑制浓度(IC50)在(57.86±0.67)~(127.28±1.22)µmol/L之间,抑制常数Ki为(54.8±0.43)~(120.58±1.35)µmol/L。实验结果表明,蔓性千斤拔提取物及其含有的类黄酮化合物能够较好的抑制乙酰胆碱酯酶的活性,具有较大的应用潜质,该研究可为植物源活性分子对神经退行性疾病改善的研究提供理论基础,为蔓性千斤拔的生理活性的拓展和功能产品的开发打下基础。
-
表 1 分离的化合物1~4对乙酰胆碱酯酶的抑制作用
Table 1 Inhibitory effect of isolated compounds 1~4 on acetylcholinesterase
化合物 IC50a(µmol/L) 动力学模式(Kib, µmol/L) 1 127.28±1.22 混合型(120.58±1.35) 2 68.54±0.72 混合型(62.42±0.62) 3 57.86±0.67 混合型(54.8±0.43) 4 97.65±1.03 混合型(86.24±0.76) 注:a.每组实验重复三次;b.抑制常数值。 -
[1] Uddin M S, Kabir M T, Niaz K, et al. Molecular insight into the therapeutic promise of flavonoids against alzheimer's disease[J]. Molecules,2020,25(6):1266−1296. doi: 10.3390/molecules25061266
[2] Zhang W J, Tarutani A, Newell K L, et al. Novel tau filament fold in corticobasal degeneration[J]. Nature,2020,580:283−287. doi: 10.1038/s41586-020-2043-0
[3] Benfante R, Lascio S D, Cardani S, et al. Acetylcholinesterase inhibitors targeting the cholinergic anti-inflammatory pathway: A new therapeutic perspective in aging-related disorders[J]. Aging - Clinical and Experimental Research,2019,33:823−834.
[4] Stanciu G D, Luca A, Rusu R N, et al. Alzheimer's disease pharmacotherapy in relation to cholinergic system involvement[J]. Biomolecules,2019,10(1):40−61. doi: 10.3390/biom10010040
[5] Sharma P, Srivastava P, Seth A, et al. Comprehensive review of mechanisms of pathogenesis involved in Alzheimer's disease and potential therapeutic strategies[J]. Progress in Neurobiology,2019,174:53−89. doi: 10.1016/j.pneurobio.2018.12.006
[6] Fancellu G, Chand K, Tomás D, et al. Novel tacrine–benzofuran hybrids as potential multi-target drug candidates for the treatment of Alzheimer's Disease[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2020,35(1):211−226. doi: 10.1080/14756366.2019.1689237
[7] Sharma K. Cholinesterase inhibitors as Alzheimer's therapeutics[J]. Molecular Medicine Reports,2019,20(2):1479−1487.
[8] Saxena M, Dubey R. Target enzyme in Alzheimer's disease: Acetylcholinesterase inhibitors[J]. Current Topics in Medicinal Chemistry,2019,19(4):264−275. doi: 10.2174/1568026619666190128125912
[9] Harald H, Marsel M M, Claudio A C, et al. The cholinergic system in the pathophysiology and treatment of Alzheimer's disease[J]. Brain A Journal of Neurology,2018,141:1917−1933. doi: 10.1093/brain/awy132
[10] 王晓珍, 王蓉. 阿尔茨海默病的药物治疗及研发进展[J]. 中国新药杂志,2019,28(24):2960−2964. [Wang X Z, Wang R. Drug treatment and development progress of Alzheimer's disease[J]. Chinese Journal of New Drugs,2019,28(24):2960−2964]. [11] 国家药典委员会. 中国人民共和国药典2010 版·Ⅰ部[M]. 北京: 化学工业出版社, 2010: 附录22, 37, 47−49, 56−57. [12] Shiao Y J, Wang C N, Wang W Y, et al. Neuroprotectiveflavonoids from Flemingia macrophylla[J]. Planta medicine,2005,71(9):835−840. doi: 10.1055/s-2005-871297
[13] Li L, Deng X, Zhang L, et al. A new coumestan with immunosuppressive activities from Flemingia philippinensis[J]. Fitoterapia,2011,82(4):615−619. doi: 10.1016/j.fitote.2011.01.019
[14] Lai W C, Tsui Y T, Singab A N, et al. Phyto-SERM constitutes from Flemingia macrophylla[J]. International Journal of Molecular Sciences,2013,14(8):15578−15594. doi: 10.3390/ijms140815578
[15] 曾春兰, 钟正贤, 卢文杰, 等. 大叶千斤拔药理作用研究[J]. 中医药导报,2011,17(7):79−81. doi: 10.3969/j.issn.1672-951X.2011.07.042 [16] 陈一, 李开双. 千斤拔的镇痛和抗炎作用[J]. 广西医学,1993,15(2):77−79. [17] 李宝强, 宋启示. 大叶千斤拔根的化学成分[J]. 中草药,2009(2):179−182. doi: 10.3321/j.issn:0253-2670.2009.02.004 [18] 袁建新, 倪立新, 冯凯, 等. 千斤拔, 人参茎叶皂甙对 Wistar 大鼠坐骨神经损伤保护作用的实验研究[J]. 中国煤炭工业医学杂志,2002,5(4):405−405. [19] 赵节绪, 曲绍春. 千斤拔对实验性蛛网膜下腔出血急性期脑组织及血脑屏障作用[J]. 白求恩医科大学学报,1997,23(5):489−491. [20] Pan B S, Kuo Y Y, Chen T Y, et al. Inflammatory activities of two different species of a Chinese herb I-Tiao-Gung[J]. Life Sciences,2005,77(22):2830−2839. doi: 10.1016/j.lfs.2005.05.027
[21] Li H, Zhai F, Liu Z. Chemical constituents and bioactivities of the plants of Genus Flemingia Roxb. et Ait. (Leguminosae)[J]. Combinatorial Chemistry & High Throughput Screening,2012,15(8):611−622.
[22] Sun G, Xing C, Zeng L, et al. Flemingia philippinensis flavonoids relieve bone erosion and inflammatory mediators in CIA mice by downregulating NF- κ B and MAPK pathways[J]. Mediators of Inflammation,2019:1−11.
[23] Jeong K, Wang Y, Song Y, et al. Antioxidant activities of phenolic metabolites from Flemingia philippinensis Merr. et rolfe and their application to dna damage protection[J]. Molecules,2018,23(4):816. doi: 10.3390/molecules23040816
[24] Cho H D, Lee J H, Moon K D, et al. Auriculasin-induced ROS causes prostate cancer cell death via induction of apoptosis[J]. Food and Chemical Toxicology,2018,111:660−669. doi: 10.1016/j.fct.2017.12.007
[25] Wang Y, Curtis-Long M J, Yuk H J, et al. Bacterial neuraminidase inhibitory effects of prenylated isoflavones from roots of Flemingia philippinensis[J]. Bioorganic & Medicinal Chemistry,2013,21(21):6398−6404.
[26] 胡艳秋, 苏瑾, 田鸣. 中药抗阿尔茨海默病的研究进展[J]. 黑龙江医药科学,2016,39(6):12−15. doi: 10.3969/j.issn.1008-0104.2016.06.005 [27] 宋庆, 张赟彬. 豆豉中乙酰胆碱酯酶抑制剂的提取与富集工艺研究[J]. 食品工业科技,2011,32(3):285−288. [28] Xue Z, Feng W, Cao J, et al. Antioxidant activity and total phenolic contents in peel and pulp of chinese jujube (ziziphus jujuba mill) fruits[J]. Journal of Food Biochemistry,2010,33(5):613−629.
[29] 杨永涛. 罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D]. 广州: 华南理工大学, 2018. [30] Cho J K, Ryu Y B, Curtis-Long M J, et al. Cholinestrase inhibitory effects of geranylated flavonoids from Paulownia tomentosa fruits[J]. Bioorganic & Medicinal Chemistry,2012,20(8):2595−2602.
[31] Selepe M A, Drewes S E, Heerden F V. Total synthesis of the pyranoisoflavone kraussianone 1 and related isoflavones[J]. Journal of Natural Products,2010,73(10):1680−1685. doi: 10.1021/np100407n
[32] Wang Y, Yuk H J, Kim J Y, et al. Novel chromenedione derivatives displaying inhibition of protein tyrosine phosphatase 1B (PTP1B) from Flemingia philippinensis[J]. Bioorganic & Medicinal Chemistry Letters,2016,26(2):318−321.
[33] Wang Y, Kim J Y, Song Y H, et al. Highly potent bacterial neuraminidase inhibitors, chromenone derivatives from Flemingia philippinensis[J]. International Journal of Biological Macromolecules,2019,128:149−157. doi: 10.1016/j.ijbiomac.2019.01.105
[34] Li H, Zhai F, Yang M, et al. A new benzofuran derivative from Flemingia philippinensis Merr. et rolfe[J]. Molecules,2012,17(7):7637−7644. doi: 10.3390/molecules17077637
[35] 袁勤生. 现代酶学. 第二版[M]. 上海: 华东理工大学出版社, 2007: 25−50.





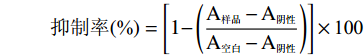
 下载:
下载:






 下载:
下载:
