Research Progress on Biological Activity and Modification Technology of Hesperidin
-
摘要: 橙皮苷是一种广泛存在于柑橘属水果中的天然黄酮类化合物,具有抗氧化、抗炎、抑菌和抗癌等多种生物活性。已有研究表明,橙皮苷因其水溶性和吸收性较差,导致生物利用度较低,因此国内外学者聚焦于橙皮苷进行物理、化学和生物改性,以增加其溶解性及生物利用度。本文对橙皮苷的生物学活性、改性技术以及改性衍生物的相关内容进行综述,为橙皮苷的高效利用提供理论支撑。Abstract: Hesperidin, a natural flavanone, predominantly existed in citrus fruit, has many biological functions, such as antioxidant, anti-inflammatory, bacteriostasis and anti-cancer. Current research suggests that hesperidin possesses a lower bioavailability due to its poor water solubility and absorption. Therefore, more and more attention from domestic and foreign scholars has been focused on physical, chemical and biological modification of hesperidin to increase its solubility and bioavailability. In this paper, the biological activity, modification technology and modification derivatives of hesperidin are reviewed to provide theoretical support for the efficient utilization of hesperidin.
-
黄酮类化合物是一类具有2-苯基色原酮结构的化合物,在柑橘类水果中含量丰富。黄酮类化合物的结构特殊,多种羟基、多甲氧基和糖苷的存在使其具有广泛的生物活性。柑橘类黄酮(如橙皮苷、柚皮苷)已被证明具有多项生理活性,包括抗氧化,抗炎,神经保护,抗癌和抗肥胖活性等[1]。柑橘类黄酮根据结构可分为黄酮、黄烷酮、黄酮醇、黄烷醇和花青素(仅在血橙中发现),其中黄烷酮的含量最丰富[2],橙皮苷属于典型的黄烷酮,广泛存在于橘子、橙子和柠檬等柑橘类水果中。我国橙子产量较大,主要以鲜食为主,少部分加工为罐头和果汁等商品。橙皮为橙子加工的副产物,每年大约会产生1000多万吨橙皮。其中,90%橙皮被废弃,造成环境污染和资源浪费。橙皮苷在橙皮中的含量最高,极具提取和利用价值[3]。然而,橙皮苷因水溶性和吸收性较差,导致生物利用度较低,因此对其进行结构修饰,将其转化为相应苷元、低糖苷或其他产物可增加其利用价值[4]。迄今为止,化学法和生物法被广泛应用于橙皮苷的修饰和改性,两者可明显提高其生物利用度。
本文就近年来关于橙皮苷生物学活性的研究现状和橙皮苷的改性技术、橙皮苷的改性衍生物进行阐述,并比较不同技术的优劣势,以期为橙皮苷的高效利用及工业化发展提供参考依据。
1. 橙皮苷的简介
1.1 橙皮苷的理化性质
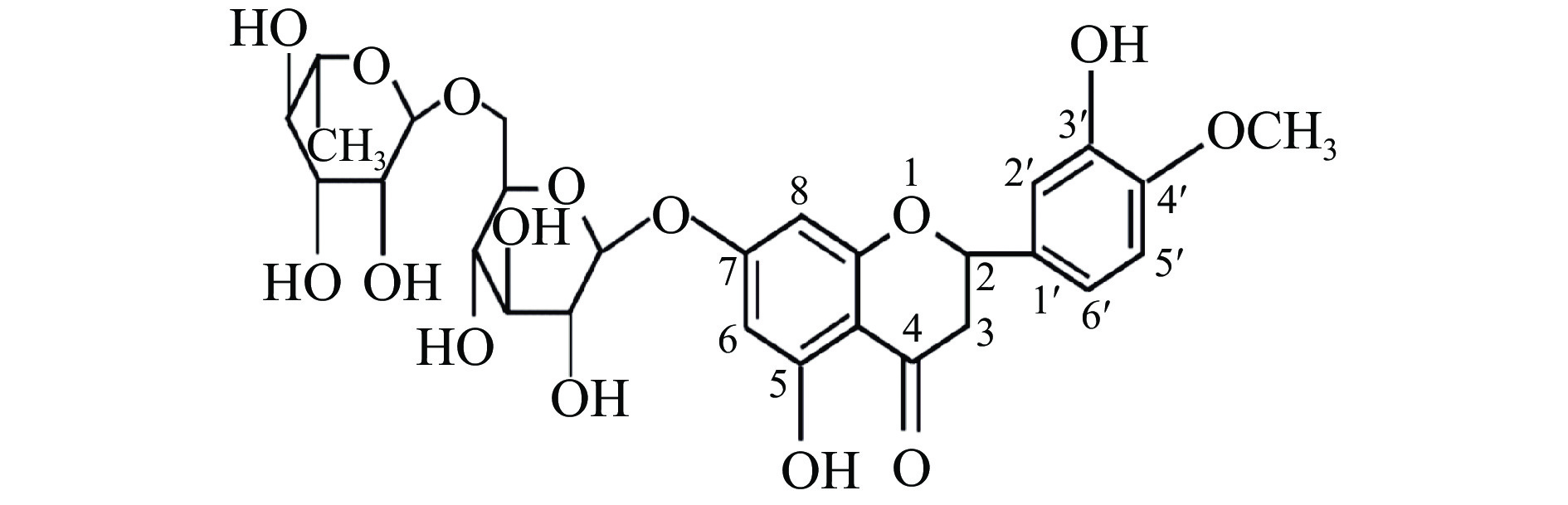
橙皮苷(Hesperidin)由橙皮素与一分子芸香糖组合而成,属二氢黄酮类衍生物,其母核为2-苯基色原酮类化合物,C7位连接芸香糖,分子式为C28H34O15,密度为1.65 g/cm3,相对分子质量为610.57[5],结构式见图1。橙皮苷分子中的酚羟基与Fe3+配合可抑制自由基引发剂的产生,具有一定的抗氧化能力,C4=O和C5-OH较高的电荷密度,成为橙皮苷有效发挥抗菌能力的关键[6]。
橙皮苷在固体条件下呈白色或淡黄色,常温下极难溶于水,几乎不溶于丙酮、苯及氯仿,但微溶于甲醇或热冰醋酸,易溶于二甲基甲酰胺、吡啶及稀碱溶液[7]。
1.2 橙皮苷的功能活性
1.2.1 抗氧化作用
适量的自由基是人体防御系统的重要组成部分,自由基过多或清除过慢时,它会通过攻击生命大分子物质及各种细胞器,造成机体在分子、细胞及组织器官水平的各种损伤,从而加速机体的老化[8]。有研究发现,在体外实验中橙皮苷能够清除羟基自由基、单线态氧和氮氧化物等物质,以防止自由基带来的损伤,橙皮苷的抗氧化活性在20~140 mg/mL范围内,随浓度的增加而增加[9]。另外,橙皮苷也可通过螯合金属离子来降低自由基引发剂的产生和清除自由基[10-11]。王晶[12]对柑橘各部分进行的总抗氧化活性评定表明,果皮的抗氧化能力最强,而橙皮苷是果皮中最主要的化合物。在此之前,曾有人发现橙皮苷的抗氧化活性机制不仅局限于其清除自由基的活性,还可通过ERK/Nrf2信号通路增强抗氧化细胞的防御能力[13]。Cao等[14]发现了橙皮苷能与壳聚糖(Chitooligosaccharide,COS)相互作用形成皮苷复合物(Hesp-COS),该复合物表现出较好的水溶性和更强的抗氧化性。
1.2.2 抗炎作用
炎症是免疫系统对一些有害物质造成的机体损伤的自然防御过程,是组织恢复稳态和功能的初始反应。有研究表明,橙皮苷可通过调节机体的免疫系统,即上调机体功能失调的T淋巴细胞,下调人体内活化过度的巨噬细胞,达到抵抗炎症的作用[15]。Tejada等[16]借助细胞模型和动物模型以及少量临床试验检测了橙皮苷的抗炎作用,结果表明橙皮苷能够显著降低炎症介质,如细胞因子、酶和粘附分子,其抗炎作用的分子基础似乎是通过信号通路,特别是核因子κβ通路介导的。然而,橙皮苷的作用机制尚不清楚,需要更深入的研究来阐明其分子抑制机制。
1.2.3 抗菌作用
抗菌作用是橙皮苷又一重要生理功能。抗菌机制研究中发现,橙皮苷可能通过改变细菌的细胞膜通透性,使得细胞内的蛋白质和核酸大分子物质穿过细胞膜泄漏到细胞外,从而影响细菌生长,达到抑菌效果[17]。研究表明,橙皮苷可有效抑制金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌和枯草芽孢杆菌的生长,它对这4种菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)分别是0.05和0.2 mg/mL[17]。另外,橙皮苷的抑菌活性和抗炎活性对于治疗痤疮有明显效果,刘光荣等[18]利用纸片扩散法检测橙皮苷对痤疮丙酸杆菌的影响,结果表明橙皮苷总量为5 nmol/disc时能够形成抑菌圈,抑菌圈直径为(13±0.4) mm,最低抑菌浓度(MIC)为4 μmol/L,因此橙皮苷有望开发成为抗痤疮化妆品添加剂。
1.2.4 抗癌作用
橙皮苷的抗癌机制并非直接杀死肿瘤细胞,而是借助于抗氧化、保护基因、抗炎和诱导肿瘤细胞的凋亡等途径实现[19]。有研究表明,橙皮苷可与相关蛋白相互作用,如蛋白激酶B(PKB)(Akt)、Fyn、MEK1、JAK1-STAT3(JAK激酶–信号转导与转录激活因子3),抑制癌细胞的恶性转化,抑制有丝分裂作用的靶向细胞周期素依赖性激酶1(CDK1)在癌细胞中的表达[20]。橙皮苷对人肝癌细胞(HepG2)的增殖具有浓度依赖的抑制作用,当样品质量浓度≥150 mg/L时,抑制效果明显增强[21]。近年来,癌中之王—乳腺癌的发病率逐年升高,有相关研究表明,橙皮苷对乳腺癌干细胞(Breast cancer stem cells,BCSCs)有一定的抑制作用,综合生物信息学进行的细胞毒性测试、乳腺球形成分析、集落形成实验、细胞周期分析、凋亡检测和定量实时逆转录酶-PCR六项体外实验表明,橙皮苷可抑制细胞增殖、乳腺球形成、集落形成以及在MCF-7 3D细胞上的迁移,并诱导MCF-7细胞G0/G1周期阻滞和凋亡[22]。同时,橙皮苷治疗降低了乳腺球中p21的mRNA水平,但增加了周期蛋白D1和p53的mRNA水平,因此橙皮苷能抑制BCSCs的增殖。但是,橙皮苷抗癌作用仍需进一步的分子机制研究,并开发橙皮苷作为BCSCs靶向药物。
1.2.5 对心血管系统的作用
橙皮苷是一种新的维生素并被命名为维生素P,主要功能为保护血管,降低毛细血管通透性,提高坏血病患者的生存率。此外,它还具备强心、降脂、抗血栓、抗血小板凝聚、增强毛细血管韧性等多种生理功能[23]。李晓霞等[24]通过建立高果糖加高脂饲料饮食诱导的的非酒精性脂肪肝病(NAFLD)模型发现,橙皮苷可明显降低高果糖+高脂饮食诱导的NAFLD小鼠肝脏组织中SREBP-1c表达,同时升高PPARα表达,进而调节血脂,保护肝脏。
1.3 橙皮苷应用的局限性
橙皮苷是由两个苯环通过中央三碳链相互连接而成的一种化合物,具有C3-C6-C3结构,水溶性较差,导致生物利用度较低。橙皮苷以芸香糖苷的形式存在,这种糖苷结构会降低橙皮苷的溶解性,使它们不易透过生物膜而被肠道吸收利用。有研究表明,橙皮苷在小肠内经过脱糖基化后,水溶性和稳定性会发生改变,并得到较好的吸收和利用[25]。所以,只有通过一定的技术手段对橙皮苷结构进行修饰才可提高其生物利用度,从而最大限度地发挥橙皮苷的作用。
2. 橙皮苷的改性技术
橙皮苷的产业化及高效利用的瓶颈在于其低水溶性和低生物利用度。因此,基于橙皮苷改性以增加其水溶性和生物利用度的课题已吸引越来越多学者的关注。迄今为止,橙皮苷改性的方法主要有两种:一是化学法;二是生物转化法(包括酶法和微生物发酵法)。化学法水解橙皮苷的成本较高、试剂损耗和环境污染严重;而生物转化法凭借其反应效率高、特异性强和反应条件温和等优势在一定程度上取代了化学法[4]。生物转化与化学转化相比,前者无论在转化速度还是转化质量等方面均表现出了明显的优势,被广泛应用于天然药物成分的合成转化和代谢机理研究[4];与酶法相比,微生物发酵法成本低、工艺简单,获得高活力酶的可能性更大。近年来,微生物发酵法因其易于培养、菌种资源丰富、产生的酶系强大等特点,在生物转化领域备受关注。
2.1 化学改性技术
2.1.1 橙皮苷的酸水解反应
橙皮苷的酸水解反应是指对橙皮苷进行脱糖基处理,即通过化学反应去掉一分子或两分子糖以增加其溶解度。
Grohmann等[26]将橙皮苷在稀硫酸的催化下高温(140 ℃)部分水解制备橙皮素单葡萄糖苷(Hesperitin-7-O-glucoside,HMG),并通过无水丙酮和低浓度乙醇水溶液萃取分离橙皮素和HMG。结果表明,橙皮苷去除一分子鼠李糖后形成的HMG,其水溶性是橙皮苷的50倍;而去除整个糖苷结构形成的橙皮素,其水溶性也明显高于橙皮苷。马丽萍[27]不仅研究了橙皮苷的水解工艺,对目标产物的分离纯化方法也做了新的尝试,在反应温度为75 ℃,体积分数为1%和5%的酸性条件下反应2 h后分别得到HMG和橙皮素,这两种化合物先经化学萃取法初步分离,然后经硅胶柱色谱分离纯化,二者的纯度均可达到95%以上。
2.1.2 橙皮苷的甲基化反应
将橙皮苷加到氢氧化钠溶液中,再加入甲基化试剂进行甲基化反应,从而制得甲基化橙皮苷。甲基化之后的橙皮苷水溶性明显增加,可改善毛细血管内壁的通透性和完整性,通常与维生素C联合使用以增强其作用,此外,它还具备抗酪氨酸酶,吸收UV-A、UV-B和SOD的作用, 从而达到皮肤美白的效用[28]。甲基橙皮苷的主要来源就是通过橙皮苷甲基化的方法进行制备,即采用硫酸二甲酯合成法、碳酸二甲酯合成法及三氟甲磺酸甲酯合成法这三种化学合成法和植物提取法达到此目的[29]。
2.1.3 橙皮苷的磺化反应
橙皮苷的磺化反应本质上就是其苯环结构与浓硫酸之间发生的亲电取代反应,陈平等[30]先将一定量的饱和NaCl溶液加至橙皮苷和浓硫酸的反应体系中,然后用饱和HCl溶液洗脱沉淀至中性。结果显示,橙皮苷磺化产物为5种橙皮苷磺化钠的混合物,磺化反应提高了其水溶性,但对磺化橙皮苷的其他功能未作评价。磺化后的橙皮苷被广泛应用于畜禽生产中,相关研究表明,以浓硫酸作为磺化试剂,在30 ℃的反应温度下,1 g橙皮苷中加入6 mL浓硫酸,搅拌浸提2 h,产品收率可达72%[31]。
2.1.4 橙皮苷与金属离子的络合反应
近年来,越来越多的学者发现将中药中的有效成分(微量元素和化学成分)形成配合物,可显著提高有效成分的综合利用率,与此同时,产生的配合物或将表现出新的生物活性[6]。
橙皮苷化学性质活泼,与Cu2+、Fe3+和Al3+等多种金属离子均可发生络合反应,形成较稳定的有色金属络合物,大大提高了其水溶性和生理活性[32]。橙皮苷和钒离子进行配位反应之后合成了橙皮苷-钒配合物(配位比1:1),结果表明配位作用并没有提高橙皮苷的抗氧化能力,而且两者还具有相似的固溶能力和类黄酮抗氧化能力,但在两个肿瘤细胞系(大鼠骨肉瘤UMR106和人结肠腺癌Caco-2)上进行的试验发现,配合物能增强游离配体的抗肿瘤细胞增殖作用,并且该效应与细胞凋亡的形态学改变相关[33]。
橙皮苷经过酸水解反应、甲基化反应、磺化反应以及与金属离子的络合反应后,生物活性发生了不同程度的改变。
2.2 酶改性技术
通过特定的酶作用于底物橙皮苷,使橙皮苷分子脱掉糖或增加糖的方法称为橙皮苷的酶法改性。酶法改性提高生物利用率的方法有两种:一种是通过糖苷酶水解橙皮苷得到它的单糖苷和苷元(脱糖基化);另一种是通过葡聚糖转移酶将橙皮苷转化为葡萄糖橙皮苷(糖基化)[34]。橙皮苷经酶法改性之后,水溶性和稳定性均有所提高,但糖基化作用还会使其抗氧化能力和疏水性等出现不同程度的下降[35]。Xiao等[36]开展的有关膳食黄酮糖基化降低血浆蛋白亲和力的研究表明,吡喃葡萄糖基化产物 (如大豆苷和燃料木苷)与牛血清白蛋白(BSA)的亲和力下降5~10倍,而鼠李糖糖基化产物(如栎素)与BSA的亲和力下降5600倍。与BSA结合的亲和力越高,黄酮类化合物的抗氧化活性越高。与此同时,糖基化也降低了类黄酮的疏水性,疏水性相互作用可能在类黄酮与蛋白质的结合中发挥重要作用。
2.2.1 橙皮苷酶和柚皮苷酶
橙皮苷酶是一种糖苷酶,它主要是由黑曲霉(Aspergillus niger)产生。橙皮苷酶是一种含有两种酶活性的酶制剂,一种是α-L-鼠李糖苷酶(EC 3.2.1.40),它将橙皮苷分解成鼠李糖和HMG;一种是β-D-葡萄糖苷酶(EC 3.2.1.21),将橙皮苷分解成鼠李糖、葡萄糖和橙皮素。橙皮苷经酶解之后得到两个重要产物,即HMG和橙皮素,酶的作用位点为α-L-鼠李糖苷键和β-D-葡萄糖苷键[34]。有关橙皮苷酶选择性水解芦丁生成异槲皮苷的研究表明,在pH7.0的条件下,α-L-鼠李糖苷酶可保持较高活力,β-D-葡萄糖苷酶则发生失活[37]。另外,有研究表明,甘氨酸-氢氧化钠(pH9.0)(10:90,v/v)和三乙酸甘油酯(1:1,v/v)组成的新型双相体系可改变橙皮苷酶的三维结构,可增强橙皮苷酶催化的HMG的合成[38]。
柚皮苷酶是一种水解酶,具有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的活性。一般来说,细菌柚皮酶在中性或碱性环境中活性最佳,也更适合柚皮苷、橙皮苷和芦丁等黄酮类化合物的转化[39],因此,后续可进行较为深入的研究。郑美瑜等[40]研究柚皮苷酶的酶解作用时发现,用一定量的柚皮苷酶处理橙皮苷,初期酶解速度很快,但一个小时之内该反应就达到了平衡,继续酶解只会使反应向逆反应方向进行,生成橙皮苷,弱化了酶解作用。
橙皮苷酶和柚皮苷酶对两种黄酮(橙皮苷和柚皮苷)结构中的糖苷键具有较好的酶解作用,特别是柚皮苷酶,除了可以酶解柚皮苷外,还可快速酶解橙皮苷。
2.2.2 糖转移酶
糖转移酶的作用就是在橙皮苷母体或糖基部分添加一个或多个糖基以达到修饰的目的。以糊精为底物,在1000 IU/g 的葡萄糖基转移酶的作用下反应24 h后得到纯度为92.3%的葡萄糖基橙皮苷,改性得到的葡萄糖基橙皮苷的水溶性和稳定性均有明显提高[41]。有研究表明,在碱性条件下,环麦芽糊精葡聚糖转移酶使橙皮苷接上一分子的葡萄糖之后得到“α-G橙皮苷H”[42]。随后,又有人采用糖苷转移酶在橙皮苷上连接多个分子葡萄糖,制备α-糖基橙皮苷[43]。
酶法改性是橙皮苷通过完成脱糖基化或糖基化反应实现的,脱糖基化反应可明显改善橙皮苷的生物活性,而糖基化反应则削弱了其抗氧化能力等某些生物活性[35]。
2.3 微生物发酵技术
微生物进行自身生长繁殖等生理活动会产生丰富而强大的酶系,这些生物酶正是微生物发酵过程中造成苷类化合物发生结构改变的物质基础,其中通过合适的酶催化反应苷类物质分解形成新成分的技术,就是近年来研究较热的微生物发酵技术[44-45]。目前有关微生物发酵转化橙皮苷的研究报道并不多,大多是一些曲霉属和青霉属等类别的真菌[46]。微生物发酵技术的核心问题是高产菌株的获得,一旦筛选出合适的菌株,它们在适宜的生长环境下便可快速大量繁殖,并产生功能强大的酶系,从而获得多种代谢产物,微生物为橙皮苷的发展提供了新的机遇。
2.3.1 曲霉属(Aspergillus)
黑曲霉(Aspergillus niger)是曲霉属真菌的一个常见种,是广泛分布于粮食、植物性产品和土壤中的丝状子囊真菌,可生产淀粉酶、纤维素酶和果胶酶等多种酶,丰富的酶系及高度的安全性使其在发酵工业生产中得到广泛应用,并一度成为重要的发酵工业菌种[47-49]。黑曲霉WP124(Aspergillus niger WP124)摇瓶发酵培养72 h后,产生橙皮苷酶的酶活能够达到1398 U/mL,该结果表明了该菌株发酵过程具有较好的工业化应用的前景[50]。斋藤曲霉(Aspergillus saitoi)可通过固体发酵的方式将橙皮苷转化为HMG和苷元,同时还产生了一些低分子量的化合物(鼠李糖、葡萄糖),这些发酵产物可用于开发医药和食品领域的高价值生物活性化合物[51]。从韩国传统大豆发酵产品中分离得到的酱油曲霉(Aspergillus sojae)具有较强的柚皮苷酶活性(α-L-鼠李糖苷酶活性在pH6.0时最优)[52-53],该酶作用于橙皮苷之后得到了溶解度较高的HMG,它能够体外抑制人肠道麦芽糖酶、HMG-CoA还原酶和幽门螺杆菌的生长,被认为是一种生物利用度更高、溶解度更高的功能性黄酮[54]。
2.3.2 雪腐镰刀菌(Fusarium nivale)
雪腐镰刀菌(Fusarium nivale)是一种减毒、弱毒或低致病性的微生物菌种,基本对人体不致病。除曲霉属外,国内报道较多的有关发酵橙皮苷的微生物就是雪腐镰刀菌,它在25 ℃左右生长,气生菌丝毡状,白色到淡桔黄色,培养基底面无色到淡桔黄色。雪腐镰刀菌产生橙皮苷酶的周期短,不易形成菌丝球,更利于产酶。李小莉[55]采用发酵-酶解-提取耦合的方法转化橙皮苷制备HMG,解决了HMG得率较低的问题。随后,有人探究了补料分批发酵工艺对雪腐镰刀菌产生橙皮苷酶的影响,为提高HMG得率提供又一途径[56]。
综上所述,橙皮苷在微生物发酵(黑曲霉、酱油曲霉和雪腐镰刀菌等)产生的强大酶系的催化作用下可被分解形成生物活性较高的新成分,该酶决定了橙皮苷是否能被微生物成功改性。微生物发酵技术已被广泛应用到橙皮苷的改性中,但大多数国内外学者对橙皮苷的发酵研究仅围绕单一微生物转化橙皮苷展开,目前还未有人探究过不同微生物共同发酵橙皮苷的效果,而菌种类型的组合、不同菌种的比例以及发酵工艺的选择等因素均会造成不同的发酵结果。基于前人已经完成的有关单一菌种发酵橙皮苷的研究报道,设计不同菌种共同发酵橙皮苷的工艺流程,然后比较单一菌种与混合菌种分别对橙皮苷发酵效果的影响,或许能够为生物法改性橙皮苷提供更多的选择。此外,改性之后的橙皮苷,其生物活性表现力更强,适用范围更广。
3. 橙皮苷的改性衍生物
利用各种技术手段对橙皮苷结构进行修饰后得到的一类化合物,称为橙皮苷的改性衍生物。化学法改性橙皮苷可以得到多种衍生物,例如:HMG、橙皮素等;酶法改性主要是橙皮苷在不同酶类的作用下通过脱糖或加糖的方式提高了水溶性,脱掉糖基之后形成的HMG、橙皮素,其生物活性有所提高,但增加糖基后形成的α-G橙皮苷H和α-糖基橙皮苷,它们的某些生物活性(如抗氧化能力、疏水性)会出现不同程度的下降;而微生物法发酵橙皮苷则是直接通过脱糖途径获取HMG和橙皮素这两种重要的化合物。总之,这些化合物相较于橙皮苷而言,水溶性和稳定性均得到明显改善。下面将重点阐述三种改性方法均可得到的HMG和橙皮素。
3.1 橙皮素单葡萄糖苷
3.1.1 橙皮素单葡萄糖苷的物化性质
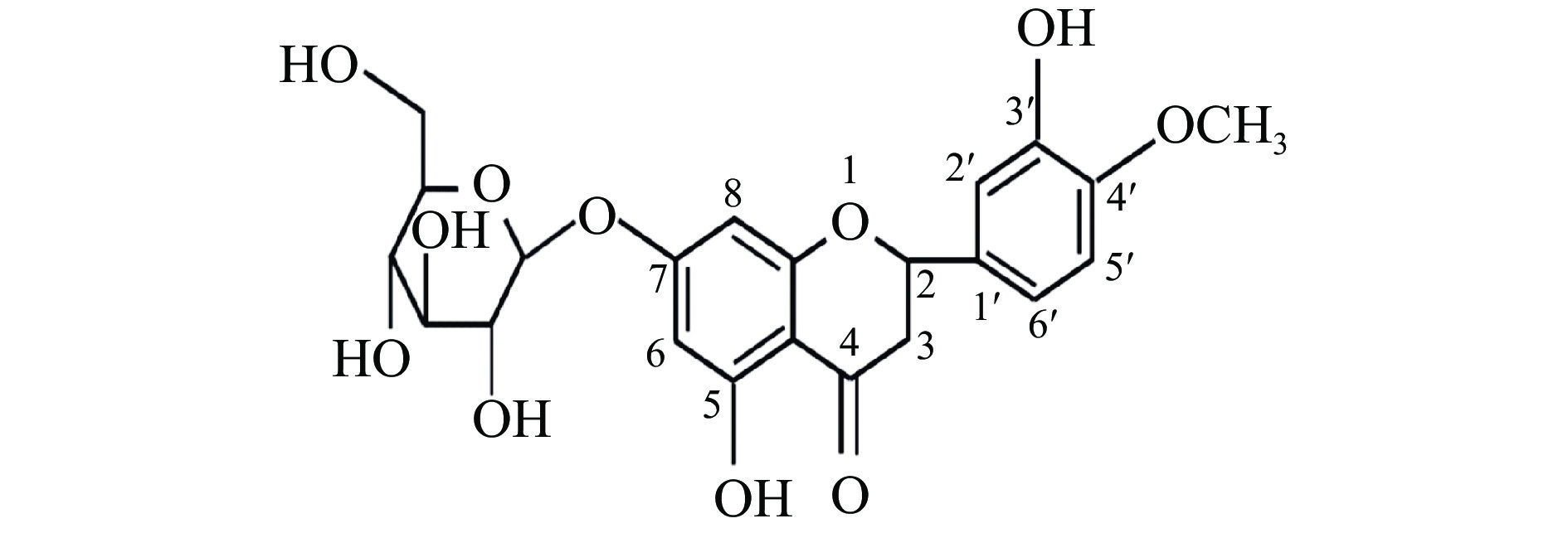
橙皮素单葡萄糖苷(Hesperitin-7-O-glucoside,HMG)是一种典型的黄酮类单葡萄糖苷,分子式C22H24O11,相对分子质量为464.42,化学结构与橙皮苷相似,其结构式见图2。作为橙皮苷去除鼠李糖分子的产物,HMG的水溶性得到较大改善。
3.1.2 橙皮素单葡萄糖苷的应用研究
HMG和橙皮苷均具有抗氧化、抗菌消炎和抗癌等作用。但由于HMG的水溶性更好(几乎是橙皮苷的50倍),因此,它的药理作用相对更加突出,可利用度比橙皮苷高。对橙皮苷和HMG的胃肠道吸收进行比较研究,发现HMG的生物利用度比橙皮苷高3倍[57]。HMG在体外可以抑制人肠道的麦芽糖酶和胆固醇合成的关键酶,抑制幽门螺杆菌的生长,减少十二指肠溃疡、胃癌等一些胃病的发生[58]。HMG还是多种新型甜味剂的前体物质,由HMG生成的一些甜味剂,具有高甜度、低热值、无毒无害等特点,可广泛应用于医药和日化工业等,同时,它还具有较强的抗感冒病毒的活性和抗氧化性[56]。Wan等[59]还深入探究了HMG与金属离子的配位反应,发现采用离子交换柱法合成的橙皮素单糖苷-铜(Ⅱ)配合物(HMG-Cu(Ⅱ)配合物)(配位比1:2),进一步提高了HMG的生物活性。
3.2 橙皮素
3.2.1 橙皮素的物化性质
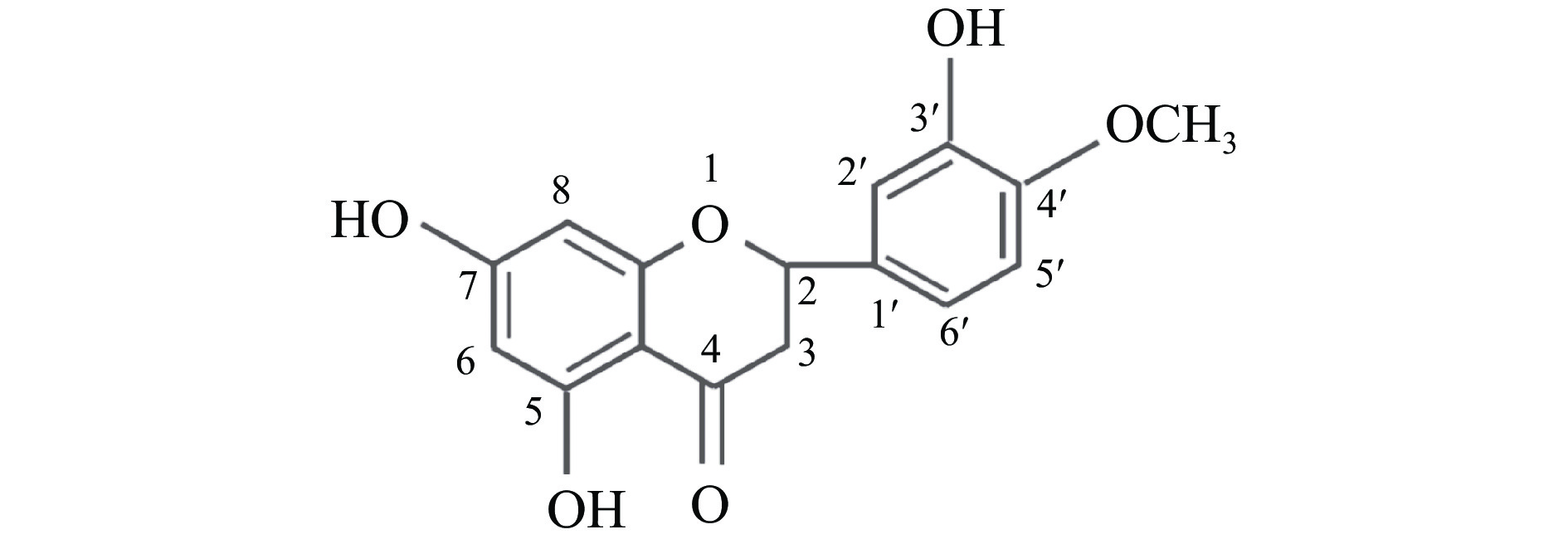
橙皮素是橙皮苷的苷元,结构中含有酮羰基、醚基、甲氧基以及多个酚羟基,其分子式C16H14O6,相对分子质量302.279,结构式见图3。橙皮素在固体状态下呈淡黄色针状结晶或粉末,易溶于乙醇,溶于稀碱溶液,部分溶于乙醚,微溶于水、氯仿和苯。
3.2.2 橙皮素的应用研究
以往研究表明,橙皮苷、橙皮素和HMG由于糖的组成、吸收部位和代谢的不同而具有很大的生物利用度差异。橙皮素作为一种无糖基化合物,其药理及生物活性较高,具有降低胆固醇、改善糖尿病肾病、治疗痤疮、保护神经等多种生物功能,并可通过下调mi R-182-5p表达而抑制口腔鳞癌细胞增殖、迁移、侵袭、EMT和分泌IL-6、IL-8,为橙皮素治疗口腔鳞癌的临床应用提供了理论资料,为研究橙皮素抗肿瘤分子机制奠定了基础[60]。此外,橙皮素还是一种重要的食品级黄酮,其水溶性高于橙皮苷,在食品、医药和化妆品的应用更加广泛,而且随着橙皮素药效学研究的不断深入,发现其对心血管疾病有着更好的预防和治疗的作用。
4. 结语与展望
本文主要讲述了橙皮苷的生物学活性、橙皮苷的改性技术及其衍生物。橙皮苷具有抗氧化、抗炎、抑菌以及抗癌等生物学活性,但因其水溶性和吸收性较差,只有通过一定的技术手段对橙皮苷结构进行修饰,才可提高其生物利用度。化学法工艺复杂、污染环境和资源浪费等现象严重,酶法带来的成本较高,唯有微生物发酵法以其低成本、绿色环保等优势吸引了众多学者的关注。未来将致力于探索微生物转化技术,选育高效的菌种,保持稳定的转化体系,寻找最佳的产物分离手段,推动微生物发酵转化苷类物质的技术走向工业化进程。
-
[1] ZHANG M, ZHU S Y, YANG W J, et al. The biological fate and bioefficacy of citrus flavonoids: Bioavailability, biotransformation, and delivery systems[J]. Food and Function, 2021. DOI: 10.1039/d0fo03403g.
[2] 黄睿, 沈淑妤, 陈虹霖, 等. 柑橘类黄酮的生物学活性及提高生物利用度技术研究进展[J]. 食品科学,2019,40(1):319−326. [HUANG R, SHENG S Y, CHEN H L, et al. Recent advances in bioactivities and technologies for bioavailability improvement of citrus flavonoids[J]. Food Science,2019,40(1):319−326. doi: 10.7506/spkx1002-6630-20170904-054 HUANG R, SHENG S Y, CHEN H L, et al. Recent advances in bioactivities and technologies for bioavailability improvement of citrus flavonoids[J]. Food Science, 2019, 40(1): 319-326. doi: 10.7506/spkx1002-6630-20170904-054
[3] 刘畅, 王雨晴, 孟倩楠, 等. 橙皮及其中抑菌成分在养殖业中应用研究进展[J]. 饲料研究,2021(5):158−160. [LIU C, WANG Y Q, MENG Q N, et al. Advances in the application of orange peel and its antimicrobial components in aquaculture[J]. Feed Reseach,2021(5):158−160. LIU C, WANG Y Q, MENG Q N, et al. Advances in the application of orange peel and its antimicrobial components in aquaculture[J]. Feed Reseach, 2021(5): 158-160.
[4] 马宗敏, 段绪红, 秦梦, 等. 微生物发酵技术在中药苷类生物转化中的应用进展[J]. 世界科学技术-中医药现代化,2017,19(5):858−864. [MA Z M, DUAN X H, QIN M, et al. Microbial transformation of glycosides in Chinese herbal medicine[J]. Modernization of Traditional Chinese Medicine and Materia Medica,2017,19(5):858−864. doi: 10.11842/wst.2017.05.025 MA Z M, DUAN X H, QIN M, et al. Microbial transformation of glycosides in Chinese herbal medicine[J]. Modernization of Traditional Chinese Medicine and Materia Medica, 2017, 19(5): 858-864. doi: 10.11842/wst.2017.05.025
[5] 王磊, 栗栖凤. 橙皮苷的生物活性及其在畜牧业中的应用[J]. 饲料研究,2021,44(1):147−150. [WANG L, LI Q F. Biological aactivity of hesperidin and its application in animal husbandry[J]. Food Research,2021,44(1):147−150. WANG L, LI Q F. Biological aactivity of hesperidin and its application in animal husbandry[J]. Food Research, 2021, 44(1): 147-150.
[6] 单艳. 产α-L-鼠李糖苷酶菌种的筛选及其制备橙皮素单葡萄糖苷的研究[D]. 南昌: 南昌大学, 2015: 13−14. SHAN Y. Study on the preparation of hesperetin monoglucoside by separating an α-L-rhamnosidase from a strain[D]. Nanchang: Nanchang University, 2015: 13−14.
[7] 王幻. 橙皮素单葡萄糖苷的酶法合成、分离纯化及其应用[D]. 广州: 华南理工大学, 2019: 12−13. WANG H. Synthesis, purification and application of hesperetin-7-O-glucoside by enzymatic method[D]. Guangzhou: South China University of Technology, 2019: 12−13.
[8] 刘学仁, 张莹, 林志群. 橙皮苷和橙皮素生物活性的研究进展[J]. 中国新药杂志,2011,20(4):329−333,381. [LIU X R, ZHANG Y, LIN Z Q. Advances in studies on the biological activities of hesperidin and hesperetin[J]. Chinese Journal of New Drugs,2011,20(4):329−333,381. LIU X R, ZHANG Y, LIN Z Q. Advances in studies on the biological activities of hesperidin and hesperetin[J]. Chinese Journal of New Drugs, 2011, 20(4): 329-333, 381.
[9] 谢琪, 王强, 高淑清, 等. 橙皮苷生物活性作用及机制研究进展[J]. 肿瘤代谢与营养电子杂志,2020,7(1):13−17. [XIE Q, WANG Q, GAO S Q, et al. Advances on the biological activity and mechanism of hesperidin[J]. Electron J Metab Nutr Cancer,2020,7(1):13−17. XIE Q, WANG Q, GAO S Q, et al. Advances on the biological activity and mechanism of hesperidin[J]. Electron J Metab Nutr Cancer, 2020, 7(1): 13-17.
[10] SUN Y Z, CHEN J F, SHEN L M, et al. Anti-atherosclerotic effect of hesperidin in LDL r-/-mice and its possible mechanism[J]. European Journal of Pharmacology,2017,815:109−117. doi: 10.1016/j.ejphar.2017.09.010
[11] MALESEV D, KUNTIC V. Investigation of metal-flavonoid chelates and the determination of flavonoids via metal-flavonoid complexing reactions[J]. Journal of the Serbian Chemical Society,2007,72(10):921−939. doi: 10.2298/JSC0710921M
[12] 王晶. 江西蜜柑酚类化合物抗氧化、抗癌、抗衰老活性及作用机理研究[D]. 广州: 华南理工大学, 2020: 92−93. WANG J. Research on antioxidant, anticancer and antiaging activities and their mechanisms of Citrus unshiu marc polyphenols[D]. Guangzhou: South China University of Technology, 2020: 92−93.
[13] 段庆, 唐小丹, 郑希, 等. 新会陈皮提取物中四种黄酮成分含量测定及其抗炎活性研究[J]. 现代食品,2019(11):156−162. [DUAN Q, TANG X D, ZHENG X, et al. Determination of four flavonoids in extracts of citrus reticulata ‘Chachi’ and their anti-inflammatory activity[J]. Xiandaishipin,2019(11):156−162. DUAN Q, TANG X D, ZHENG X, et al. Determination of four flavonoids in extracts of citrus reticulata ‘Chachi’ and their anti- inflammatory activity[J]. XIANDAISHIPIN, 2019, (11): 156-162.
[14] CAO R G, ZHAO Y L, ZHOU Z K, et al. Enhancement of the water solubility and antioxidant activity of hesperidin by chitooligosaccharide[J]. Journal of the Science of Food and Agriculture,2018,98(6):2422−2427. doi: 10.1002/jsfa.8734
[15] PARHIZ H, ROOHBAKHSH A, SOLTANI F, et al. Antioxidant and anti-Inflammatory properties of the citrus flavonoids hesperidin and hesperetin: An updated review of their molecular mechanisms and experimental models[J]. Phytotherapy Research,2015,29(3):323−331. doi: 10.1002/ptr.5256
[16] TEJADA S, PINYA S, MARTORELL M, et al. Potential anti-inflammatory effects of hesperidin from the genus citrus[J]. Current Medicinal Chemistry, 2018, 25(37): 4929-4945.
[17] 汪晓辉, 郭溶, 聂晓彬, 等. 佛手抗菌活性及其药效成分橙皮苷对金黄色葡萄球菌的作用机制研究[J]. 中国抗生素杂志,2021(5):437−441. [WANG X H, GUO R, NIE X B, et al. Antibacterial activity of Citri Sarcodactylis Fructus and its antibacterial mechanism against Staphylococcus aureus[J]. Chinese Journal of Antibiotics,2021(5):437−441. doi: 10.3969/j.issn.1001-8689.2021.05.012 WANG X H, GUO R, NIE X B, et al. Antibacterial activity of Citri Sarcodactylis Fructus and its antibacterial mechanism against Staphylococcus aureus[J]. Chinese Journal of Antibiotics, 2021, (05): 437-441. doi: 10.3969/j.issn.1001-8689.2021.05.012
[18] 刘光荣, 赵俊钢, 邓文娟, 等. 橙皮苷的抗痤疮作用研究[J]. 日用化学品科学,2020,43(3):42−46. [LIU G R, ZHAO J G, DENG W J, et al. Study of the anti-acne effects of hesperidin[J]. Household Chemicals Science,2020,43(3):42−46. doi: 10.3969/j.issn.1006-7264.2020.03.011 LIU G R, ZHAO J G, DENG W J, et al. Study of the anti-acne effects of hesperidin[J]. Household Chemicals Science, 2020, 43(3): 42-46. doi: 10.3969/j.issn.1006-7264.2020.03.011
[19] 李丽, 任周新, 赵鹏, 等. 橙皮苷及橙皮素抗肿瘤药理活性研究进展[J]. 中医学报,2018,33(12):2304−2308. [LI L, REN Z X, ZHAO P, et al. Research progress in antitumor pharmacological activities of hesperidin and hesperetin[J]. Journal of Traditional Chinese Medicine,2018,33(12):2304−2308. LI L, REN Z X, ZHAO P, et al. Research progress in antitumor pharmacological activities of hesperidin and hesperetin[J]. Journal of traditional Chinese medicine, 2018, 33(12): 2304-2308.
[20] 曾佑炜. 黄酮抗癌作用研究进展[J]. 天然产物研究与开发,2016,28(11):1838−1844. [ZENG Y W. Review on anticancer effects of plant-based flavonoids[J]. Natural Product Research and Development,2016,28(11):1838−1844. ZENG Y W. Review on anticancer effects of plant-based flavonoids[J]. Natural product research and development, 2016, 28(11): 1838-1844.
[21] 程翠林, 王荣春, 杨雨茗, 等. 橙皮苷半合成香叶木苷及其抑癌作用[J]. 精细化工,2020,37(11):2308−2312, 2341. [CHENG C L, WANG R C, YANG Y M, et al. Semi-synthesis of diosmin from hesperidin and its anticancer effect[J]. Fine Chemicals,2020,37(11):2308−2312, 2341. CHENG C L, WANG R C, YANG Y M, et al. Semi-synthesis of diosmin from hesperidin and its anticancer effect[J]. Fine Chemicals, 2020, 37(11): 2308-2312, 2341.
[22] HERMAWAN A, KHUMAIRA A, IKAWATI M, et al. Identification of key genes of hesperidin in inhibition of breast cancer stem cells by functional network analysis[J]. Computational Biology and Chemistry,2021,90:107427−107427. doi: 10.1016/j.compbiolchem.2020.107427
[23] KARIM N, SHISHIR M R I, GOWD V, et al. Hesperidin-an emerging bioactive compound against metabolic diseases and its potential biosynthesis pathway in microorganism[J]. Food Reviews International,2021:1−23.
[24] 李晓霞, 许莹, 徐波, 等. 橙皮苷对果糖饮食诱导的非酒精性脂肪肝小鼠的作用研究[J]. 世界中医药,2021,16(2):249−253. [LI X X, XU Y, XU B, et al. Effect of hesperidin on nonalcoholic fatty liver rats induced by high fructose diet[J]. World Chinese Medicine,2021,16(2):249−253. doi: 10.3969/j.issn.1673-7202.2021.02.011 LI X X, XU Y, XU B, et al. Effect of Hesperidin on Nonalcoholic Fatty Liver Rats Induced by High Fructose Diet[J]. World Chinese Medicine, 2021, 16(2): 249-253. doi: 10.3969/j.issn.1673-7202.2021.02.011
[25] ARTS I, SESINK A, FAASSEN-PETERS M, et al. The type of sugar moiety is a major determinant of the small intestinal uptake and subsequent biliary excretion of dietary quercetin glycosides[J]. British Journal of Nutrition,2004,91(6):841−847. doi: 10.1079/BJN20041123
[26] GROHMANN K, MANTHEY J A, CAMERON R G. Acid-catalyzed hydrolysis of hesperidin at elevated temperatures[J]. Carbohydrate Research,2000,328(2):141−146. doi: 10.1016/S0008-6215(00)00081-1
[27] 马丽萍. 桔皮中活性成分的提取与转化[D]. 无锡: 江南大学, 2008: 47−60. MA L P. Extraction and conversion of active ingredients in citrus peel[D]. Wuxi: Jiangnan University, 2008: 47−60.
[28] LI J, WANG S. Molecular spectroscopic on interaction between Methyl hesperidin and Buman serum albumin[J]. Spectrochimica Acta-Part A: Molecular and Biomolecular Spectroscopy,2013,102:200−204. doi: 10.1016/j.saa.2012.10.012
[29] 尚曼, 张文亮, 黄军, 等. 甲基橙皮苷的研究进展[J]. 煤炭与化工,2019,42(7):121−123,149. [SHANG M, ZHANG W L, HAUNG J, et al. Research progress of methyl hesperidin[J]. Coal and Chemical Industry,2019,42(7):121−123,149. SHANG M, ZHANG W L, HAUNG J, et al. Research progress of methyl hesperidin[J]. Coal and chemical industry, 2019, 42(7): 121-123, 149.
[30] 陈平, 樊瑞胜, 聂芊. 水溶性橙皮苷的合成及结构表征[J]. 食品科学,2007(08):143−147. [CHEN P, FAN R S, NIE Q. Synthesis and structure characterization of water-soluble hesperidin[J]. Food Science,2007(08):143−147. doi: 10.3321/j.issn:1002-6630.2007.08.030 CHEN P, FAN R S, NIE Q. Synthesis and structure characterization of water-soluble hesperidin[J]. Food Science, 2007, (08): 143-147. doi: 10.3321/j.issn:1002-6630.2007.08.030
[31] 于进永, 赵永会, 杨璐, 等. 饲料添加剂橙皮苷磺化工艺研究[J]. 中国奶牛,2015(21):6−8. [YU J Y, ZHAO Y H, YANG L, et al. Research on feed additive of hesperidin modification[J]. China Dairy Cattle,2015(21):6−8. doi: 10.3969/j.issn.1004-4264.2015.21.002 YU J Y, ZHAO Y H, YANG L, et al. Research on feed additive of hesperidin modification[J]. China Dairy Cattle, 2015(21): 6-8. doi: 10.3969/j.issn.1004-4264.2015.21.002
[32] FRANCESCHINI SARRIA A L, LOPES VILELA A F, FRUGERI B M, et al. Copper (II) and zinc (II) complexes with flavanone derivatives: Identification of potential cholinesterase inhibitors by on-flow assays[J]. Journal of Inorganic Biochemistry,2016,164:141−149. doi: 10.1016/j.jinorgbio.2016.09.010
[33] ETCHEVERRY S B, FERRER E G, NASO L, et al. Antioxidant effects of the VO (IV) hesperidin complex and its role in cancer chemoprevention[J]. Journal of Biological Inorganic Chemistry,2008,13(3):435−447. doi: 10.1007/s00775-007-0332-9
[34] 申丽静. 橙皮苷酶的制备及其催化性质的研究[D]. 杭州: 浙江工业大学, 2006: 13-19. SHEN L J. Study on preparation and catalytic propertie of the hesperidinase[D]. Hangzhou: Zhejiang University of Technology, 2006: 13-19.
[35] 张红城, 吴正双, 高文宏, 等. 黄酮类化合物改性方法的研究进展[J]. 食品科学,2011,32(3):256−261. [ZHANG H C, WU Z S, GAO W H, et al. Research progress on modification methods for flavonoids[J]. Food Science,2011,32(3):256−261. ZHANG H C, WU Z S, GAO W H, et al. Research progress on modification methods for flavonoids[J]. Food Science, 2011, 32(3): 256-261.
[36] XIAO J, CAO H, WANG Y, et al. Glycosylation of dietary flavonoids decreases the affinities for plasma protein[J]. Journal of Agricultural & Food Chemistry,2009,57(15):6642.
[37] WANG J, MA Y L, WU X Y, et al. Selective hydrolysis by commercially available hesperidinase for isoquercitrin production[J]. Journal of Molecular Catalysis B-Enzymatic,2012,81:37−42. doi: 10.1016/j.molcatb.2012.05.005
[38] WANG J, GONG A, YANG C F, et al. An effective biphase system accelerates hesperidinase-catalyzed conversion of rutin to isoquercitrin[J]. Scientific Reports,2015,5(1):8682. doi: 10.1038/srep08682
[39] ZHU Y P, JIA H Y, XI M L, et al. Purification and characterization of a naringinase from a newly isolated strain of Bacillus amyloliquefaciens 11568 suitable for the transformation of flavonoids[J]. Food Chemistry,2017,214:39−46. doi: 10.1016/j.foodchem.2016.06.108
[40] 郑美瑜, 陆胜民, 陈剑兵, 等. 糖苷酶对橙皮苷和柚皮苷的酶解作用研究[J]. 中国食品学报,2010,10(4):141−146. [ZHENG M Y, LU S M, CHEN J B, et al. Study on enzymatic hydrolysis of hesperidin and naringin with glycoside hydrolase[J]. Journal of Chinese Institute of Food Science and Technology,2010,10(4):141−146. doi: 10.3969/j.issn.1009-7848.2010.04.022 ZHENG M Y, LU S M, CHEN J B, et al. Study on Enzymatic Hydrolysis of Hesperidin and Naringin with Glycoside hydrolase[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(4): 141-146. doi: 10.3969/j.issn.1009-7848.2010.04.022
[41] 盛占武. 橙皮苷的超滤提取及其酶法改性研究[D]. 重庆: 西南大学, 2008: 41−51. SHENG Z W. Studies on the technology of extracting hesperidin by ultrafiltration and enzyme modification[D]. Chongqing: Southwest University, 2008: 41−51.
[42] 陈曾三. 酶处理橙皮苷的特性和利用[J]. 江苏食品与发酵,1999(4):18−21. [CHEN Z S. Characteristics and utilization of enzymatic treatment of hesperidin[J]. Jiangsu Shipin Yu Fajiao,1999(4):18−21. CHEN Z S. Characteristics and utilization of enzymatic treatment of hesperidin[J]. JIANGSU SHIPIN YU FAJIAO, 1999(4): 18-21.
[43] HIJIYA H, MIYAKE T. Alpha-glycosyl hesperidin, and its preparation and uses: EP 0402049A2[P]. 1989-06-03.
[44] 杨红亚, 吴少华, 王兴红, 等. 开展中药生物转化研究意义深远[J]. 中草药,2004(12):4−7. [YANG H Y, WU S H, WANG X H, et al. Significance of biotransformation of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs,2004(12):4−7. YANG H Y, WU S H, WANG X H, et al. Significance of biotransformation of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2004(12): 4-7.
[45] 徐萌萌, 王建芳, 徐春, 等. 微生物转化苷类中药的机理及应用[J]. 世界科学技术,2006(2):24−27. [XU M M, WANG J F, XU C, et al. Mechanism and application of microbe-transformed glycosides in traditional Chinese medicine[J]. World Science and Technology,2006(2):24−27. XU M M, WANG J F, XU C, et al. Mechanism and application of microbe-transformed glycosides in traditional Chinese medicine[J]. World Science and Technology, 2006(2): 24-27.
[46] RAJAL V B, CID A G, ELLENRIEDER G, et al. Production, partial purification and characterization of α-l-rhamnosidase from Penicillium ulaiense[J]. World Journal of Microbiology & Biotechnology,2009,25(6):1025−1033.
[47] 靳梦琦, 李军, 朱凤妹, 等. 黑曲霉代谢组学研究进展[J]. 食品工程,2017(4):1−4,37. [JIN M Q, LI J, ZHU F M, et al. Advances in metabolomics of aspergillus niger[J]. Food Engineering,2017(4):1−4,37. doi: 10.3969/j.issn.1673-6044.2017.04.001 JIN M Q, LI J, ZHU F M, et al. Advances in metabolomics of aspergillus niger[J]. Food Engineering, 2017(4): 1-4, 37. doi: 10.3969/j.issn.1673-6044.2017.04.001
[48] 杨丹, 杨放晴, 燕娜娜, 等. 黑曲霉发酵对陈皮黄酮类成分及抗氧化活性的影响[J]. 食品科技,2019,44(12):23−27. [YANG D, YANG F Q, YAN N N, et al. Effects of Aspergillus niger fermentation on flavonoids and antioxidant activity of pericarpium citri reticulatae(PCR)[J]. Food Science and Technology,2019,44(12):23−27. YANG D, YANG F Q, YAN N N, et al. Effects of Aspergillus niger fermentation on flavonoids and antioxidant activity of pericarpium citri reticulatae(PCR)[J]. Food Science and Technology, 2019, 44(12): 23-27.
[49] DIAZ-MALVAEZ F I, GARCIA-ALMENDAREZ B E, HERNANDEZ-ARANA A, et al. Isolation and properties of β-xylosidase from Aspergillus niger GS1 using corn pericarp upon solid state fermentation[J]. Process Biochemistry,2013,48(7):1018−1024. doi: 10.1016/j.procbio.2013.05.003
[50] 孟娜, 魏胜华, 郑长龙. 黑曲霉发酵产橙皮苷酶的工艺优化[J]. 生物技术,2011,21(2):77−80. [MENG N, WEI S H, ZHENG C L. Optimization of fermentation conditions for production of hesperidinase by Aspergillus niger[J]. Biotechnology,2011,21(2):77−80. MENG N, WEI S H, ZHENG C L. Optimization of Fermentation Conditions for Production of Hesperidinase by Aspergillus niger[J]. Biotechnology, 2011, 21(02): 77-80.
[51] CANDELARIAPEREZ-NAJERA V, LUGO-CERVANTES E, AMAYA-DELGADO L, et al. Biotransformation of hesperidin from lime peel (Citrus limetta Risso) in solid fermentation by Aspergillus saitoi[J]. Cyta-Journal of Food,2018,16(1):537−543.
[52] ARAKI Y, YUZUKI M, MASAKARI Y, et al. High-level heterologous protein production using an attenuated selection marker in Aspergillus sojae[J]. The Journal of General and Applied Microbiology, 2020, 67(2): 77-80.
[53] CHANG H Y, LEE Y B, BAE H A, et al. Purification and characterisation of Aspergillus sojae naringinase: The production of prunin exhibiting markedly enhanced solubility within vitro inhibition of HMG-CoA reductase[J]. Food Chemistry,2011,124(1):234−241.
[54] LEE Y S, HUH J Y, NAM S H, et al. Enzymatic bioconversion of citrus hesperidin by Aspergillus sojae naringinase: Enhanced solubility of hesperetin-7-O-glucoside with in vitro inhibition of human intestinal maltase, HMG-CoA reductase, and growth of Helicobacter pylori[J]. Food Chemistry,2012,135(4):2253−2259.
[55] 李小莉. 产橙皮苷酶菌株的筛选及发酵提取耦合制备橙皮素单葡萄糖苷的研究[D]. 南京: 南京农业大学, 2012: 36−61. LI X L. Study on screening of hesperidinase-producing strain and preparation of hesperetin monoglucoside by ferment-extracted coupling[D]. Nanjing: Nanjing Agricultural University, 2012: 36−61.
[56] 刘晓晶. 雪腐镰刀菌6238发酵产橙皮苷酶及橙皮苷酶纯化和性质研究[D]. 杭州: 浙江大学, 2015: 48-58. LIU X J. Fermentation, purification and characterization of hesperidinase produced by Snow rot fusarium 6238[D]. Hangzhou: Zhejiang University, 2015: 48-58.
[57] WU F, SHI Z J, LEI H H, et al. Short-term intake of hesperetin-7-O-glucoside affects fecal microbiota and host metabolic homeostasis in mice[J]. Journal of Agricultural and Food Chemistry,2021,69(5):1478−1486.
[58] CÉLIZ G, RODRIGUEZ J, SORIA F, et al. Synthesis of hesperetin 7-O-glucoside from flavonoids extracted from citrus waste using both free and immobilized α-L-rhamnosidases[J]. Biocatalysis and Agricultural Biotechnology,2015,4(3):335−341.
[59] WAN W J, XIA N, ZHU S M, et al. Synthesis and characterization of a novel soluble hesperetin monoglucoside-copper(II) complex using ion exchange column[J]. Inorganica Chimica Acta,2020,512:119857.
[60] 王超, 马旭亮, 程瑞卿, 等. 橙皮素调控miR-182-5p对口腔鳞癌BcaCD885细胞迁移和分泌IL-6、IL-8的影响[J]. 中国免疫学杂志,2021,37(4):463−468. [WANG C, MA X L, CHENG R Q, et al. Hesperetin regulates effect of miR-182-5p on migration and secretion of IL-6, IL-8 in oral squamous cell carcinoma BcaCD885 cells[J]. Chinese Journal of Immunology,2021,37(4):463−468. WANG C, MA X L, CHENG R Q, et al. Hesperetin regulates effect of miR-182-5p on migration and secretion of IL-6, IL-8 in oral squamous cell carcinoma BcaCD885 cells[J]. Chinese Journal of Immunology, 2021, 37(4): 463-468.





 下载:
下载:
 下载:
下载:
