Research Progress on the Extraction, Purification and Biological Activity of Ttriterpenoids from the Ganoderma lucidum
-
摘要: 三萜类化合物是灵芝代表性活性成分,在医药及保健食品领域具有很高的应用开发价值。本文通过查阅文献和归纳资料,综述了灵芝三萜类化合物的主要提取、分离纯化技术及其生物活性研究进展,分析了目前灵芝三萜类化合物研究及应用开发方面存在的问题,并对其未来的研究及其功能性应用开发方向进行了展望,以期为灵芝三萜类化合物的研究及应用开发提供相应的参考。Abstract: The triterpenes are the typical bioactive components in the Ganoderma lucidum, which has high valuable application and development in the field of medicine and health food. In this paper, by consulting literature and summarizing data, the main techniques and methods of extraction, separation and purification of Ganoderma lucidum triterpenes and their biological activities are reviewed, and the problems existing in the research and application development of Ganoderma lucidum triterpenes are analyzed. Moreover, the future research and application development of the biological activities are prospected in order to provide corresponding reference for the research, application and development of the Ganoderma lucidum triterpenes.
-
灵芝(Ganoderma)为担子菌亚门、层菌纲、多孔菌科、灵芝属,长期以来灵芝被视为滋补强壮、固本扶正的珍奇中草药,作为保健养生的珍品,常常被用于预防疾病、增强身体抵抗力、提高机体灵活度,具有延年益寿的功效[1]。灵芝中含有多种生物活性物质,到目前为止,已从其中鉴定出的灵芝三萜类化合物的种类达300多种[2],主要活性化学成分有三萜类、多糖类、有机酸、生物碱、氨基酸和矿物质等,其中,三萜化合物是灵芝中最重要的生物活性成分之一。
灵芝属植物主要有赤灵芝、清灵芝、黄灵芝、紫芝、白灵芝和黑灵芝等,是预防和治疗癌症的潜在候选药物,其中,三萜类化合物是主要的生物活性成分。因此,灵芝三萜化合物作为药品和各种保健品的重要成分引起了广泛关注[3-4]。然而,由于培养条件、品种、生长期的不同,以及提取及分离纯化方法的不同,其三萜类化合物的含量及提取率不同,且对其生物活性也有不同的影响。因此,对灵芝三萜类化合物的提取分离纯化方法及其生物活性进行综述研究具有重要意义。基于上述背景,本文综述了灵芝三萜类化合物的主要提取、分离纯化技术方法,及其生物活性应用的研究进展,以期为灵芝三萜类化合物的研究及应用开发提供相应的参考。
1. 三萜化合物提取方法研究进展
1.1 有机溶剂提取法
灵芝三萜类化合物结构相似,根据相似相溶原理,通常采用甲醇或乙醇等有机溶剂提取。RUAN等[5]以无水乙醇为提取溶剂,采用响应曲面法优化灵芝三萜类的提取条件为温度60 ℃,时间6 h,三萜中灵芝酸提取得率由0.88 mg/g提高到2.09 mg/g。侯敏娜等[6]采用95%乙醇3次回流提取,优化后该品种粗提物中灵芝总三萜含量为9.07%。陈德力等[7]用传统氯仿加热回流提取三萜,测得弯柄灵芝三萜提取得率为(0.42%±0.08%),而以60%甲醇(氯仿-甲醇)混合液为溶剂,提取温度180 ℃,静态提取2次,每次12 min的加速溶剂萃取法,弯柄灵芝总三萜提取得率为(2.14%±0.18%)。上述不同学者的研究结果表明,尽管同样采用有机溶剂提取法,但采用的不同溶剂,其提取得率也有较大差异,这是由于灵芝三萜在不同溶剂中的溶出率存在一定的差异,另一方面,其提取参数条件、重复提取次数、原料品种及部位的不同,均会对提取得率有一定的影响。
1.2 超声波辅助提取
超声波是一种高频振荡波,该法是利用超声波产生的强烈振动而产生的空化效应及搅拌等作用,破坏细胞壁,以促进活性物质溶出的速度,从而提高活性物质的提取得率。ZHENG等[8]在超声功率210 W、提取时间100 min的最佳工艺条件下,测得三萜得率达到0.38%。康同辉等[9]以85%乙醇为溶剂,超声时间15 min,最佳超声辅助提取工艺条件下,灵芝三萜得率为2.19%。贾瑞博等[10]以树舌灵芝为原料,通过响应面进行分析,通过最优工艺优化,其总三萜的平均提取得率为1.75%。超声辅助提取与有机溶剂提取法相比缩短了提取时间、提高了提取效率和提取得率。
1.3 酶辅助提取
酶法是通过酶解破坏细胞壁的致密构造,减小细胞壁及细胞间的传质屏障对有效成分从胞内向提取介质扩散的传质阻力[11],从而有利于有效成分的溶出。刘晓燕等[12]通过对纤维素酶、果胶酶和中性蛋白酶不同添加比例的研究,优化灵芝三萜的最佳提取工艺条件为酶解时间80 min、提取pH为5、酶解温度50 ℃,测得菌草灵芝总三萜得率为0.99%。丁霄霄等[13]用纤维素酶、半纤维素酶、木瓜蛋白酶组成的复合酶解处理后的原料继续用无水乙醇80 ℃水浴回流提取2 h,在此条件下灵芝总三萜的提取得率为(1.29%±0.04%)。该提取技术方法不仅能够保持天然产物的构象,不破坏其立体结构和生物活性,还具有快速、高效、专一、反应条件温和且污染较小等优点,具有较高的应用推广价值。
1.4 微波辅助提取
微波是目前天然产物提取的重要辅助手段之一,具有选择性强、耗时少、能耗低、环保等优点,其高频电磁波能够穿透灵芝致密的外层结构而迅速到达内部,并能够破坏细胞壁而促使细胞内容物的释出,可有效提高提取率。CHEN等[14]采用微波辅助提取灵芝总三萜,得率为0.968%。并与常规提取法进行对比,得出微波辅助不仅缩短时间还提高了提取得率。林倩倩等[15]在最佳微波提取条件下,测得三萜类化合物的平均提取得率为0.748%。篑霄云等[16]研究了灵芝三萜类化合物的微波提取法,在最优条件下灵芝三萜一次提取率可达93%,提取率均高于超声辅助提取法、回流法和常规浸提法,通过与其他提法方法的对比分析得出,微波辅助提取法具有试剂用量少、加热速度快、提取率高等特点,较适合灵芝三萜化合物的提取。
1.5 超临界CO2萃取
超临界CO2萃取技术是一种新型绿色萃取、分离和纯化技术。王杉等[17]用超临界CO2萃取菌草灵芝,在萃取压力28 MPa,萃取温度45 ℃,萃取时间2.5 h,CO2流量为35 kg/h的条件下,得到粗提物中三萜类物质含量为30.25%。华正根等[18]的研究结果表明:采用高压超临界CO2提取,灵芝三萜含量为1.35%,而采用乙醇回流提取法提取的灵芝三萜含量仅为0.92%,提取物中三萜不仅含量高,而且成分种类多。因此,高压超临界CO2提取法具有得率高、提取温度低、无化学溶剂消耗和残留、能耗低、易回收、提取时间短等优点,较适合灵芝三萜的提取,但也有设备要求高、提取成本高等不足。
2. 灵芝三萜的分离纯化研究进展
根据三萜类化合物的物理化学性质,在分离过程中普遍采用的分离方法为色谱法,包括高效液相色谱(HPLC)、柱层析、薄层色谱、大孔树脂、高速逆流色谱等,此外,还有离子交换法、结晶和重结晶、密度和梯度离心等其他分离纯化方法。鉴于篇幅所限,本文仅对目前普遍采用的主要色谱分离方法的研究进展加以介绍。
2.1 高效液相色谱分离纯化
灵芝三萜的分离纯化是提高其纯度的重要环节,唐文[19]采用高效液相色谱优化后的色谱纯化条件,将各个色谱峰达到了基线分离。采用建立的液相色谱方法,利用半制备液相从灵芝中分离得到了两种目标灵芝酸单体,纯度大于99%。贾红岩等[20]对不同品种间三萜类成分含量测定,得出乙腈-醋酸水溶液为流动相进行梯度洗脱对多种三萜类成分分离纯化度高,适用于12种三萜成分的同时测定。高效液相色谱分离纯化法具有分离纯化度高,精密度高,稳定性和重复性好等优点,但也有成本高、过程复杂等不足,适合于分离纯化像灵芝三萜这类附加值较高的产品。
2.2 大孔树脂分离纯化
大孔吸附树脂色谱是一种不含交换基团、有大孔结构的有机高聚物吸附剂,有吸附和分子筛双重作用,具有成本低、吸附容量大、选择性好、树脂再生简便、解吸容易、洗脱率高和可再生等优点。钱竹[21]利用定性显色反应和薄板层析,通过水、20%乙醇、40%乙醇、95%乙醇的洗脱顺序进行洗脱,AB-8树脂对灵芝酸的吸附量达8.8372 mg/g。大孔树脂95%乙醇洗脱组分经反相C18柱和制备高效液相色谱分离,经HPLC检测分析,纯度达到92.5%。檀琪等[22]对桦褐孔菌三萜粗提物用AB-8大孔树脂吸附、90%乙醇洗脱,三萜纯度达85.13%。崔月花等[23]用HPD400对灵芝发酵液正丁醇萃取相进行分离和纯化,最大吸附量达82.0 mg/g。可见,尽管大孔树脂分离纯化解决了高效液相色谱成本高的问题,但不同大孔树脂类型对灵芝三萜的分离纯化效果差异性较大,需要在实际使用中进行选择性试验;另外,单一采用大孔树脂很难获得理想的纯化效果,需要和其他方法配合使用。
2.3 高速逆流色谱HSCCC分离纯化
以乙醇和石油醚提取获得的三萜粗提液,经HSCCC两相溶剂系统进一步分离后,可方便高效地分离出灵芝酸S、灵芝酸T和灵芝B。此外,优化后的HSCCC方法可用于较大规模的灵芝菌丝体中三萜的分离[24]。朱忠敏等[25]利用HZ-816树脂和石油醚-乙酸乙酯-甲醇-水的溶剂体系再经高速逆流色谱一次分离,可分离得到纯度高于93%的灵芝酸F和纯度高于90%的灵芝酸C1;当改变溶剂体系中的甲醇和水的比例时,再经高速逆流色谱分离,可分离得到纯度高于90%的灵芝酸A和纯度高于85%的灵芝酸C2。采用了大孔吸附树脂柱层析结合高速逆流色谱法分离纯化,具有高效、快速、制备量大、费用低等优点,即节约了成本和很好地解决了有机溶剂对环境的污染问题,且有利于高纯度灵芝酸的工业化生产。
国内外相关研究结果表明,灵芝三萜分离纯化是一个较为复杂的过程,尽管该领域尝试了对很多方法进行研究,但各种方法都存在一定的不足,细化分离纯化流程,采用分阶段多方法联合的分离纯化形式可能是未来的发展趋势。
3. 灵芝三萜药理作用
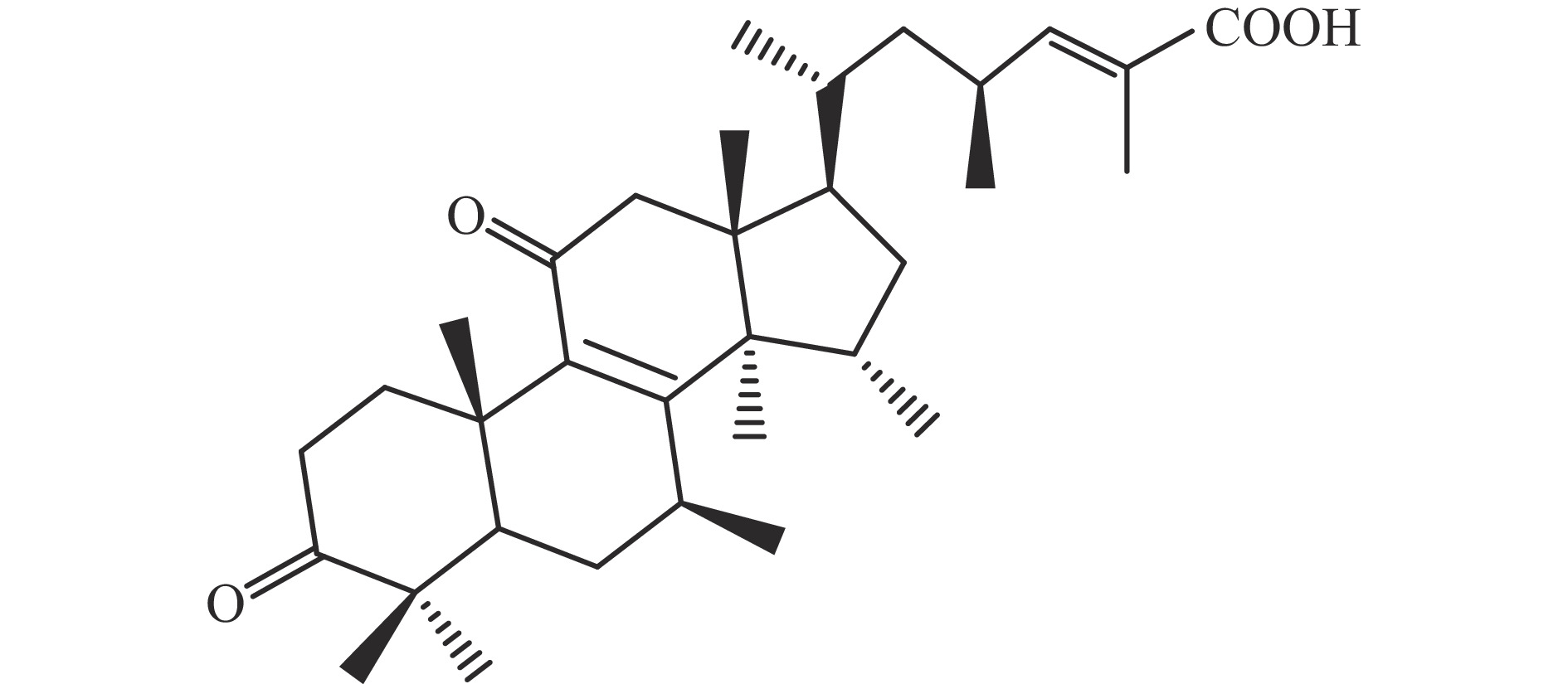
三萜类化合物是灵芝中的主要生物活性物质,其中,最具代表性的就是灵芝酸,而灵芝酸是一类高度氧化的羊毛甾烷衍生物,其结构如图1所示[26]。
根据异戊二烯定则,多数三萜被认为是由6个异戊二烯缩合而成的,而主要活性部分是四环三萜和五环三萜,依据碳原子数目的不同可分为C24、C27及C30三种。环上的双键大多数位于△8(9)位,大部分在C11和C23位有羰基,而且C3、C7和C15位大多数被羰基或羟基取代。根据官能团和侧链将其命名为灵芝酸、灵芝酸甲酯、赤灵酸、灵赤酸、灵赤酸甲酯、灵芝孢子酸、灵芝醇、灵芝醛和灵芝内酯等[27]。其中,灵芝酸又分为灵芝酸A、灵芝酸DM、灵芝酸T、灵芝酸D、灵芝酸H等。根据灵芝三萜类结构、种类、羊毛甾烷骨架上所连基团的不同以及与生物受体作用的多样性,决定了其药理学和生物学活性的多样性。
3.1 对肾病的治疗作用
肾脏疾病因其在世界范围内的大量存在,及其复杂的发病机制导致缺乏有效的治疗方法而逐渐引起人们的关注。SU等[28]研究了利用从中药灵芝中分离出的灵芝三萜对常染色体显性多囊肾病的影响,灵芝三萜通过囊肿小管的生成、延长和上皮细胞的分化来阻止肾脏囊肿的发生。灵芝三萜活性成分物质有望成为治疗常染色体显性多囊肾病的新型药物。
在阿霉素肾病的发病机制中,氧化应激是引起慢性肾病的普遍因素之一,活性氧激活NF-κB调节促炎细胞因子和趋化因子的表达[29]。在体外抗纤维化活性的研究中发现灵芝内酯B在体内可通过剂量依赖性抑制转化生长因子-β信号转导和ROS的产生,激活Nrf2,从而抑制阿霉素肾病[30]。此外,在慢性肾病模型中,灵芝内酯B降低了尿白蛋白水平,并抑制了肌成纤维细胞的激活。这些发现有望为抗慢性肾病药物的开发提供新的途径。
3.2 抗肿瘤细胞的作用
癌症是一种多因素疾病,会导致行为和代谢的改变,并导致细胞增殖失控和免疫系统减弱。三萜类物质能抑制肿瘤细胞增殖,并通过某些信号通路间接诱导癌细胞凋亡。
据研究报道,从灵芝菌子实体提取的灵芝三萜能抑制肝癌细胞和Hela细胞等的增殖,以及对人类结肠HT-29癌细胞、乳腺癌细胞和肺癌细胞具有细胞毒活性[31-34]。SMINA等[32]通过小鼠试验证明,灵芝总三萜具有诱导细胞凋亡和抗肿瘤活性的作用;MIN等[33]通过体外细胞毒实验证明三萜类化合物对Meth-A和LLC肿瘤细胞株具有细胞毒作用;WANG等[34]发现灵芝三萜类具有激活Caspases-9和Caspases-3来诱导细胞凋亡,从而导致前列腺癌细胞发生调亡;SHAO等[35]发现灵芝三萜类的抗癌作用可能与组蛋白乙酰化和有丝分裂细胞周期有关,分别通过调控不可降压性5GCN5和细胞周期蛋白依赖性激酶2CDK2来实现,尽而通过相互调节作用来发挥抗癌作用,主要作用于NF-κB、RAS-MAPK、PI3K/Akt/mTOR和细胞周期,导致细胞凋亡[36];DEDIS等[37]从灵芝菌子实体中提取分离得到的lucidumol D对人体乳腺癌MCF-7细胞、人体肝癌HepG2细胞、人体宫颈癌HeLa细胞、人体结直肠癌Caco-2细胞和人体结直肠癌HCT-116细胞具有选择性的抗增殖和细胞毒性作用;LIN等[38]对灵芝三萜类进行了端粒G-四链体DNA的高亲和力和选择性稳定的筛选,结果表明灵芝酸A和灵芝酸DF具有较高的结合亲和力并有选择性地与pG4DNA的侧链结合,表明该三萜类可能是潜在的抗癌药物[39];ZHENG等[40]发现灵芝酸A、灵芝酸B、灵芝醇B、灵芝甘露三醇和灵芝甘露二醇5个三萜类化合物对人鼻咽癌5-8F细胞的端粒酶有明显的抑制作用;LIU等[41]证明了灵芝烯酸,具有逆转HepG2/ADM细胞对阿霉素DOX、长春新碱VCR和紫杉醇的耐药性,并显著逆转表达MCCB1的耐药性。上述国内外诸多学者的研究结果表明,灵芝三萜类化合物对多种癌细胞或具有细胞毒性、抑制作用、诱导癌细胞凋亡的效果,可能是未来重要的抗癌药物成分之一,具有很高的应用开发价值。
3.3 抗骨质疏松作用
骨质疏松症是一种骨量减少,骨组织微结构恶化,导致骨骼脆性增强和骨折风险,严重会造成全身性骨骼疾病[42]。LIU等[43]研究发现从灵芝提取物中分离出灵芝酸DM能通过抑制破骨细胞的分化而明显地抑制破骨细胞的形成,灵芝酸DM抑制活化的T细胞c-FOS和核因子C1的表达,这两个转录因子是破骨细胞形成的关键转录因子,导致树突状细胞特异性跨膜蛋白的表达受到抑制,减少了向破骨细胞融合的转化。其中,灵芝酸F(2)和灵芝酸DM(5)在C7上有羰基具有抑制破骨细胞分化的效果,这些结果表明,灵芝酸F和灵芝酸DM抑制破骨细胞分化过程中C7上的羰基,该羰基是诱导抑制破骨细胞分化的必需基团。因此,这两个化合物由于有抑制破骨细胞分化的作用,可能成为治疗骨质疏松症的新疗法。
3.4 抗衰老作用
从灵芝子实体中提取到的三萜类在体外和体内均显示出具有抗氧化特性,通过直接清除细胞中产生的自由基来减少氧化损伤,包括自由基清除剂和抗癌活性[44]。并且三萜类还显示出清除超氧阴离子自由基和羟自由基的活性[45]。AJITH等[46]报道三萜类对老年大鼠线粒体脱氢酶、电子传递链复合物I和II活性的影响。SUDHEESH等[47]分析了三萜类物质对衰老小鼠心脏和大脑线粒体抗氧化状态的影响,三萜类物质可显著提高老龄小鼠心脏和脑线粒体GSH水平以及锰超氧化物歧化酶、谷胱甘肽过氧化物酶和谷胱甘肽S-转移酶GST活性(P<0.05),显著降低老龄小鼠心脏和脑线粒体脂质过氧化水平、晚期氧化蛋白产物AOPP和活性氧(ROS)水平(P<0.05),从而改善衰老所致的抗氧化状态。
3.5 抗炎作用
炎症与癌症、糖尿病和其他多种代谢性疾病有关,由于一氧化氮水平的增加与急性和慢性炎症疾病密切相关,因此,许多学者通过对一氧化氮水平的控制来降低炎症。SU等[48]从灵芝中分离出多种灵芝三萜化合物,并通过实验研究对脂多糖激活的RAW264.7细胞产生一氧化氮的抑制作用,发现ganoluciduone B在12.5 μmol/mL的浓度下对一氧化氮的抑制率为45.5%,表明三萜化合物对炎症有很好的控制作用。
3.6 其他活性
此外,灵芝三萜类化合物能降低血清丙氨酸氨基转氨酶和天冬氨酸氨基转氨酶的浓度,增强肝脏中的超氧化物歧化酶和过氧化氢酶活性,并降低丙二醛含量[49]。灵芝三萜具有促进BDNF样神经元的存活[50],以及具有降低了脂肪细胞中的甘油三酸酯、总胆固醇水平[51]和促血管生成[52]等多种功效。灵芝中的三萜烯类化合物能够影响鼻咽癌5-8F细胞端粒酶的活性和存活,并通过分子对接的方式强化三萜类化合物对抑制端粒酶的活性的影响。可见,灵芝三萜生物活性涉及诸多领域,除已经发现并进行研究的领域之外,还有尚未探究的空白领域,因此,要加大对灵芝三萜提取、分离纯化及其生物活性研究,将会为寻找疾病的新治疗药物提供新途径。
3.7 灵芝在保健食品及功能性食品中的应用
目前,灵芝食品的开发多停留在全成分利用的初级阶段,远未达到医药领域类似灵芝三萜这样的细化程度,主要用于开发保健食品及新型功能性食品。近年来,灵芝可用部位不断被挖掘,在保健食品中的可用部位原料包括灵芝子实体、灵芝孢子粉、灵芝孢子油和灵芝菌丝体等。截至2018年底,已批准含有上述可用部位的保健食品数量达到1270余个[53]。鉴于灵芝孢子在功能性成分释放和有效利用方面存在的瓶颈问题,有关学者对灵芝孢子破壁方法进行了系统的研究,并开发了硬胶囊、软胶囊、片剂、口服液、粉剂、颗粒、茶剂等保健食品[54]。为探究灵芝功能性食品的功能性,林花等[55]通过小鼠动物实验验证了灵芝功能性食品具有增强小鼠免疫功能的作用。张瑞婷等[56]不仅综述了灵芝在保健食品中的应用研究进展,还对未来灵芝在普通食品及化妆品等多领域的应用开发进行了展望,说明灵芝在未来食品领域具有广阔的应用前景。
4. 总结及展望
尽管人们在灵芝研究及应用领域已取得了一定的进展,但仍然存在一系列问题需要进一步探究。同时,对灵芝三萜化合物研究及未来发展趋势加以展望,以期为灵芝三萜类化合物的研究及应用开发提供相应的参考。
提取技术及方法的综述结果表明,各种方法均具有各自的优缺点,尝试采用组合提取方法从而汲取不同方法的优点,克服单一方法的缺点和不足,以提高提取率及提取效率。探究更高的提取率及提取效率、使工艺过程更简单、成本更低、方便易行、环境更友好的新方法、新技术、新装备将成为未来灵芝三萜提取领域的研究发展趋势,同时,不断优化提取方案和引进生物活性追踪等先进技术,确保在提取过程中有效保护其生物活性,也是未来提取技术研究的重要课题。
分离纯化的综述结果表明,尽管现有技术已经实现了灵芝三萜较高纯度的分离纯化,但仅仅能够分离出灵芝三萜中的灵芝酸A、灵芝B、灵芝酸C1、灵芝酸C2、灵芝酸S、灵芝酸T等部分化合物,且由于分离程度低,所以分离出来的三萜化合物种类少,大部分属于混合物,尚有大量的化合物无法进一步细化分离,这严重制约灵芝三萜生物活性的应用开发。探究灵芝三萜细化分离纯化技术方法,分离出更多的三萜化合物单体,以深度开发和综合利用其生物活性,为药理学、药效学和毒理学等方面的深入研究打下基础,也将是未来该领域的一个重要研究分支。
三萜化合物的作用机理、构效关系、分子调控机制以及药理动力学研究尚不是很明确。未来还有很多方面需要不断探究:从分子结构层面揭示其分子结构和生物活性之间的关系,了解其不同功能性的作用基团,探究提取分离过程中不同方法对其结构及生物活性的影响关系,最大限度地降低提取分离过程中对其结构及生物活性的影响,以有效保护其生物活性成分;另一方面,从人体细胞学、代谢组学和预防医学等多方面来阐述灵芝三萜化合物的特殊功能性,以期更深入地了解灵芝三萜的作用机制,揭示灵芝三萜作用机理等,将会为未来灵芝三萜化合物的应用开发奠定更坚实的基础。
在食品工程领域,灵芝主要用于开发附加值较高的保健食品及新型功能性食品,灵芝制品尚停留在原料的初级利用阶段,远未达到医药领域类似灵芝三萜这样的细化程度。随着灵芝精细化加工的不断深入,灵芝医药加工副产物的综合利用也将成为一个重要的研究开发方向。这不仅可以提高灵芝深加工的附加值,还可以降低食品开发原料成本,从而有利于应用于食品开发,成为大众百姓消费的产品。
相信随着上述问题的逐一解决,将会更加有效地提高三萜化合物的应用潜力及靶向性,以利于功能性食品和药品的开发,并将其副产物应用于普通食品开发,为人类饮食健康及临床医学发挥更大的作用。
-
[1] 李卫东, 林志彬. 灵芝的扶正固本及对“亚健康”者的保健作用[J]. 食药用菌,2016,24(1):29−32. [LI Weidong, LIN Zhibin. The effects of Ganoderma lucidum on the strengthening the body and improving sub-health[J]. Edible and Medicinal Mushrooms,2016,24(1):29−32. [2] XIA Q, ZHANG H Z, SUN X F, et al. A comprehensive review of the structure elucidation and biological activity of triterpenoids from Ganoderma spp.[J]. Molecules,2014,19(11):17478−17535. doi: 10.3390/molecules191117478
[3] TANG W, LIU J W, ZHAO W M, et al. Ganoderic acid T from Ganoderma lucidum mycelia induces mitochondria mediated apoptosis in lung cancer cells[J]. Life Sci,2006,80(3):205−211. doi: 10.1016/j.lfs.2006.09.001
[4] WU G H. Ganoderic acid DM, a natural triterpenoid, induces DNA damage, G1 cell cycle arrest and apoptosis in human breast cancer cells[J]. Fitoterapia,2012,83(2):408−414. doi: 10.1016/j.fitote.2011.12.004
[5] RUAN W M, LIM A H H, HUANG L G, et al. Extraction optimisation and isolation of triterpenoids from Ganoderma lucidum and their effect on human carcinoma cell growth[J]. Natural Product Research,2014,28(24):2264−2272. doi: 10.1080/14786419.2014.938337
[6] 侯敏娜, 刘剑. 灵芝三萜的提取分离及总三萜的含量测定[J]. 现代中药研究与实践,2010,24(5):70−71. [HOU Minna, LIU Jian. Ganoderma triterpenoids extraction and determination of the total triterpenoid[J]. Chin Med J Res Prac,2010,24(5):70−71. [7] 陈德力, 王小兵, 吕伟, 等. 弯柄灵芝总三萜加速溶剂提取工艺及其清除DPPH自由基活性研究[J]. 天然产物研究与开发,2016,28(10):1597−1601. [CHEN Deli, WANG Xiaobin, LV Wei, et al. Accelerated solvent extraction and DPPH free radical scavenging activity of triterpenoids from Ganoderma flexipes[J]. Nat Prod Res Dev,2016,28(10):1597−1601. [8] ZHENG Shizhong, ZHANG Weirui, LIU Shengrong. Optimization of ultrasonic-assisted extraction of polysaccharides and triterpenoids from the medicinal mushroom Ganoderma lucidum and evaluation of their in vitro antioxidant capacities[J]. PloS One,2020,15(12):1−16.
[9] 康同辉, 张一凡, 解婉莹, 等. 超声波辅助提取灵芝三萜工艺研究[J]. 农业科技与装备,2017(6):41−43. [KANG Tonghui, ZHANG Yifan, XIE Wanying, et al. Research on the technology extraction of the Ganoderma triterpenoids by ultrasonic-assisted[J]. Agricultural Science & Technology and Equipment,2017(6):41−43. [10] 贾瑞博, 赵慧, 刘凯丽, 等. 树舌灵芝总三萜提取工艺优化及其抗氧化作用研究[J]. 应用化工,2016,45(6):1030−1035. [JIA Ruibo, ZHAO Hui, LIU Kaili, et al. Extraction process optimization and its antioxidant activity of the total triterpenoids from Ganoderma applanatum[J]. Applied Chemical Industry,2016,45(6):1030−1035. [11] 亓小妮, 谢苗, 吴杨洋, 等. 灵芝三萜化合物的制备与药理活性研究进展[J]. 安徽农业科学,2021,49(5):38−42. [QI Xiaoni, XIE Miao, WU Yangyang, et al. Research progress on preparation and pharmacological activities of Ganoderma lucidum triterpenes[J]. J Anhui Agric Sci,2021,49(5):38−42. doi: 10.3969/j.issn.0517-6611.2021.05.010 [12] 刘晓艳, 陈艺煊, 吴林秀, 等. 响应面法优化灵芝总三萜酶辅助提取工艺及其抗氧化活性研究[J]. 食品科技,2017,42(8):225−230. [LIU Xiaoyan, CHEN Yixuan, WU Linxiu, et al. Response surface optimization of enzyme-assisted extractiontriterpene from Juncao Ganoderma lucidum and its antioxidant activity[J]. Food Science and Technology,2017,42(8):225−230. [13] 丁霄霄, 李凤伟, 余晓红. 响应面法优化复合酶提取灵芝总三萜工艺[J]. 食品工业,2018,39(8):40−44. [DING Xiaoxiao, LI Fengwei, YU Xiaohong. Optimization of complex enzyme extraction technology of total triterpenoids from Ganoderma lucidum by response surface methodology[J]. Food Industry,2018,39(8):40−44. [14] CHEN Y, XIE M Y, GONG X F. Microwave-assisted extraction used for the isolation of total triterpenoid saponins from Ganoderma atrum[J]. Journal of Food Engineering,2007,81(1):162−170. doi: 10.1016/j.jfoodeng.2006.10.018
[15] 林倩倩, 赵淑杰, 朱鹤. 树舌灵芝中三萜类化合物的提取工艺研究[J]. 安徽农业科学,2012,40(18):9669−9671. [LIN Qianqian, ZHAO Shujie, ZHU He. Study on the extraction technology of triterpenoids from Ganoderma applanatum (Pers.) Pat[J]. J Anhui Agric Sci,2012,40(18):9669−9671. doi: 10.3969/j.issn.0517-6611.2012.18.037 [16] 篑霄云, 何晋浙, 王静, 等. 微波提取灵芝中三萜类化合物的研究[J]. 中国食品学报,2010(2):89−96. [KUI Xiaoyun, HE Jinzhe, WANG Jing, et al. The study on the microwave extraction of the triterpenoid saponins from Ganoderma lucidum[J]. Chinese Journal of Food,2010(2):89−96. doi: 10.3969/j.issn.1009-7848.2010.02.013 [17] 王杉, 周科勤, 范青生, 等. 超临界CO2萃取菌草灵芝孢子油中三萜类物质和脂肪酸的测定[J]. 食品与机械,2006(1):74−76. [WANG Shan, ZHOU Keqin, FAN Qingsheng, et al. Determination of triterpenoids and fatty acid in grass-cultivated Ganoderma lucidum spores oil extracted by supercritical CO2[J]. Food and Machinery,2006(1):74−76. doi: 10.3969/j.issn.1003-5788.2006.01.025 [18] 华正根, 王金亮, 朱丽萍, 等. 高压超临界CO2提取灵芝三萜和甾醇成分的研究[J]. 中国食用菌,2018,37(5):62−65,69. [HUA Zhenggen, WANG Jinliang, ZHU Liping, et al. Study on the extraction of triterpenes and sterols from Ganoderma lucidum by supercritical CO2 under high pressure[J]. Edible Fungi of China,2018,37(5):62−65,69. [19] 唐文. 高效液相色谱分离纯化灵芝酸条件的优化研究[J]. 食品工业,2013,34(11):74−77. [TANG Wen. Purification conditions of ganoderic acids optimized by HPLC[J]. Food Industry,2013,34(11):74−77. [20] 贾红岩, 王亚涛, 张芝华, 等. 高效液相色谱法测定不同产地及品种灵芝三萜类成分的含量[J]. 微生物学通报,2017,44(1):238−244. [JIA Hongyan, WANG Yatao, ZHANG Zhihua, et al. Determination of triterpenoids in Ganodema lingzhi from differentareas and species by HPLC[J]. Microbiol China,2017,44(1):238−244. [21] 钱竹. 灵芝酸的液体发酵及其分离纯化的研究[D]. 无锡: 江南大学, 2006. QIAN Zhu. Study on liquid fermentation and its separation and purification of Ganoderma acid[D]. Wuxi: Jiangnan University, 2006.
[22] 檀琪, 阮文辉, 杨官娥, 等. 大孔吸附树脂纯化桦褐孔菌三萜类化合物工艺优化[J]. 食品工业,2021,42(3):142−146. [TAN Qi, RUAN Wenhui, YANG Guane, et al. Optimization of purification of triterpenoids from Inonotus obliquus by macro-porous resin[J]. Food Industry,2021,42(3):142−146. [23] 崔月花, 缪婧, 陈清颖, 等. 大孔树脂对灵芝发酵液中抗氧化物质的分离纯化的研究[J]. 食品工业,2018,39(11):49−52. [CUI Yuehua, MIAO Jing, CHEN Qingying, et al. Study on isolation effect of antioxidant component in GLCB by macro porous adsorption resin[J]. Food Industry,2018,39(11):49−52. [24] WENG C J, CHAU C F, CHEN K D, et al. The anti-invasive effect of lucidenic acids isolated from a new Ganoderma lucidum strain[J]. Molecular Nutrition & Food Research,2017,51(12):1472−1477.
[25] 朱忠敏, 李晔, 周岩飞, 等. 大孔树脂层析结合高速逆流色谱分离纯化灵芝酸[A]. 2013年灵芝产品研究与开发学术研讨会论文摘要[C]. 南京: 2013, 9. ZHU Zhongmin, LI Ye, ZHOU Yanfeng, et al. Separation of the ganodenic acid by HSCCC and macro porous adsorption resin[A]. Research and development symposium of the ganoderic products in 2013[C]. Nanjing: 2013, 9.
[26] SHIAO M S, LEE K R, LIN L J, et al. Natural products and biological activities of the Chinese medicinal fungus Ganoderma lucidum[J]. Chem Inform,1994,25(15):342−354.
[27] FENG J, FENG N, YANG Y, et al. Simple and reproducible two-stage agitation speed control strategy for enhanced triterpene production by Lingzhi or Reishi medicinal mushrooms, Ganoderma lucidum ACCC G0119 (higher basidiomycetes) based on submerged liquid fermentation[J]. International Journal of Medicinal Mushrooms,2015,17(12):1151−1159. doi: 10.1615/IntJMedMushrooms.v17.i12.50
[28] SU Limin. Ganoderma triterpenes retard renal cyst development by down regulating Ras/MAPK signaling and promoting cell differentiation[J]. Kidney International,2017,92:1404−1418. doi: 10.1016/j.kint.2017.04.013
[29] REISMAN S A, CHERTOW G M, HEBBAR S, et al. Bardoxolone methyl decreases megalin and activates nrf2 in the kidney.[J]. Journal of the American Society of Nephrology:JASN,2012,23(10):1663−1673. doi: 10.1681/ASN.2012050457
[30] YAN Yongming. Lingzhilactones from Ganoderma lingzhi ameliorate adriamycin-induced nephropathy in mice[J]. Journal of Ethnopharmacology,2015,176:385−393. doi: 10.1016/j.jep.2015.11.024
[31] 王涛. 灵芝三萜的提纯及其对前列腺癌细胞生长的影响[D]. 深圳: 南方医科大学, 2016. WANG Tao. Purification of triterpenoids from Ganoderma lucidum and its effect on the growth of prostatecancer cells[D]. Shenzhen: Southern University of Science and Technology, 2016.
[32] SMINA T P, MATHEW J, JANARDHANAN K K. Ganoderma lucidum total triterpenes attenuate DLA induced ascites and EAC induced solid tumours in Swiss albino mice[J]. Cellular and Molecular Biology (Noisy-le-Grand, France),2016,62(5):55−59.
[33] MIN B S. Triterpenes from the spores of Ganoderma lucidum and their cytotoxicity against Meth-A and LLC tumor cells[J]. Chemical and Pharmaceutical Bulletin,2000,48(7):1026−1033. doi: 10.1248/cpb.48.1026
[34] WANG Tao, XIE Ziping, HUANG Zhansen, et al. Total triterpenoids from Ganoderma lucidum suppresses prostate cancer cell growth by inducing growth arrest and apoptosis[J]. Journal of Huazhong University of Science and Technology [Medical Sciences],2015,35(5):736−741. doi: 10.1007/s11596-015-1499-x
[35] SHAO Yanyan, QIAO Liansheng, WU Lingfang, et al. Structure identification and anti-cancer pharmacological prediction of triterpenes from Ganoderma lucidum[J]. Molecules (Basel, Switzerland),2016,21(5):865−878.
[36] GILL B S, NAVGEET, MEHRA R, et al. Ganoderic acid, lanostanoid triterpene: A key player in apoptosis[J]. Investigational New Drugs,2018,36(1):136−143. doi: 10.1007/s10637-017-0526-0
[37] DEDI S. Lucidumol D, a new lanostane-type triterpene from fruiting bodies of Reishi (Ganoderma lingzhi)[J]. Natural Product Research,2019,33(2):189−195. doi: 10.1080/14786419.2018.1440229
[38] LIN T Y, HSU H Y, SUN W H, et al. Induction of Cbl-dependent epidermal growth factor receptor degradation in Lingzhi-8 suppressed lung cancer[J]. International Journal of Cancer,2017,140(11):2596−2607. doi: 10.1002/ijc.30649
[39] SITTICHAI S, SOMCHAI Y, DARAWAN P, et al. Molecular docking based screening of triterpenoids as potential G-quadruplex stabilizing ligands with anti-cancer activity[J]. Bioinformation,2017,13(9):284−292.
[40] ZHENG Dongshu, CHEN Liangshu. Triterpenoids from Ganoderma lucidum inhibit the activation of EBV antigens as telomerase inhibitors.[J]. Experimental and Therapeutic Medicine,2017,14(4):3273−3278. doi: 10.3892/etm.2017.4883
[41] LIU Daolu, LI Yingjie, YANG Donghua, et al. Ganoderma lucidum derived ganoderenic acid B reverses ABCB1-mediated multidrug resistance in HepG2/ADM cells[J]. International Journal of on Cology,2015,46(5):2029−2038.
[42] MIYAMOTO I, LIU J, SHIMIZU K, et al. Regulation of osteoclastogenesis by ganoderic acid DM isolated from Ganoderma lucidum[J]. European Journal of Pharmacology,2009,602(1):1−7. doi: 10.1016/j.ejphar.2008.11.005
[43] LIU Jie, JUN Shiono, SHIMIZU Kuniyoshi, et al. Ganoderic acid DM: Anti-androgenic osteoclastogenesis inhibitor[J]. Bioorganic & Medicinal Chemistry Letters,2009,19(8):2154−2157.
[44] SHIV B, LEEK E, VIVEK D D, et al. Density functional theory and molecular dynamics simulation support Ganoderma lucidum triterpenoids as broad range antagonist of matrix metalloproteinases[J]. Journal of Molecular Liquids,2020,37(11):311−321.
[45] CHERIAN E, SUDHEESH N P, JANARDHANAN K K, et al. Free radical scavenging and mitochondrial antioxidant activities of Reishi-Ganoderma lucidum (Curt: Fr) P. Karst and Arogyapacha-Trichopus zeylanicus gaertn extracts[J]. Journal of Basic and Clinical Physiology and Pharmacology,2009,20(4):289−308.
[46] AJITH T A, SUDHEESH N P, ROSHNY D, et al. Effect of Ganoderma lucidum on the activities of mitochondrial dehydrogenases and complex I and II of electron transport chain in the brain of aged rats[J]. Experimental Gerontology,2009,44(3):219−223. doi: 10.1016/j.exger.2008.11.002
[47] SUDHEESH N P, AJITH T A, RAMNATH V, et al. Therapeutic potential of Ganoderma lucidum (Fr.) P. Karst. against the declined antioxidant status in the mitochondria of post-mitotic tissues of aged mice[J]. Clinical Nutrition (Edinburgh, Scotland),2010,29(3):406−412. doi: 10.1016/j.clnu.2009.12.003
[48] SU Haiguo, PENG Xingrong, SHI Qiangqiang, et al. Lanostane triterpenoids with anti-inflammatory activities from Ganoderma lucidum[J]. Phytochemistry,2020,60:173−181.
[49] WU Huihui, TANG Shanshan, HUANG Zhaoqin, et al. Hepatoprotective effects and mechanisms of action of triterpenoids from Lingzhi or Reishi medicinal mushroom Ganoderma lucidum (Agaricomycetes) on α-amanitin-induced liver injury in mice[J]. International Journal of Medicinal Mushrooms,2016,18(9):841−850. doi: 10.1615/IntJMedMushrooms.v18.i9.80
[50] ZHANG X Q, FANNY C F, ZHANG D M, et al. Triterpenoids with neurotrophic activity from Ganoderma lucidum[J]. Natural Product Research,2011,25(17):1607−1613. doi: 10.1080/14786419.2010.496367
[51] SU Haiguo, WANG Qian, LIN Zhou, et al. Highly oxygenated lanostane triterpenoids from Ganoderma applanatum as a class of agents for inhibiting lipid accumulation in adipocytes[J]. Bioorganic Chemistry,2020,10(4):263−276.
[52] JIANG Chunjiao, JI Jiancheng, LI Peihai, et al. New lanostane-type triterpenoids with proangiogenic activity from the fruiting body of Ganoderma applanatum[J]. Natural Product Research,2021,34(1):1−7.
[53] 萨翼. 从灵芝类保健食品批准情况看未来中药类保健食品发展方[J]. 中国现代中,2020,22(7):1124−119. [SA Yi. Development trend of traditional Chinese medicine dietary supplement from approval of Ganoderma dietary supplements[J]. Mod Chin Med,2020,22(7):1124−119. [54] 马超, 马传贵, 戚俊, 等. 灵芝孢子粉破壁技术及灵芝类保健食品开发研究进展[J]. 中国食用菌,2020,39(12):8−12,17. [MA Chao, MA Chuangui, QI Jun, et al. Progress in research on sporoderm-breaking technology of Ganoderma lucidum spore powder and development of Ganoderma health food[J]. Edible Fungi of China,2020,39(12):8−12,17. [55] 林花, 王霞, 车成来, 等. 灵芝功能性食品对小鼠免疫功能促进作用的研究[J]. 农业与技术,2018,38(17):10−13. [LIN Hua, WANG Xia, CHE Chenglai, et al. Study on the effect of Ganoderma health food on the Immune function of mice[J]. Agriculture & Technology,2018,38(17):10−13. [56] 张瑞婷, 张述仁, 海娟, 等. 灵芝在保健食品中的应用研究进展[J]. 安徽农业科学,2018,46(10):33−35. [ZHANG Ruiting, ZHAGN Shuyin, HAI Juan, et al. Research progress on application of Ganoderma lucidum in health food[J]. J Anhui Agric Sci,2018,46(10):33−35. doi: 10.3969/j.issn.0517-6611.2018.10.009





 下载:
下载:
 下载:
下载:
