Natural Deep Eutectic Solvent Extraction of Amentoflavone from Selaginella uncinata
-
摘要: 目的:采用低共熔溶剂提取翠云草中穗花杉双黄酮(amentoflavone,AME),优化提取工艺参数。方法:合成了3种低共熔溶剂并进行筛选,然后对提取效果最佳的低共熔溶剂进行结构分析,研究提取时间、提取温度、提取功率、液固比对翠云草中AME提取量的影响,再进一步运用响应面设计技术优化提取条件,并与传统提取方法(浸渍法、渗漉法、超声法)比较。结果:筛选出适合提取AME的溶剂为氯化胆碱:4-松油醇,最佳的提取条件为:低共熔溶剂(氯化胆碱与4-松油醇摩尔比1:5)含水量30%、超声功率为280 W、液固比为16:1 mL/g、提取温度为48 ℃、提取时间为24 min,AME最大提取量为(0.941±0.07) mg/g。与超声法、冷浸法、热浸法比较,低共熔溶剂提取AME的含量提高了近5倍,且时间缩短了1/10(P<0.05)。结论:低共熔溶剂提取法是一种高效、快速且简便的提取方法,可为中药有效成分的提取研究提供一些参考。Abstract: Objective: The deep eutectic solvent was used to extract the amentoflavone (AME) of Selaginella uncinata and the extraction process parameters were optimized. Method: Three deep eutectic solvents were synthesized and screened, and then the structure of the deep eutectic solvent with the best extraction effect was characterized. The effect of extraction time, extraction temperature, extraction power, and liquid-solid ratio on the extraction effect of amentoflavone from Selaginella uncinata were investigated. The response surface design technology was further used to optimize the extraction conditions, and compared with traditional extraction methods (dipping method, percolation method, ultrasonic method). Results: The suitable deep eutectic solvent for extracting AME was selected as choline chloride: 4-terpineol. The best extraction conditions were: Ultrasonic power of 280 W, liquid-to-solid ratio of 16:1 mL/g, extraction temperature of 48 ℃, extraction time of 24 min, and AME maximum extraction of (0.941±0.07) mg/g. Compared with the ultrasonic method, cold soaking method, and hot soaking method, the content of AME extracted by eutectic solvent was increased nearly 5 times, and the extraction time was shortened by 1/10 (P<0.05). Conclusion: The deep eutectic solvent extraction method was an efficient, fast and simple extraction method, which can provide some references for the extraction and research of the effective components of traditional Chinese medicine.
-
翠云草(Selaginella uncinata,SU),别名龙须、剑柏等,属卷柏科卷柏属多年生草本植物。中医理论认为翠云草具有清热利湿、止血消淤等功效[1]。现代药理学研究表明,翠云草具有药理作用,包括抗肿瘤[2]、平喘[3]、抗病毒[4]、抗菌[5]、抗氧化[5]等。
翠云草中含有双黄酮类[6]、酚类[7]、皂苷类[8]、酸酯类[9]、挥发油类[10]等多种化学成分,其中穗花杉双黄酮(amentoflavone, AME)是其主要活性成分。Chen等[11]研究发现AME可以使胶质瘤细胞中铁、MDA和脂质OS水平升高,GSH水平和线粒体膜电位降低,调节自噬相关蛋白以及AMPK/mTOR信号促进自噬,并以剂量依赖性阻断胶质瘤细胞周期进程从而抑制胶质瘤细胞的生长。Kim等[12]研究发现AME通过抑制EMT及其相关蛋白的表达,从而抑制体内癌细胞细胞的转移和侵袭从而达到抗肿瘤作用。传统提取黄酮的方法包括回流提取法[13]、渗漉法[14]、碱溶酸沉法[15]等,具有能耗较高,提取率低,溶剂易挥发的缺点,所以寻找一种安全、高效、成本低的提取方法从翠云草中提取AME显得尤为迫切。
低共熔溶剂(Deep eutectic solvent,DES)是由Abbott在2003年开发的一种新型的绿色溶剂,是由氢键受体如季铵盐和氢键供体如酰胺、羧酸等组成的低共熔混合物,具有合成步骤简单、成本低、安全、能生物降解、结构可调节等优点[16]。由于DES具有独特的溶解性和结构,因此DES能够在中药有效成分提取过程中通过与目标物形成较强的分子间氢键从而提高目标物的溶出,使得DES具有优于传统溶剂的选择性与提取能力。因此,本研究了合成3种新型DES并对其结构进行了表征,首次以DES为溶剂提取翠云草中的AME,对工艺参数进行优化并与传统提取方法进行比较,由此为翠云草的进一步开发和应用提供参考。
1. 材料和方法
1.1 材料与仪器
翠云草(Selaginella uncinata) 采自遵义市四面山,经遵义医科大学张玉金副教授鉴定为真品;4-松油醇(批号20121003)、橙花醇(批号20080902)、橙花叔醇(批号20111101)、氯化胆碱(批号20120302) 上海源叶生物科技有限公司;穗花杉双黄酮标准品(纯度>98%,批号20201602) 成都瑞芬思生物科技有限公司。
Agient1260高效液相色谱仪 美国安捷伦公司;FW177粉碎机 泰斯特仪器公司;KQ5200超声波清洗器 昆山市超声仪器有限公司;OSB-2100旋转蒸发仪 上海蒙朗仪器有限公司;Nicolet IS5 傅里叶红外光谱仪 美国赛默飞世尔科技;Labsys Evo热重分析仪 法国塞塔拉姆公司。
1.2 实验方法
1.2.1 翠云草中穗花杉双黄酮提取工艺及其测定方法
1.2.1.1 提取工艺
取3 g过80目筛的翠云草干燥粉末与一定体积的DES混匀,在50 ℃、240 W条件下超声提取25 min,提取完毕后过滤,将滤液进行旋转蒸发除去溶剂,得AME提取物。将提取物用甲醇溶解,转移至100 mL容量瓶,用甲醇定容至刻度,经0.45 μm微孔滤膜过滤后以“1.2.1.3”项下色谱条件进行HPLC分析,按照下式计算AME的提取量。
AME(mg/g)=C×V/M 式中:C为提取液中AME浓度,mg/mL;V为提取液的体积,mL;M为样品质量,g。
1.2.1.2 标准曲线绘制
取AME标准品10.18 mg于25 mL量瓶中,以甲醇稀释定容作为母液。分别取1、2、3、4、5、6 mL母液于25 mL量瓶并以甲醇稀释定容,得系列对照品溶液,分别注入高效液相色谱仪中,按照“1.2.1.3”项下色谱条件测定峰面积。以对照品浓度为横坐标,色谱峰峰面积为纵坐标进行线性回归,回归方程为y=67633x−272.6,其决定系数R2=0.9996,表明在0.016~0.098 mg/mL范围内线性良好。
1.2.1.3 色谱条件
色谱柱:Ascentis-C18 (250 mm×4.6 mm,5 µm);流动相:乙腈(A),0.1%甲酸水溶液(B);流速:1 mL/min;柱温:25 ℃;检测波长:330 nm;进样量:10 μL[17]。洗脱梯度如表1所示。
表 1 AME洗脱梯度Table 1. AME elution gradient时间(min) 乙腈(%) 0.1%甲酸水溶液(%) 0 30 70 20 30 70 50 100 0 55 40 60 1.2.2 DES的制备
以氯化胆碱(Choline chloride)为氢键受体(HBA),以4-松油醇、橙花醇、橙花叔醇为氢键供体(HBD),摩尔比为1:5,60 ℃下加热搅拌8 h,制备了3种DES[18]。
1.2.3 DES筛选及结构分析
1.2.3.1 最佳DES筛选
如表2所示,按照“1.2.2.1”项下方法合成3种DES,并分别调整其含水量为20%。取3 g翠云草粉末分别与3种DES按照液固比为8 mL/g混合,在温度为50 ℃、超声功率240 W的条件下超声提取25 min,计算AME提取量,筛选出最佳的DES。
表 2 不同类型的DESTable 2. Different types of DES编号 HBD HBA DES-1 橙花醇 氯化胆碱 DES-2 橙花叔醇 氯化胆碱 DES-3 4-松油醇 氯化胆碱 1.2.3.2 结构分析
DES的特征基团通过傅里叶红外光谱进行分析,将少量样品涂布于溴化钾晶片上,用红外光谱分析仪进行扫描,扫描范围为400~4000 cm−1;DES的结构和组成通过核磁分析进行测定,以DMSO-d6为溶剂,TMS为内标,分辨率为100 MHz,对样品进行核磁分析;DES的热稳定性通过热重分析进行测定,将少量样品装入氧化铝坩埚,以氮气为载体、升温速率10 ℃/min、温度范围25~900 ℃的条件下进行测定。
1.2.4 单因素实验
1.2.4.1 含水量对AME提取量的影响
将氯化胆碱和4-松油醇按摩尔比为1:5合成DES-3,调整其含水量分别为(10%、20%、30%、40%、50%)。取3 g翠云草粉末与DES按照液固比为8:1 mL/g在温度为50 ℃,超声功率240 W的条件下超声提取25 min,计算AME提取量,考察含水量对AME提取量的影响。
1.2.4.2 液固比对AME提取量的影响
将氯化胆碱和4-松油醇按摩尔比为1:5合成DES-3,调节其含水量为20%。取3 g翠云草粉末,按照不同液固比(4:1、8:1、12:1、16:1、20:1 mL/g)在温度为50 ℃,超声功率240 W的条件下超声提取25 min,计算AME提取量,考察液固比对AME提取量的影响。
1.2.4.3 提取时间对AME提取量的影响
将氯化胆碱和4-松油醇按摩尔比为1:5合成DES-3,调节其含水量为20%。取3 g翠云草粉末与DES-3按照液固比为8:1 mL/g在温度为50 ℃,超声功率240 W的条件下超声提取不同时间(5、15、25、35、45 min),计算AME提取量,考察提取时间对AME提取量的影响。
1.2.4.4 提取温度对AME提取量的影响
将氯化胆碱和4-松油醇按摩尔比为1:5合成DES-3,调节其含水量为20%。取3 g翠云草粉末与DES-3按照液固比为8:1 mL/g在不同温度(30、40、50、60、70 ℃),超声功率240 W的条件下超声提取25 min,计算AME提取量,考察提取温度对AME提取量的影响。
1.2.4.5 超声功率对AME提取量的影响
将氯化胆碱和4-松油醇按摩尔比为1:5合成DES-3,调节其含水量为20%。取3 g翠云草粉末与DES-3按照液固比为8:1 mL/g在温度为50 ℃下,用不同超声功率(160、200、240、280、320 W)对翠云草粉末超声提取25 min,计算AME提取量,考察超声功率对AME提取量的影响。
1.2.5 Box-Benhnken (BBD)试验
结合单因素实验结果,采取3因素3水平BBD试验选择最佳AME提取条件。在液固比(A)、提取时间(B)、提取温度(C)中选取对提取的AME浓度影响最大的三个水平,分别以−1、0、1编码,因素与水平设计见表3。
表 3 因素水平设计Table 3. Factor and level design水平 A液固比( mL/g) B提取时间(min) C提取温度(℃) −1 12 15 40 0 16 25 50 1 20 35 60 1.2.6 与其他提取方法比较
1.2.6.1 浸渍法
根据刘昊等[19]研究的方法稍作修改,取3 g翠云草粉末于锥形瓶中,加入70%乙醇100 mL,室温下浸泡6 h,浸泡完毕后过滤,将滤液进行旋转蒸发除去溶剂,得AME提取物。将提取物用甲醇溶解,转移至100 mL容量瓶,用甲醇定容至刻度,经0.45 μm微孔滤膜过滤后以“1.2.1.3”项下条件进行HPLC分析,并计算AME的提取量。
1.2.6.2 渗漉法
根据张明等[20]研究的方法稍作修改,取3 g翠云草粉末,用100 mL 70%乙醇浸泡6 h后,以3 mL/min收集提取液,然后将收集的提取液进行旋转蒸发以除去溶剂,得AME提取物。将提取物用甲醇溶解,转移至100 mL容量瓶,用甲醇定容至刻度,经0.45 μm微孔滤膜过滤后以“1.2.1.3”项下条件进行HPLC分析,并计算AME的提取量。
1.2.6.3 超声法
根据崔大明等[21]研究方法稍作修改,取3 g翠云草粉末于锥形瓶中,加入70%乙醇100 mL,以280 W功率进行超声提取27 min,提取完毕后过滤,将滤液进行旋转蒸发除去溶剂,得AME提取物。将提取物用甲醇溶解,转移至100 mL容量瓶,用甲醇定容至刻度,经0.45 μm微孔滤膜过滤后以“1.2.1.3”项下条件进行HPLC分析,并计算AME的提取量。
1.3 数据处理
所有实验重复三次,测定数据以平均值±标准差表示。本文使用Origin 9软件进行作图,采用Design-Expert 11软件中的Box-Behnken对AME提取的相关因素进行响应面分析和优化,采用SPSS 25.0软件对测定数据进行方差显著性分析,P<0.05具有显著性差异,P<0.01具有极显著性差异。
2. 结果与分析
2.1 DES筛选及结构分析
2.1.1 DES筛选
不同DES具有不同的扩散能力、表面张力、极性、溶解度等,因而对AME提取效果也会有所差异[22]。如图1和图2所示,不同的DES对翠云草中AME的提取量具有明显差异(P<0.05),3种不同类型的DES提取AME的能力为:DES-3>DES-1>DES-2,因此选择DES-3(4-松油醇:氯化胆碱=5:1)作为提取AME的最佳溶剂。
2.1.2 DES-3结构分析
2.1.2.1 红外光谱分析
DES-3、4-松油醇、氯化胆碱的红外光谱如图3所示。从图3中可知,在DES-3中,4-松油醇的νOH吸收峰从原来的3436 cm−1红移至3360 cm−1,δOH吸收峰由原来的1368 cm−1蓝移至1373 cm−1;氯化胆碱的δCH3吸收峰从原来的1473 cm−1蓝移至1477 cm−1,δOH吸收峰由954 cm−1红移至949 cm−1。以上结果说明DES-3在合成过程中未发生化学反应,吸收峰的改变是由于溶剂中有强烈的氢键作用所致。
2.1.2.2 核磁分析
DES-3的核磁共振谱图如图4所示。从图4A可知,DES-3共6个特征峰,分别是67.3×10−6和55.4×10−6(归属于氯化胆碱),17.28×10−6、27.49×10−6、119.44×10−6和132.82×10−6(归属于4-松油醇);从图4B可知,DES-3的氯化胆碱氢原子化学位移为3.11×10−6,4-松油醇的氢原子的化学位移为0.81×10−6、0.92×10−6和2.21×10−6。对比氯化胆碱和4-松油醇的标准氢谱和碳谱发现DES-3在制备过程中没有发生化学反应,说明DES-3为多组分共存的混合物。
2.1.2.3 热重分析
DES-6的热重分析图谱如图5所示。100 ℃以内的失重是由于DES-3中的吸收水分丢失所致;100~300 ℃内DES-3的失重不足6%,表现出良好的稳定性;温度高于300 ℃时DES-3剧烈失重,这可能是因为DES-3开始分解所导致的。
2.2 单因素实验结果
2.2.1 含水量对AME提取量的影响
DES的含水量是影响提取效果的重要影响因素。含水量不同,DES的黏度和极性也会随之变化,因此选择适宜的含水量可以提升提取效果[23]。本文共考察了5种不同含水量对AME提取量的影响,结果如图6A所示。当含水量从10%升高到30%时,AME提取量逐渐上升,这可能是因为随着含水量增加,DES的粘度降低,极性增大,有利于翠云草中AME的溶出,因此AME的提取量增加[24];当含水量高于30%时,随着含水量增加,AME提取量逐渐降低,这可能是由于含水量过高影响了DES与AME之间的相互作用[25]。因此选择30%含水量的DES作为翠云草提取溶剂。
2.2.2 提取时间对AME提取量的影响
提取时间对AME提取的影响很大,在一定时间内,AME提取含量随着时间增加,但是时间过长会导致杂质溶出而影响AME提取效果[26]。本文考察了不同提取时间对AME提取量的影响,其结果如图6B所示,当提取时间从5 min增加到25 min时,AME提取量随着时间增加而增加;当提取时间达到25 min时AME提取量最好;当提取时间超过25 min之后,随着时间的增加,AME提取量反而降低,这可能是因为长时间的提取导致杂质溶出增加进而导致AME提取量下降,故选择15~35 min进一步优化。
2.2.3 提取温度对AME提取量的影响
DES的扩散系数、黏度等受温度影响较大,因而温度的差异会影响DES对AME的提取率[27]。本文考察了不同提取温度对AME提取量的影响,结果如图6C所示,当温度从30 ℃上升到50 ℃时,AME的提取量随着温度上升而提高,这是因为随着温度的升高,DES黏度降低,并且高温会增加AME的溶解度和扩散系数[28],故而AME提取量增加;当温度超过50 ℃之后,AME的提取量反而降低,这可能是由于温度的增高而导致AME氧化速度增加以及与DES相互作用减弱,进而导致AME提取量下降[29];当温度为50 ℃时AME提取量最高,故选择40~60 ℃进一步优化。
2.2.4 液固比对AME提取量的影响
溶剂与药材比率是影响AME提取的重要因素,适当的液固比能够使溶剂与药材之间充分接触从而提升AME提取效果。本文考察了不同液固比对AME提取量的影响,结果如图6D所示,液固比在4:1~16:1 mL/g之间时,AME提取量随着液固比增加而提高,这是由于DES增加促进了AME与溶剂接触与分散度,增强扩散作用,从而使AME提取量增加[30];当液固比超过16 mL/g时AME提取量反而降低,这可能是由于液固比增加到一定程度后AME能完全溶出,继续增加液固比会降低AME的浓度,导致细胞内外渗透压下降,渗透压降低,影响AME的溶出[31],进而使AME提取量降低,故选择12~20 mL/g进一步优化。
2.2.5 超声功率对AME提取量的影响
超声提取法是利用超声波的空化作用、机械效应和热效应等加速细胞内有效物质的释放、扩散和溶解从而显著提高提取效率的提取方法。本文考察了不同功率对AME提取量的影响,结果如图6E所示,当超声功率从160 W增加到280 W时,AME提取量随着功率增加而增加,这可能是因为超声功率增大时,空化作用会随超声功率的增大而增强,加快分子扩散速度,加速AME的溶出,从而提高AME得率[32];当超声功率超过280 W之后AME提取量基本不变,所以选择功率280 W为最佳提取功率。
2.3 BBD试验结果
2.3.1 统计分析与模型拟合
结合单因素实验结果,确定液固比(A)、提取时间(B)、提取温度(C)3个水平,以AME浓度为指标进行BBD实验,通过Design-Expert 11软件进行二次响应面回归分析,其结果如表3、表4所示。根据表4得出的回归方程为Y(mg/g)=0.939432+0.0124858×A−0.0234702B−0.0303397C+0.0176446AB+0.011466AC−0.0256474BC−0.0968985A2−0.139072B2−0.086228C2。由表5可知模型的F值为100.7723,P值小于0.0001,说明模型显著;失拟项为3.6189,P值0.1230大于0.05,说明回归方程无失拟因素;模型R2为0.9923,说明模型拟合度较高,能够较好地反映实际情况。一次项A、B、C,交互项BC,二次项A2、B2、C2均具有显著性影响,其中一次项各因素对AME提取量的影响依次为C>B>A。R2adj=0.9825、R2pre=0.9072、精密度为27.7090、变异系数为1.82均说明本模型设计十分合理。
表 4 Box-Behnken试验试验设计及响应值Table 4. Box-Behnken experiment design and response value实验号 液固比
(A,mL/g)提取时间
(B,min)提取温度
(C,℃)AME浓度
(mg/g)1 20 35 50 0.721 ± 0.04 2 16 35 40 0.752 ± 0.08 3 16 15 60 0.728 ± 0.14 4 12 15 50 0.721 ± 0.15 5 20 25 40 0.772 ± 0.13 6 16 25 50 0.948 ± 0.04 7 12 35 50 0.643 ± 0.05 8 16 15 40 0.752 ± 0.15 9 16 25 50 0.935 ± 0.09 10 16 35 60 0.625 ± 0.12 11 16 25 50 0.947 ± 0.11 12 12 25 60 0.718 ± 0.07 13 20 15 50 0.728 ± 0.05 14 12 25 40 0.787 ± 0.02 15 16 25 50 0.943 ± 0.05 16 16 25 50 0.924 ± 0.08 17 20 25 60 0.748 ± 0.12 表 5 Box-Behnken试验设计及回归分析结果Table 5. Box-Behnken experimental design and regression analysis results方差来源 平方和 自由度 均方 F值 P值 模型 0.1865 9 0.0207 100.7723 <0.0001 A-液固比 0.0012 1 0.0012 6.0646 0.0433 B-提取时间 0.0044 1 0.0044 21.4294 0.0024 C-提取温度 0.0074 1 0.0074 35.8093 0.0006 AB 0.0012 1 0.0012 6.0557 0.0434 AC 0.0005 1 0.0005 2.5572 0.1538 BC 0.0026 1 0.0026 12.7947 0.0090 A2 0.0395 1 0.0395 192.2447 <0.0001 B2 0.0814 1 0.0814 396.0040 <0.0001 C2 0.0313 1 0.0313 152.2360 <0.0001 残差 0.0014 7 0.0002 失拟项 0.0011 3 0.0004 3.6189 0.1230 纯误差 0.0004 4 0.0001 总离差 0.1879 16 2.3.2 各因素交互影响分析
由回归方程可知各因素之间交互影响,其结果如7所示。图7A、图7B、图7C分别为时间、温度、液固比为零水平时温度-液固比、时间-液固比、时间-温度两两因素对AME提取效果的影响。从图7中可以看出,所有的响应面图均向上凸,AME浓度具有最大值,显示了3D响应面模型的合理性。由二次方程可得出最佳提取条件:液固比为16.198 mL/g、提取温度为48.375 ℃、提取时间为24.340 min,AME浓度的预测值为0.943 mg/g。实际调整为液固比为16 mL/g、提取温度为48 ℃、提取时间为24 min,AME浓度为0.941±0.07 mg/g,与预测值基本相同,表明该模型可用于AME的提取。
2.4 与其他方法比较
本文采取4种方法(DES法、浸渍法、渗漉法、超声法)对翠云草进行提取,比较这些方法对翠云草中AME提取效果,结果如图8所示,与超声法相比,DES法提取的AME含量提高了近2倍;与浸渍法和渗漉法比较,DES法提取的AME含量提高了近5倍并且提取时间从360 min降到了24 min;与三种方法相比,DES法所用的溶剂量从100 mL减少到48 mL,极大地节约了有机试剂的使用量。通过对4种提取方法进行比较,证明了DES法提取翠云草中AME具有极大的潜在应用价值,有望成为一种从翠云草中快速、高效、绿色的提取AME的方法。
3. 结论
本文以翠云草为研究对象,以DES为提取溶剂,对翠云草中AME进行提取。DES氢键供体为氯化胆碱,氢键受体为4-松油醇,二者摩尔比为1:5时翠云草中AME提取量最高。通过单因素和响应面试验,得到最佳的提取条件为:含水量为30%,超声功率为280 W,液固比为16:1 mL/g、提取温度为48 ℃、提取时间为24 min。将DES法与传统提取方法(超声法、浸渍法、渗漉法)比较,表明DES法对翠云草中AME的提取效果优于传统方法。结果表明,DES法作用条件温和,无需高温高压,AME提取量高,可将其应用天然药物提取等领域,拓展天然产物的的提取分离途径。
-
表 1 AME洗脱梯度
Table 1 AME elution gradient
时间(min) 乙腈(%) 0.1%甲酸水溶液(%) 0 30 70 20 30 70 50 100 0 55 40 60 表 2 不同类型的DES
Table 2 Different types of DES
编号 HBD HBA DES-1 橙花醇 氯化胆碱 DES-2 橙花叔醇 氯化胆碱 DES-3 4-松油醇 氯化胆碱 表 3 因素水平设计
Table 3 Factor and level design
水平 A液固比( mL/g) B提取时间(min) C提取温度(℃) −1 12 15 40 0 16 25 50 1 20 35 60 表 4 Box-Behnken试验试验设计及响应值
Table 4 Box-Behnken experiment design and response value
实验号 液固比
(A,mL/g)提取时间
(B,min)提取温度
(C,℃)AME浓度
(mg/g)1 20 35 50 0.721 ± 0.04 2 16 35 40 0.752 ± 0.08 3 16 15 60 0.728 ± 0.14 4 12 15 50 0.721 ± 0.15 5 20 25 40 0.772 ± 0.13 6 16 25 50 0.948 ± 0.04 7 12 35 50 0.643 ± 0.05 8 16 15 40 0.752 ± 0.15 9 16 25 50 0.935 ± 0.09 10 16 35 60 0.625 ± 0.12 11 16 25 50 0.947 ± 0.11 12 12 25 60 0.718 ± 0.07 13 20 15 50 0.728 ± 0.05 14 12 25 40 0.787 ± 0.02 15 16 25 50 0.943 ± 0.05 16 16 25 50 0.924 ± 0.08 17 20 25 60 0.748 ± 0.12 表 5 Box-Behnken试验设计及回归分析结果
Table 5 Box-Behnken experimental design and regression analysis results
方差来源 平方和 自由度 均方 F值 P值 模型 0.1865 9 0.0207 100.7723 <0.0001 A-液固比 0.0012 1 0.0012 6.0646 0.0433 B-提取时间 0.0044 1 0.0044 21.4294 0.0024 C-提取温度 0.0074 1 0.0074 35.8093 0.0006 AB 0.0012 1 0.0012 6.0557 0.0434 AC 0.0005 1 0.0005 2.5572 0.1538 BC 0.0026 1 0.0026 12.7947 0.0090 A2 0.0395 1 0.0395 192.2447 <0.0001 B2 0.0814 1 0.0814 396.0040 <0.0001 C2 0.0313 1 0.0313 152.2360 <0.0001 残差 0.0014 7 0.0002 失拟项 0.0011 3 0.0004 3.6189 0.1230 纯误差 0.0004 4 0.0001 总离差 0.1879 16 -
[1] 马家宝, 韦丽富, 梁建莉, 等. 翠云草的化学成分及药理作用研究概况[J]. 广西中医药大学学报,2014,17(3):67−69. [MA Jiabao, WEI Lifu, LIANG Jianli, et al. General situation of the research on the chemical constituents and pharmacological effects of Selaginella uncinata[J]. Journal of Guangxi University of Chinese Medicine,2014,17(3):67−69. [2] 金旭东, 钟佳美, 卢轩, 等. 两种卷柏属植物对人单核细胞白血病U937细胞的增殖和凋亡影响[J]. 中药药理与临床,2018,34(5):74−77. [JIN Xudong, ZHONG Jiamei, LU Xuan, et al. Anti-proliferative and apoptosis effect of two Selaginella plants on human monocytic leukemia U937 cell line[J]. Pharmacology and Clinics of Chinese Materia Medica,2018,34(5):74−77. [3] 应华忠, 王德军, 徐孝平, 等. 翠云草平喘作用的实验研究[J]. 江西科学,2004(5):379−381. [YING Huazhong, WANG Dejun, XU Xiaoping, et al. Experimental study on the antiasthmatic effects of Selaginella uncinata[J]. Jiangxi Science,2004(5):379−381. doi: 10.3969/j.issn.1001-3679.2004.05.017 [4] 江海燕, 吴思超, 朱家杰, 等. 几种瑶药的体外抗病毒活性初步研究[J]. 暨南大学学报(自然科学版),2008(5):500−504. [JIANG Haiyan, WU Sichao, ZHU Jiajie, et al. Several Yao drug in vitro antiviral activity preliminary study[J]. Journal of Jinan University(Natural Science & Medicine Edition),2008(5):500−504. [5] 雷杰, 黎维维, 欧阳陈琳, 等. 翠云草挥发油成分分析、抗氧化及抗菌效果[J]. 食品工业科技,2020,41(17):269−273. [LEI Jie, LI Weiwei, OUYANG Chenlin, et al. Composition analysis, antioxidant and antibacterial effect of volatile oil from Selaginella uncinata[J]. Science and Technology of Food Industry,2020,41(17):269−273. [6] 肖凌, 陈莹, 张飞, 等. 翠云草双黄酮类化学成分研究[J]. 药物分析杂志,2018,38(12):2093−2103. [XIAO Ling, CHEN Ying, ZHANG Fei, et al. Chemical constituents of biflavonoids from Selaginella uncinata[J]. Chinese Journal of Pharmaceutical Analysis,2018,38(12):2093−2103. [7] 郑俊霞, 郑扬, 张磊, 等. 翠云草中黄酮及酚性成分研究[J]. 时珍国医国药,2012,23(12):3006−3007. [ZHENG Junxia, ZHENG Yang, ZHANG Lei, et al. Isolation and identification of flavonoids and phenolic constituents from Selaginella uncinata (Desv.) Spring[J]. Lishizhen Medicine and Materia Medica Research,2012,23(12):3006−3007. doi: 10.3969/j.issn.1008-0805.2012.12.025 [8] ZHENG J, ZHENG Y, ZHI H, et al. Two new steroidal saponins from Selaginella uncinata (Desv.) Spring and their protective effect against anoxia[J]. Fitoterapia,2013,88(6):963−987.
[9] LIU R, ZOU H, XU P-S, et al. Uncinatic acids A-C, three new carboxylated flavonoids from Selaginella uncinata[J]. Chinese Chemical Letters,2017,28(7):1120−1141.
[10] 鲁曼霞, 黄可龙, 施树云, 等. 3种卷柏属植物挥发性化学成分的气相色谱-质谱联用分析与比较[J]. 时珍国医国药,2009,20(9):2119−2121. [LU Manxia, HUANG Kelong, SHI Shuyun, et al. Comparison of chemical constituents of volatile oils from three kinds of selaginella plants by gas chromatography-mass spectrometry[J]. Lishizhen Medicine and Materia Medica Research,2009,20(9):2119−2121. doi: 10.3969/j.issn.1008-0805.2009.09.005 [11] Chen Y, Li N, Wang H J, et al. Amentoflavone suppresses cell proliferation and induces cell death through triggering autophagy-dependent ferroptosis in human glioma[J]. Life Sciences,2020,24(7):13−30.
[12] KIM G L, JANG E H, LEE D E, et al. Amentoflavone, active compound of Selaginella tamariscina, inhibits in vitro and in vivo TGF-β-induced metastasis of human cancer cells[J]. Archives of Biochemistry and Biophysics,2020,68(7):108384.
[13] SATI P, DHYANI P, BHATT I D, et al. Ginkgo biloba flavonoid glycosides in antimicrobial perspective with reference to extraction method[J]. Journal of Traditional and Complementary Medicine,2019,9(1):15−23. doi: 10.1016/j.jtcme.2017.10.003
[14] HASHEMI Z, EBRAHIMZADEH M A, KHALILI M. Sun protection factor, total phenol, flavonoid contents and antioxidant activity of medicinal plants from Iran[J]. Tropical Journal of Pharmaceutical Research,2019,18(7):1443−1448.
[15] 张曼玉, 李帅, 任凯霞, 等. 碱溶酸沉法提取血红铆钉菇中总黄酮的技术研究[J]. 海南师范大学学报(自然科学版),2019,32(2):170−176. [ZHANG Manyu, LI Shuai, REN Kaixia, et al. Extraction of total flavonoids from Chroogomphidius viscidus by alkali-soluble acid precipitation method[J]. Journal of Hainan Normal University(Natural Science),2019,32(2):170−176. [16] 都宏霞, 缪领珍, 胡梓恒, 等. 低共熔溶剂提取桂花黄酮的工艺优化[J]. 现代食品科技,2021,37(5):1−9. [DU Hongxia, MIAO Lingzhen, HU Ziheng, et al. Optimizing the extraction of flavonoids from osmanthus fragrans using deep eutectic solvents[J]. Modern Food Science & Technology,2021,37(5):1−9. [17] 蒋永梅, 田雨佳, 钱艳, 等. 不同产地石上柏中3种双黄酮含量测定[J]. 辽宁中医药大学学报,2018,20(11):34−37. [JIANG Yongmei, TIAN Yujia, QIAN Yan, et al. Determination of three bioflavonoids in Selaginella doederleinii by HPLC-DAD[J]. Journal of Liaoning University of Traditional Chinese Medicine,2018,20(11):34−37. [18] WIBOWO H, LIAO W J, ZHOU X Y, et al. Study on the effect of operating parameters towards CO2 absorption behavior of choline chloride - Monoethanolamine deep eutectic solvent and its aqueous solutions[J]. Chemical Engineering and Processing-Process Intensification,2020:157.
[19] 刘昊. 芒果黄酮的提取分离及抗氧化活性的研究[D]. 南宁: 广西大学, 2012. LIU Hao. Study on extraction separation and anti-oxidation of the flavonoids from mango[D]. Nanning: Guangxi University, 2012.
[20] 张明. 山楂黄酮提取工艺研究[J]. 安徽农业科学,2014,42(33):11857−11858. [ZHANG Ming. Resrarch on extract technology to extraction of falconoid from hawthorn fruits[J]. Journal of Anhui Agricultural Sciences,2014,42(33):11857−11858. doi: 10.3969/j.issn.0517-6611.2014.33.085 [21] 崔大明, 张益波, 付璐, 等. 响应面法优化超声法提取枸杞中总黄酮工艺[J]. 食品研究与开发,2011,32(3):55−59. [CUI Daming, ZHANG Yibo, FU Lu, et al. Study on optimization of ultrasonic-assistend extraction of general flavonoids in Lycium barbarum L. using response surface method[J]. Food Research and Development,2011,32(3):55−59. doi: 10.3969/j.issn.1005-6521.2011.03.016 [22] DUAN L, ZHANG W H, ZHANG Z H, et al. Evaluation of natural deep eutectic solvents for the extraction of bioactive flavone C-glycosides from Flos Trollii[J]. Microchemical Journal,2018,14(5):423−456.
[23] CHEN Y, DANG J, YAN X, et al. Optimization studies on the extraction of flavone di-c-glycosides from Premna fulva Craib by deep eutectic solvents[J]. Journal of Chemistry,2020,2020(19):1−9.
[24] SMINK D, KERSTEN S R A, SCHUUR B. Recovery of lignin from deep eutectic solvents by liquid-liquid extraction[J]. Separation and Purification Technology,2020,23(5):102−132.
[25] 都宏霞, 石巾艺, 王冬娥. 绿色低共熔溶剂提取互叶白千层精油及成分分析[J]. 广西植物,2021,12(2):1−15. [DU Hongxia, SHI Jinyi, WANG Donge, et al. Extraction and composition analysis of essential oil of Melaleuca alternifolia by green deep eutectic solvents[J]. Guihaia,2021,12(2):1−15. [26] 李杰, 李婼楠, 王艺文, 等. 超声辅助低共熔溶剂法提取黄芩中3种黄酮类成分的工艺研究[J]. 中华中医药学刊,2021,39(2):143−146. [LI Jie, LI Ruonan, WANG Yiwen, et al. Extraction of three flavonoids from Huangqin(Scutellaria baicalensis Georgi) by ultrasonic assistant deep eutectic solvent method[J]. Chinese Archives of Traditional Chinese Medicine,2021,39(2):143−146. [27] ATHANASIADIS V, GRIGORAKIS S, LALAS S, et al. Highly efficient extraction of antioxidant polyphenols from Olea europaea leaves using an eco-friendly glycerol/glycine deep eutectic solvent[J]. Waste & Biomass Valorization,2017,56(2):123−142.
[28] NIE J G, CHEN D T, LU Y B. Deep eutectic solvents based ultrasonic extraction of polysaccharides from edible brown seaweed Sargassum horneri[J]. Journal of Marine Science and Engineering,2020,8(6):456−475. doi: 10.3390/jmse8060456
[29] ZHANG L J, WANG M S. Optimization of deep eutectic solvent-based ultrasound-assisted extraction of polysaccharides from Dioscorea opposita Thunb[J]. International Journal of Biological Macromolecules,2017,95:675−681. doi: 10.1016/j.ijbiomac.2016.11.096
[30] 李杰, 吴艳芳, 王新胜, 等. 低共熔溶剂提取枳实中黄酮类成分的工艺研究[J]. 应用化工,2020,49(12):3078−3082. [LI Jie, WU Yanfang, WANG Xinsheng, et al. Extraction of flavonoids from fructus aurantii immaturus by deep eutectic solvent[J]. Applied Chemical Industry,2020,49(12):3078−3082. doi: 10.3969/j.issn.1671-3206.2020.12.027 [31] 弓威, 顾丰颖, 贺凡, 等. 山楂叶有效成分提取工艺优化及抗氧化活性研究[J]. 核农学报,2015,29(8):1547−1558. [GONG Wei, GU Fengyi, HE Fan, et al. Optimization of extraction technology of effective components from hawthorn leaves and assessment of antioxidant activity[J]. Journal of Nuclear Agricultural Sciences,2015,29(8):1547−1558. doi: 10.11869/j.issn.100-8551.2015.08.1547 [32] 都宏霞, 刘宴秀, 严忠杰, 等. 超声波辅助-绿色低共熔溶剂提取茉莉花黄酮的工艺优化[J]. 现代食品科技,2021,37(1):199−206. [DU Hongxia, LIU Yanxiu, YAN Zhongjie, et al. Optimization of ultrasonic assisted-green deep eutectic solvent extraction of flavonoids from jasmine[J]. Modern Food Science & Technology,2021,37(1):199−206.





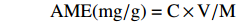
 下载:
下载:








 下载:
下载:
