Effects of Acidic/Alkali Pretreatment on Physicochemical Properties and Gelation Characteristics of Bone Gelatin from American Eel (Anguilla rostrata)
-
摘要: 以美洲鳗鲡(Anguilla rostrata)鱼骨为原料,采用酸或碱预处理结合热水浸提制备鱼骨明胶,并通过得率、凝胶强度测定、SDS-PAGE、紫外全波长扫描、红外光谱扫描、动态流变学测定以及扫描电镜等研究鱼骨明胶的理化性质和凝胶特性。结果表明:酸法预处理明胶(AG60)与碱法预处理明胶(BG60)得率分别为13.6%和6.88%,凝胶强度分别为101.95 g和78.74 g。AG60和BG60的羟脯氨酸含量为3.2 g/100 g和2.7 g/100 g。两种明胶均含有β和α1、α2链,其中AG60的α1+α2含量显著高于BG60。AG60与BG60均具有明胶的特征吸收峰,且无杂蛋白吸收峰。与BG60相比,AG60具有更高的凝胶温度与熔融温度,以及更短的胶凝时间。扫描电镜分析显示,AG60具有更致密、均一的凝胶网络结构。本研究表明,与碱法预处理相比,酸法预处理制备得到的鳗鱼骨明胶具有更高的得率与更好的凝胶特性。Abstract: Fish bone gelatins were prepared from Anguilla rostrata by acidic or alkali pretreatment combined with hot water extraction. The physicochemical properties and gel properties of fish bone gelatins were investigated via the yield determination, gel strength measurement, SDS-PAGE analysis, ultraviolet full-wavelength scanning, infrared spectrum scanning, dynamic rheology measurement and scanning electron microscopy. As results, the yields of acid pretreated gelatin (AG60) and alkaline pretreated gelatin (BG60) were 13.6% and 6.88%, with the corresponding gel strengths of 101.95 g and 78.74 g, respectively. The hydroxyproline contents of AG60 and BG60 were 3.2 g/100 g and 2.7 g/100 g. Both gelatins were mainly consisted of β and α1, α2 chains, the contents of α1 and α2 chains in AG60 was significantly higher than those in BG60. Both AG60 and BG60 possessed the characteristic absorption peak of gelatin without any absorption peaks for other proteins. The AG60 possessed higher gelling temperature and melting temperature, as well as a shorter gelling time. Scanning electron microscopy analysis showed that AG60 showed a more dense and uniform gel network structure as compared with BG60. Present study suggested that the eel bone gelatin prepared by acidic pretreatment had better gel properties than that of gelatin prepared by alkali pretreatment.
-
明胶是胶原蛋白的变性产物,由于其独特的功能特性而被广泛应用于食品、制药和化妆品等领域[1]。一般来说,商业明胶主要是以猪、牛等哺乳动物的皮和骨为原料制得。然而哺乳动物来源的明胶存在牛海绵状脑病(TSE)和口蹄疫(FMD)等人畜共患疾病的安全风险以及宗教信仰的使用限制,使其在食品领域中的应用受到一定程度的影响[2]。相比之下,利用水产动物副产物(如:鱼皮、鱼鳞、鱼骨等)制备明胶,不仅具有良好的安全性与接受度,还有利于副产物的高值化利用,具有广阔的市场应用前景。
商业明胶的制备主要包括原料的预处理和提取明胶两部分:在预处理阶段,不仅可以去除样品表面的非胶原蛋白,还可以破坏稳定胶原蛋白结构的共价键,使胶原纤维发生溶胀,促进其溶解,从而提高明胶提取效率[3]。在提取阶段,通过45 ℃以上的水浴加热使胶原蛋白受热水解,导致胶原分子的螺旋结构更多地向无规则线圈转变,产生松散卷曲的明胶多肽链,转化为可溶性明胶[4]。鱼骨和鱼皮作为水产品大规模工业化加工过程中产生的主要副产物,往往残留鱼肉或油脂,且骨骼中含有40%左右的无机矿物质,需要进行必要的预处理以提高明胶提取率和纯度。常用的预处理方式主要有酸处理和碱处理,其相应得到的明胶也分别被称为酸法明胶(A型明胶)和碱法明胶(B型明胶)。Hao等[5]比较了氢氧化钙和醋酸溶液不同预处理对西伯利亚鲟鱼(Acipenser baeri)鱼皮明胶的理化特性,发现氢氧化钙和醋酸结合的预处理方式制得的明胶特性最好。Ali等[6]发现硫酸/乙酸预处理结合超声波预处理可以有效地提高金鲫鱼(Probarbus jullieni)鱼皮明胶的提取效率和凝胶特性。由此可见,酸/碱预处理对明胶的理化特性与凝胶特性具有重要影响。针对鱼骨或鱼皮明胶的提取,目前国内外研究已有较多报道,如:于淑池等[7]研究了提取工艺对金鲳鱼(Trachinotus ovatus)鱼骨明胶性质影响;Muyonga 等[8]则对比了尼罗河鲈鱼(Lates niloticus)鱼皮和鱼骨明胶的理化特性;Mi等[9]研究了酶法辅助提取对阿拉斯加狭鳕(Theragra chalco-gramma)和黄鳍金枪鱼(Limanda aspera)鱼骨明胶特性的影响。这些研究主要围绕提取工艺对明胶性质的影响以及不同来源明胶的性质对比等方面,而对比酸和碱处理后鱼骨明胶的差异则鲜有报道。
鳗鲡是我国重要的经济水产养殖品种之一,随着养殖和加工技术的进步,我国已成为世界鳗鱼制品(以烤鳗为主)的出口基地。福建是我国鳗鱼制品的出口大省,2019年福建省鳗鱼产量10.14万吨,占全国鳗鱼养殖总产量的43.31%,2018年福建省烤鳗出口量为2.0万吨,占当年中国烤鳗出口量的51.28%[10]。烤鳗在加工过程中会产生大量的副产物,其中鱼骨可占鳗鱼总重的10%。鳗鱼骨中含有丰富的胶原蛋白,是制备胶原蛋白和明胶的理想原料。
本研究以我国当前主要的鳗鲡养殖品种——美洲鳗鲡(Anguilla rostrata)为对象,研究酸/碱预处理对美洲鳗鲡鱼骨明胶理化特性及其凝胶性质的影响,旨在为鳗鱼骨的明胶制备与品质控制提供理论参考。
1. 材料与方法
1.1 材料与仪器
美洲鳗鲡鱼骨 福建省汉德(武夷山)食品有限公司提供;十二烷基硫酸钠(SDS)、羟脯氨酸 标准品,美国Sigma公司;异丙醇、氢氧化钠、盐酸 国药集团化学试剂有限公司。
HD-E702-100T高低温交变试验箱 海达仪器有限公司;恒温水浴锅 厦门精艺工业科技有限公司;Alpha 1-4 LD plus冷冻干燥机 德国CHRIST公司;NamoPhotometer超微量分光光度计 德国IMPLEN公司;Mini-PROTEAN蛋白质电泳装置 美国Bio-Rad公司;G:BOX凝胶成像仪 英国Syngene公司;Phenom Pro台式扫描电子显微镜 荷兰Phenom World Pr公司;TA.XTPLUS质构仪 美国TA Instruments仪器;NICOLET傅里叶红外光谱分析仪 Thermo SCIENTIFIC公司;DHR-1流变仪 美国TA Instruments仪器公司。
1.2 实验方法
1.2.1 美洲鳗鲡鱼骨明胶的制备
1.2.1.1 美洲鳗鲡鱼骨预处理
鱼骨预处理参考Bandeira[11]和Abedinia[12]等的方法并做适当修改。将解冻好的美洲鳗鲡鱼骨放置温度为27 ℃、湿度为10%的干燥箱中冷风风干至水分含量低于10%,用粉碎机粉碎成骨粉,在−20 ℃储存备用。在两个烧杯中分别称取100.0±0.1 g的鱼骨粉,分别加入料液比为1:10(w/v)的浓度为0.1 mol/L NaOH溶液和0.6 mol/L HCl溶液。在4 ℃下缓慢搅拌处理24 h,每隔6 h更换一次处理液。处理结束后,用蒸馏水反复洗涤鳗鲡鱼骨残渣,直至洗涤水的pH呈中性。由于鳗鱼油脂较多,酸或碱处理后用10%的异丙醇进行脱脂处理24 h,每隔12 h更换一次溶液。脱脂结束后用蒸馏水进行冲洗,沥干备用。
1.2.1.2 鱼骨明胶的提取
称取处理好的鳗鲡骨粉于烧杯中,加入料液比为1:5(w/v)的蒸馏水,并置于60 ℃水浴锅中提取4 h[13]。提取结束后,样品用双层绢布过滤,收集滤液,进行真空冷冻干燥。冻干样分别命名为AG60和BG60(G表示明胶;A表示酸预处理;B表示碱预处理),储存于−20 ℃备用。
1.2.2 鱼骨明胶得率测定
参考Mi等[9]的方法,将处理后的鳗鲡鱼骨在27 ℃的烘箱中烘干至水分含量低于5%,称重,记录前处理鱼骨的干量。冷冻干燥后的明胶进行称重,记录干重。鳗鲡鱼骨明胶提取率的计算公式为:
得率(%)=明胶(g)鱼骨(g)×100 1.2.3 羟脯氨酸含量测定
明胶中的羟脯氨酸含量按照 Woessner等[14]的方法进行测定。称取20 mg的明胶冻干样,加入3 mL浓度为6 mol/L的盐酸,在130 ℃下水解4 h,冷却后倒入小烧杯中,滴入甲基红试剂一滴,随后加入1 mL柠檬酸缓冲液和1 mL绿胺T,混匀后室温下反应10 min。加入1 mL浓度为3.5 mol/L的高氯酸,室温下反应10 min,加入发色剂1 mL,在65 ℃水浴反应20 min,冷却至室温后在560 nm下侧吸光值。以羟脯氨酸为标准品,绘制标准曲线进行定量分析。
1.2.4 鱼骨明胶凝胶强度测定
鳗鲡鱼骨明胶凝胶强度的测定参考Tan等[15]的方法并做适当修改。称取鳗鲡鱼骨明胶0.667 g 置于烧杯中,加入10 mL蒸馏水,在60 ℃水浴至充分溶解,制备浓度为6.67%的明胶溶液。在4 ℃冰箱内放置16~18 h直至形成明胶凝胶。在室温下快速用TA.XTPLUS质构仪测定其凝胶强度,采用型号为p/5 s的球形探头,设置测试速度为0.5 mm/s,触发力为5 gf,当质构仪的探头下压至6 mm,凝胶对探头的最大反作用力就是凝胶强度(g)。
1.2.5 SDS-PAGE分析
参照Laemmli[16]的方法做适当修改,进行鱼骨明胶SDS-PAGE电泳分析。称取适量明胶冻干样溶解于蒸馏水中,配制样品浓度为2 mg/mL的明胶溶液,按照样品与缓冲液的比例为3:1,将样品SDS化。浓缩胶和分离胶丙烯酰胺浓度分别为4%和8%,在10 mA电流下进行电泳。待电泳结束后,通过考马斯亮蓝R-250染液进行染色,再用30%(v/v)甲醇和10%(v/v)乙酸溶液进行脱色,利用凝胶成像仪拍照。
1.2.6 鱼骨明胶紫外全波扫描
使用Namo Photo-meter超微量分光光度计测定鱼骨明胶的紫外-可见光吸收光谱。使用蒸馏水配制浓度为0.5 mg/mL的明胶溶液,在200~400 nm的范围内进行全波长扫描,蒸馏水为参考。
1.2.7 鱼骨明胶红外光谱扫描
在干燥条件下,取适量分析纯KBr研磨压片,作为扫描背景。取1 mg鱼骨明胶冻干样和100 mg KBr晶体于玛瑙研钵中充分研磨均匀,手动压片,选取均匀度和厚薄适中的样品放入样品室,使用Nicolet傅立叶红外光谱分析仪对样品在500~4000 cm−1区间内扫描,基数校正后进行吸光度分析[17]。
1.2.8 鱼骨明胶流变学特性分析
明胶的动态流变学分析根据Tan等[15]的方法进行测定。称取鳗鲡鱼骨明胶置于烧杯中,加入蒸馏水,在60 ℃水浴至充分溶解,配制成浓度为6.67%的明胶溶液。使用DHR-1流变仪测定其流变学特性,测试夹具为40 mm铝平板。在进行流变试验之前,首先进行应力扫描,以确定明胶样品的线性粘弹性区域。
1.2.8.1 温度扫描
采用温度扫描测定样品的凝胶温度和熔融温度。取适量样品溶液于流变仪的帕尔帖平板上,调整至夹具间隙后在样品的外边缘用硅油封边,以减少样品在测量中的水分损失。测定程序参数条件为:应变为0.5%,频率为1 Hz,扫描速率为2 ℃/min,温度程序设定为一个循环。冷却扫描,温度范围设置为40~0 ℃;加热扫描,温度范围设置为0~40 ℃,平衡时间均为120 s。每30 s采集一个点,记录储能模量和损耗模量随温度扫描的变化曲线。
1.2.8.2 时间扫描
流变仪参数设置:应变为0.5%,实验温度为4 ℃,频率为1 Hz,时间设置600 s,进行时间扫描,观察样品储能模量和损耗模量的变化情况。
1.2.9 鱼骨明胶扫描电镜分析
使用扫描电镜观察这两种鱼骨明胶凝胶的微观结构。配制浓度为6.67%的明胶样品,在4 ℃下静置18 h形成明胶凝胶。明胶凝胶切成厚2~3 μm的小块。样品在含有2.5%戊二醛的pH7.2、0.2 mol/L的磷酸盐缓冲液中固定12 h。用蒸馏水冲洗1 h,并使用浓度分别为50%、70%、80%、90%和100%的乙醇梯度脱水[18]。固定后的明胶凝胶样品直接真空冷冻干燥。将两种方法脱水后的样品固定在电镜样品台上,用离子溅射仪进行喷金,扫描电子显微镜在10 kV的加速电压下观察样品微观结构。
1.3 数据处理
所有实验使用三个不同的样品批次进行三次。用Excel软件进行数据录入和图表制作,数据以平均值±标准偏差表示。
2. 结果与分析
2.1 鱼骨明胶得率、羟脯氨酸含量以及凝胶强度分析
如表1所示,在同等提取条件下,美洲鳗鲡鱼骨AG60和BG60的得率分别为13.60%和6.88%,酸法预处理的明胶得率明显高于碱法预处理。这可能是由于盐酸可以与鱼骨中的无机矿物质主要是羟基磷灰石反应,破坏了胶原蛋白与钙盐的结合,生成可溶性钙盐,促进了胶原溶出,导致AG60的得率更高[19]。相比之下,Sockalingam等 [20]采用酸处理提取的黑罗非鱼(Oreochromis mossambicus)鱼头骨明胶得率为5.75%,远低于与本研究中酸法预处理的明胶得率。此外,杜杰等[21]采用酸法从大目金枪鱼(Thunnus obesus)鱼皮中提取的明胶得率为22.01%,Zhang等[22]碱处理提取的罗非鱼(Oreochromis mossambicus)鱼皮明胶得率为18.4%,鱼皮明胶的得率远高于鱼骨明胶。这可能是由于鱼皮中胶原蛋白含量本就高于鱼骨,因而相同提取方法下明胶的最终得率也高于鱼骨。
表 1 鳗鲡鱼骨明胶得率、羟脯氨酸含量以及凝胶强度Table 1. Yield, hydroxyproline content and gel strength of eel bone gelatin样品 得率(%) 羟脯氨酸含量(g/100 g) 凝胶强度(g) AG60 13.60±0.43a 3.2±0.02a 101.95±4.59a BG60 6.88±0.33b 2.7±0.45b 78.74±1.16b 注:同列不同字母表示差异显著(P<0.05)。 脯氨酸和羟脯氨酸是胶原蛋白和明胶的特征氨基酸,对稳定胶原蛋白的三螺旋结构与明胶的凝胶特性具有重要影响[23]。以羟脯氨酸标准品制作标准曲线,所得标准曲线为:y=0.1074x+0.001(R2=0.998)。如表1所示,AG60和BG60的羟脯氨酸含量分别为3.2和2.7 g/100 g,AG60高于BG60,这与得率结果一致。BG60的羟脯氨酸含量降低可能与碱预处理过程中部分羟脯氨酸的羟基被碱破坏相关。美洲鳗鲡鱼骨明胶的羟脯氨酸含量远低于点纹斑竹鲨鱼皮(Chiloscyllium punctatum)(7.6 g/100 g)和黑尖鲨鱼皮(Carcharhinus limbatus)(7.28 g/100 g)[18]、商业牛明胶(9.8%±0.61%)和鸡肉皮(11.63%±0.11%)[23]明胶。不同物种明胶的羟脯氨酸含量不同,这可能与动物生长栖息环境的温度相关,冷水鱼明胶的羟脯氨酸含量低于温水鱼[24]。
凝胶强度是明胶的重要功能性质之一。鱼骨AG60和BG60的凝胶强度如表1所示,分别为101.95±4.59和78.74±1.16 g,均低于商品牛明胶(238.25 g)[23]。明胶凝胶强度与羟脯氨酸的含量相关,明胶中羟脯氨酸含量越高,蛋白分子间的交联作用也越强,形成的凝胶网络结构也越稳固[23]。不同类型鱼明胶的凝胶强度不同,冷水鱼明胶的凝胶强度通常在100 g左右,而温水鱼明胶的凝胶强度一般高于200 g,这可能与不同种类鱼的生活环境及其胶原蛋白中的亚氨基酸含量有关[25]。此外,明胶分子的蛋白组成被认为在凝胶化过程中也起着重要作用,在凝胶化过程中,具有长肽链(含有大量α链和β链)的明胶能够更有效地排列或自聚集,形成更稳定的三维网络结构,从而增强了明胶的凝胶强度[15]。
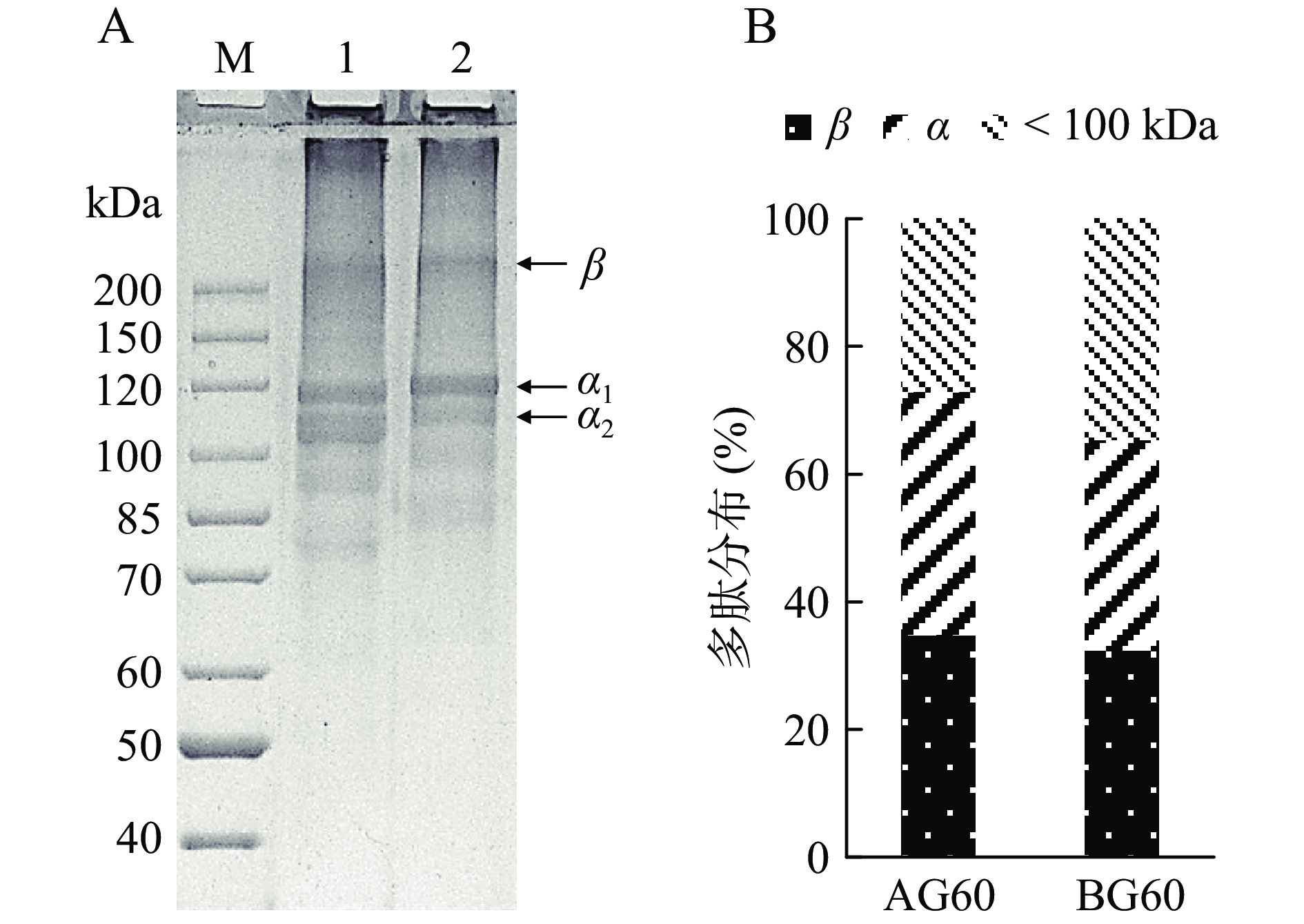
2.2 鱼骨明胶SDS-PAGE分析
鱼骨明胶的蛋白组成及分子量分布如图1所示。AG60和BG60的分子量分布较为相似,均含有明胶的主要条带α1、α2、β链以及少量低于100 kDa的组分。灰度分析结果显示(图1B),AG60的β和α亚基含量较高,表明酸处理更容易使胶原蛋白溶胀,有利于明胶提取。在胶原转化为明胶的过程中,连接胶原链的分子间和分子内作用力被破坏,进而产生一些较低分子量的蛋白组分[26]。明胶的凝胶强度主要取决于明胶的分子量分布,β和α亚基含量越高明胶的凝胶强度越好[27],这与表1中的结果一致。蔡成魁等[28]发现适度的碱处理有助于螺旋结构保持一定的松散和解体,而过度和不足的碱处理都会影响胶原分子结构的分解,从而影响明胶的产量和质量。结合表1和电泳图结果显示,在同等提取条件下,碱处理明胶的得率低于酸处理,推测碱预处理没有使羟基磷灰石与胶原蛋白充分解离。
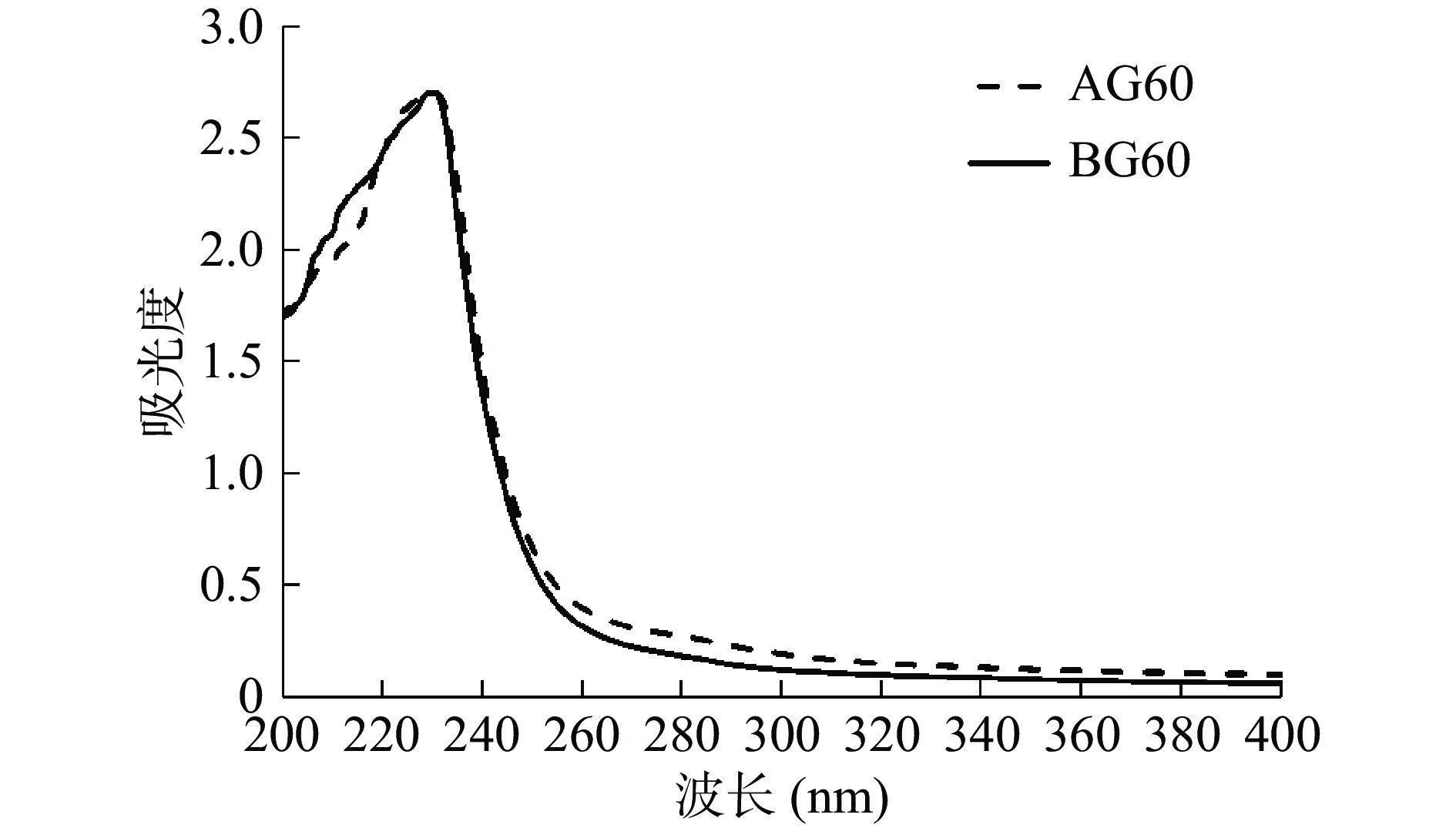
2.3 鱼骨明胶紫外全波长扫描
已有研究表明由于明胶的芳香族氨基酸含量较少,蛋白在280 nm处没有明显的吸收峰,其最大吸收峰在230 nm附近[7]。如图2所示,两种预处理下的明胶最大吸收峰均出现在230 nm处,这与金鲳鱼(Trachinotus ovatus)鱼骨明胶的紫外扫描结果一致[7],这主要由于明胶的 n→π*和n→σ*价电子能级跃迁而造成的[29]。AG60和BG60在280 nm处均没有吸收峰,表明此样品中没有其他蛋白存在,两种预处理方式都能有效去除非明胶的杂蛋白。
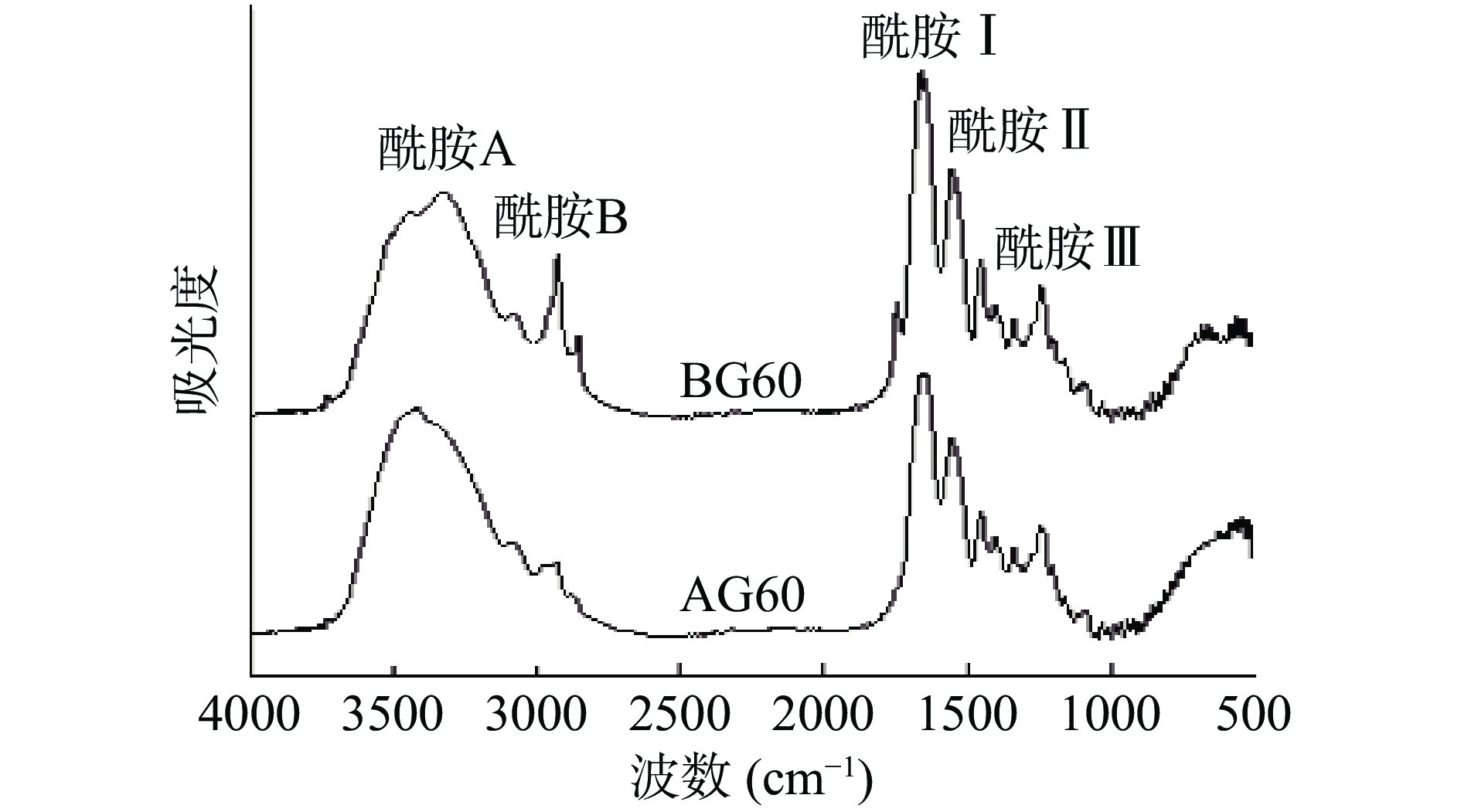
2.4 鱼骨明胶傅里叶红外光谱扫描
不同预处理方式下的美洲鳗鲡鱼骨明胶的红外光谱如图3所示,与真鳕鱼鱼骨明胶[15]的红外结果相似。鱼骨明胶的二级结构主要涉及酰胺Ⅰ(1656~1644 cm−1)、酰胺Ⅱ(1550~1520 cm−1)和酰胺Ⅲ(1300~1200 cm−1),其中酰胺Ⅰ带主要是由多肽骨架C=O双键伸缩振动产生,酰胺Ⅱ带是因N-H键变形形成的,酰胺Ⅲ带是C-H振动的吸收峰,这部分结构与蛋白质的三级螺旋结构有关。鱼骨明胶AG60和BG60的酰胺Ⅰ峰分别出现在1640.16、1636.79 cm−1,与AG60相比,BG60酰胺Ⅰ带发生了红移,说明BG60中与羰基有关的氢键含量较少[30]。通常,酰胺Ⅲ对应的波数与1454 cm−1的比率约为1.0,揭示胶原蛋白的三螺旋结构[31]。AG60和BG60的酰胺Ⅲ峰分别在1242.98和1244.78 cm−1处,峰强度都很低,说明在提取过程中,明胶的α-螺旋结构受到一定程度破坏,导致三螺旋结构丢失[15]。
一般情况下,胶原的酰胺A带在3400~3440 cm−1的波数范围内,是由N-H伸缩振动或O-H 伸缩振动而形成的。当肽键中的N-H基团参与氢键的形成时,酰胺A带常向低波数移动[32]。由图3所示,AG60和BG60的酰胺A带分别在3419.57和3325.77 cm−1,BG60的酰胺A带波数较低的现象表明碱处理制备的明胶更容易降解,可以释放更多的游离氨基以增强与其他反应基团的相互作用[33]。AG60和BG60酰胺B带分别在3092.16、2933.06 cm−1和2927.54、2855.63 cm−1。酰胺B带是由C-H对称和非对称拉伸振动引起的,BG60表现出较低波数,表明肽链之间存在-NH3相互作用[12]。
2.5 鱼骨明胶流变学特性分析
2.5.1 温度扫描
明胶的温度扫描过程主要包括三个阶段,分别为降温、恒温和升温。在降温和升温的过程中储能模量(G′)和损耗模量(G″)的交点分别为凝胶点和熔融点。由图4可知,AG60样品在0~40 ℃和40~0 ℃的扫描过程中,G′和G″相交并出现了两个交点,分别为熔融温度21.43 ℃和凝胶温度9.00 ℃。在温度扫描的过程中,明胶样品发生了从凝胶到溶液再到凝胶的转变。BG60的G′和G″随温度的变化趋势与AG60相似,熔融温度和凝胶温度分别为18.78和6.22 ℃。Tan等[15]发现黑罗非鱼(Oreochromis mossambicus)鱼皮明胶的熔融温和凝胶温度分别为21.6和14.6 ℃。相比之下,美洲鳗鲡鱼骨明胶表现出较低的凝胶温度和熔融温度,这可能与鱼骨和鱼皮中胶原分子间交联程度不同有关。
另一方面,鳗鲡鱼骨AG60的熔融温度和凝胶均高于BG60,这可能是因为AG60保留了较完整的亚基结构(图1),在凝胶化过程中能形成更多的类胶原螺旋结构,进而使其具有更高的弹性模量与凝胶强度[34]。明胶热稳定性的差异可以归因于每种明胶具有不同含量羟脯氨酸,羟脯氨酸含量越高,凝胶化和熔融温度越高[35],这与羟脯氨酸含量结果一致。
2.5.2 时间扫描
如图5所示,在32和75 s前,AG60和BG60的储能模量一直低于损耗模量,表明鱼骨明胶呈现溶胶状态。当时间分别延长到32 s和75 s时,这两种鱼骨明胶的G′迅速增大,并远远超过G″,体系由粘性瞬间转变为弹性,形成凝胶。储能模量增加速度越快,明胶分子交联速度就越快,形成明胶凝胶所需的时间就越短。AG60和BG60的形成凝胶所需时间分别为32.28 s和75.82 s,AG60形成凝胶的时间较短。明胶中羟脯氨酸的羟基和自由水分子可以形成氢键稳定其螺旋结构,羟脯氨酸含量较高的明胶表现出较好的流变性,具有较高的凝胶强度、熔融和凝胶温度,形成凝胶所需时间更短[23]。
2.6 鱼骨明胶扫描电镜分析
分别采用乙醇梯度脱水与真空冷冻干燥两种方式处理明胶凝胶样品用于扫描电镜观察,由图6A~图6C可知,乙醇梯度脱水明胶的样品表面微观皱缩严重,观察不到明胶凝胶的网络结构。而采用真空冷冻干燥脱水的样品,在冻干过程中随着水分流失,明胶凝胶的微观结构呈现出不同的网络结构。两种明胶凝胶呈现出不同大小的孔洞结构,AG60(图6B)的孔洞较小且分布较为均匀。相比之下,BG60(图6D)形成了大小不均匀的孔洞,且孔壁较厚。凝胶基质中蛋白质分子的排列和结合会直接影响明胶的凝胶特性,其中较高含量的羟脯氨酸更有利于氢键与分子间交联的形成,进而在凝胶过程中能形成更加致密与稳定的凝胶网络结构[36-37]。如表1所示,AG60的羟脯氨酸含量明显高于BG60,这与明胶凝胶微观结构的结果相一致。
3. 结 论
本研究表明,酸法与碱法预处理均能有效去除鳗鱼骨中的杂蛋白,获得高纯度的明胶。两种方法所得的明胶在制备过程中均发生一定程度的蛋白降解,其原有胶原蛋白的三股螺旋结构均受到破坏。与碱法预处理相比,美洲鳗鲡鱼骨经酸法预处理制备明胶的得率更高,所得明胶的羟脯氨酸含量较高,蛋白降解程度较低,螺旋结构破坏较少,且具有更好的凝胶特性。本研究为美洲鳗鲡鱼骨的综合利用提供了新途径,也为鳗鱼骨明胶的制备和品质控制提供了一定的理论参考。
-
表 1 鳗鲡鱼骨明胶得率、羟脯氨酸含量以及凝胶强度
Table 1 Yield, hydroxyproline content and gel strength of eel bone gelatin
样品 得率(%) 羟脯氨酸含量(g/100 g) 凝胶强度(g) AG60 13.60±0.43a 3.2±0.02a 101.95±4.59a BG60 6.88±0.33b 2.7±0.45b 78.74±1.16b 注:同列不同字母表示差异显著(P<0.05)。 -
[1] KARIM A A, BHAT R. Fish gelatin: Properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids,2009,23(3):563−576. doi: 10.1016/j.foodhyd.2008.07.002
[2] KIM S K, MENDIS E. Bioactive compounds from marine processing byproducts-A review[J]. Food Research International,2006,39(4):383−393. doi: 10.1016/j.foodres.2005.10.010
[3] BORAN G, REGENSTEIN J M. Optimization of gelatin extraction from silver carp skin[J]. Journal of Food Science,2009,74(8):E432−E441. doi: 10.1111/j.1750-3841.2009.01328.x
[4] DJABOUROV M, LECHAIRE J P, GAILL F. Structure and pheology of gelatin and collagen gels[J]. Biorheology,1993,30(3-4):191−205. doi: 10.3233/BIR-1993-303-405
[5] HAO S, LI L, YANG X, et al. The characteristics of gelatin extracted from sturgeon (Acipenser baeri) skin using various pretreatments[J]. Food Chemistry,2009,115(1):124−128. doi: 10.1016/j.foodchem.2008.11.080
[6] ALI A M M, KISHIMURA H, BENJAKUL S. Physicochemical and molecular properties of gelatin from skin of golden carp (Probarbus jullieni) as influenced by acid pretreatment and prior-ultrasonication[J]. Food Hydrocolloids,2018,82:164−172. doi: 10.1016/j.foodhyd.2018.03.052
[7] 于淑池, 赖卓慧. 金鲳鱼骨明胶的提取工艺及性质研究[J]. 食品研究与开发,2020,41(3):159−165. [YU Shuchi, LAI Zhuohui. Study on extraction technology and properties of bone gelatin from pomfret[J]. Food Research and Development,2020,41(3):159−165. [8] MUYONGA J H, COLE C, DUODU K G. Extraction and physico-chemical characterisation of nile perch (Lates niloticus) skin and bone gelatin[J]. Food Hydrocolloids,2004,18(4):581−592. doi: 10.1016/j.foodhyd.2003.08.009
[9] MI H, WANG C, CHEN J, et al. Characteristic and functional properties of gelatin from the bones of alaska pollock (Theragra chalcogramma) and yellowfin sole (Limanda aspera) with papain-aided process[J]. Journal of Aquatic Food Product Technology,2019,28(3):287−297. doi: 10.1080/10498850.2019.1577933
[10] 葛蕾丹, 王琰婷, 乔雯. 中国烤鳗出口现状与竞争力分析[J]. 对外经贸,2020(1):28−30. [GE Leidan, WANG Yanting, QIAO Wen. Export status and competitiveness analysis of roast eel in China[J]. Foreign Economic Relations Trade,2020(1):28−30. doi: 10.3969/j.issn.2095-3283.2020.01.007 [11] BANDEIRA S F, SILVA R S G, MOURA J M, et al. Characterization and film-forming properties of gelatins from whitemouth croaker (Micropogonias furnieri) skin and bones[J]. Journal of Aquatic Food Product Technology,2017,26(4):447−456. doi: 10.1080/10498850.2016.1210268
[12] ABEDINIA A, ARIFFIN F, HUDA N, et al. Extraction and characterization of gelatin from the feet of Pekin duck (Anas platyrhynchos domestica) as affected by acid, alkaline, and enzyme pretreatment[J]. International Journal of Biological Macromolecules,2017,98:586−594. doi: 10.1016/j.ijbiomac.2017.01.139
[13] LADISLAUS K M. 鱼皮、鱼骨中明胶的提取研究[D]. 无锡: 江南大学, 2006 LADISLAUS K M. Study on the extraction of gelatin from fish skin and fish bone[D]. Wuxi: Jangnan University, 2006.
[14] WOESSNER J F J. The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid[J]. Archives of Biochemistry and Biophysics,1961,93:440−447. doi: 10.1016/0003-9861(61)90291-0
[15] TAN C, KARIM A A, UTHUMPORN U, et al. Effect of extraction temperature on the physicochemical properties of gelatin from the skin of black tilapia (Oreochromis mossambicus)[J]. Journal of Physical Science,2019,30(Supp.1):1−21. doi: 10.21315/jps2019.30.s1.1
[16] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680−685. doi: 10.1038/227680a0
[17] 王珊珊, 卢玉坤, 杨霞, 等. 提取温度与提取时间对真鳕鱼骨明胶理化性质的影响[J]. 食品工业科技,2013,34(13):53−57. [WANG Shanshan, LU Yukun, YANG Xia, et al. Effect of extraction temperature and time on physicochemical properties of cod bone gelatin[J]. Science and Technology of Food Industry,2013,34(13):53−57. [18] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Comparative study on characteristics of gelatin from the skins of brownbanded bamboo shark and blacktip shark as affected by extraction conditions[J]. Food Hydrocolloids,2010,24(2-3):164−171. doi: 10.1016/j.foodhyd.2009.09.001
[19] 郑惠彬. 鱼鳞明胶的提取及其成膜性能的研究[D]. 厦门: 集美大学, 2014 ZHENG Huibin. Extraction and film-forming properties of fish scale gelatin [D]. Xiamen: Jimei University, 2014.
[20] SOCKALINGAM K, ABDULLAH H Z. Extraction of high value added gelatin biopolymer from black tilapia (Oreochromis mossambicus) head bones [C]// AIP Conference Proceedings. 2015.
[21] 杜杰, 刘廷薇, 马良, 等. 微波-快速冻融耦合鱼皮明胶理化性质分析[J]. 食品科学,2021,42(11):108−115. [DU Jie, LIU Tingwei, MA Liang, et al. Analysis of physicochemical properties of microwave-fast freeze-thaw coupled fish skin gelatin[J]. Food Science,2021,42(11):108−115. doi: 10.7506/spkx1002-6630-20200612-161 [22] ZHANG T, SUN R, DING M, et al. Effect of extraction methods on the structural characteristics, functional properties, and emulsion stabilization ability of tilapia skin gelatins[J]. Food Chemistry,2020,328(30):127114.
[23] AYKIN-DINCER E, KOC A, ERBAS M. Extraction and physicochemical characterization of broiler (Gallus gallus domesticus) skin gelatin compared to commercial bovine gelatin[J]. Poultry Science,2017,96(11):4124−4131. doi: 10.3382/ps/pex237
[24] AKITA M, NISHIKAWA Y, SHIGENOBU Y, et al. Correlation of proline, hydroxyproline and serine content, denaturation temperature and circular dichroism analysis of type I collagen with the physiological temperature of marine teleosts[J]. Food Chemistry,2020,329(1):126775.
[25] 詹丽, 陈雪岚. 鱼明胶特性及改性对其品质影响的研究进展[J]. 食品工业科技, 2021, 42(23): 385-393 ZHAN Li, CHEN Xuelan. Research progress on characteristics of fish gelatin and effects of modification on its quality[J]. Science and Technology of Food Industry, 2021, 42(23): 385-393.
[26] TAN C, KARIM A A, UTHUMPORN U, et al. Effect extraction temperature on the emulsifying properties of gelatin from black tilapia (Oreochromis mossambicus) skin[J]. Food Hydrocolloids,2020,108(3):106024.
[27] KITTIPHATTANABAWON P, BENJAKUL S, SINTHUSAMRAN S, et al. Gelatin from clown featherback skin: Extraction conditions[J]. LWT-Food Science and Technology,2016,66:186−192. doi: 10.1016/j.lwt.2015.10.029
[28] 蔡成魁, 滕军. 明胶浸灰促进剂对浸灰周期的影响[J]. 明胶科学与技术,1999(4):205−208. [CAI Chengkui, TENG Jun. Effect of gelatin leaching promoter on leaching cycle[J]. The Science and Technology of Gelatin,1999(4):205−208. [29] YAN M, LI B, ZHAO X, et al. Characterization of acid-soluble collagen from the skin of walleye pollock (Theragra chalcogramma)[J]. Food Chemistry,2008,107(4):1581−1586. doi: 10.1016/j.foodchem.2007.10.027
[30] 钟朝辉, 李春美, 顾海峰, 等. 温度对鱼鳞胶原蛋白二级结构的影响[J]. 光谱学与光谱分析,2007(10):1970−1976. [ZHONG Chaohui, LI Chunmei, GU Haifeng, et al. Effect of temperature on secondary structure of fish scale collagen[J]. Spectroscopy and Spectral Analysis,2007(10):1970−1976. [31] PLEPIS A, GOISSIS G, Das GUPTA D K. Dielectric and pyroelectric characterization of anionic and native collagen[J]. Polymer Engineering and Science,1996,36(24):2932−2938. doi: 10.1002/pen.10694
[32] DOYLE B B, BENDIT E G, BLOUT E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers,1975,14(5):937−957. doi: 10.1002/bip.1975.360140505
[33] LIU Y, XIA L, JIA H, et al. Physiochemical and functional properties of chum salmon (Oncorhynchus keta) skin gelatin extracted at different temperatures[J]. Journal of the Science of Food and Agriculture,2017,97(15):5406−5413. doi: 10.1002/jsfa.8431
[34] CHIOU B, AVENA-BUSTILLOS R J, SHEY J, et al. Rheological and mechanical properties of cross-linked fish gelatins[J]. Polymer,2006,47(18):6379−6386. doi: 10.1016/j.polymer.2006.07.004
[35] PARK J, CHOE J, KIM H, et al. Effects of various extraction methods on quality characteristics of duck feet gelatin[J]. Korean Journal for Food Science of Animal Resources,2013,33(2):162−169. doi: 10.5851/kosfa.2013.33.2.162
[36] BENJAKUL S, OUNGBHO K, VISESSANGUAN W, et al. Characteristics of gelatin from the skins of bigeye snapper, Priacanthus tayenus and Priacanthus macracanthus[J]. Food Chemistry,2009,116(2):445−451. doi: 10.1016/j.foodchem.2009.02.063
[37] 满泽洲, 涂宗财, 王辉, 等. 加工条件对鱼鳞明胶凝胶性能和微观结构的影响[J]. 食品科学,2013,34(23):67−71. [MAN Zezhou, TU Zongcai, WANG Hui, et al. Effect of processing conditions on gel properties and microstructure of fish scale gelatin[J]. Food Science,2013,34(23):67−71.





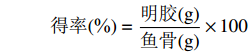
 下载:
下载:



 下载:
下载:
