Isolation and Identification of a Pathogen Causing Guava Black Spot
-
摘要: 目的:旨在为明确番石榴黑斑病优势病原菌的种类及其特性提供科学依据。方法:从受黑斑病病害侵染的番石榴果实上分离纯化出一株优势病原菌,命名为S1,并对其进行形态学观察、致病性测定、生长特性研究及聚合酶链式反应(Polymerase Chain Reaction,PCR)测序比对分析,较为全面的对分离出的优势病原菌S1进行鉴定。结果:由形态学观察可知,S1菌落的气生菌丝蓬松且致密,颜色呈墨绿色或黑色,其孢子形态为单孢且透明,大小均匀,约为(6~10) μm×(6~7) μm,呈圆形或椭圆形,与《真菌鉴定手册》比对,初步判定其属叶点霉属菌,将其反接于健康番石榴果实上进行致病性测定。结果表明,S1为致使番石榴产生黑斑病的主导优势病原菌。通过生长特性研究表明,S1在偏碱性、黑暗、常温条件下较为适宜生长,结合PCR测序结果,确定出致使番石榴黑斑病的优势病原菌S1为首都叶点霉(Phyllosticta capitalensis)。结论:引起番石榴黑斑病的优势病原菌为首都叶点霉。Abstract: Objective: In order to provide scientific basis for further clarifying the species and characteristics of dominant pathogens causing guava black spot. Method: A dominant pathogen, named S1, was isolated and purified from the guava fruit infected with black spot disease, and subjected to morphology observation, pathogenicity determination, growth characteristics study and polymerase chain reaction (PCR) sequencing comparison analysis were conducted for comprehensive identification of the dominant pathogen S1. Results: According to the morphological observation, the aerial hyphae of the S1 colony were fluffy and dense, and the color was dark green or black. The spore morphology was monospore and transparent, and the size was uniform, about (6~10) μm×(6~7) μm, round or elliptical, compared with the "Fungus Identification Manual", it was preliminarily determined to belong to Phyllanthus spp., and once again inoculated to healthy guava fruits for pathogenicity determination. The results showed that S1 was the dominant pathogen causing guava black spot disease. Research on growth characteristics showed that S1 was more suitable for growth under alkaline, dark and normal temperature conditions. Moreover, S1 was identified as Phyllosticta capitalensis by the comparison of the PCR sequencing results. Conclusion: The dominant pathogen causing guava black spot disease was Phyllosticta capitalensis.
-
Keywords:
- Psidium guajava /
- pathogenic bacteria /
- identification /
- Phyllosticta capitalensis
-
番石榴(Psidium guajava Linn. guava)隶属桃金娘科番石榴属,又名芭乐、鸡矢果、拔子、喇叭番石榴、番桃树,广泛分布于热带和亚热带地区,栽培历史悠久且用途广泛[1]。番石榴果实中富含膳食纤维、萜类、矿物微量元素等营养功能成分[2-4],具有生津止渴、收敛止泻、消炎止血等功效,是一种药食两用的果实[5-7],已成为农业经济最具有发展前景的重要水果之一。
据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)报道,每年约有14%~21%的果蔬因各种因素被浪费[8]。番石榴由于果实含水量高、营养丰富、皮薄等特点[9-10],在采后的加工及贮藏运输过程中易受机械损伤[11],从而引起病原微生物侵染,导致其腐烂变质严重影响其商品价值和果农的种植积极性。其中,黑斑病是番石榴果实采后腐烂变质的主要病害之一,例如张慧丽等[12]从番石榴上分离鉴定出了一株致使番石榴黑斑病病害的芒果球座菌。但目前对于引起番石榴黑斑病病害的主导病原菌的研究还相对较少,近年来,国内外通过形态学观察和聚合酶链式反应(PCR)技术鉴定出番石榴病害的种类主要有炭疫病[13]、疮痂病[14]、焦腐病[15]等。
随着科学技术的发展,病原菌鉴定方法越来越系统化,形态学观察及PCR技术相配合越来越普遍,但结合生物学特性对病原菌鉴定的系统研究相对罕见。因此,本文拟采用组织分离法对染病番石榴果实的病原菌进行分离纯化及致病性验证,筛选出引起番石榴产生黑斑病的主导病原菌,通过生理生化研究,初步判断出其相应的生物学特性,并利用显微镜和PCR技术进行克隆扩增,将扩增得到的产物进行序列测定,所测序列于GenBank和美国国家生物技术信息中心(NCBI)数据库中进行比对和同源性分析,并于Neighbor-joining建立系统发育树,实现番石榴果实优势病原菌的分离鉴定,旨在明晰引起番石榴黑斑病病害的主导病原菌对于采后防治措施的实施具有重要的现实意义。
1. 材料与方法
1.1 材料与仪器
珍珠番石榴 采集于福建省漳州市,自然条件下放至发病且病状为发病中期,即果体表皮出现木质化病斑,凹陷,病斑中心颜色为黑色,外围为棕色;Taq DNA聚合酶TransGen AP221-02试剂盒 北京全式金生物技术(TransGen Biotech)有限公司;细菌/真菌DNA提取试剂盒(磁珠法) 上海美吉逾华生物医药科技有限公司;其余试剂 均为国产分析纯;马铃薯葡萄糖(Potato Dextrose Agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1000 mL,121 ℃灭菌20 min;YM(YM Medium)培养基:酪蛋白胨5 g,麦芽浸粉3 g,葡萄糖10 g,酵母浸粉3 g,蒸馏水1000 mL,121 ℃灭菌20 min。
GI54DS自动压力蒸汽灭菌器 致微(厦门)仪器有限公司;PRX-450A智能人工气候箱 宁波赛福实验仪器有限公司;SPX-250智能生化培养箱 宁波江南仪器厂;SW-CJ-2D双人单面净化工作台 苏州净化设备有限公司;OLYMPUS奥林巴斯显微镜 奥林巴斯(中国)有限公司;DSHZ-300A旋转式水浴恒温振荡器 苏州培英实验设备有限公司;GL-12B飞鸽牌高速冷冻离心机 上海安亭科学仪器厂;ABI GeneAmp® 9700型PCR仪 北京赛百奥科技有限公司;FR-1000全功能生物电泳图像分析系统凝胶成像仪 上海复日科技有限公司。
1.2 实验方法
1.2.1 病原菌的分离纯化
选取颜色、大小、发病症状一致的番石榴病果,参照董汉松[16]的组织分离法对番石榴黑斑病病原菌进行分离、纯化。取发病中期的番石榴,用无菌手术刀片切取病健交界处组织,75%酒精表面消毒2 min,无菌水清洗3次,后接种于含PDA培养基的平板上,将平板置于智能生化培养箱中28 ℃恒温培养。待菌落长出后,采用平板划线法对病原菌进行分离,于28 ℃生化培养箱中恒温培养,数日后观察菌落生长情况,若无其他杂菌生长,即为病原菌纯菌种;用无菌接种环将带有孢子的培养基切下移入新的PDA培养基中生长,待其萌芽后再挑取培养,反复几次操作直至无其他杂菌生长,即为纯化后的病原菌,并命名为S1。
1.2.2 病原菌的形态学观察
1.2.2.1 菌落的形态观察
将纯化后的S1菌株接种到PDA培养基中,置于智能生化培养箱中28 ℃恒温培养5~14 d进行形态学观察,记录其菌落颜色和形态特征并拍照。
1.2.2.2 病原菌孢子的显微形态观察
将分离纯化后的病原菌S1接种于含PDA培养基的平板上,于智能生化培养箱中28 ℃恒温培养14 d,待其长满整个平板,用无菌药匙轻轻刮取表面孢子,于无菌研钵中进行研磨后,加入无菌水,利用已灭菌的四层纱布过滤,即为病原菌S1孢子悬浮液。将孢子悬浮液滴一滴于无菌载玻片上,用镊子取出盖玻片并盖上,用生物显微镜对病原菌S1的分生孢子进行形态观察和拍照。
1.2.3 病原菌致病性测定
参照董汉松[16]的方法,将分离纯化得到的病原菌S1回接到健康的番石榴果实上。选取16颗健康无病害的番石榴果实并将其在1%的次氯酸钠溶液中浸泡30 s,无菌水漂洗3次,置于超净工作台内自然风干。用经高压蒸汽灭菌的打孔器在果实底部中心处打直径为7 mm的伤口,取100 μL由血球计数板配制成浓度为104 CFU/mL孢子悬浮液接种于打孔部位,以接种100 μL无菌水于打孔部位为空白组,接种后将其放于密封的塑料盒中,并放置于28 ℃,90%湿度条件下的智能人工气候箱中培养,实验分2组,每组8颗,共16颗番石榴果实。每隔24 h观察病害症状及发病程度,选取病害明显的果实再次采用1.2.1组织分离法对病原菌进行分离、纯化,通过形态观察初步判断其与所接病原菌S1是否一致。
1.2.4 病原菌的生长特性
1.2.4.1 pH对病原菌菌丝生长的影响
用0.1 mol/L HCl与NaOH溶液调节灭菌后的PDA培养基至不同pH(5.0、6.0、7.0、8.0、9.0),用无菌打孔器取直径为7 mm的病原菌S1菌块,移入调节pH后的PDA培养基上,于28 ℃生化培养箱恒温培养7 d后测量菌落生长直径。
1.2.4.2 光照对病原菌菌丝生长的影响
参照1.2.4.1取病原菌S1菌块,移入PDA培养基上,并分别放于连续光照(光照强度为300 lx)、12 h连续光照与12 h完全黑暗交替、和完全黑暗三种光照条件下28 ℃恒温培养7 d后测量菌落生长直径。
1.2.4.3 温度对病原菌菌丝生长的影响
参照1.2.4.1取病原菌S1菌块于PDA培养基上,分别置于20、24、28、32、36 ℃的生化培养箱中恒温培养7 d后测量菌落生长直径。
1.2.5 病原菌分子生物学鉴定
1.2.5.1 总DNA提取
总DNA提取使用细菌/真菌DNA 提取试剂盒(磁珠法),按照试剂盒说明书方法操作。将病原菌的孢子悬浮液按1%的接种量加入含有50 mL YM培养基的100 mL锥形瓶中,于28 ℃,160 r/min条件下的恒温振荡器下培养5 d,8000 r/min,4 ℃下离心10 min,得到病原菌S1的菌丝体。
1.2.5.2 rDNA-ITS区PCR扩增
rDNA-ITS区扩增采用真菌ITS通用引物ITS1(ITS1:TCCGTAGGTGAACCTGCGG)和ITS4(ITS4:TCCTCCGCTTATTGATATGC)对病原菌S1的总DNA进行扩增,引物由上海美吉生物医药科技有限公司合成。20 μL PCR反应体系(所有试剂的终浓度):10×Ex Taq buffer为2 μL、5u Ex Taq为0.2 μL、2.5mmol/L dNTP Mix为1.6 μL、5p Primer1为1 μL、5p Primer 2为1 μL、DNA模板约为0.5 μL,ddH2O加至20 μL。PCR反应条件:95 ℃下预热5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,25个循环;最后72 ℃延伸10 min。反应结束后,取3 μL PCR扩增产物于1%琼脂糖凝胶电泳检测,稳点电压5 V/cm,电泳20 min,于凝胶成像仪分析结果。
1.2.5.3 PCR产物测序
采用TransGen AP221-02试剂盒纯化PCR产物,并根据Sanger测序法[17]将获得的两端原始序列(Raw sequence)分别进行质控去除低质量的碱基,获得干净的序列(Clean sequence)后进行拼接获得组装序列。
1.2.5.4 测序结果分析
经校正后的测序结果于GenBank数据库中进行BLAST(Basic Local Alignment Search Tool,BLAST)同源性比对分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),比较测试S1菌株序列与数据库中现有序列的相似程度,并获得相似度较高的序列。
1.3 数据处理
各指标测定均重复3次,用Origin 2021软件进行数据处理及分析;将获得相似度较高的序列用MEGA7.0中的Neighbor-Joining法构建系统发育树,共循环1000次。
2. 结果与分析
2.1 病原菌的形态学观察结果
2.1.1 菌落的形态观察结果
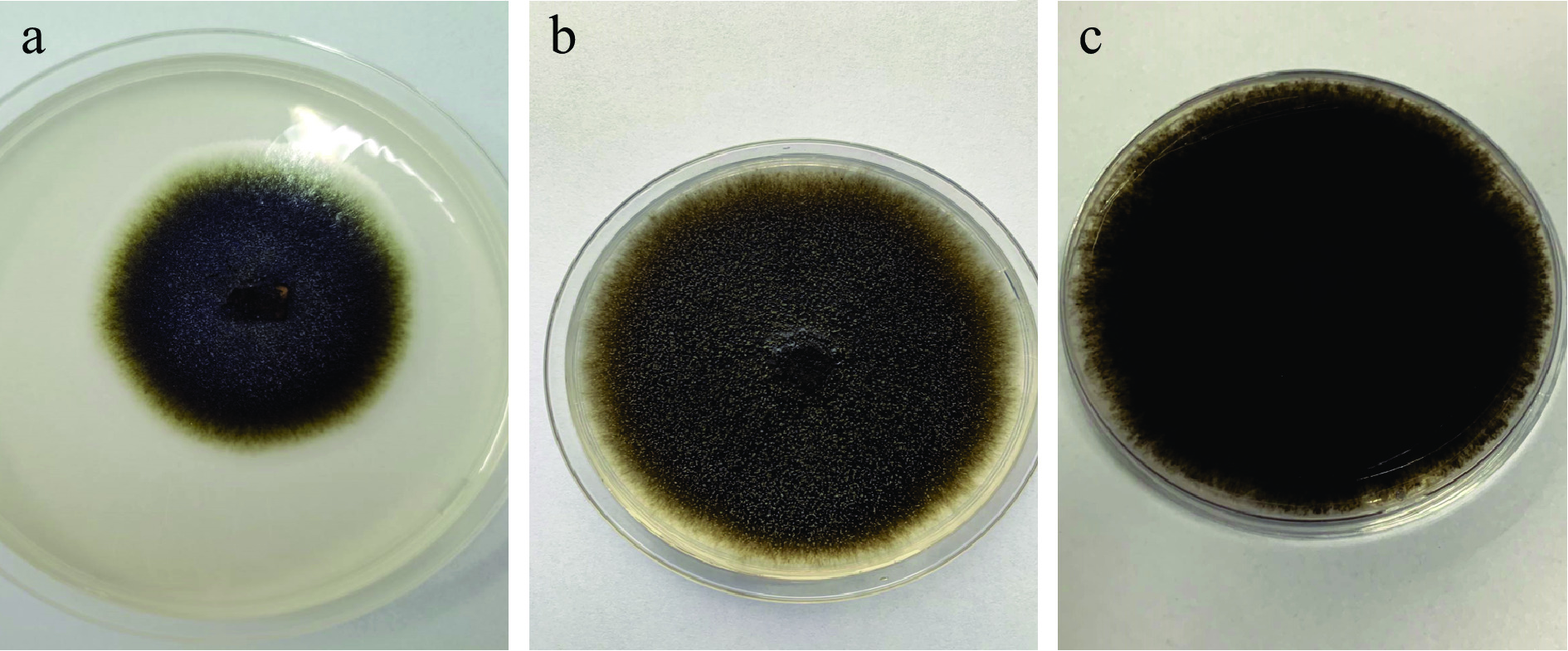
将病原菌S1接种到PDA培养基中,置于智能生化培养箱中28 ℃恒温培养5~14 d的形态学观察,结果如图1所示。由图1可以看出,刚分离出的S1菌株表面初期为橄榄绿色(图1a),随着时间的延长,菌落菌丝以接种点为中心向四周呈圆形扩散,具有较多的气生菌丝,14 d左右可长满直径为90 mm的平板,表面凹凸不平,含有颗粒状的灰白色孢子,边缘呈凹陷状(图1b)。其颜色随着时间逐渐加深直至变成墨绿色或黑色,菌落背面颜色呈墨绿色或黑色(图1c),菌落的形态特征与前人研究的番石榴黑斑病病原菌形态特征较为一致[18-19]。
2.1.2 病原菌的显微形态观察结果
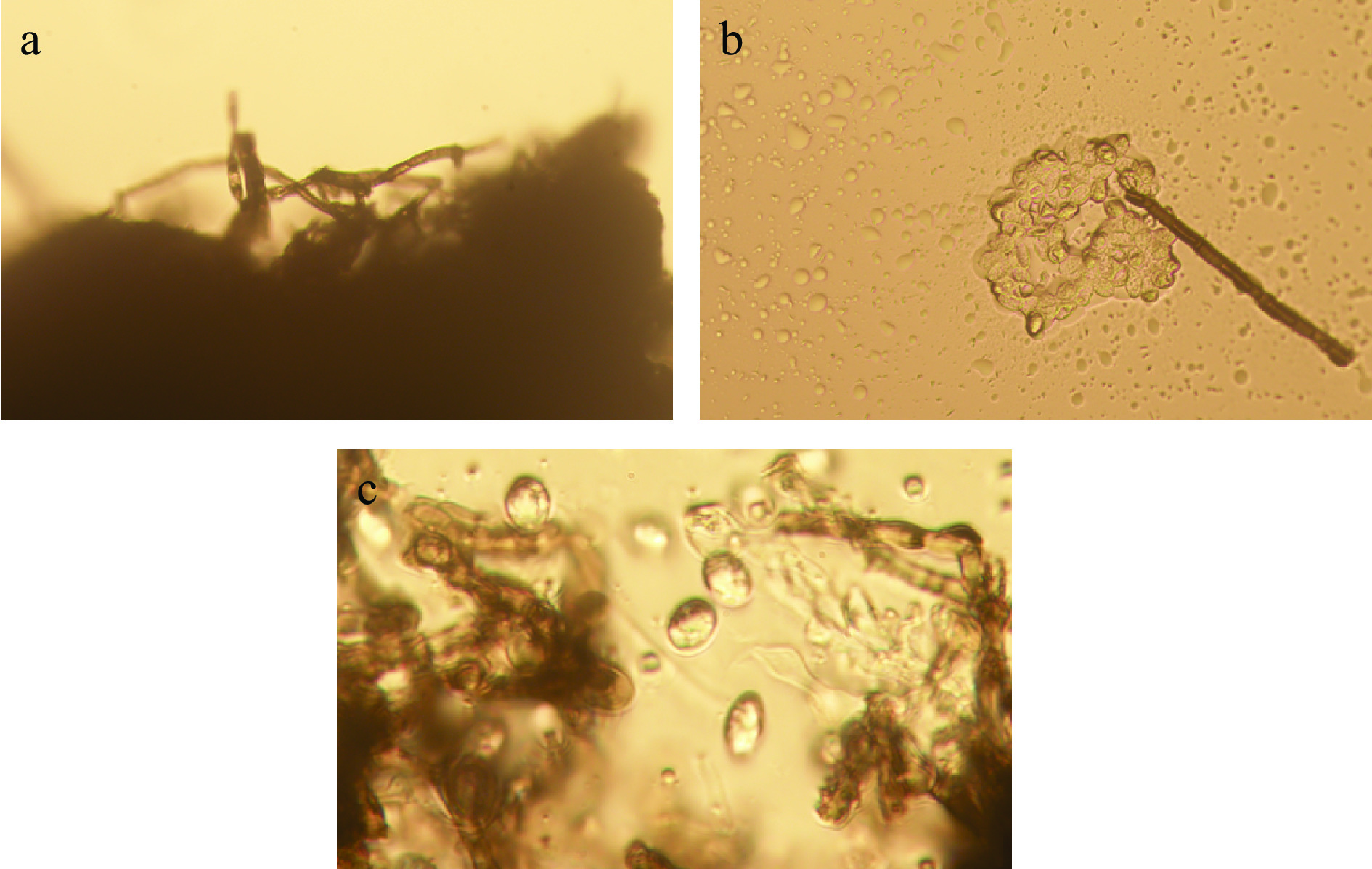
取S1菌株于显微镜下进行显微观察,结果如图2所示。在显微镜100×下可以看到S1的气生菌丝蓬松且致密,呈绒毛状,其形态呈不规则网状且具有分支结构(图2a);在显微镜200×下可以明显看到菌丝及孢子,其菌丝形态类似竹竿状具有分节,孢子形态呈圆形或者椭圆形,大小均匀(图2b);在显微镜400×下观察S1的分生孢子,可以看到其呈现状态为单孢且透明,大小约为(6~10) μm×(6~7) μm(图2c),此结果与Arafat K[18]从番石榴黑斑病中分离出优势病原菌的显微形态结果较为相似,将其孢子形态及大小与《真菌鉴定手册》[20]进行比对,初步判断出其为叶点霉菌属。
2.2 病原菌致病性测定结果
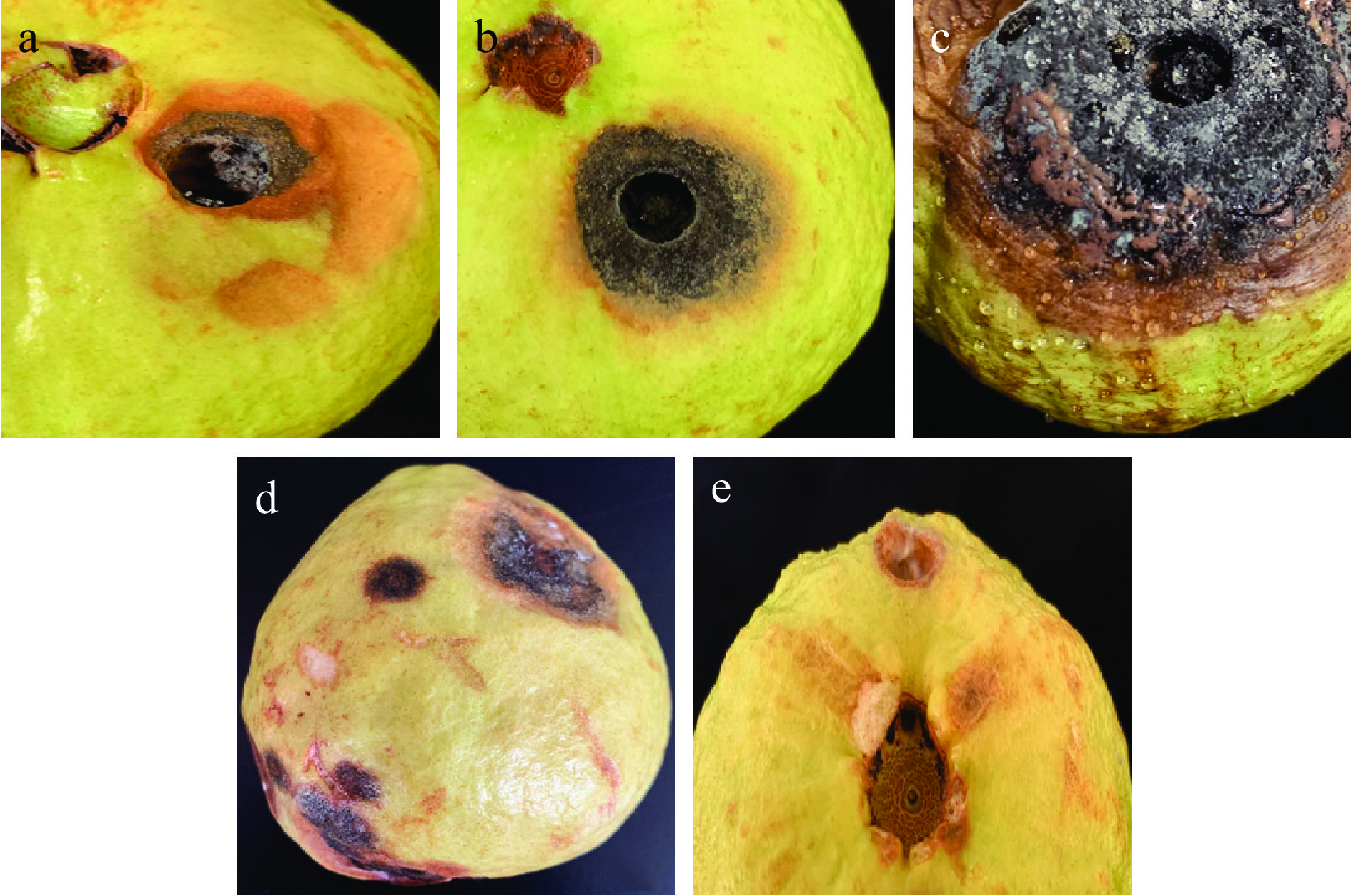
病原菌S1配制成104 CFU/mL孢子悬浮液回接到健康的番石榴果实上进行致病性实验,如图3所示。结果表明,回接S1孢子悬浮液后,5 d左右开始出现病状,发病症状打孔位置的颜色为黑色,孔径外围颜色为微棕色,随着时间延长,病斑逐渐扩大,并向四周扩散(图3a);回接8 d病斑更加明显,黑化部位由打孔位置扩散出来,病健交界处仍为微棕色(图3b);回接14 d时,颜色为暗褐色或黑色,病健交界处呈棕色木质化,稍有凹陷(图3c);发病过程中所出现的症状与自然条件下黑斑病的发病症状较为一致(图3d);然而,14 d时空白组所出现症状为果实表皮发生褐变(图3e),未出现实验组所产生病状,与自然发病症状也不符。实验后期全果软化,流汁,果体表面黑化腐烂,此结果与国内外关于番石榴黑斑病病害[18-19]发病症状报道相似。从番石榴病健交界处组织上重新分离病原菌,通过形态观察,重新分离、纯化后的病原菌与所接病原菌S1形态一致。由此证明病原菌S1是造成福建省漳州珍珠番石榴采后腐烂的病原菌。
2.3 病原菌的生长特性
2.3.1 pH对病原菌菌丝生长的影响
病原菌S1在5个不同pH下均能生长,如图4所示,以pH为7.0~8.0较适宜菌丝的生长,最适生长pH为8.0,菌落直径达74 mm,这与研究学者[21-22]对叶点霉属菌的最适生长条件研究成果较为相似,从而表明了病原菌S1较为适合在偏碱性条件下生长。
2.3.2 光照对病原菌菌丝生长的影响
病原菌S1在三种培养条件下均可生长,不同处理对于S1菌丝的影响不同,如图5所示。28 ℃完全黑暗处理培养7 d时,菌落生长直径达71.3 mm,比连续光照和12 h光暗交替处理下的病原菌菌落生长速度快,由此可见,光照不利于番石榴病原菌菌丝生长。这与叶点霉属菌所表现出的生物学特性[22-23]相符。
2.3.3 温度对病原菌菌丝生长的影响
病原菌S1在5个不同温度条件下均能生长,如图6所示,以温度为24~28 ℃较适合菌丝生长,此时菌丝生长速度达到最快,高于36 ℃则不利于菌丝生长,由图可知,病原菌S1的最适生长温度为28 ℃,此时菌落直径达到最大为61 mm。因此,病原菌S1于常温下较为适宜生长,在温度偏低或偏高下生长缓慢或不生长[22]。
2.4 分子鉴定结果
2.4.1 病原菌rDNA-ITS区PCR扩增及测序结果
用细菌/真菌DNA 提取试剂盒(磁珠法)对病原菌S1提取总DNA,并利用PCR技术进行扩增,扩增产物经琼脂糖凝胶电泳检测,结果所显示的PCR产物分子质量大小与预期结果一致,如图7所示。得到S1菌株的ITS区序列约为600 bp的片段,这与Arafat[18]从番石榴黑斑病病害分离出的病原菌扩增序列较为相近,克隆并测序了S1菌珠的rDNA-ITS序列,测得该片段全长实际为642 bp。
2.4.2 rDNA-ITS序列相似度比对分析
利用GenBank中的BLAST功能,将病原菌S1所测的rDNA-ITS序列与GenBanK数据库中已有的相关数据进行同源性比对分析,发现其与首都叶点霉菌的ITS序列相似度最为相近,高达99%以上。并从比对结果中选取15个相似度最为相近的菌株的ITS序列,以Phyllosticta citriasiana、Phytophthora nicotianae菌株(GenBank登录号:JN791609.1、KX250514.1)作为外源菌,进一步利用MEGA7.0软件中的Neighbor-joining建立系统发育树,如图8所示。由图可知,在与病原菌S1具有较高相似度的菌株中,病原菌S1与Phyllosticta capitalensis(GenBank登录号: MK396571.1、MK396601.1)处于同一分支上,与Phyllosticta citriasiana处于不同分支,这与2.1.2初步判断出的结果相符,与Phytophthora nicotianae的遗传距离较远。因此,综合S1菌株的形态学特征、致病性和ITS序列分析结果,可确定引起番石榴的病原菌为首都叶点霉Phyllosticta capitalensis,这与BLAST比对结果一致。
3. 讨论与结论
病原菌可以从果实的伤口或者气孔等不同部位入侵,病症初期病斑仅存在于果皮上,随着时间的延长,病原菌扩散至全果后,开始逐渐蔓延至果肉,导致全果腐烂。目前已报道引起番石榴果实采后腐烂的病原微生物主要有芒果球座菌[12]、葡萄座腔菌[24]、炭疽病菌[25-26]、可可球二孢菌[25]、疮痂病菌[14]等。近年来,在对病原菌的鉴定中,利用PCR扩增其rDNA-ITS序列的方法进行鉴定越来越广泛[27]。本研究对福建漳州地区珍珠番石榴的病原菌进行分离、纯化与回接,获得一株优势病原菌S1,对其进行了生长特性研究实验,确定了其相关生物学特性,并结合PCR技术,对PCR扩增所得rDNA-ITS基因序列进行同源性分析,建立了其在真菌系统发育树上的分类地位,明确了不同菌种之间的同源度、亲缘关系及进化地位,结合形态学观察,鉴定出引起番石榴黑斑病病害的优势病原菌为首都叶点霉(Phyllosticta capitalensis)。
首都叶点霉属于叶点霉属,是一类源于植物的病原菌[28]。相关研究表明[29-30],其菌落生长速度缓慢,PDA上培养7 d直径仅为60 mm左右,菌落形态主要为黑色,表面有絮状灰白色小颗粒,孢子主要以单孢形式存在,呈椭圆形或卵圆形且透明,大小约为(11~12) μm×(6~7) μm,生存方式主要有寄生或腐生,具有较强致病性,易导致植物产生病害,所产生的病害通常称为黑斑病或黑星病。如Duan等[31]从黑斑病的台湾柿子中分离出优势病原菌并对其进行了形态学观察及生物学鉴定,最后通过致病性检测,首次发现柿子所产生黑斑病的主导病原菌为首都叶点霉;Arafat[18]从黑斑病的番石榴中分离鉴定出了首都叶点霉,对其进行了致病性检测,验证了其为造成黑斑病的主导病原菌之一。但近年来,国内外对于首都叶点霉的鉴定研究中,大多局限于生物学鉴定,极少对其相关生长特性进行研究,在今后番石榴采后贮藏及抑菌上,所能提供的参考价值有局限性。因此,本实验中对从番石榴病果中分离纯化出的病原菌S1进一步进行果实体外致病性实验,接种S1菌株的番石榴果实均出现病症,且发病症状与番石榴自然条件下黑斑病的发病症状一致,接种无菌水的番石榴果实未出现相似症状,从病健交界处组织重新分离病原菌,得到的病原菌与所接病原菌形态一致。通过酸碱性试验、光照试验和温度试验研究可知,其较适宜于偏碱性、黑暗、常温条件下生长,与番石榴采后贮藏条件较为符合,并结合其PCR扩增序列片段及系统发育树,与前人[18-19]研究所报道的从番石榴黑斑病中分离出的首都叶点霉形态特征及致病症状较为相似,由此证明首都叶点霉(Phyllosticta capitalensis)是引起福建省珍珠番石榴采后腐烂的一种病原真菌。
本研究与以往研究相比引起珍珠番石榴采后腐烂的病原微生物种类有所差异,其原因可能是番石榴被不同病原菌入侵的方式不同,以及地理环境、生长条件和气候条件等方面的差异[32]或者运输过程中造成的机械损伤引起不同种类病原菌的入侵等,从而导致在贮藏过程中引起番石榴腐败的病原微生物种类存在一定的差异[33-34]。通过对福建省漳州地区的珍珠番石榴黑斑病病原菌的研究,明确了引起珍珠番石榴采后病原菌的种类及其特性,为进一步加强珍珠番石榴在采后贮藏、运输过程中出现微生物病害防治及抑制奠定了理论基础。
-
-
[1] 刘建林, 夏明忠, 袁颖. 番石榴的综合利用现状及发展前景[J]. 中国林副特产,2005,4(6):60−62. [LIU Jianlin, XIA Mingzhong, YUAN Ying. Psidium guajava integrated utlizaiton and its development prospects in China[J]. Forest By-product and Speciality in China,2005,4(6):60−62. doi: 10.3969/j.issn.1001-6902.2005.06.036 LIU Jianlin, XIA Mingzhong, YUAN Ying. Psidium guajava integrated utlizaiton and its development prospects in China[J]. Forest By-product and Speciality in China, 2005, 4(6): 60-62. doi: 10.3969/j.issn.1001-6902.2005.06.036
[2] 彭燕, 张敏, 崔小丽, 等. 珍珠番石榴果实中的营养成分与活性物质分析[J]. 食品与机械,2020,36(8):36−40. [PENG Yan, ZHANG Min, CUI Xiaoli, et al. Analysis of nutrients and bioactive compounds in fruits of Psidium guajava l. cv. pearl[J]. Food & Machinery,2020,36(8):36−40. PENG Yan, ZHANG Min, CUI Xiaoli, et al. Analysis of nutrients and bioactive compounds in fruits of Psidium guajava l. cv. pearl[J]. Food & Machinery, 2020, 36(8): 36-40.
[3] 张朝坤, 黄婉莉, 陈洪彬, 等. 番石榴果实生长发育和营养品质变化规律分析[J]. 热带作物学报,2021,42(4):1035−1040. [ZHANG Chaokun, HUANG Wanli, CHEN Hongbin, et al. Analysis on the law of Psidium guajava L. fruit growth and nutritional quality[J]. Chinese Journal of Tropical Crops,2021,42(4):1035−1040. doi: 10.3969/j.issn.1000-2561.2021.04.018 ZHANG Chaokun, HUANG Wanli, CHEN Hongbin, et al. Analysis on the law of Psidium guajava L. fruit growth and nutritional quality[J]. Chinese Journal of Tropical Crops, 2021, 42(4): 1035-1040. doi: 10.3969/j.issn.1000-2561.2021.04.018
[4] 孙锐, 孙蕾, 赵登超, 等. 不同石榴品种果实的营养成分比较分析[J]. 食品工业科技,2015,36(2):358−361. [SUN Rui, SUN Lei, ZHAO Dengchao, et al. Comparative analysis of nutritional ingredients in different kinds of pomegranate fruits[J]. Science and Technology of Food Industry,2015,36(2):358−361. SUN Rui, SUN Lei, ZHAO Dengchao, et al. Comparative analysis of nutritional ingredients in different kinds of pomegranate fruits[J]. Science and Technology of Food Industry, 2015, 36(2): 358-361.
[5] LI P Y, HSU C C, YIN M C, et al. Protective effects of red guava on inflammation and oxidative stress in streptozotocin-induced diabetic mice[J]. Molecules,2015,20(12):22341−22350. doi: 10.3390/molecules201219831
[6] HIRUDKAR J R, PARMAR K M, PRASAD R S, et al. The antidiarrhoeal evaluation of Psidium guajava L. against enteropathogenic Escherichia coli induced infectious diarrhoea[J]. Journal of Ethnopharmacology,2020,251:112561. doi: 10.1016/j.jep.2020.112561
[7] 宋银雪, 高烨, 许静, 等. 番石榴叶总三萜对脓毒症大鼠急性肾损伤的治疗及对PI3K/AKT通路的调控[J]. 河北医药,2021,43(15):2270−2274. [SONG Yinxue, GAO Ye, XU Jing, et al. Therapeutic effects of total triterpenoids in guava leaves on acute kidney injury in septic rats and its regulation of PI3K/AKT pathway[J]. Hebei Medical Journal,2021,43(15):2270−2274. doi: 10.3969/j.issn.1002-7386.2021.15.006 SONG Yinxue, GAO Ye, XU Jing, et al. Therapeutic effects of total triterpenoids in guava leaves on acute kidney injury in septic rats and its regulation of PI3K/AKT pathway[J]. Hebei Medical Journal, 2021, 43(15): 2270-2274. doi: 10.3969/j.issn.1002-7386.2021.15.006
[8] REZAEI M, LIU B. Food loss and waste in the food supply chain[J]. International Nut and Dried Fruit Council: Reus, Spain,2017:26−27.
[9] HWANG S G, LI Y Y, LIN H L. Excellent nutritional value in fruits of three guava cultivars in Taiwan[J]. Acta Horticulturae,2017,1166:209−213.
[10] 周浓, 杨锡洪, 解万翠, 等. “珍珠”番石榴的营养成分与挥发性风味特征分析[J]. 食品与机械,2016,32(2):37−40. [ZHOU Nong, YANG Xihong, XIE Wangcui, et al. Analysis of nutrition and valitile flavor of guava fruit (Psidium guajava L.)[J]. Food & Machinery,2016,32(2):37−40. ZHOU Nong, YANG Xihong, XIE Wangcui, et al. Analysis of nutrition and valitile flavor of guava fruit (Psidium guajava L. )[J]. Food & Machinery, 2016, 32(2): 37-40.
[11] PRUSKY D. Reduction of the incidence of postharvest quality losses, and future prospects[J]. Food Security,2011,3(4):463−474. doi: 10.1007/s12571-011-0147-y
[12] 张慧丽, 徐瑛, 段维军, 等. 番石榴黑斑病病原菌的分离鉴定[J]. 安徽农业科学,2011,39(28):17310−17311. [ZHANG Huili, XU Ying, DUAN Weijun, et al. Isolation and identification of black spot pathogen in Psidium guajava[J]. Journal of Anhui Agricultural Sciences,2011,39(28):17310−17311. doi: 10.3969/j.issn.0517-6611.2011.28.073 ZHANG Huili, XU Ying, DUAN Weijun, et al. Isolation and identification of black spot pathogen in Psidium guajava[J]. Journal of Anhui Agricultural Sciences, 2011, 39(28): 17310-17311. doi: 10.3969/j.issn.0517-6611.2011.28.073
[13] 赵志常, 黄建峰. 番石榴炭疫病[J]. 世界热带农业信息,2019(8):43. [ZHAO Zhichang, HUANG Jianfeng. Guava anthracnose[J]. World Tropical Agriculture Information,2019(8):43. ZHAO Zhichang, HUANG Jianfeng. Guava Anthracnose[J]. World Tropical Agriculture Information, 2019, (8): 43.
[14] SOLARTE F, MUÑOZ C G, MAHARACHCHIKUMBURA S S N, et al. Diversity of Neopestalotiopsis and Pestalotiopsis spp., causal agents of guava scab in colombia[J]. Plant Disease,2018,102(1):49−59. doi: 10.1094/PDIS-01-17-0068-RE
[15] 高新明, 李本金, 兰成忠, 等. 番石榴焦腐病菌的ITS分析及PCR检测[J]. 植物保护学报,2011,38(3):227−232. [GAO Xinming, LI Benjin, LAN Chengzhong, et al. Analysis of ITS sequence and PCR detection of Botryosphaeria rhodina[J]. Journal of Plant Protection,2011,38(3):227−232. GAO Xinming, LI Benjin, LAN Chengzhong, et al. Analysis of ITS sequence and PCR detection of Botryosphaeria rhodina[J]. Journal of Plant Protection, 2011, 38(3): 227-232.
[16] 董汉松. 植病研究法[M]. 北京: 中国农业出版社, 2012 DONG Hansong. Plant disease research method[M]. Beijing: China Agriculture Press, 2012.
[17] SANGER F, COULSON A R, BARRELL B G, et al. Cloning in single-stranded bacteriophage as an aid to rapid DNA sequencing[J]. Journal of Molecular Biology,1980,143(2):161−178. doi: 10.1016/0022-2836(80)90196-5
[18] ARAFAT K. A novel isolate of Phyllosticta capitalensis causes black spot disease on guava fruit in Egypt[J]. Asian Journal of Plant Pathology,2018,12(1):27−37.
[19] SRISKULTEIW N. 番石榴黑星病之鉴定及感染源[D]. 台中: 中兴大学, 2014. SRISKULTEIW N. Identification and infection source of guava scab[D]. Taizhong: Zhongxing University, 2014.
[20] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979 WEI Jingchao. Fungus identification manual[M]. Shanghai: Shanghai Science and Technology Press, 1979.
[21] 孙俊. 榛子叶斑病病原菌生物学特性[J]. 江苏农业科学,2017,45(7):101−103. [SUN Jun. Biological characteristics of the pathogen of hazelnut leaf spot[J]. Jiangsu Agricultural Sciences,2017,45(7):101−103. SUN Jun. Biological characteristics of the pathogen of hazelnut leaf spot[J]. Jiangsu Agricultural Sciences, 2017, 45(7): 101-103.
[22] 王晓梅, 黄琦, 李玉. 桂花叶斑病病原鉴定及其生物学特性研究[J]. 吉林农业大学学报,2011,33(2):151−157. [WANG Xiaomei, HUANG Qi, LI Yu. Pathogeny identification and biological characteristics of the leaf spot lesions of Osmamthus fragrans[J]. Journal of Jilin Agricultural University,2011,33(2):151−157. WANG Xiaomei, HUANG Qi, LI Yu. Pathogeny identification and biological characteristics of the leaf spot lesions of Osmamthus fragrans[J]. Journal of Jilin Agricultural University, 2011, 33(2): 151-157.
[23] 张桥. 桂花叶枯病病原菌生物学特性研究[J]. 现代农业科技,2016(11):153−154. [ZHANG Qiao. Study on the biological characteristics of the pathogen of Osmanthus fragrans leaf blight[J]. Modern Agricultural Science and Technology,2016(11):153−154. doi: 10.3969/j.issn.1007-5739.2016.11.097 ZHANG Qiao. Study on the biological characteristics of the pathogen of Osmanthus fragrans leaf blight[J]. Modern Agricultural Science and Technology, 2016(11): 153-154. doi: 10.3969/j.issn.1007-5739.2016.11.097
[24] 王正贤, 朱文倩, 黄奕蔓, 等. 广西玉林市番石榴焦腐病的病原菌鉴定[J]. 植物病理学报,2021,51(5):813−816. [WANG Zhengxian, ZHU Wenqian, HUANG Yiman, et al. Identification of the pathogen causing guava black-rot in Yulin, Guangxi[J]. Acta Phytopathologica Sinica,2021,51(5):813−816. WANG Zhengxian, ZHU Wenqian, HUANG Yiman, et al. Identification of the pathogen causing guava black-rot in Yulin, Guangxi[J]. Acta Phytopathologica Sinica, 2021, 51(5): 813-816.
[25] 刘任, 戚佩坤. 广州地区番石榴病害鉴定[J]. 仲恺农业技术学院学报,1991,4(1):38−46. [LIU Ren, QI Peikun. Identification on the diseases of guava in Guangzhou District[J]. Journal of Zhongkai Agrotechnical College,1991,4(1):38−46. LIU Ren, QI Peikun. Identification on the diseases of guava in Guangzhou District[J]. Journal of Zhongkai Agrotechnical College, 1991, 4(1): 38-46.
[26] LAN C, YAO J, YANG X, et al. Specific and sensitive detection of the guava fruit anthracnose pathogen (Colletotrichum gloeosporioides) by loop-mediated isothermal amplification (LAMP) assay[J]. Microbiology,2020,66(1):17−24.
[27] 张志华, 洪葵. 核酸序列直接分析在真菌鉴定方面的应用[J]. 华南热带农业大学学报,2006,12(2):39−43. [ZHANG Zhihua, HONG Kui. Application of nucleic ACID sequence analysis in fungi taxonmy[J]. Journal of South China University of Tropical Agrjculture,2006,12(2):39−43. ZHANG Zhihua, HONG Kui. Application of nucleic ACID sequence analysis in fungi taxonmy[J]. Journal of South China University of Tropical Agrjculture, 2006, 12(2): 39-43.
[28] SAOWANEE W, LORENZO L, PEDRO W, et al. Phylosticta capialensis, a widespread endophyte of plants[J]. Fungal Diversity,2013,60(1):91−105. doi: 10.1007/s13225-013-0235-8
[29] 赵杏利, 胡镇杰, 侯典云, 等. 牡丹内生真菌MD76的鉴定及次级代谢产物研究[J]. 中国药学杂志,2018,53(21):1826−1830. [ZHAO Xingli, HU Zhenjie, HOU Dianyun, et al. Identification and secondary metabolites of endophytic fungus MD76 from Paeonia suffruticosa[J]. Chinese Pharmaceutical Journal,2018,53(21):1826−1830. ZHAO Xingli, HU Zhenjie, HOU Dianyun, et al. Identification and secondary metabolites of endophytic fungus MD76 from Paeonia suffruticosa[J]. Chinese Pharmaceutical Journal, 2018, 53(21): 1826-1830.
[30] 张建芬, 林璟, 徐好仪, 等. 华泽兰内生真菌的分离及其抑菌、抗肿瘤活性[J]. 中成药,2020,42(1):133−138. [ZHANG Jianfen, LIN Jing, XU Haoyi, et al. Isolation of endophytic fungi from eupatorium Chinense and their antimicrobial, antitumor activities[J]. Chinese Traditional Patent Medicine,2020,42(1):133−138. doi: 10.3969/j.issn.1001-1528.2020.01.029 ZHANG Jianfen, LIN Jing, XU Haoyi, et al. Isolation of endophytic fungi from eupatorium Chinense and their antimicrobial, antitumor activities[J]. Chinese Traditional Patent Medicine, 2020, 42(1): 133-138. doi: 10.3969/j.issn.1001-1528.2020.01.029
[31] DUAN C H, CHANG C M, SU C C, et al. Phyllosticta capitalensis causes black spot on persimmon (Diospyros kaki) fruit in Taiwan[J]. Australasian Plant Disease Notes,2017,12(1):1−4. doi: 10.1007/s13314-016-0226-1
[32] PURBAJANTI E D, SETIADI A, ROESSALI W. Variability and nutritive compounds of guava (Psidium guajava L.)[J]. Indian Journal of Agricultural Research,2016,50(3):273−277.
[33] SOARES-COLLETTI A R, FISCHER I H, LOURENÇO S D A. The effects of temperature and wetness duration on the development of Guignardia psidii in guava fruit naturally infected[J]. Australasian Plant Pathology,2015,44(4):413−418. doi: 10.1007/s13313-014-0327-2
[34] 肖倩莼, 陈永强, 余卓桐, 等. 主要热带果树煤烟病的为害性及病原菌种类研究[J]. 热带作物学报,2000,21(1):25−30. [XIAO Qianchun, CHEN Yongqiang, YU Zhuodong, et al. A study on sooty moulds of tropical fruit crops and their pathogens[J]. Chinese Journal of Tropical Crops,2000,21(1):25−30. doi: 10.3969/j.issn.1000-2561.2000.01.005 XIAO Qianchun, CHEN Yongqiang, YU Zhuodong, et al. A Study on sooty moulds of tropical fruit crops and their pathogens[J]. Chinese Journal of Tropical Crops, 2000, 21(1): 25-30. doi: 10.3969/j.issn.1000-2561.2000.01.005





 下载:
下载:





 下载:
下载:
