Bioactive Components and Antioxidant Activities of Different Parts of Cistanche tubulosa in Qinghai Province
-
摘要: 本文以青海地区仿野生栽培的管花肉苁蓉为原料,对其不同部位生物活性物质以及抗氧化活性进行比较分析。结果表明,肉苁蓉不同部位的多种有效成分差异显著,根部总多酚、总多糖、总三萜、松果菊苷和毛蕊花糖苷的含量显著高于中部和顶部(P<0.05)。其中松果菊苷与毛蕊花糖苷总含量为4.67%,满足2020版《中国药典》的规定。肉苁蓉不同部位的抗氧化能力强弱顺序为根部>中部>顶部,根、中、顶三部位对ABTS自由基清除能力的IC50值分别为0.91、1.59、2.32 mg/mL,对DPPH自由基清除能力的IC50值分别为0.77、5.16、10.66 mg/mL。相关性分析表明,肉苁蓉不同部位抗氧化活性与多种生物活性物质含量密切相关,其ABTS IC50值、DPPH IC50值与总多酚、总三萜、总多糖、松果菊苷以及毛蕊花糖苷含量均呈负相关关系,且相关系数较高。本文为管花肉苁蓉的药、食安全以及综合开发利用提供了理论参考。Abstract: In this paper, the bioactive components and antioxidant activities of Cistanche tubulosa (CT) cultivated in Qinghai Province were comprehensively analyzed. The results showed that the bioactive components in different parts of Cistanche tubulosa were significantly different (P<0.05). Contents of total polyphenols, total polysaccharides, total triterpenes, echinoside and verbascoside in bottom part were significantly higher than those in the middle and top parts. Especially, the contents of the total echinoside and verbascoside content was 4.67%, which was higher than the standard of Chinese pharmacopoeia 2020 edition. The IC50 values of ABTS free radical scavenging abilities of root, middle and top parts were 0.91, 1.59, 2.32 mg/mL, respectively. The IC50 values of DPPH free radical scavenging activities were 0.77, 5.16, 10.66 mg/mL, respectively. The antioxidant activities of different parts of Cistanche tubulosa were closely related to the contents of various bioactive substances, the IC50 value of ABTS and DPPH were negatively correlated with the contents of total polyphenols, total triterpenoids, total polysaccharides, echinoside and verbascoside, and the correlation coefficient was high. The results will provide a theoretical basis for the medicine, food safety and utilization of Cistanche tubulosa in Qinghai Province.
-
Keywords:
- Cistanche tubulosa /
- different parts /
- functional components /
- antioxidant activity
-
管花肉苁蓉(Cistanche tubulosa),也称之为南疆大芸、红柳大芸、硬大芸[1],主要分布在我国新疆南疆[2],寄生于柽柳(红柳)属植物的根部,柴性较大,木质纤维比重较高。由于肉苁蓉属为寄生植物,其有效成分的种类和含量与寄主的存活能力以及获取养分的能力密切相关[3]。管花肉苁蓉的宿主植物红柳根系深广,能够为其提供更多的营养成分,故管花肉苁蓉中生物活性物质种类丰富,如松果菊苷、毛蕊花糖苷和多糖等[4-5]。研究发现,肉苁蓉具有抗氧化、护肝、润肠通便、降血糖、降血脂、缓解疲劳等生理活性[6-11]。其中松果菊苷和毛蕊花糖苷等苯乙醇苷类化合物为补肾阳、抗衰老、抗疲劳主要药效物质[12],同时能够增殖成骨细胞并促进骨髓间充质干细胞向成骨细胞分化[13-14]。2020版《中国药典》规定管花肉苁蓉中松果菊苷和毛蕊花糖苷的总量不得少于1.5%[15]。
随着肉苁蓉需求量的增加,野生资源的逐渐匮乏,人工种植管花肉苁蓉已成为市场上的主流品种[16]。青海省位于我国的西北地区,与甘肃、新疆相邻,其中柴达木盆地降水量低,气候干旱,适合荒漠植物的生长。目前在青海地区已成功实现肉苁蓉仿野生栽培,产量日益增加。肉苁蓉具有“性从地变,质与物迁”的特性,栽培环境对其品质具有显著影响,目前我国对管花肉苁蓉的研究产地多为新疆南疆地区,关于其它地区管花肉苁蓉品质的研究不够深入。
因管花肉苁蓉各部位的有效成分含量差异悬殊[1],为更加合理的进行品质评价,本文以青海地区栽培的管花肉苁蓉为原料,对其不同部位生物活性成分及抗氧化活性进行系统测定,为青海管花肉苁蓉的质量评价及其加工产品的标准化提供基础数据。
1. 材料和方法
1.1 材料与仪器
肉苁蓉样品 青海柴达木地区管花肉苁蓉干燥肉质茎。取1 kg样品(15~20 cm),根据已报道[17-18]的取样方法,将每个样品平均分成3份,分别命名为根部、中部、顶部(图1),样品粉碎后过50目筛,真空密封包装备用。乙腈、甲酸 色谱纯,德国Merck公司;毛蕊花糖苷、松果菊苷标准品 色谱纯,安倍尔(上海)有限公司;其他试剂 均为国产分析纯。
FA2204B电子天平 欧莱博光电技术(北京)有限公司;FW-135超微粉碎机 北京永光明医疗器械有限公司;DHG-9030A电热鼓风干燥箱 上海精宏实验设备有限公司;HC-1016离心机 安徽中科中佳科学仪器有限公司;752G紫外可见分光光度计、LC-210高效液相色谱仪 上海精密科学仪器有限公司;BK-EL10C多功能酶标仪 博腾仪器有限公司。
1.2 实验方法
1.2.1 总多酚含量测定
采用福林酚法测定,参照LI等[19]的方法稍作修改。
样液的制备:准确称取样品粉末0.50 g,按料液比1:40(70%乙醇),于60 ℃条件下超声辅助提取40 min,冷却后离心10 min(4500 r/min),取上清液定容至50 mL备用。
取样品溶液1 mL,加入5 mL福林酚溶液(10%),混匀,静置15 min,加入4 mL Na2CO3溶液(7.5%),漩涡振荡摇匀,于室温条件下避光静置40 min,用紫外-可见分光光度计于765 nm处测定吸光度。以没食子酸配制标准溶液绘制标准曲线方程为y=0.0505x+0.0347,R2=0.9991,样品测定结果以没食子酸当量表示(mg Gallic acid equivalent,GAE/g DW)。
1.2.2 总多糖含量测定
采用苯酚-硫酸法测定,参照Dubois等[20]的方法稍作修改。
样液的制备:精确称取样品粉末1.00 g,按料液比1:30(去离子水),于50 ℃条件下超声辅助提取60 min,冷却后离心10 min(4500 r/min),取上清液,缓慢加入95%乙醇至乙醇终浓度为80%,4 ℃条件下静置12 h后,4500 r/min离心处理,弃去上清液,将沉淀依次用无水乙醇、丙酮、乙醚清洗,反复清洗两次后,加入去离子水复溶,用sevage溶液(氯仿:正丁醇=4:1)脱去蛋白,定容后待测。
取1 mL样液加入600 μL苯酚溶液(6%)、3 mL浓硫酸,涡旋混合60 s后,沸水浴10 min,冷却至室温后于490 nm处测定吸光度。以葡萄糖配制标准溶液绘制标准曲线方程为y=0.0146x−0.015,R2=0.9998,样品测定结果以葡萄糖当量表示(mg dextrose equivalent,DE/g DW)。
1.2.3 总三萜含量测定
参照何策等[21]的方法稍作修改。
样液制备方法同1.2.1。取0.4 mL样液水浴挥干,加入0.4 mL 1.5%香草醛-冰乙酸溶液(现用现配),再加入1.6 mL高氯酸,70 ℃水浴15 min,取出后快速冷却,加入5 mL乙酸乙酯,静置5 min后于560 nm处测定吸光度。以齐墩果酸配制标准溶液绘制标准曲线方程为y=16.005x−0.0256,R2=0.9987,样品测定结果以齐墩果酸当量表示(mg Oleanolic acid equivalent,OAE/g DW)。
1.2.4 总原花青素含量测定
采用香草醛-盐酸法测定,参照吕筱等[22]的方法稍作修改。
样液的制备:精确称取样品粉末0.50 g,按料液比1:30(80%乙醇),于50 ℃条件下超声辅助提取40 min,冷却后离心10 min(4500 r/min),取上清液定容至50 mL备用。取干净试管加入0.5 mL样液、3 mL香草醛-甲醇溶液(4%),混匀,再加入1.5 mL浓盐酸,混匀后于室温条件下显色20 min,于500 nm处测定吸光度。以原花青素配制标准溶液绘制标准曲线方程为y=2.1709x−0.0036,R2=0.9979,样品测定结果以原花青素当量表示(mg Proanthocyanidin equivalent,PCE/g DW)。
1.2.5 毛蕊花糖苷与松果菊苷含量测定
参照许明君等[23]的实验方法并略加修改。
样液的制备:精确称取样品粉末1.00 g,按料液比1:30(80%乙醇),于60 ℃条件下超声辅助提取40 min,冷却后离心10 min(4500 r/min),取上清液定容至50 mL备用。
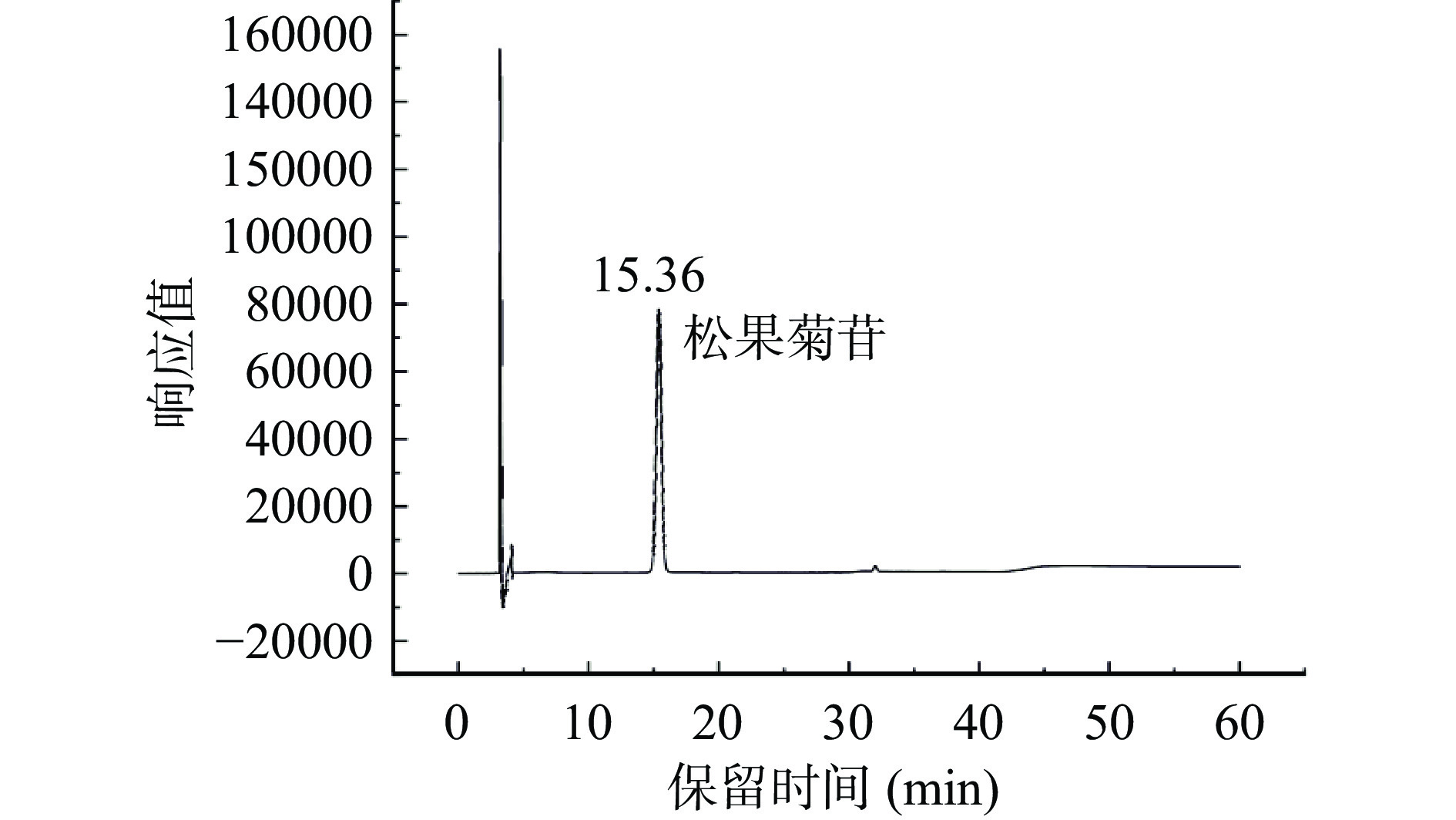
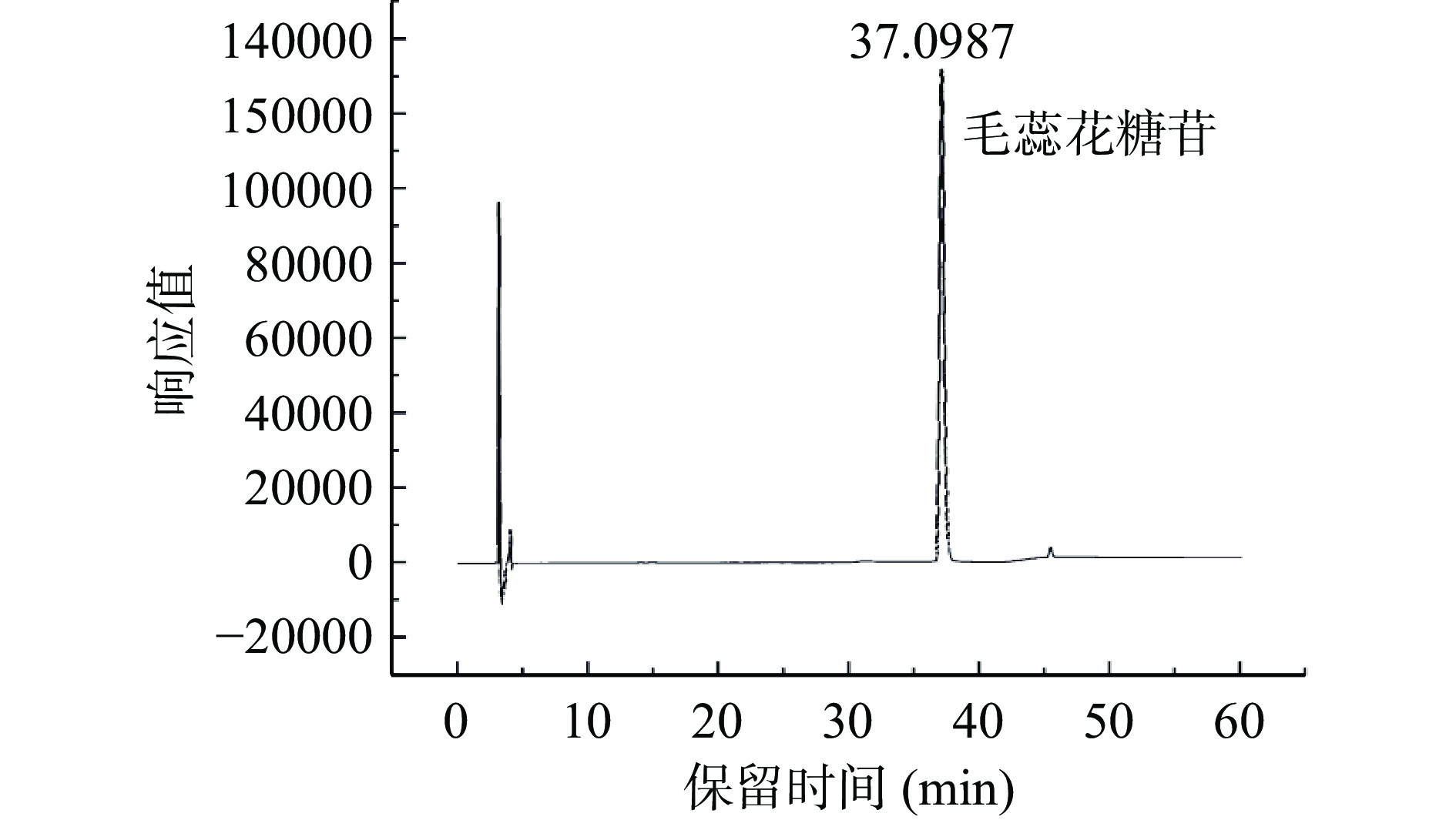
色谱柱:Alltima C18柱(4.6 mm×250 mm,5 μm);流动相:0.4%甲酸溶液(A)-乙腈(B);洗脱程序为0~10 min,90%(A);10~20 min,90%~80%(A);20~30 min,80%~75%(A);30~40 min,75%~80%(A);40~50 min,80%~90%(A),柱温25 ℃,流速1.00 mL/min;检测波长:330 nm;进样量10 μL。以浓度为横坐标,相应的峰面积为纵坐标,绘制松果菊苷标准曲线y=15311296.40x−119140.61,R2=0.9996,线性范围0.04~0.48 mg/mL;毛蕊花糖苷标准曲线y=21780400.45x−121356.95,R2=0.9994,线性范围0.04~0.08 mg/mL。松果菊苷与毛蕊花糖苷标准品HPLC色谱图见图2和图3。
1.2.6 体外抗氧化活性测定
样液制备:称取1.20 g样品粉末,加入30 mL乙醇(60%),于60 ℃条件下超声辅助提取40 min,冷却后离心10 min(4500 r/min),取上清溶液,加入乙醇(60%)稀释,使样液浓度分别为1、3、5、10、20、30、40 mg/mL,待测。
1.2.6.1 ABTS自由基清除能力
参照Roberta等[24]的实验方法稍作修改:用去离子水配制ABTS终浓度为7 mmol/L与过硫酸钾终浓度为2.45 mmol/L的混合溶液,于25 ℃避光静置12 h。使用前用去离子水稀释,使其在734 nm处的吸光度为(0.70±0.05),即得ABTS工作液。取10 μL样液加入酶标板中,再加入200 μL ABTS工作液,室温避光反应30 min后,于734 nm处测定吸光度,以60%乙醇为对照。按照公式(1)计算ABTS自由基清除率。
ABTS自由基清除率(%)=(1−A1−A2A0)×100 (1) 其中:A0:空白对照(60%乙醇代替样品)的吸光值;A1:ABTS溶液与样品的吸光值;A2:去离子水代替ABTS溶液的吸光值。
1.2.6.2 DPPH自由基清除能力
参照Kirigaya等[25]的实验方法稍作修改:将10 μL样液与250 μL新配制的DPPH溶液加入酶标板充分混匀,室温避光条件下反应30 min,以60%的乙醇为对照,在517 nm处测定吸光度。按照公式(2)计算DPPH自由基清除率。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (2) 其中:A0:空白对照(60%乙醇代替样品)的吸光值;A1:DPPH溶液与样品的吸光值;A2:无水乙醇代替DPPH溶液的吸光值。
1.3 数据处理
所有数据平行测定三次,结果以平均值±标准偏差(SD)的表示。利用SPSS Statistics 26.0软件对数据进行相关性分析、方差分析,P<0.05表示差异显著。
2. 结果与分析
2.1 管花肉苁蓉不同部位的生物活性物质含量
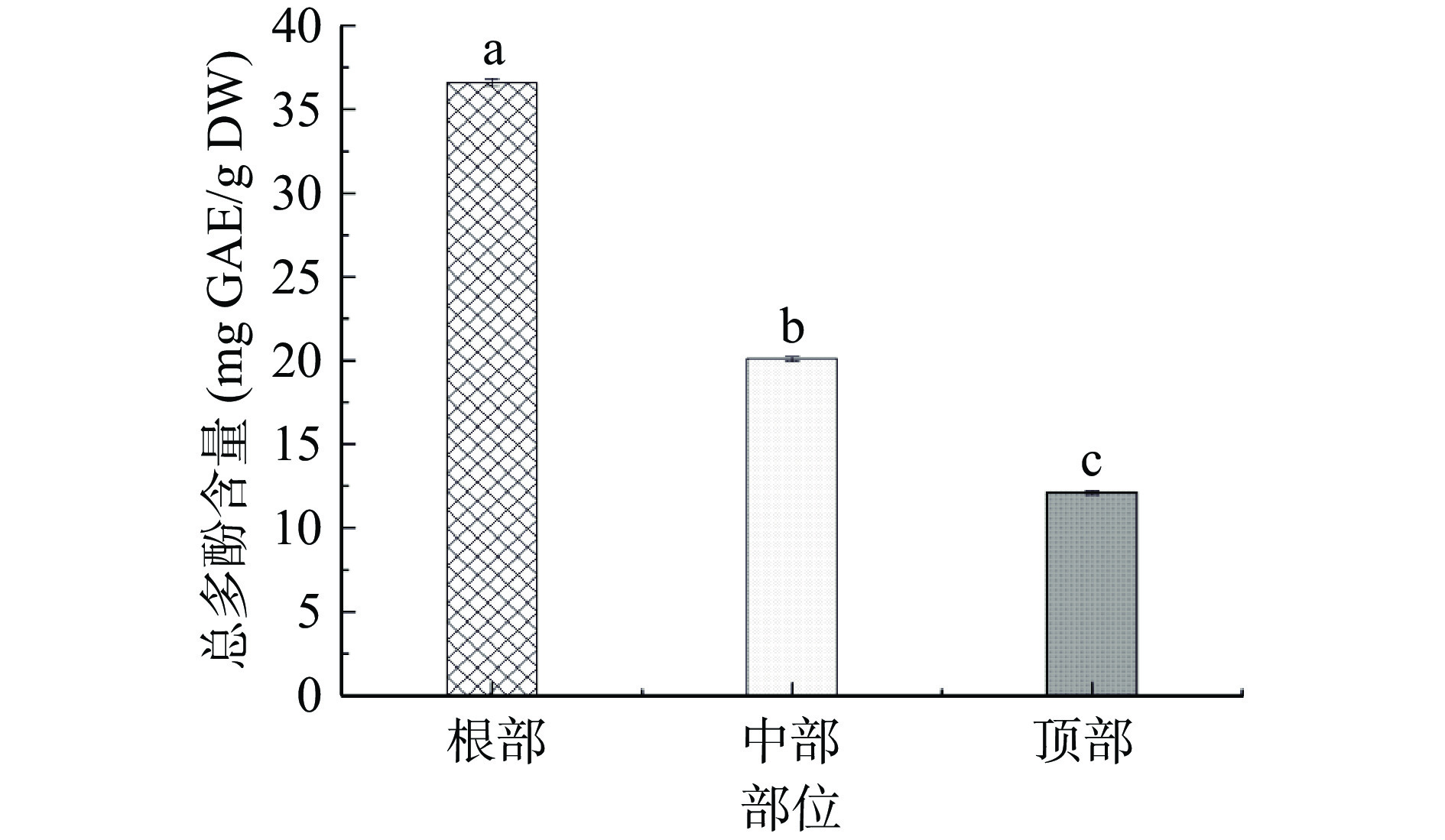
图4为管花肉苁蓉不同部位总多酚含量。由图4可知:根部的总多酚含量显著高于中部和顶部(P<0.05)。根部含量为36.62 mg GAE/g DW,中部和顶部分别为20.10 mg GAE/g DW和12.13 mg GAE/g DW。根部总多酚含量分别为中部、顶部的1.82倍和3.02倍。包斌等[26]通过用不同溶剂提取管花肉苁蓉中的总多酚,结果显示甲醇、乙醇提取物中总多酚含量分别为32.65±6.22和31.45±3.54 mg GAE/g DW,与本文根部总多酚含量较接近。
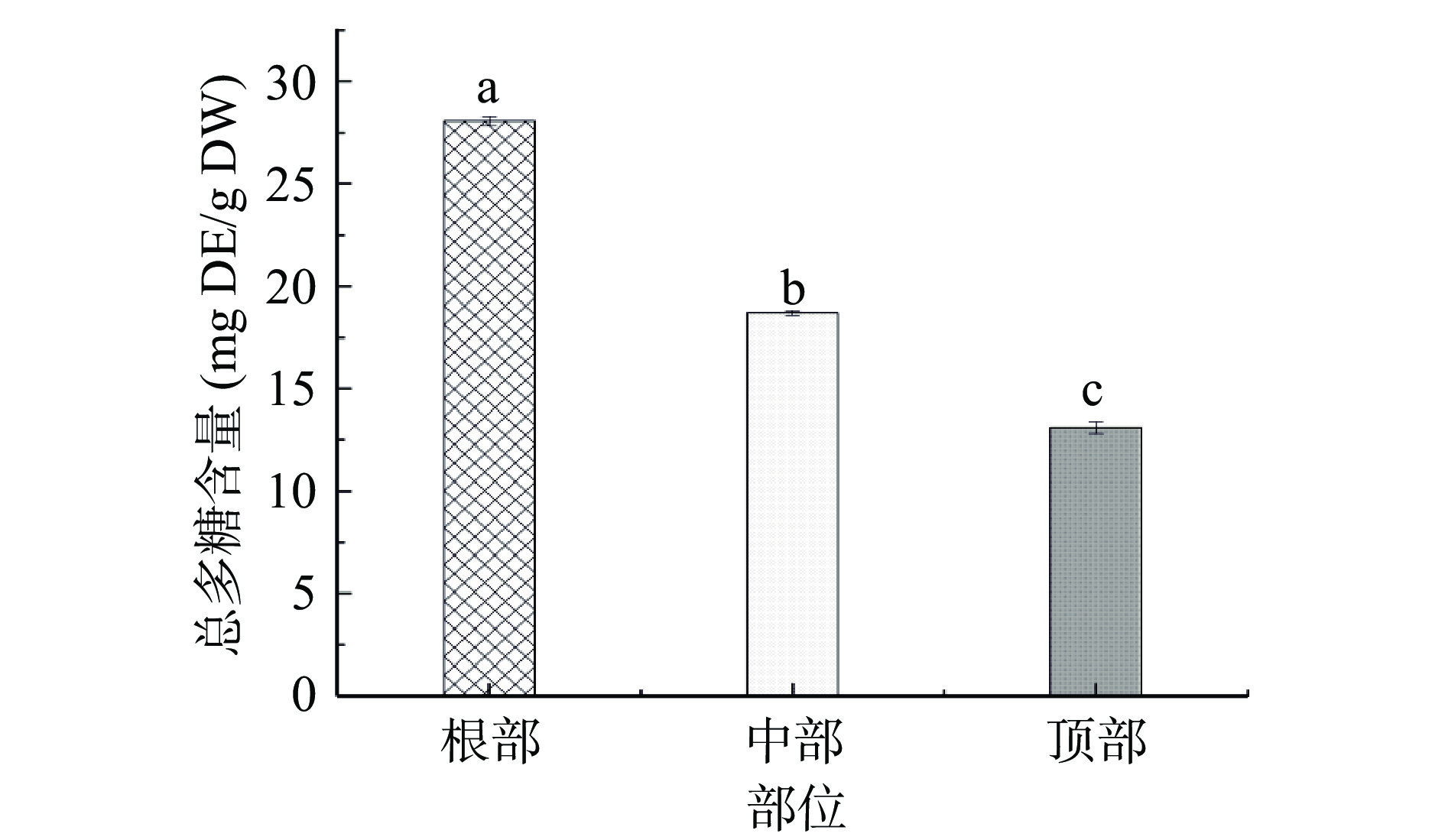
图5为管花肉苁蓉不同部位总多糖含量。由图5可知:根部的总多糖含量显著高于中部和顶部(P<0.05),根部含量(28.06 mg DE/g DW)分别为中部含量(18.71 mg DE/g DW)和顶部含量(13.15 mg DE/g DW)的1.50倍、2.13倍。杨太新等[27]通过对华北平原管花肉苁蓉不同部位的多糖含量进行研究,发现多糖含量根部>中部>顶部,与本文研究结果一致。
原花青素广泛存在于植物中,有着较强的清除自由基和抗氧化能力,具有抗肿瘤、抗衰老、防治糖尿病的功效,具有极高的食用、药用价值[28]。三萜类化合物具有抗肿瘤、抗炎、保肝保肾以及调节免疫系统等作用[29]。
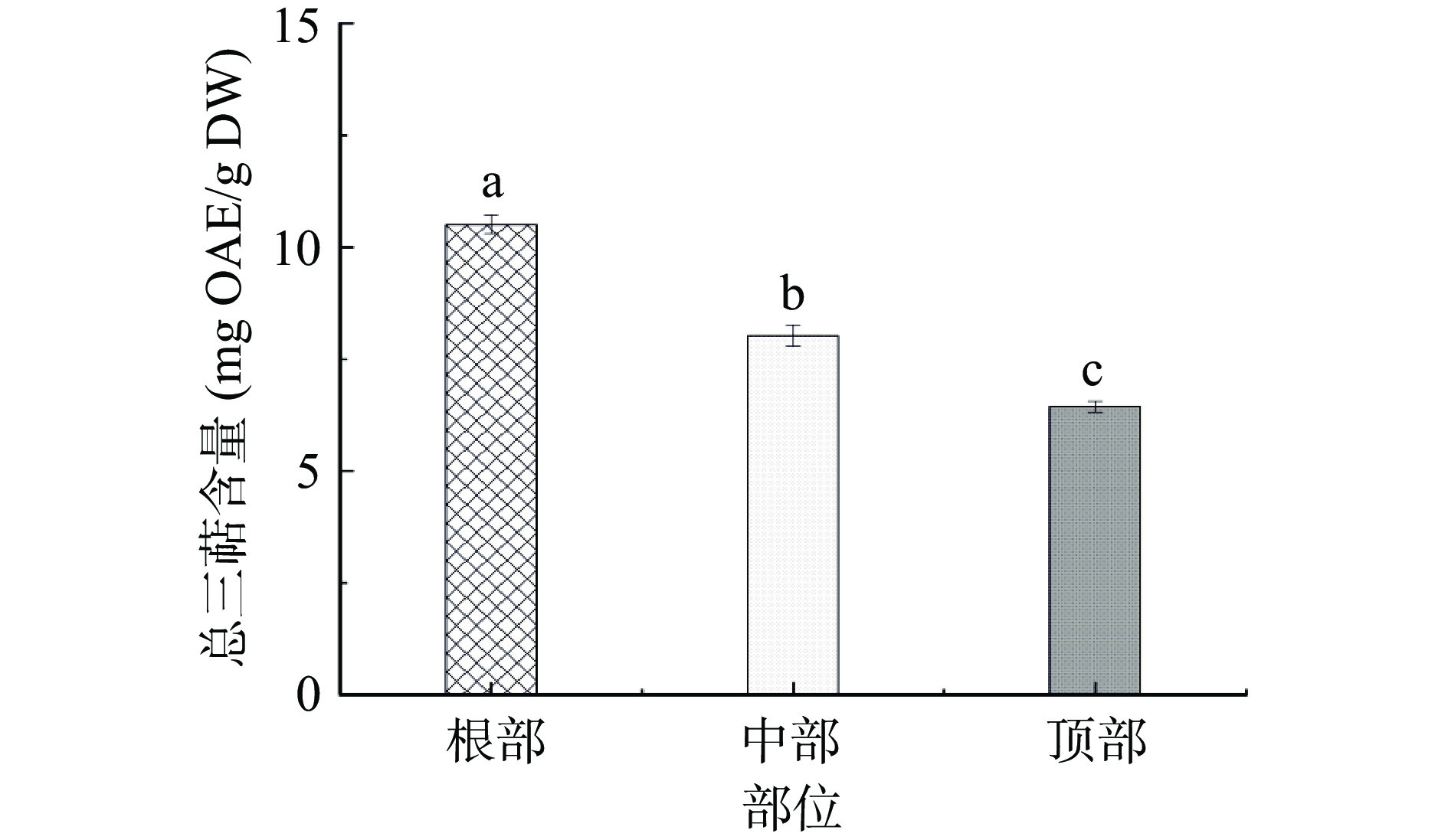
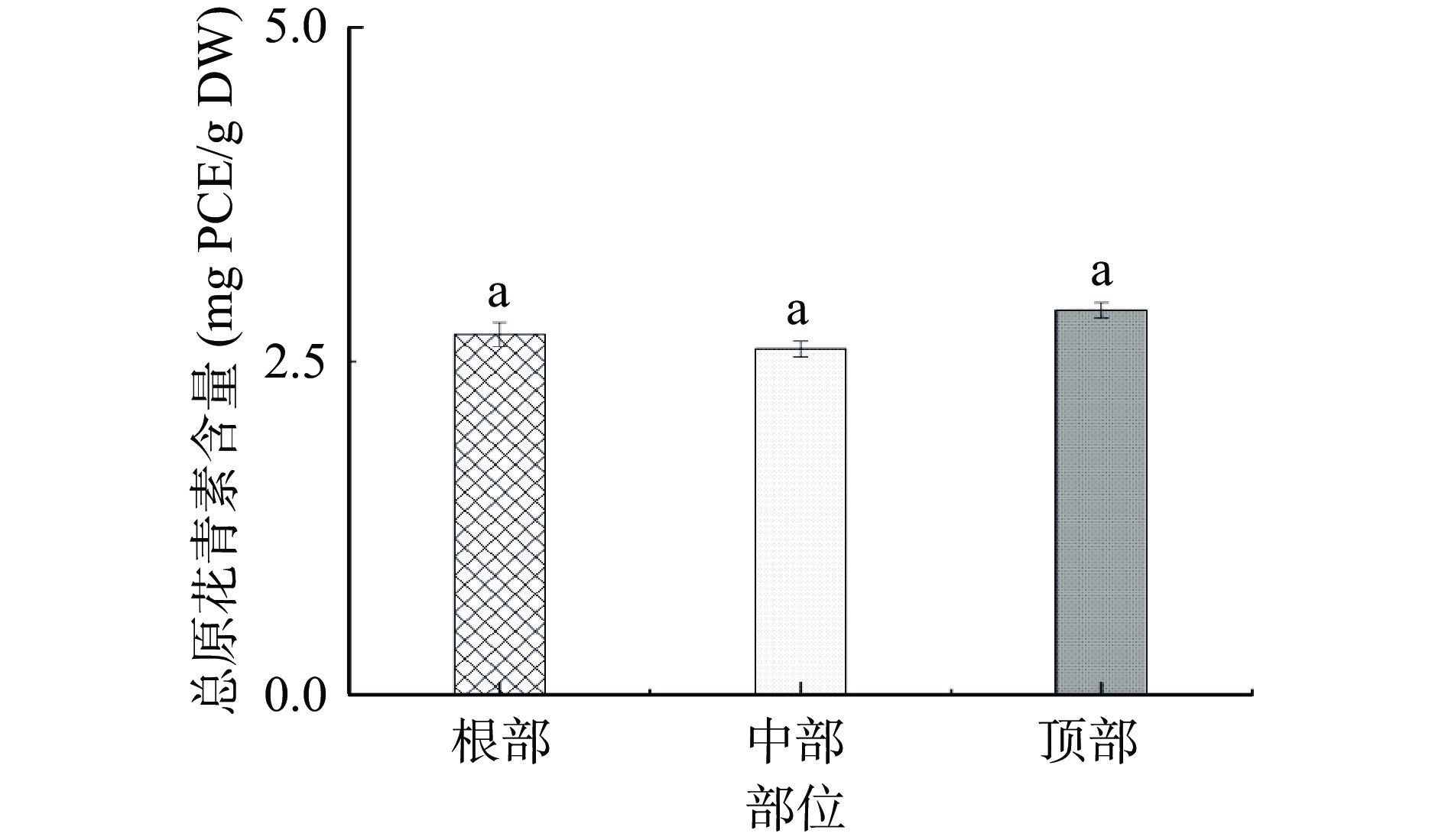
本文研究了管花肉苁蓉不同部位的总三萜含量(图6)和总原花青素含量(图7)。由图6可知:根部的总三萜含量较高,为10.52 mg OAE/g DW,其次为中部(8.02 mg OAE/g DW)和顶部(6.44 mg OAE/g DW)。由图7可知:三部位之间的总原花青素含量无明显差异(P>0.05),其根部、中部和顶部的含量分别为2.76、2.59、2.88 mg PCE/g DW。与其他富含色素的植物相比,管花肉苁蓉中原花青素含量较低。
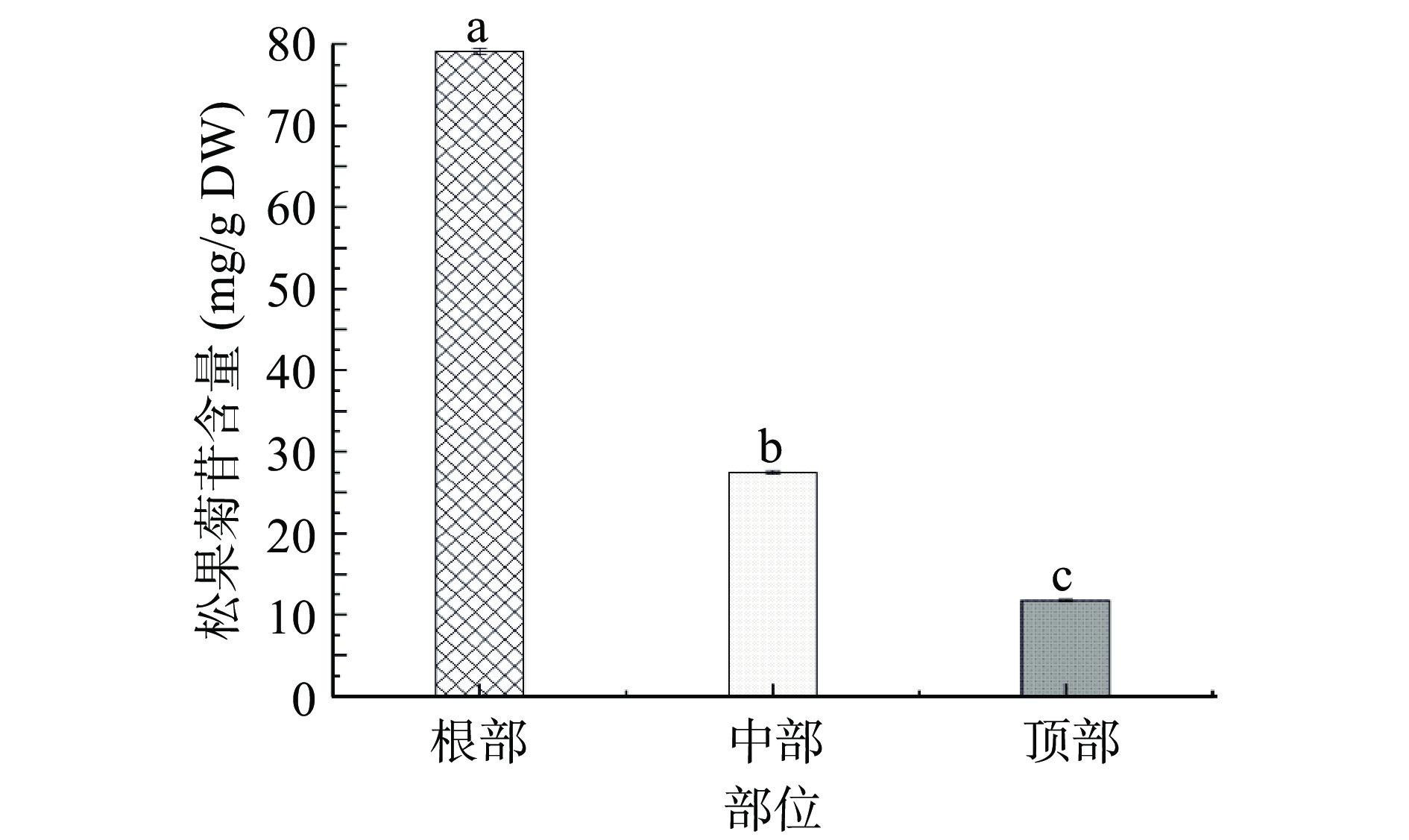
松果菊苷和毛蕊花糖苷是肉苁蓉中主要的生物活性物质。图8为肉苁蓉不同部位松果菊苷含量。由图8可知:根部的松果菊苷含量最高,含量为79.12 mg/g DW,中部和顶部含量分别为27.53、11.73 mg/g DW,根部含量分别为中部和顶部的2.87倍、6.75倍。
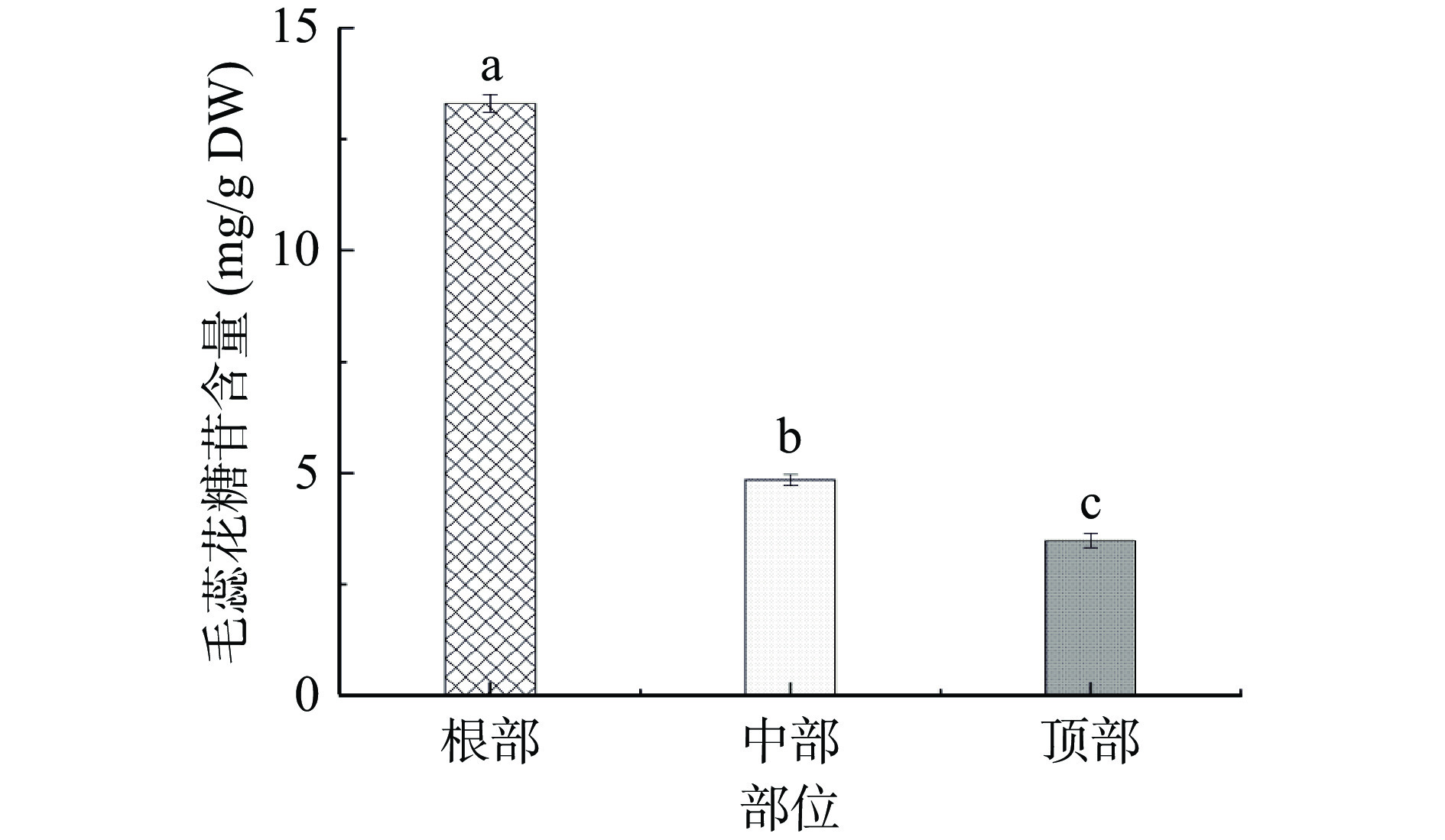
图9为肉苁蓉不同部位毛蕊花糖苷含量。由图9可知:根部的含量为13.31 mg/g DW,中部和顶部的含量分别为4.84、3.48 mg/g DW;根部含量分别为中部、顶部的2.75倍、3.82倍。郭雄飞[1]、杨太新[17]通过对管花肉苁蓉不同部位的松果菊苷与毛蕊花糖苷进行测定比较,发现根部的含量显著高于其他部位,与本文测定结果一致。本文中青海管花肉苁蓉三个部位松果菊苷的平均含量为39.46 mg/g DW,毛蕊花糖苷的平均含量为7.21 mg/g DW,两种有效成分总含量为46.67 mg/g DW(4.67%),满足《中国药典》对其规定的不少于1.5%的含量要求。而蔡鸿等[16]测定60批新疆地区产管花肉苁蓉,其中松果菊苷含量为3.39~86.64 mg/g DW,平均含量29.24 mg/g DW,毛蕊花糖苷含量为0.70~12.89 mg/g DW,平均含量为5.43 mg/g DW。由此表明,本文中青海管花肉苁蓉样品根部的松果菊苷与毛蕊花糖苷含量较高,且三部位的平均值也高于新疆地区60批样品的平均值。
综上所述,本文所研究的管花肉苁蓉样品三个部位中,除总原花青素无显著差异性,其它有效成分含量均为根部>中部>顶部。这一结果与同为肉苁蓉基源植物的荒漠肉苁蓉表现一致,姬晓慧等[30]通过对荒漠肉苁蓉不同部位的功效物质含量差异进行比较,发现根部的多种功效物质要高于其他部位,分析产生这一现象可能与其生殖生长及营养成分的运输有关。
2.2 管花肉苁蓉不同部位的抗氧化活性
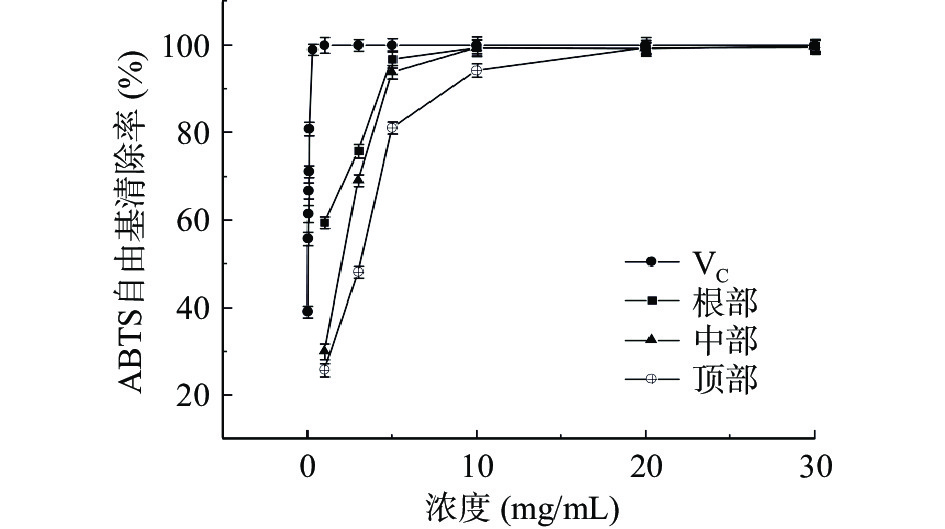
肉苁蓉富含多种抗氧化活性成分,其总抗氧化活性与不同活性成分之间的协同作用密切相关[26]。图10和图11分别为管花肉苁蓉不同部位对ABTS和DPPH自由基的清除能力。由图10可知:随着样品浓度的增加,对ABTS自由基的清除能力逐渐增强。根部对ABTS自由基的清除能力最强,其次为中部和顶部。当浓度为5 mg/mL时,根部、中部和顶部的清除率分别为96.75%、93.82%和81.03%;当样品浓度为10 mg/mL时,根部和中部对ABTS自由基的清除率达到99%以上,接近抗坏血酸的清除能力。根部、中部和顶部对ABTS自由基清除能力的IC50值分别为0.91、1.59和2.32 mg/mL(表1)。
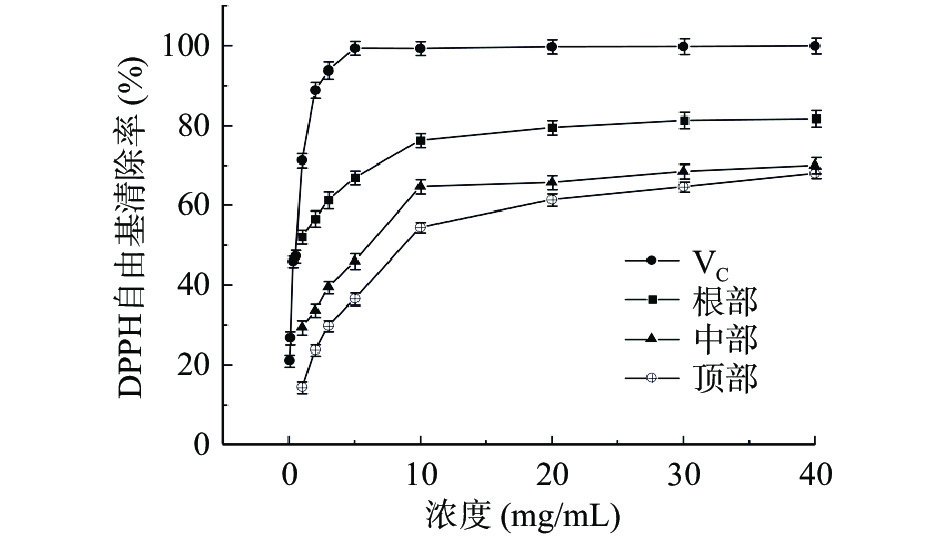
表 1 不同部位自由基清除能力的IC50值(mg/mL)Table 1. IC50 values of free radical scavenging ability of different parts (mg/mL)自由基清除能力 根部 中部 顶部 ABTS 0.91±0.05c 1.59±0.09b 2.32±0.11a DPPH 0.77±0.06c 5.16±0.16b 10.66±0.22a 注:同一行不同字母表示差异显著(P<0.05)。 如图11所示,随着样品浓度的增加,对DPPH自由基的清除能力也逐渐增强。根部对DPPH自由基的清除能力最强,其次为中部和顶部。当样品浓度为10 mg/mL时,根部、中部和顶部的清除率分别为76.31%、64.75%和54.54%,当样品浓度大于10 mg/mL时,浓度的增加并没有对DPPH自由基的清除带来明显的效果,虽然未达到抗坏血酸的清除效果,但也表现出较好的自由基清除能力。根部、中部和顶部对DPPH自由基清除能力的IC50值分别为0.77、5.16、10.66 mg/mL(表1)。
包斌等[26]分别研究了管花肉苁蓉甲醇和乙醇提取物的抗氧化活性,结果显示两种提取物均可有效清除DPPH自由基,甲醇和乙醇提取物的DPPH IC50值分别为0.142、0.175 mg/mL;何梦梦等[31]通过研究发现,肉苁蓉水提物对DPPH和ABTS自由基具有较强的清除能力。上述研究结果均表明肉苁蓉提取物均有较好的自由基清除能力。
综上所述,青海省管花肉苁蓉对ABTS和DPPH自由基均有较好的清除能力,且不同部位的抗氧化能力顺序均为:根部>中部>顶部。
2.3 相关性分析
表2为不同指标之间的相关性,由表2可知,总多酚含量与总多糖、总三萜以及松果菊苷含量之间呈显著正相关(P<0.05);总多糖与总三萜含量呈极显著正相关(P<0.01),与松果菊苷含量呈显著正相关(P<0.05);松果菊苷与毛蕊花糖苷含量呈显著正相关(P<0.05);ABTS IC50值与总三萜含量呈显著负相关(P<0.05);ABTS IC50值及DPPH IC50值与总多酚、总三萜、总多糖、松果菊苷、毛蕊花糖苷含量呈负相关,说明青海管花肉苁蓉的DPPH和ABTS自由基清除能力与总多酚、总三萜、总多糖、松果菊苷以及毛蕊花糖苷含量密切相关;ABTS IC50值及DPPH IC50值与总原花青素含量呈正相关关系,可能是由于三个部位的总原花青素含量差异不显著导致,并不能说明总原花青素无抗氧化能力。
表 2 不同测定指标相关性分析Table 2. Correlation analysis of different measured indexes总多酚 总多糖 总三萜 总原花青素 松果菊苷 毛蕊花糖苷 DPPH
IC50ABTS
IC50总多酚 1 总多糖 0.999* 1 总三萜 0.998* 1.000** 1 总原花青素 −0.448 −0.495 −0.51 1 松果菊苷 0.995* 0.988* 0.985 −0.356 1 毛蕊花糖苷 0.98 0.969 0.964 −0.263 0.995* 1 DPPH IC50 −0.966 −0.978 −0.982 0.664 −0.935 −0.896 1 ABTS IC50 −0.977 −0.987 −0.990* 0.627 −0.951 −0.916 0.999* 1 *相关性显著(P<0.05),**相关性极显著(P<0.01)。 3. 结论
本文对青海管花肉苁蓉根、中、顶三部位生物活性成分含量及其抗氧化活性进行了比较研究。研究表明,青海管花肉苁蓉中含有丰富的多酚、三萜、多糖、苯乙醇苷类等生物活性物质。除总原花青素在不同部位的含量差异不显著外,总多酚、总三萜、总多糖、松果菊苷及毛蕊花糖苷含量均表现为根部>中部>顶部。其中的松果菊苷与毛蕊花糖苷平均含量分别为39.46、7.21 mg/g DW,满足2020版《中国药典》规定的标准。管花肉苁蓉对ABTS和DPPH自由基均有较强的清除能力,且不同部位的抗氧化能力强弱顺序均为根部>中部>顶部。其根部、中部和顶部对ABTS自由基清除能力的IC50值分别为0.91、1.59、2.32 mg/mL,对DPPH自由基清除能力的IC50值分别为0.77、5.16、10.66 mg/mL。管花肉苁蓉醇提物对ABTS自由基与DPPH自由基的具有较强的清除能力。本研究为青海管花肉苁蓉的精深加工提供了基础数据。
-
表 1 不同部位自由基清除能力的IC50值(mg/mL)
Table 1 IC50 values of free radical scavenging ability of different parts (mg/mL)
自由基清除能力 根部 中部 顶部 ABTS 0.91±0.05c 1.59±0.09b 2.32±0.11a DPPH 0.77±0.06c 5.16±0.16b 10.66±0.22a 注:同一行不同字母表示差异显著(P<0.05)。 表 2 不同测定指标相关性分析
Table 2 Correlation analysis of different measured indexes
总多酚 总多糖 总三萜 总原花青素 松果菊苷 毛蕊花糖苷 DPPH
IC50ABTS
IC50总多酚 1 总多糖 0.999* 1 总三萜 0.998* 1.000** 1 总原花青素 −0.448 −0.495 −0.51 1 松果菊苷 0.995* 0.988* 0.985 −0.356 1 毛蕊花糖苷 0.98 0.969 0.964 −0.263 0.995* 1 DPPH IC50 −0.966 −0.978 −0.982 0.664 −0.935 −0.896 1 ABTS IC50 −0.977 −0.987 −0.990* 0.627 −0.951 −0.916 0.999* 1 *相关性显著(P<0.05),**相关性极显著(P<0.01)。 -
[1] 艾拉旦·麦麦提艾力, 杨婷, 袁洁, 等. 管花肉苁蓉药渣中多糖提取工艺及体外抗氧化活性研究[J]. 化学与生物工程,2020,37(2):36−41. [MAIMAITIAILI A, YANG T, YUAN J, et al. Study on extraction technology and antioxidant activity of polysaccharide from the residue of Cistanche tubulosa[J]. Chemical and Biological Engineering,2020,37(2):36−41. doi: 10.3969/j.issn.1672-5425.2020.02.008 [2] 郭雄飞, 吴亚东, 倪慧, 等. 管花肉苁蓉不同部位有效成分含量的考察比较[J]. 新疆医科大学学报,2012,35(1):48−50. [GUO X F, WU Y D, NI H, et al. Comparative study on the content of active components in different parts of Cistanche tubulosa[J]. Journal of Xinjiang Medical University,2012,35(1):48−50. doi: 10.3969/j.issn.1009-5551.2012.01.011 [3] 陈虞超, 张丽, 巩檑, 等. 管花肉苁蓉人工控制寄生技术研究[J]. 时珍国医国药,2017,28(10):2507−2510. [CHEN Y C, ZHANG L, GONG L, et al. Study on artificial control parasitism of Cistanche tubulosa[J]. Shizhen Chinese Medicine,2017,28(10):2507−2510. [4] 夏美茹, 张青, 孙志惠, 等. 肉苁蓉中功能因子测定及提取研究进展[J]. 现代食品,2020(15):22−25,37. [XIA M R, ZHANG Q, SUN Z H, et al. Research progress in determination and extraction of functional factors in Cistanche deserticola[J]. Modern Food,2020(15):22−25,37. [5] ZHU K N, MENG Z Q, TIAN Y S, et al. Hypoglycemic and hypolipidemic effects of total glycosides of Cistanche tubulosa in diet/streptozotocin-induced diabetic rats[J]. Journal of Ethnopharmacology,2021,276:113991. doi: 10.1016/j.jep.2021.113991
[6] WANG F J, TU P F, ZENG K W, et al. Total glycosides and polysaccharides of C. deserticola prevent osteoporosis by activating Wnt/β-catenin signaling pathway in SAMP6 mice[J]. Journal of Ethnopharmacology,2021,271:113899. doi: 10.1016/j.jep.2021.113899
[7] FAN L, PENG Y, WANG J W, et al. Total glycosides from stems of Cistanche tubulosa alleviate depression-like behaviors: Bidirectional interaction of the phytochemicals and gut microbiota[J]. Phytomedicine,2021,83:153471. doi: 10.1016/j.phymed.2021.153471
[8] LEI H B, WANG X Y, ZHANG Y H, et al. Herba Cistanche (Rou Cong Rong): A review of its phytochemistry and pharmacology: Reviews[J]. Chemical and Pharmaceutical Bulletin,2020,68(8):694−712. doi: 10.1248/cpb.c20-00057
[9] 郭元亨, 曹丽丽, 赵兵, 等. 荒漠肉苁蓉苯乙醇苷对酒精诱导的慢性肝损伤的修复作用[J]. 食品科学,2018,39(13):176−183. [GUO Y H, CAO L L, ZHAO B, et al. Repairing effect of phenylethanol glycoside in Cistanche deserticola on alcohol-induced chronic liver injury[J]. Food Science,2018,39(13):176−183. doi: 10.7506/spkx1002-6630-201813026 [10] FU Z F, FAN X, WANG X Y, et al. Cistanches herba: An overview of its chemistry, pharmacology, and pharmacokinetics property[J]. Journal of Ethnopharmacology,2018,219:233−247. doi: 10.1016/j.jep.2017.10.015
[11] GUO Y L, CUI Q L, REN S M, et al. The hepatoprotective efficacy and biological mechanisms of three phenylethanoid glycosides from Cistanches herba and their metabolites based on intestinal bacteria and network pharmacology[J]. Journal of Natural Medicines,2021:1−14.
[12] 颜贵卉, 田金虎, 龙本文, 等. 肉苁蓉中苯乙醇苷类成分的研究进展[J]. 中南药学,2012,10(9):692−695. [YAN G H, TIAN J H, LONG B W, et al. Research progress of phenylethanol glycosides in Cistanche deserticola[J]. Central Pharmacy,2012,10(9):692−695. [13] 田原. 松果菊苷诱导骨髓间充质干细胞向成骨细胞分化及作用机制研究[D]. 沈阳: 辽宁中医药大学, 2015: 35−55. TIAN Y. Differentiation of bone marrow mesenchymal stem cells into osteoblasts induced by echinoside and its mechanism[D]. Shenyang: Liaoning University of Traditional Chinese Medicine, 2015: 35−55.
[14] 尉大为, 葛锌雨, 刘奕含, 等. 松果菊苷诱导骨髓间充质干细胞向成骨细胞分化的研究[J]. 中药药理与临床,2017,33(2):48−52. [WEI D W, GE X Y, LIU Y H, et al. Differentiation of bone marrow mesenchymal stem cells into osteoblasts induced by echinoside[J]. Chinese Medicine Pharmacology and Clinic,2017,33(2):48−52. [15] 国家药典委员会. 中华人民共和国药典(1部)[M]. 北京: 化学工业出版社, 2020: 140. National Pharmacopoeia Commission. Pharmacopoeia of the people's republic of China (Part 1)[M]. Beijing: Chemical Industry Press, 2020: 140.
[16] 蔡鸿, 鲍忠, 姜勇, 等. 不同影响因素下肉苁蓉中3种活性成分的定量分析[J]. 中草药,2013,44(22):3223−3230. [CAI H, BAO Z, JIANG Y, et al. Quantitative analysis of three active components in Cistanche under different influencing factors[J]. Chinese Herbal Medicine,2013,44(22):3223−3230. [17] 杨太新, 杜艳华, 刘金娜, 等. 管花肉苁蓉不同生长时间和部位的有效成分含量分析[J]. 时珍国医国药,2014,25(5):1191−1193. [YANG T X, DU Y H, LIU J N, et al. Analysis of active components in different growth time and parts of Cistanche tubulosa[J]. Shizhen Chinese Medicine,2014,25(5):1191−1193. [18] 周美娟, 沈丽琴, 刘强, 等. 肉苁蓉产地加工方法研究[J]. 亚太传统医药,2020,16(12):54−58. [ZHOU M J, SHEN L Q, LIU Q, et al. Study on the producing area processing method of Cistanche deserticola[J]. Asia-pacific Traditional Medicine,2020,16(12):54−58. [19] LI F H, ZHANG X L, ZHENG S J, et al. Corrigendum to the composition, antioxidant and antiproliferative capacities of phenolic compounds extracted from tartary buckwheat bran[J]. Journal of Functional Foods,2016,22:145−155. doi: 10.1016/j.jff.2016.01.027
[20] 牛晓方, 高一军, 怀宝刚, 等. 硫酸-苯酚法测定六种牡丹叶中总多糖的含量[J]. 山东农业工程学院学报,2021,38(4):33−35. [NIU X F, GAO Y J, HUAI B G, et al. Determination of total polysaccharides in six kinds of peony leaves by sulfuric acid-phenol method[J]. Journal of Shandong University of Agricultural Engineering,2021,38(4):33−35. doi: 10.3969/j.issn.1008-7540.2021.04.008 [21] 何策, 王超, 陈纯, 等. 桑树桑黄总三萜提取工艺优化及其降血脂、抗氧化活性研究[J]. 食品工业科技,2021,42(7):208−215. [HE C, WANG C, CHEN C, et al. Optimization of extraction technology of total triterpenoids from Inonotus sanghuang and their hypolipidemic and antioxidant activities[J]. Science and Technology of Food Industry,2021,42(7):208−215. [22] 吕筱, 郑天元, 韦新月, 等. 花生红衣中原花青素的提取工艺与活性研究[J]. 农产品加工,2021(9):27−31. [LV X, ZHENG T Y, WEI X Y, et al. Study on extraction technology and activity of procyanidins from peanut red coat[J]. Agrotechny,2021(9):27−31. [23] 许明君, 高如意, 邓辰辰, 等. HPLC法同时测定复方中药保健酒中松果菊苷和毛蕊花糖苷的含量[J]. 食品与发酵科技,2020,56(1):100−105. [XU M J, GAO R Y, DENG C C, et al. Simultaneous determination of echinoside and mulinoside in compound Chinese medicine health wine by HPLC[J]. Food and Fermentation Technology,2020,56(1):100−105. doi: 10.3969/j.issn.1674-506X.2020.01.019 [24] ROBERTA R, NICOLETTA P, ANNA P, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9):1231−1237.
[25] KIRIGAYA N, KATO H, FUJIMAKI M. Studies on antioxidant activity of nonenzymic browning reaction products. Part 3. fractionation of browning reaction solution between ammonia and D-glucose and antioxidant activity of the resulting fractions[J]. Nippon Nogeikagaku Kaishi,1971,45:292−298. doi: 10.1271/nogeikagaku1924.45.292
[26] 包斌, 唐晓阳, 田宏, 等. 管花肉苁蓉提取物的抗氧化活性研究[J]. 上海中医药杂志,2010,44(2):68−71. [BAO B, TANG X Y, TIAN H, et al. Study on antioxidant activity of extracts from Cistanche tubulosa[J]. Shanghai Journal of Traditional Chinese Medicine,2010,44(2):68−71. [27] 杨太新, 杜艳华, 刘金娜, 等. 华北平原管花肉苁蓉中多糖的含量分析[J]. 时珍国医国药,2013,24(5):1149−1150. [YANG T X, DU Y H, LIU J N, et al. Analysis of polysaccharide content in Cistanche tubulosa in North China Plain[J]. Shi Zhen Chinese Medicine,2013,24(5):1149−1150. doi: 10.3969/j.issn.1008-0805.2013.05.053 [28] 张玉清, 毕可海, 张玉莹, 等. 超声辅助有机溶剂法提取葡萄皮原花青素工艺条件[J]. 食品工业,2021,42(2):1−5. [ZHANG Y Q, BI K H, ZHANG Y Y, et al. Extraction of proanthocyanidins from grape skin by ultrasound-assisted organic solvent method[J]. Food Industry,2021,42(2):1−5. [29] 罗云, 陈霖, 张雪涟, 等. 灵芝三萜类成分药理活性研究进展[J]. 中国药理学通报,2021,37(9):1185−1188. [LUO Y, CHEN L, ZHANG X L, et al. Advances in pharmacological activities of triterpenoids from Ganoderma lucidum[J]. Chinese Pharmacological Bulletin,2021,37(9):1185−1188. doi: 10.3969/j.issn.1001-1978.2021.09.001 [30] 姬晓慧, 李鸿辉, 李桂芳, 等. 新疆古尔班通古特沙漠不同地区荒漠肉苁蓉功效物质评价[J]. 广东农业科学,2018,45(10):112−117. [JI X H, LI H H, LI G F, et al. Evaluation of efficacy of Cistanche deserticola in different regions of the Gurbantunggut Desert in Xinjiang[J]. Guangdong Agricultural Sciences,2018,45(10):112−117. [31] 何梦梦, 游林, 包晓玮, 等. 肉苁蓉水提物体外抗氧化及对小鼠肠道菌群紊乱的作用[J]. 食品研究与开发,2020,41(23):44−50. [HE M M, YOU L, BAO X W, et al. Antioxidantion of Cistanche deserticola water extract in vitro and its effect on intestinal flora disorder in mice[J]. Food Research and Development,2020,41(23):44−50.






 下载:
下载:
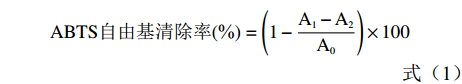
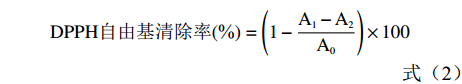
 下载:
下载:
