Optimization of Sturgeon Cartilage Products and Its Regulation on Human Chondrocyte Inflammation
-
摘要: 本文旨在以鲟鱼软骨为原料制得一种鲟鱼软骨制品,并探究其对人软骨细胞炎症的影响。通过高温高压技术对鲟鱼软骨和龙筋进行热液化处理并加工制得了一种鲟鱼软骨制品,通过单因素及正交试验确定了其最佳制备条件,通过制备含药血清来培养人软骨细胞,以MTT、阿尔新兰染色、ELISA等方法考察了鲟鱼软骨制品对白细胞介素1β(Interleukin 1β,IL-1β)诱导细胞炎症模型的影响。结果表明,鲟鱼软骨制品的最佳制备条件为热液化温度120 ℃、热液化时间20 min、熬煮温度80 ℃、熬煮时间30 min,此条件下该产品的感官评分为59.69分,且鲟鱼软骨制品组的含药血清不具备细胞毒性,能够刺激软骨细胞分泌胶原蛋白及蛋白聚糖等细胞外基质。同时,该产品可以显著提升炎症细胞的增殖活力达156%(P<0.05),且可以显著抑制炎症状态下软骨细胞NO、INOS、IL-6、COX-2和PGE2的表达水平(P<0.05)。Abstract: The purpose of this paper was to prepare a sturgeon cartilage product from sturgeon cartilage and explore its effect on inflammation of human chondrocytes. A kind of sturgeon cartilage product was prepared by thermal liquefaction of sturgeon cartilage and dragon tendon at high temperature and high pressure. The optimum preparation conditions were determined by single factor and orthogonal test. Human chondrocytes were cultured by preparing drug-containing serum and the effects of sturgeon cartilage products on Interleukin 1β (IL-1β)-induced cell inflammatory model were investigated by MTT, Alsinland staining and ELISA. The results showed that the best preparation conditions of sturgeon cartilage products were as follows: Hot liquefaction temperature was 120 ℃, hot liquefaction time was 20 min, boiling temperature was 80 ℃, boiling time was 30 min. Under this condition, the sensory score of the product was 59.69. The drug-containing serum of sturgeon cartilage products group had no cytotoxicity and could stimulate chondrocytes to secrete collagen and proteoglycan and other extracellular matrix. Meanwhile, the product could significantly increase the proliferation activity of inflammatory cells by 156% (P<0.05), and significantly inhibited the expression levels of NO, INOS, IL-6, COX-2 and PGE2 in the inflammatory chondrocytes (P<0.05).
-
Keywords:
- sturgeon /
- cartilage /
- osteoarthritis /
- chondrocyte /
- inflammatory factor /
- process optimization
-
鲟鱼是现存起源最早的脊椎动物之一,具有极高的经济价值和科研价值,我国的鲟鱼市场需求仍在不断扩大[1]。然而,鲟鱼产业逐步发展至今,主要加工方向仍为鱼子酱产品,加工过程中鱼骨和龙筋等副产物利用率较低[2]。在鲟鱼的软骨和龙筋中含有丰富的胶原蛋白、硫酸软骨素、氨基葡萄糖等营养物质,其在缓解骨性关节炎、关节疼痛等方面具有潜在价值[3]。骨性关节炎(Osteoarthritis,OA)又称骨质增生性关节炎、退行性关节炎等,是一种进行性慢性发展的骨关节疾病,亦是导致下肢残疾的起因之一[4]。软骨细胞的损伤和退化是造成骨性关节炎的重要原因之一[5-8]。研究发现,硫酸软骨素、Ⅱ型胶原蛋白及氨基葡萄糖都可作用于软骨细胞,对其产生刺激,导致其分泌多聚体糖蛋白,并且可以减少对软骨细胞有毒的一些细胞因子的释放,进一步润滑保护骨关节[9-13]。
目前,关于鲟鱼的研究大部分为对鱼肉营养成分和风味机制的探究,而关于鱼骨的研究主要报道有鱼骨酶解加工工艺的优化以及酶解物的抗肿瘤活性等探究,国内外以鲟鱼鱼骨为原料的产品开发及其对骨性关节炎的活性影响报道较少[14-17]。因此,本文以鲟鱼鱼骨为研究对象,对其进行产品开发以及骨关节炎缓解作用的探究。
本实验选用鲟鱼软骨为原料制成食品,探究产品的最佳制备条件,并考察其对人软骨细胞炎症的调控作用,为鲟鱼有效成分预防及缓解骨性关节炎在细胞层面提供新的理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜雄性人工养殖西伯利亚鲟和史氏鲟杂交鲟鱼鱼骨、龙筋、花胶 杭州千岛湖鲟龙科技股份有限公司;8周龄雌性SD大鼠40只,体重均为(180±20)g 济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)2019-0003;冰糖、蜂蜜 市售;健力多Ⅱ型胶原氨糖软骨素片 汤臣倍健股份有限公司;双抗(青链霉素) Invitrogen公司;乙腈(色谱纯)、阿尔新蓝染液、单糖标准品 Sigma公司;DMEM培养液、特级胎牛血清、0.25%胰蛋白酶、MTT、羟脯氨酸含量检测试剂盒、前列腺素E2(Prostaglandin E2,PGE2)ELISA试剂盒、白细胞介素6(Interleukin 6,IL-6)ELISA试剂盒、白细胞介素8(Interleukin 8,IL-8)ELISA试剂盒、环氧化酶2(Cyclooxygenase 2,COX-2)ELISA试剂盒、诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase,INOS)、一氧化氮(Nitric Oxide,NO)含量测定试剂盒 北京索莱宝科技有限公司;人软骨肉瘤细胞株(SW1353 细胞) 武汉普诺赛生命科技有限公司。
LC-20AD高效液相色谱仪 日本岛津公司;IX73倒置显微镜 日本Olympus公司;Multiskan FC全自动酶标仪、HERAcell 150 CO2细胞培养箱、Sorvall Stratos低温高速离心机 美国赛默飞世尔科技公司;LE2002E电子天平 上海梅特勒-托利多仪器有限公司;LGJ-10C真空冷冻干燥机 北京四环福瑞科仪科技发展有限公司;F-50微型反压灭菌釜 山东创美机械科技有限公司。
1.2 实验方法
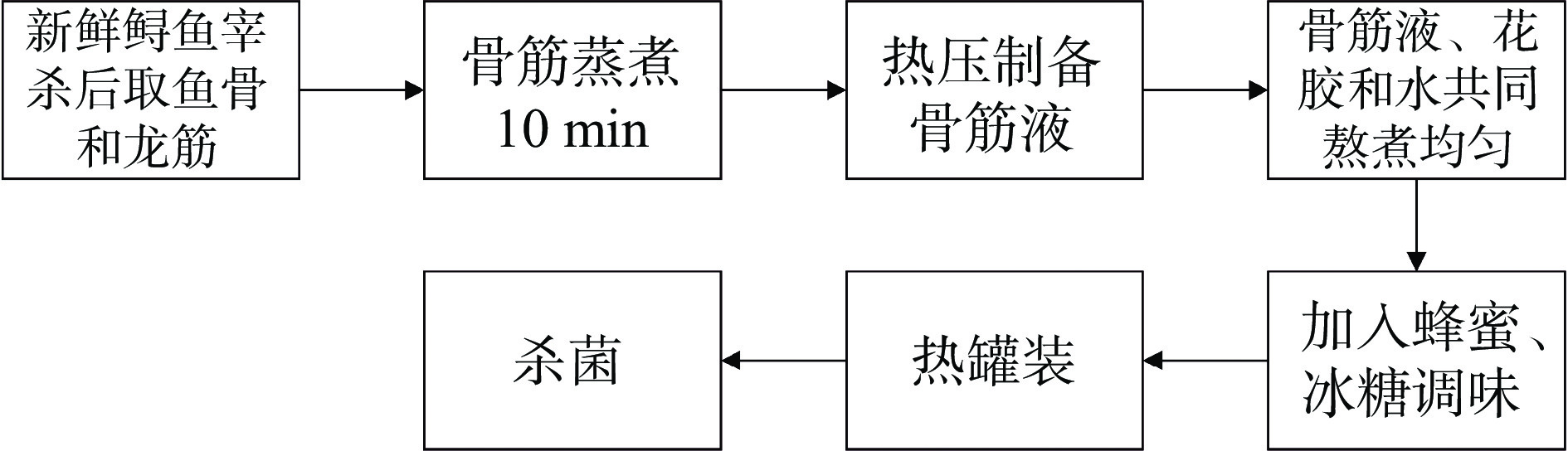
1.2.1 鲟鱼软骨制品的制备
鲟鱼软骨制品的总体制备工艺如图1所示。参考文献[18]进行预实验,确定了鲟鱼软骨制品各原料添加量的基本配比为鲟鱼骨筋液的配比为鱼骨:龙筋:水=4:1:12,熬煮过程中骨筋液、花胶、蜂蜜、冰糖和水的配比为骨筋液:花胶:蜂蜜:冰糖:水=16:6:3:1:74,不再进行后续单因素实验。
操作要点:参考文献[19]并加以修改,将新鲜鲟鱼宰杀后取鱼骨和龙筋,于40 ℃下蒸煮10 min以脱去残留的鱼肉,将洗净的鱼骨、龙筋及水按上述质量比加入微型反压灭菌釜,通过热液化使原料充分压化至液态,将液态物料过200目筛网后,将鲟鱼骨筋液、泡发花胶及水按上述质量比混合熬煮,待物料整体均匀透明无分层后,加入蜂蜜与冰糖调味,过200目筛网后热罐装并杀菌。
1.2.2 单因素实验
1.2.2.1 不同热液化工艺对鲟鱼软骨制品的影响
称取鲟鱼软骨湿基18.8 g,鲟鱼龙筋4.7 g、泡发花胶30 g、蜂蜜15 g、冰糖5 g、水426.4 g,根据1.2.1的方法制备鲟鱼软骨制品,按鲟鱼骨筋液的热液化温度120 ℃,混合熬煮时间30 min,熬煮温度80 ℃,分别于10、15、20、25、30 min的热液化时间下进行制备,探究不同热液化时间对鲟鱼软骨制品感官品质的影响,确定最佳热液化时间。
按照上述条件,控制鲟鱼骨筋液的热液化时间20 min,混合熬煮时间30 min,熬煮温度80 ℃不变,分别于100、110、120、130、140 ℃的热液化温度下进行制备,探究不同热液化温度对鲟鱼软骨制品感官品质的影响,确定最佳热液化温度。
1.2.2.2 不同熬煮工艺对鲟鱼软骨制品的影响
按1.2.1条件制备鲟鱼软骨制品,按鲟鱼骨筋液的热液化时间20 min,热液化温度120 ℃,混合熬煮温度80 ℃,分别于10、20、30、40、50 min的熬煮时间下进行制备,探究不同熬煮时间对鲟鱼软骨制品感官品质的影响,确定最佳熬煮时间。
按照上述方法,控制鲟鱼骨筋液的热液化时间20 min,热液化温度120 ℃,混合熬煮时间30 min不变,分别于60、70、80、90、100 ℃的熬煮温度下进行制备,探究不同熬煮温度对鲟鱼软骨制品感官品质的影响,确定最佳熬煮温度。
1.2.3 正交试验
在单因素实验基础上,以感官品质为评价指标,设计L9(34)正交试验用以确定制备鲟鱼软骨制品的最佳工艺条件,试验因素设计见表1。
表 1 正交试验因素水平设计Table 1. Factor and level of orthogonal experimental水平 因素 热液化温度(℃) 热液化时间(min) 熬煮温度(℃) 熬煮时间(min) 1 110 15 70 20 2 120 20 80 30 3 130 25 90 40 1.2.4 感官评定方法
参考大鲵胶原蛋白多肽口服液的感官评价标准,修改制定鲟鱼软骨制品的评价标准[18]。由9人构成感官评价小组(小组成员均受过专业感官评价培训),根据表2对产品从颜色、性状、气味和滋味三个方面进行测评。评分等级分为:46~60、31~45、16~30、0~15。
表 2 感官评定标准Table 2. Sensory evaluation standard项目 总分(分) 色泽 性状 气味、滋味 浅棕黄色,色泽透亮均匀 质地均匀透明,无分层 香味浓郁协调,无腥味,无苦涩感,细腻顺滑 46~60 浅棕黄色,色泽略暗均匀 质地均匀,略透明,无分层 香味稍淡,无腥味,略涩,口感顺滑 31~45 棕黄色,色泽暗淡 质地略不均匀,有絮状物漂浮 无香味,略带腥味,偏甜或偏酸,略涩,口感略微下降 16~30 深棕色,色泽较黑不均匀 质地不均匀,有絮状沉淀 难以接受的臭味,腥味重,过甜或过酸,有涩味,口感难以接受 0~15 1.2.5 理化、微生物及主要营养成分指标测定
鲟鱼软骨制品的各项理化指标测定方法如下:甲基汞的测定方法参照GB 5009.17-2014食品中总汞及有机汞的测定中的第二法;多氯联苯的测定方法参照GB 5009.190-2014食品中指示性多氯联苯含量的测定中的第二法;N-二甲基硝铵的测定方法参照GB 5009.26-2016食品中N-亚硝胺类化合物的测定中的第一法;铅的测定方法参照GB 5009.12-2017食品中铅的测定中的第一法;铬的测定方法参照GB 5009.123-2014食品中铬的测定;镉的测定方法参照GB 5009.15-2014食品中镉的测定;苯甲酸的测定方法参照GB 5009.28-2016食品中苯甲酸、山梨酸和糖精钠的测定中的第一法;无机砷的测定方法参照GB 5009.11-2014食品中总砷及无机砷的测定中的第二篇第一法。
微生物指标测定方法如下:沙门氏菌的测定方法参照GB 4789.4-2016食品微生物学检验沙门氏菌检验;金黄色葡萄球菌的测定方法参照GB 4789.10-2016食品微生物学检验金黄色葡萄球菌检验中的第二法;副溶血性弧菌的测定方法参照GB4789.7-2013食品微生物学检验副溶血性弧菌检验。
参考陆剑峰等[20]的方法,按照羟脯氨酸检测试剂盒的说明测定羟脯氨酸含量,再乘以换算系数11.1,即可得胶原蛋白含量;硫酸软骨素和氨基葡萄糖的测定方法参照GB/T 20365-2006硫酸软骨素和盐酸氨基葡萄糖含量的测定。
1.2.6 鲟鱼软骨制品对人软骨细胞的影响
1.2.6.1 动物实验
参考文献并略作修改:选用8周龄雌性SD大鼠40只,适应性喂养7 d后,随机分为空白血清组(生理盐水)、阳性对照组(Ⅱ型胶原氨糖软骨素片)、鲟鱼软骨制品低、中、高剂量组五组,每组8只。根据大鼠给药剂量与正常人给药量换算系数6.3,参考大鼠胃容积每百克0.9 mL灌胃干预[21]。
鲟鱼软骨制品灌胃剂制备:将本实验研发的鲟鱼软骨制品低温冻干浓缩成粉状,以蒸馏水控制灌胃剂浓度为每毫升含药1 g。按照大鼠与人体的受药量公式换算每只动物的灌胃量低、中、高三组分别为100、250、500 mg/kg。
阳性对照组灌胃剂制备:将健力多Ⅱ型胶原氨糖软骨素片磨碎成粉状,使用蒸馏水溶解,剂量为大鼠每日每千克250 mg。
空白血清组灌胃剂制备:用同体积的0.9%氯化钠注射液。
1.2.6.2 含药血清的制备
参考文献[22]的培养方法,将上述每组大鼠适应性喂养一周,生活状态无异常后,受试物灌胃1个月,取血前禁食水,于第32 d灌胃后等待2 h,以8%的水合氯醛根据动物体重每百克0.5 mL进行腹腔注射麻醉,腹主动脉取血法收集血液,各组血液于4 ℃静置4~5 h,于4000 r/min的参数下低温低速离心15 min,离心后的上清过0.22 μm滤膜除菌分装,−80 ℃下冻存备用。
1.2.6.3 含药血清中羟脯氨酸及单糖组成的测定
羟脯氨酸的具体测定方法按照羟脯氨酸含量检测试剂盒说明进行。血清样品水解及标准品衍生参考杨大俏等[23]的方法进行,使用液相色谱法对血清的单糖组成进行分析,色谱柱选用Gracesmart C18色谱柱(250 mm×4.6 mm,5 μm),流动相A为100 mmol/L磷酸钠缓冲溶液,流动相B为乙腈,柱温30 ℃,流速1 mL/min,进样量5 μL,于250 nm下检测。以各单糖的质量浓度为横坐标,峰面积为纵坐标分别计算线性回归方程,各单糖在各自浓度范围内线性关系良好,详细结果见表3。
表 3 各单糖成分的线性回归方程和范围Table 3. The linear equations and linear ranges of each monosaccharide单糖成分 线性回归方程 决定系数(R2) 线性范围(μg/mL) 甘露糖 y=26550x−15442 0.9996 1.50~650.00 氨基葡萄糖 y=18445x−15004 0.9991 1.50~650.00 葡萄糖醛酸 y=32008x+123354 0.9994 1.50~650.00 氨基半乳糖 y=18664x+12116 0.9997 1.50~650.00 葡萄糖 y=18008x−487660 0.9992 1.50~650.00 半乳糖 y=38562x−6624 0.9994 1.50~650.00 1.2.6.4 人软骨肉瘤细胞的培养
参考文献[24]的培养方法,将人软骨肉瘤细胞(SW1353)在含10%特级胎牛血清(FBS)和1×104 U/mL双抗(青链霉素)的DMEM高糖培养基中培养,倒置显微镜下观察细胞的生长状态,待细胞生长至80%以上时,用胰酶进行传代培养,每隔2 d换液,细胞传至三代左右时可进行实验。实验前,将细胞提前分组,分别为空白血清组、鲟鱼软骨制品低、中、高浓度组、阳性对照组、空白对照组和无IL-1β(白细胞介素1β)处理组。
1.2.6.5 细胞炎症模型造模
参考文献[25]的方法,将细胞用胰酶消化并重悬成细胞密度1×108 个/mL的细胞悬液,每孔接种10 μL到6孔板上,依次每孔加2 mL完全培养基(DMEM培养基含血清及双抗)。完全贴壁后,PBS漂洗,按上述1.2.6.4分组每孔加1.8 mL含10%含药血清的DMEM培养基(无IL-1β处理组每孔加2 mL培养基),培养箱中孵育30 min,除无IL-1β处理组外,每孔各加0.2 mL的IL-1β(10 μg·L−1)处理48 h,造模完毕。
1.2.6.6 阿尔新蓝染色
细胞造模24 h后,PBS洗液漂洗3~5次,每孔加1.5 mL 4%多聚甲醛固定30 min后, PBS洗液漂洗3~5次,各孔加0.5 mL 1%阿尔新蓝染液过夜。弃染液后,每孔加1.5 mL 75%乙醇溶液润洗,弃去乙醇,加去离子水洗涤3~5次,自然晾干,镜下观察并拍照记录。
1.2.6.7 MTT法检测细胞增殖活力
将细胞用胰酶消化并重悬成细胞密度1×104个/mL的细胞悬液,于96孔板中培养至贴壁,弃去培养基,按分组加入含药血清培养基,孵育30 min后每孔加入IL-1β过夜,避光配置5 mg/mL的MTT溶液,每孔加20 μL,孵育4 h后,各孔分别加200 μL DMSO,将96孔板置于恒温低速摇床上低速振荡15 min,使用酶标仪于490 nm处检测吸光度。
1.2.6.8 ELISA检测细胞培养液中炎症因子的表达水平
参考文献的方法,将造模完备的细胞以含药血清干预后培养24 h,收集每孔培养液,具体测定方法按照NO、INOS、IL-6、COX-2和PGE2检测试剂盒说明进行[26]。
1.3 数据处理
本文实验均重复4次以上,采用SPSS 21.0软件进行数据分析,实验计量数据采用平均值±标准差(
ˉx ±s)表示,使用Origin 2019软件进行数据处理,通过单因素和双因素方差分析进行比较,P<0.05表示差异具有统计学意义。2. 结果与分析
2.1 单因素实验结果
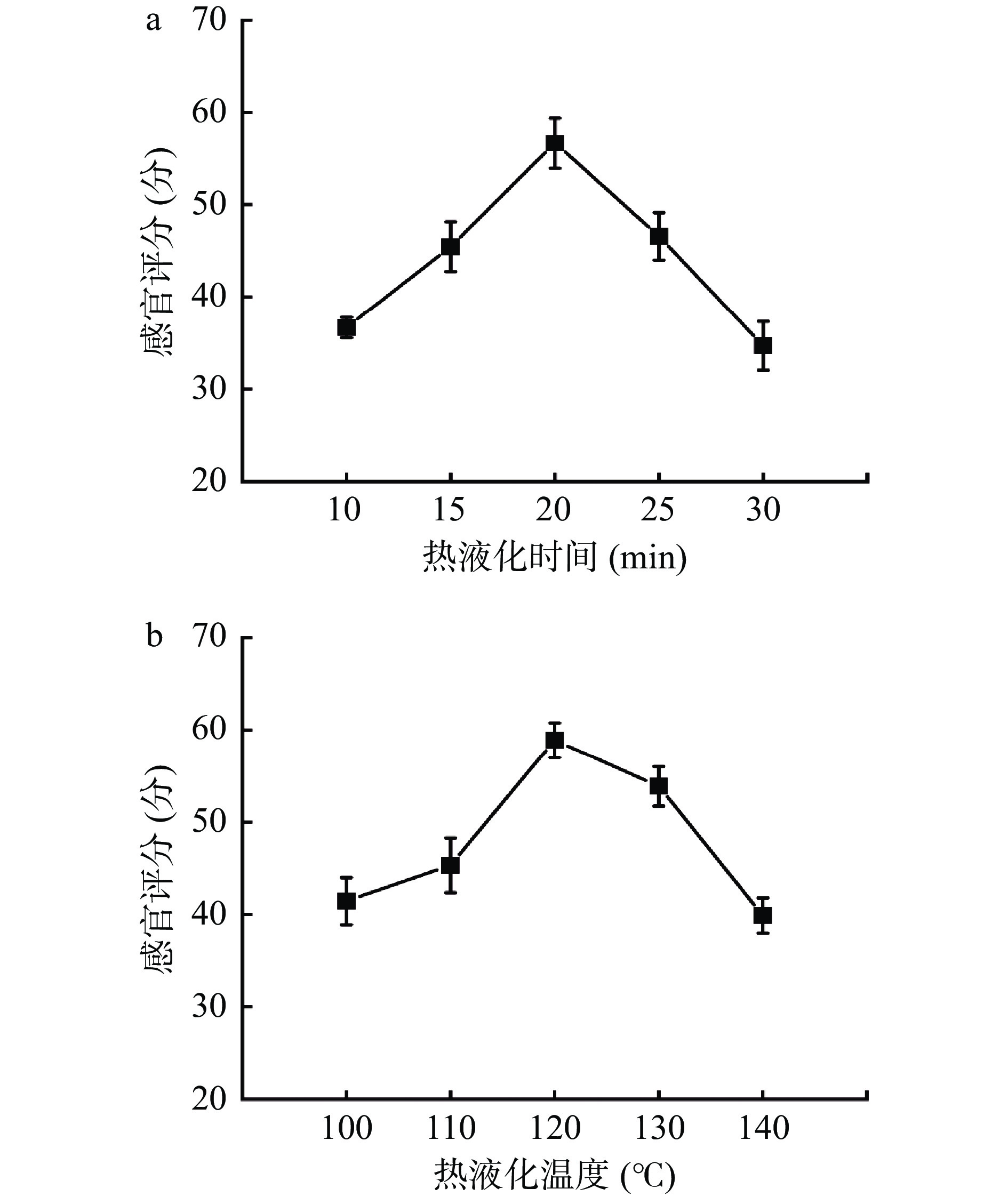
2.1.1 不同热液化条件对鲟鱼软骨制品的影响
由图2可知,鲟鱼软骨制品的感官品质受到鲟鱼骨筋液热液化温度和时间的影响。当热液化温度达到120 ℃时,产品感官评分最高,随后评分随温度的升高而降低。同时,随着处理时间的增加,产品感官评分也在逐渐上升,20 min后,评分开始下降。这是由于热液化温度和时间过低均会导致鲟鱼鱼骨和龙筋的液化不完全,大部分物料残存在设备中没有被压化,从而使产品浓度降低[26]。此外,产品后续制作中又被过度稀释,其特有的鲟鱼风味、顺滑口感等都会受到不良影响;而液化温度和时间过高则会导致物料在设备中过分受热,使部分物料呈焦糊状态,导致产品原有的独特风味难以体现,还附有令人难以接受的焦糊口感和色泽。因此,控制热液化温度在110~130 ℃和热液化时间在15~25 min范围内,产品可以呈现较好的感官品质。
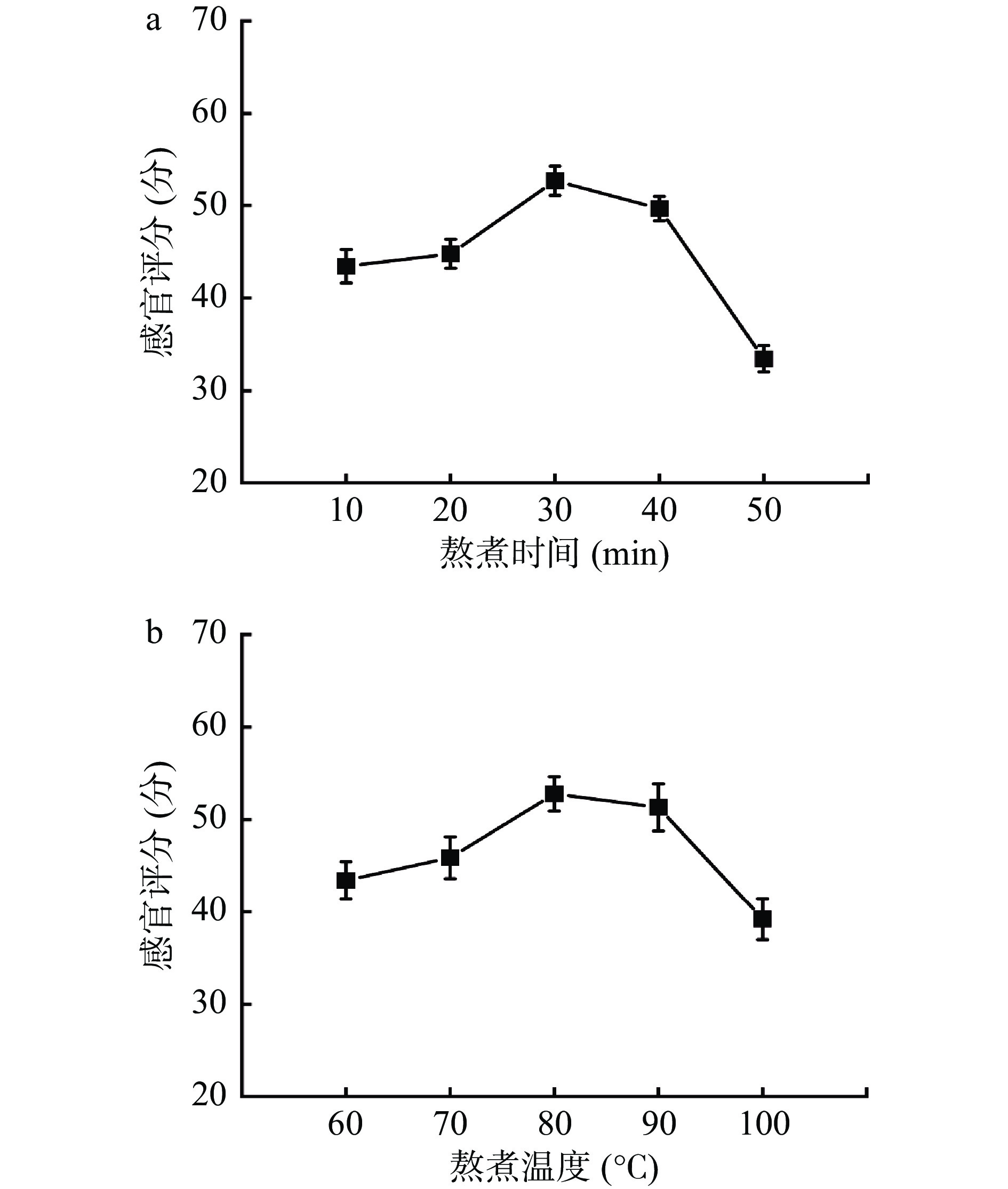
2.1.2 不同熬煮条件对鲟鱼软骨制品的影响
由图3可知,鲟鱼软骨制品的感官品质受到不同熬煮条件的影响。感官评分随着熬煮温度的升高而增加,当温度达到80 ℃时,产品的感官评分最高,之后随温度的继续升高而降低。同时,随着熬煮时间的增加,产品的感官评分也在逐渐上升,30 min后,评分开始明显下降。这是由于熬煮温度和时间过低会导致物料混合不均匀,美拉德反应不完全,使产品的性状质地不均一,出现分层现象;而熬煮温度和时间过高则会导致美拉德反应过度,物料呈焦糊状,最终产品呈现棕黑色,口感过于甜腻且焦糊风味严重[26]。因此,控制熬煮温度在70~90 ℃和熬煮时间在20~40 min范围内,产品可以呈现较好的感官品质。
2.2 正交试验结果
通过单因素实验,可知鲟鱼软骨制品的感官品质受热液化和熬煮工艺条件的影响较大,故而设计L9(34)正交试验用以确定制备鲟鱼软骨制品的最佳工艺条件,并进行分析,结果见表4。
表 4 正交试验结果Table 4. Results of orthogonal experiment实验号 A热液化温度 B热液化时间 C熬煮温度 D熬煮时间 感官评分(分) 1 1 1 1 1 52.86 2 1 2 2 2 58.11 3 1 3 3 3 55.72 4 2 1 2 3 59.19 5 2 2 3 1 59.17 6 2 3 1 2 58.51 7 3 1 3 2 58.33 8 3 2 1 3 57.78 9 3 3 2 1 57.12 K1 166.69 170.38 169.15 169.15 K2 176.87 175.06 174.42 174.95 K3 173.23 171.35 173.22 172.69 k1 55.56 56.79 56.38 56.38 k2 58.96 58.35 58.14 58.32 k3 57.74 57.12 57.74 57.56 R 3.40 1.56 1.76 1.94 结合表4与表5,发现鲟鱼软骨制品感官品质受热液化温度的影响较显著(P<0.05),影响产品品质因素的顺序为热液化温度>熬煮时间>熬煮温度>热液化时间,此外分析K值发现,产品的最优化工艺条件是A2B2C2D2,即热液化温度120 ℃、热液化时间20 min、熬煮温度80 ℃、熬煮时间30 min。
表 5 方差分析结果Table 5. Results of variance analysis方差来源 自由度 F比 显著性 热液化温度 2 3.58 * 热液化时间 2 0.43 熬煮温度 2 0.56 熬煮时间 2 0.64 注:*表示显著,P<0.05。 2.3 验证实验
按照最优化工艺条件A2B2C2D2进行三次平行实验,结果得到鲟鱼软骨制品的感官评分平均为(59.69±0.32)分,高于上述9个实验组合,由图4可以看出,在此条件下制备的鲟鱼软骨制品呈浅棕黄色,色泽透亮均匀,质地透明,无分层现象,香味浓郁协调,无腥味,口感细腻顺滑。
2.4 鲟鱼软骨制品的理化、微生物及主要营养成分指标测定结果
参考动物性水产制品国标,由表6、表7可知,鲟鱼软骨制品的理化指标和微生物指标均符合标准[27]。
表 6 鲟鱼软骨制品理化指标检测结果Table 6. Results of physical and chemical indexes of sturgeon cartilage product项目 结果 定量限 限值 说明 甲基汞(mg/kg) 未检出 0.025 ≤1.0 符合 多氯联苯(PCBs)(mg/kg) 未检出 − ≤0.5 符合 N-二甲基硝胺(μg/kg) 未检出 1.0 ≤4.0 符合 铅(Pb)(mg/kg) 未检出 0.04 ≤1.0 符合 铬(Cr)(mg/kg) 未检出 0.1 ≤2.0 符合 镉(Cd)(mg/kg) 未检出 0.003 ≤0.1 符合 苯甲酸(g/kg) 未检出 0.010 不得检出 符合 无机砷(mg/kg) 未检出 0.08 ≤0.1 符合 表 7 鲟鱼软骨制品微生物指标检测结果Table 7. Results of microbiological index detection of sturgeon cartilage product项目 结果 n c m M 说明 沙门氏菌/25 g 未检出 5 0 0 − 符合 金黄色葡萄糖球菌(CFU/g) <10 5 1 100 1000 符合 副溶血性弧菌(MPN/g) <0.3 5 1 100 1000 符合 注:n:同一批次产品应采集的样品件数;c:最大可允许超出m值的样品数;m:微生物指标可接受水平的限量值;M:微生物指标的最高安全限量值。 由表8可知,鲟鱼软骨制品中含有胶原蛋白、硫酸软骨素及氨基葡萄糖三种主要营养物质,含量分别为2.20、2.82 g/100 g和1.17 g/100 g,推测其可能对后续软骨细胞实验造成影响。
表 8 鲟鱼软骨制品主要营养成分检测结果Table 8. Results of main nutrients of sturgeon cartilage product项目(g/100 g) 方法 结果 检出限 胶原蛋白 羟脯氨酸含量换算 2.20 0.1 硫酸软骨素 GB/T 20365-2006 2.82 0.1 氨基葡萄糖 GB/T 20365-2006 1.17 0.1 注:羟脯氨酸含量换算方法,参考陆剑锋等[20]的方法。 2.5 含药血清中羟脯氨酸和单糖组成测定结果
由图5可知,与空白对照组相比,各受试物组血清中的羟脯氨酸含量均显著增加(P<0.05),说明摄入鲟鱼软骨制品可以促使血液中羟脯氨酸的分泌量显著增加。产品组内中浓度组血清的羟脯氨酸含量最高,参考陈俊等[28]的研究发现,由于鲟鱼软骨制品中添加了蜂蜜和冰糖调味,因此,随着产品浓度的增加,产品的含糖量也在增加,而长期的高糖饮食会导致氧化应激、蛋白水解酶的产生以及晚期糖基化终末产物的积累,影响了Ⅱ型胶原蛋白的合成,而羟脯氨酸作为形成胶原蛋白的必需氨基酸,其分泌量也显著降低[29]。
羟脯氨酸是Ⅱ型胶原蛋白的主要构成成分之一,可以通过羟脯氨酸含量的变化推测Ⅱ型胶原蛋白含量的变化。Ⅱ型胶原蛋白可促使已经去分化的软骨细胞再次表达Ⅱ型胶原蛋白和分泌糖胺聚糖。因此,由于每组血清中羟脯氨酸含量不同,推测各组含药血清会对后续的软骨细胞实验造成不同的影响,可以继续进行后续实验。
由表9可知,与空白对照组相比,各受试物组血清中的氨基葡萄糖和葡萄糖的摩尔浓度比率均有较明显的上升,而每组血清中葡萄糖醛酸和氨基半乳糖的摩尔浓度比率均较低,说明通过相应受试物灌胃后可以促使血液中氨基葡萄糖和葡萄糖的比率升高,可以继续进行后续实验。由于葡萄糖醛酸和氨基半乳糖是构成硫酸软骨素的主要成分,说明硫酸软骨素在摄入后被分解代谢,可能通过其它方式对机体产生作用[30]。
表 9 含药血清中单糖成分分析Table 9. Analysis of monosaccharide composition in drug-containing serum组别 摩尔浓度比率(%) 甘露糖(%) 氨基葡萄糖(%) 葡萄糖醛酸(%) 氨基半乳糖(%) 葡萄糖(%) 半乳糖(%) 空白对照组 27.56±0.12a 27.66±0.04c 0.99±0.16a 0.58±0.04b 28.40±0.74c 14.80±1.42b 阳性对照组 24.44±0.24bc 31.83±1.24a 0.16±0.02c 0.62±0.14a 31.05±0.86b 11.90±0.24cd 产品低浓度组 26.30±0.09ab 30.04±0.84b 0.08±0.06d 0.57±0.27b 27.34±1.24d 15.67±0.06ab 产品中浓度组 25.15±0.14b 32.26±1.66a 0.08±0.08d 0.59±0.12b 31.08±1.08b 10.84±1.04d 产品高浓度组 23.43±0.60c 30.01±0.57b 0.22±0.04b 0.64±0.02a 33.05±0.26a 12.65±0.84c 注:同列不同小写字母表示组间差异显著(P<0.05)。 氨基葡萄糖作为软骨细胞外基质的主要组成部分之一,具有可以有效地促进软骨蛋白聚糖的生成,抑制炎症因子和炎症介质的扩散,刺激软骨细胞合成胶原蛋白等功效。因此,推测由于含药血清中的氨基葡萄糖比率不同,后续的软骨细胞培养结果也会随之受到影响,可以继续进行后续实验。
2.6 阿尔新蓝染色结果
阿尔新蓝染液可以将软骨细胞细胞膜和细胞外基质中的蛋白聚糖染成蓝色[31],由图6可明显看出,与空白对照组相比,除未造模组和阳性对照外,产品中浓度组的软骨细胞染色范围最广颜色最深,说明IL-1β软骨细胞促炎造模成功,且各组含药血清对于处于炎症状态的软骨细胞都有一定的缓解和保护作用,同时也证明了产品组血清可以有效地刺激软骨细胞增殖和分泌蛋白聚糖。
2.7 MTT法检测软骨细胞的增殖活力
如图7所示,与空白对照组相比,各组细胞活力均显著上升(P<0.05),说明含药血清对软骨细胞没有毒性。以造模后不加含药血清的空白对照组细胞活力为100%计,除阳性对照组外,产品中浓度组的细胞增殖活力为156%,在受试物组间活力最高,说明产品组含药血清可以显著提升炎症软骨细胞增殖活力(P<0.05)。由上述2.5和吴松等[32]的研究可知,软骨细胞在高糖环境下培养,会引起氧化应激程度加剧、细胞外基质进一步降解,从而导致细胞凋亡。因此,产品组的细胞增殖活力并无剂量依赖性。
2.8 细胞培养液中炎症因子的表达水平
由图8(A)可知,与空白对照组相比,鲟鱼软骨制品组INOS和NO的表达水平均显著降低(P<0.05),说明鲟鱼软骨制品组含药血清可以有效地抑制软骨细胞表达INOS和NO。鲟鱼软骨制品组内中浓度血清组对INOS表达的抑制效果最为显著(P<0.05);中浓度和高浓度血清组对NO表达的抑制效果最为显著(P<0.05),且两组组内无显著性差异(P>0.05),此结果与上述2.5和2.7结果一致。NO属于活性氧,过量的NO会导致低度炎症的产生,有研究表明,由于软骨细胞衰老、凋亡和发炎导致的骨性关节炎与NO含量的不正常升高有着密切关系,NO的升高可以有效抑制软骨细胞的生长及其分泌胶原蛋白和蛋白聚糖的能力。INOS属于一种同工酶,可以通过在机体内催化L-精氨酸氧化生成L-瓜氨酸的过程产生NO,从而损坏软骨细胞,影响细胞的正常生理功能并促发炎症[33-34]。
由图8(B)可知,与空白对照组相比,产品含药血清组IL-8的表达水平均无显著性变化(P>0.05),而阳性对照组和未造模组中IL-8的表达水平均有显著性下降(P<0.05),说明产品组含药血清对软骨细胞IL-8的表达水平并无显著影响(P>0.05)。产品含药血清组IL-6的表达水平与对照组相比均有显著下降(P<0.05),说明产品组含药血清可以有效地抑制软骨细胞表达IL-6。IL-6和IL-8都属于复杂的炎症趋化性细胞因子,它们在机体中可以通过调节和刺激细胞的生长分化等过程来起到促进炎症发生的作用[35-36]。
由图8(C)可知,产品含药血清组COX-2和PGE2的表达水平与空白对照组相比均显著下降(P<0.05),说明产品组含药血清可以抑制软骨细胞表达COX-2和PGE2。产品组内中浓度组的PGE2表达水平最低,且与其它两组相比具有显著性差异(P<0.05),此结果与上述2.5和2.7的结果相符,推测是由于高浓度组含药血清中葡萄糖含量最高,高糖环境导致软骨细胞的氧化应激程度加剧和细胞外基质降解,从而使高浓度组含药血清对PGE2表达的抑制效果弱于中浓度组。COX-2是炎症反应过程中的关键酶,COX-2的分泌会导致机体进一步释放炎症因子,诱导基质金属蛋白酶(MMP)的合成,从而促发炎症反应并介导软骨细胞蛋白多糖分泌功能紊乱。PGE2属于类花生酸类物质,PGE2可以通过刺激软骨细胞、巨噬细胞等细胞直接影响软骨细胞的正常生长和分化,还可以通过诱导MMP等分解代谢物质,抑制软骨细胞分泌胶原蛋白和蛋白聚糖等细胞外基质[37-38]。
3. 结论
本研究通过热液化鲟鱼鱼骨及龙筋,熬煮和调味等处理,成功研制出一种鲟鱼软骨制品,结合产品的感官评价通过正交试验确定了影响产品品质因素的顺序为热液化温度>熬煮时间>熬煮温度>热液化时间,最佳制作条件为热液化温度120 ℃、热液化时间20 min、熬煮温度80 ℃、熬煮时间30 min,在此条件下,产品的感官评分为59.69分。此基础上,采用IL-1β构建软骨细胞炎症模型,以受试物对SD大鼠进行灌胃后制备含药血清,在细胞实验水平探究了鲟鱼软骨制品对炎症状态下的软骨细胞生理功能的影响。结果表明,产品含药血清对软骨细胞不具备细胞毒性,并且可以有效地保护炎症软骨细胞的增殖能力。同时,产品含药血清还可以显著抑制炎症软骨细胞NO、INOS、IL-6、COX-2和PGE2的表达水平(P<0.05),从而起到舒缓炎症反应进程并维持软骨细胞分泌胶原蛋白和蛋白聚糖等细胞外基质的正常生理功能的作用。综上,本研究可以丰富鲟鱼鱼骨及龙筋的食品营养学理论基础,为今后鲟鱼软骨制品预防和缓解骨性关节炎提供理论依据。
-
表 1 正交试验因素水平设计
Table 1 Factor and level of orthogonal experimental
水平 因素 热液化温度(℃) 热液化时间(min) 熬煮温度(℃) 熬煮时间(min) 1 110 15 70 20 2 120 20 80 30 3 130 25 90 40 表 2 感官评定标准
Table 2 Sensory evaluation standard
项目 总分(分) 色泽 性状 气味、滋味 浅棕黄色,色泽透亮均匀 质地均匀透明,无分层 香味浓郁协调,无腥味,无苦涩感,细腻顺滑 46~60 浅棕黄色,色泽略暗均匀 质地均匀,略透明,无分层 香味稍淡,无腥味,略涩,口感顺滑 31~45 棕黄色,色泽暗淡 质地略不均匀,有絮状物漂浮 无香味,略带腥味,偏甜或偏酸,略涩,口感略微下降 16~30 深棕色,色泽较黑不均匀 质地不均匀,有絮状沉淀 难以接受的臭味,腥味重,过甜或过酸,有涩味,口感难以接受 0~15 表 3 各单糖成分的线性回归方程和范围
Table 3 The linear equations and linear ranges of each monosaccharide
单糖成分 线性回归方程 决定系数(R2) 线性范围(μg/mL) 甘露糖 y=26550x−15442 0.9996 1.50~650.00 氨基葡萄糖 y=18445x−15004 0.9991 1.50~650.00 葡萄糖醛酸 y=32008x+123354 0.9994 1.50~650.00 氨基半乳糖 y=18664x+12116 0.9997 1.50~650.00 葡萄糖 y=18008x−487660 0.9992 1.50~650.00 半乳糖 y=38562x−6624 0.9994 1.50~650.00 表 4 正交试验结果
Table 4 Results of orthogonal experiment
实验号 A热液化温度 B热液化时间 C熬煮温度 D熬煮时间 感官评分(分) 1 1 1 1 1 52.86 2 1 2 2 2 58.11 3 1 3 3 3 55.72 4 2 1 2 3 59.19 5 2 2 3 1 59.17 6 2 3 1 2 58.51 7 3 1 3 2 58.33 8 3 2 1 3 57.78 9 3 3 2 1 57.12 K1 166.69 170.38 169.15 169.15 K2 176.87 175.06 174.42 174.95 K3 173.23 171.35 173.22 172.69 k1 55.56 56.79 56.38 56.38 k2 58.96 58.35 58.14 58.32 k3 57.74 57.12 57.74 57.56 R 3.40 1.56 1.76 1.94 表 5 方差分析结果
Table 5 Results of variance analysis
方差来源 自由度 F比 显著性 热液化温度 2 3.58 * 热液化时间 2 0.43 熬煮温度 2 0.56 熬煮时间 2 0.64 注:*表示显著,P<0.05。 表 6 鲟鱼软骨制品理化指标检测结果
Table 6 Results of physical and chemical indexes of sturgeon cartilage product
项目 结果 定量限 限值 说明 甲基汞(mg/kg) 未检出 0.025 ≤1.0 符合 多氯联苯(PCBs)(mg/kg) 未检出 − ≤0.5 符合 N-二甲基硝胺(μg/kg) 未检出 1.0 ≤4.0 符合 铅(Pb)(mg/kg) 未检出 0.04 ≤1.0 符合 铬(Cr)(mg/kg) 未检出 0.1 ≤2.0 符合 镉(Cd)(mg/kg) 未检出 0.003 ≤0.1 符合 苯甲酸(g/kg) 未检出 0.010 不得检出 符合 无机砷(mg/kg) 未检出 0.08 ≤0.1 符合 表 7 鲟鱼软骨制品微生物指标检测结果
Table 7 Results of microbiological index detection of sturgeon cartilage product
项目 结果 n c m M 说明 沙门氏菌/25 g 未检出 5 0 0 − 符合 金黄色葡萄糖球菌(CFU/g) <10 5 1 100 1000 符合 副溶血性弧菌(MPN/g) <0.3 5 1 100 1000 符合 注:n:同一批次产品应采集的样品件数;c:最大可允许超出m值的样品数;m:微生物指标可接受水平的限量值;M:微生物指标的最高安全限量值。 表 8 鲟鱼软骨制品主要营养成分检测结果
Table 8 Results of main nutrients of sturgeon cartilage product
项目(g/100 g) 方法 结果 检出限 胶原蛋白 羟脯氨酸含量换算 2.20 0.1 硫酸软骨素 GB/T 20365-2006 2.82 0.1 氨基葡萄糖 GB/T 20365-2006 1.17 0.1 注:羟脯氨酸含量换算方法,参考陆剑锋等[20]的方法。 表 9 含药血清中单糖成分分析
Table 9 Analysis of monosaccharide composition in drug-containing serum
组别 摩尔浓度比率(%) 甘露糖(%) 氨基葡萄糖(%) 葡萄糖醛酸(%) 氨基半乳糖(%) 葡萄糖(%) 半乳糖(%) 空白对照组 27.56±0.12a 27.66±0.04c 0.99±0.16a 0.58±0.04b 28.40±0.74c 14.80±1.42b 阳性对照组 24.44±0.24bc 31.83±1.24a 0.16±0.02c 0.62±0.14a 31.05±0.86b 11.90±0.24cd 产品低浓度组 26.30±0.09ab 30.04±0.84b 0.08±0.06d 0.57±0.27b 27.34±1.24d 15.67±0.06ab 产品中浓度组 25.15±0.14b 32.26±1.66a 0.08±0.08d 0.59±0.12b 31.08±1.08b 10.84±1.04d 产品高浓度组 23.43±0.60c 30.01±0.57b 0.22±0.04b 0.64±0.02a 33.05±0.26a 12.65±0.84c 注:同列不同小写字母表示组间差异显著(P<0.05)。 -
[1] 唐淑玮, 高瑞昌, 曾名湧, 等. 鲟鱼鱼糜凝胶形成过程中的物理化学变化[J]. 食品科学,2019,40(7):82−87. [TANG S W, GAO R C, ZENG M Y, et al. Physicochemical changes during gel formation of sturgeon surimi[J]. Food Science,2019,40(7):82−87. doi: 10.7506/spkx1002-6630-20180320-253 TANG S W, GAO R C, ZENG M Y, et al. Physicochemical changes during gel formation of sturgeon surimi[J]. Food Science, 2019, 40(7): 82-87. doi: 10.7506/spkx1002-6630-20180320-253
[2] 李军, 李平兰, 高亮, 等. 萝卜籽蛋白提取物对托盘包装鲟鱼片冷藏品质的影响[J]. 食品科学,2018,39(9):224−231. [LI J, LI P L, GAO L, et al. Effect of radish seed protein extract on refrigerated quality of tray packed sturgeon fillet[J]. Food Science,2018,39(9):224−231. doi: 10.7506/spkx1002-6630-201809034 LI J, LI P L, GAO L, et al. Effect of radish seed protein extract on refrigerated quality of tray packed sturgeon fillet[J]. Food Science, 2018, 39(9): 224-231. doi: 10.7506/spkx1002-6630-201809034
[3] 周艳丽, 陈世杰, 劳文艳, 等. 氨基葡萄糖和骨碎补联用对大鼠慢性骨关节炎的干预作用及机制[J]. 食品科学,2018,39(3):213−221. [ZHOU Y L, CHEN S J, LAO W Y, et al. Intervention effect and mechanism of glucosamine combined with bone crusher on chronic osteoarthritis in rats[J]. Food Science,2018,39(3):213−221. doi: 10.7506/spkx1002-6630-201803033 ZHOU Y L, CHEN S J, LAO W Y, et al. Intervention effect and mechanism of glucosamine combined with bone crusher on chronic osteoarthritis in rats[J]. Food Science, 2018, 39(3): 213-221. doi: 10.7506/spkx1002-6630-201803033
[4] TANG Y H, LI Y F, XIN D W, et al. Icariin alleviates osteoarthritis by regulating autophagy of chondrocytes by mediating PI3K/AKT/mTOR signaling[J]. Bioengineered,2021,12(1):2984−2999. doi: 10.1080/21655979.2021.1943602
[5] EBATA T, TERKAWI M A, HAMASAKI M, et al. Flightless I is a catabolic factor of chondrocytes that promotes hypertrophy and cartilage degeneration in osteoarthritis[J]. Science,2021,24(6):102643.
[6] 杭兴伟, 增田泰伸, 木村守, 等. 硫酸氨基葡萄糖对口服透明质酸缓解小鼠佐剂性关节炎的增效作用[J]. 食品科学,2015,36(5):189−194. [HANG X W, ZENGTIANTAI S, MUCUN S, et al. Synergism of glucosamine sulfate in relieving effect of hyaluronic acid by oral administration on mice with adjuvant arthritis[J]. Food Science,2015,36(5):189−194. doi: 10.7506/spkx1002-6630-201505036 HANG X W, ZENGTIANTAI S, MUCUN S, et al. Synergism of glucosamine sulfate in relieving effect of hyaluronic acid by oral administration on mice with adjuvant arthritis[J]. Food Science, 2015, 36(5): 189-194 doi: 10.7506/spkx1002-6630-201505036
[7] RAFAEL D R M, LUCAS F D F, JOSE F S D L, et al. Biofat grafts as an orthobiologic tool in osteoarthritis: An update and classification proposal[J]. World Journal of Meta Analysis,2021,9(1):29−39. doi: 10.13105/wjma.v9.i1.29
[8] WANG K Y, BAI F, ZHOU X D, et al. Characterization of chondroitin sulfates isolated from large hybrid sturgeon cartilage and their gastroprotective activity against ethanol-induced gastric ulcers[J]. Food Chemistry,2021,363:130436. doi: 10.1016/j.foodchem.2021.130436
[9] 武瑞赟, 杜怡丽, 张金兰, 等. 乳杆菌发酵鲟鱼骨酶解液条件优化及营养成分分析[J]. 食品科学,2019,40(10):57−63. [WU R Y, DU Y L, ZHANG J L, et al. Optimization of fermentation conditions for higher viable count of lactobacillus paraplantarum in enzymatic hydrolysate of sturgeon cartilage and changes in nutrient components before and after fermentation[J]. Food Science,2019,40(10):57−63. doi: 10.7506/spkx1002-6630-20181210-123 WU R Y, DU Y L, ZHANG J L, et al. Optimization of fermentation conditions for higher viable count of lactobacillus paraplantarum in enzymatic hydrolysate of sturgeon cartilage and changes in nutrient components before and after fermentation[J]. Food Science, 2019, 40(10): 57-63 doi: 10.7506/spkx1002-6630-20181210-123
[10] 李崇阳, 李艳, 牟德华. 氨基葡萄糖硫酸软骨素促进骨骼健康作用研究进展[J]. 食品科学,2015,36(23):382−385. [LI C Y, LI Y, MOU D H. Advances in research on the promotion effect of glucosamine and chondroitin sulfate on bone health[J]. Food Science,2015,36(23):382−385. doi: 10.7506/spkx1002-6630-201523068 LI C Y, LI Y, MOU D H. Advances in research on the promotion effect of glucosamine and chondroitin sulfate on bone health[J]. Food Science, 2015, 36(23): 382-385 doi: 10.7506/spkx1002-6630-201523068
[11] 许蓉, 郑淋, 赵谋明. 温度和pH值对鸡胸软骨Ⅱ型胶原蛋白的结构、黏度和热稳定性的影响[J]. 食品科学,2020,41(14):66−71. [XU R, ZHENG L, ZHAO M M. Effect of temperature and pH on the structure, viscosity and thermal stability of type II collagen from chicken cartilage[J]. Food Science,2020,41(14):66−71. doi: 10.7506/spkx1002-6630-20190624-294 XU R, ZHENG L, ZHAO M M. Effect of temperature and pH on the structure, viscosity and thermal stability of type II collagen from chicken cartilage[J]. Food Science, 2020, 41(14): 66-71. doi: 10.7506/spkx1002-6630-20190624-294
[12] RUI F, KANG J W, HAO Y T, et al. Undenatured type II collagen prevents and treats osteoarthritis and motor function degradation in T2DM patients and db/db mice[J]. Food & Function,2021,12(3):4373−4391.
[13] CAO F, CHEN Y, WANG X, et al. Therapeutic effect and potential mechanisms of intra-articular injections of miR-140-5p on early-stage osteoarthritis in rats[J]. International Immunopharmacology,2021,96(7):107786.
[14] 彭海川, 钱琴, 母运龙, 等. 不同烹饪方式处理的鲟鱼肉营养成分和风味比较[J/OL]. 现代食品科技: 1−9 [2021-11-15]. https://doi.org/10.13982/j.mfst.1673-9078.2022. 2.0585 PENG H C, QIAN Q, MU Y L, et al. Comparison of nutrient composition and flavor of sturgeon meat processed by different cooking methods [J/OL]. Modern Food Science and Technology: 1−9 [2021-11-15]. https://doi.org/10.13982/j.mfst.1673-9078.2022.2.0585.
[15] 向晨曦, 李钰金, 高瑞昌, 等. 打印参数对未漂洗鲟鱼糜凝胶3D打印成型效果的影响[J/OL]. 食品工业科技: 1−15 [2021-11-15]. https://doi.org/10.13386/j.issn1002-0306.2021040100. XIANG C X, LI Y J, GAO R C, et al. Effect of printing parameters on 3D printing effect of unrinsed sturgeon surimi gel[J/OL]. Science and Technology of Food Industry: 1−15 [2021-11-15]. https://doi.org/10.13386/j.issn1002-0306.2021040100.
[16] 黄卉, 魏涯, 李来好, 等. 季节变化对杂交鲟鱼肉营养成分的影响[J]. 食品工业科技,2021,42(7):360−365. [HUANG H, WEI Y, LI L H, et al. Effects of seasonal variation on nutrient composition of meat of hybrid sturgeon[J]. Science and Technology of Food Industry,2021,42(7):360−365. HUANG H, WEI Y, LI L H, et al. Effects of seasonal variation on nutrient composition of meat of hybrid sturgeon[J]. Science and Technology of Food Industry, 2021, 42(7): 360-365.
[17] 武瑞赟, 杜怡丽, 黄雨霞, 等. 鲟鱼软骨酶解条件优化及酶解物的体外抗肿瘤活性[J]. 中国农业大学学报,2020,25(1):131−141. [WU R Y, DU Y L, HUANG Y X, et al. Optimization of enzymolysis conditions of Sturgeon cartilage and in vitro antitumor activity of enzymolysis products[J]. Journal of China Agricultural University,2020,25(1):131−141. doi: 10.11841/j.issn.1007-4333.2020.01.15 WU R Y, DU Y L, HUANG Y X, et al. Optimization of enzymolysis conditions of Sturgeon cartilage and in vitro antitumor activity of enzymolysis products[J]. Journal of China Agricultural University, 2020, 25(1): 131-141. doi: 10.11841/j.issn.1007-4333.2020.01.15
[18] 徐阳, 孙强, 李静, 等. 大鲵胶原蛋白多肽口服液的开发研究[J]. 食品工业,2016,37(3):1−5. [XU Y, SUN Q, LI J, et al. Development and research for andrias davidianus collagen peptide oral liquid[J]. The Food Industry,2016,37(3):1−5. XU Y, SUN Q, LI J, et al. Development and research for andrias davidianus collagen peptide oral liquid[J]. The Food Industry, 2016, 37(3): 1-5
[19] 程雨晴, 解万翠, 杨锡洪, 等. 鱼鳞胶原蛋白凝冻休闲食品的制备及其优化[J]. 农产品加工(学刊),2014(5):12−14. [CHENG Y Q, XIE W C, YANG X H, et al. Preparation and optimization of fish scale collagen frozen snack food[J]. Agricultural Processing (Journal),2014(5):12−14. CHENG Y Q, XIE W C, YANG X H, et al. Preparation and optimization of fish scale collagen frozen snack food[J]. Agricultural Processing (Journal), 2014(5): 12-14.
[20] 陆剑锋, 万全, 殷章敏, 等. 中华鳖裙边胶原蛋白的提取及其特征[J]. 水产学报,2010,34(6):981−988. [LU J F, WAN Q, YIN Z M, et al. Extraction and characteristics of collagen from skirt edge of China turtles[J]. Journal of Fisheries of China,2010,34(6):981−988. LU J F, WAN Q, YIN Z M, et al. Extraction and characteristics of collagen from skirt edge of China turtles[J]. Journal of Fisheries of China, 2010, 34(6): 981-988.
[21] LI J W, WANG R L, XU J, et al. Methylene blue prevents osteoarthritis progression and relieves pain in rats via upregulation of Nrf2/PRDX1[J]. Acta Pharmacologica Sinica,2021:1−12.
[22] 李梦秋,黄娟,邹国发,等. 高良姜含药血清及主要成分对TRPA1信号通路的影响[J]. 中国药理学通报,2021,37(10):1443−1449. [LI M Q, HUANG J, ZOU G F, et al. Effects of galangal serum and its main components on TRPA1 signaling pathway[J]. Chinese Pharmacological Bulletin,2021,37(10):1443−1449. LI M Q, HUANG J, ZOU G F, et al. Effects of galangal serum and its main components on TRPA1 sig- naling pathway[J]. Chinese Pharmacological Bulletin, 2021,37(10):1443-1449.
[23] 杨大俏, 王锦旭, 李来好, 等. 近江牡蛎多糖的结构鉴定及免疫调节能力分析[J]. 食品科学,2020,41(10):38−46. [YANG D Q, WANG J X, LI L H, et al. Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J]. Food Science,2020,41(10):38−46. doi: 10.7506/spkx1002-6630-20190524-295 YANG D Q, WANG J X, LI L H, et al. Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J]. Food Science, 2020, 41(10): 38-46 doi: 10.7506/spkx1002-6630-20190524-295
[24] YANG J, YAO L T, LI Y X, et al. Interleukin-35 regulates angiogenesis through P38 mitogen-activated protein kinase signaling pathway in Interleukin-1β-Stimulated SW1353 cells and cartilage bioinformatics analysis[J]. Journal of Interferon & Cytokine Research: The Official Journal of the International Society for Interferon and Cytokine Research,2021,41(5):164−171.
[25] 孙群周. 狗脊多糖通过miR-181c调控IL-1β介导的骨关节炎软骨细胞增殖和凋亡[J]. 中国老年学杂志,2021,41(11):2398−2402. [SUN Q Z. MiR-181c regulates the proliferation and apoptosis of osteoarthritis chondrocytes mediated by IL-1β[J]. Chinese Journal of Gerontology,2021,41(11):2398−2402. doi: 10.3969/j.issn.1005-9202.2021.11.046 SUN Q Z. MiR-181c regulates the proliferation and apoptosis of osteoarthritis chondrocytes mediated by IL-1β[J]. Chinese Journal of Gerontology, 2021, 41(11): 2398-2402 doi: 10.3969/j.issn.1005-9202.2021.11.046
[26] 虞舒蓓, 林淑. 依达拉奉对脂多糖激活的BV-2小胶质细胞中促炎细胞因子的影响[J]. 中国临床药理学杂志,2019,35(12):1244−1246. [YU S P, LIN S. Effects of edaravone on pro-inflammatory cytokines in lipopolysaccharide-activated BV-2 microglia[J]. The Chinese Journal of Clinical Pharmacology,2019,35(12):1244−1246. YU S P, LIN S. Effects of edaravone on pro-inflammatory cytokines in lipopolysaccharide-activated BV-2 microglia[J]. The Chinese Journal of Clinical Pharmacology, 2019, 35(12): 1244-1246.
[27] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 10136-2015动物性水产制品[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China, GB 10136-2015 Aquatic products of animal origin[S]. Beijing: China Standard Press, 2007
[28] 陈俊, 张娜玲, 邹冰, 等. 糖尿病和高糖血症在骨性关节炎中的作用[J]. 局解手术学杂志,2020,29(7):590−593. [CHEN J, ZHANG N L, ZOU B, et al. Role of diabetes or hyperglycemia in osteoarthritis[J]. Journal of Regional Anatomy and Operative Surgery,2020,29(7):590−593. CHEN J, ZHANG N L, ZOU B, et al. Role of diabetes or hyperglycemia in osteoarthritis[J]. Journal of Regional Anatomy and Operative Surgery, 2020, 29(7): 590-593
[29] 杨舒乔,王迪,高彦祥. 非变性Ⅱ型胶原蛋白研究进展[J]. 食品科学,2021,42(17):343−349. [YANG S Q, WANG D, GAO Y X. The research of undenatured type II collagen[J]. Food Science,2021,42(17):343−349. YANG S Q, WANG D, GAO Y X. The research of undenatured type II collagen[J]. Food Science,2021,42(17):343-349.
[30] FERNANDEZ M S, GONZALEZ C A, MUNOZ F, et al. Glucosamine and chondroitin sulfate: Is there any scientific evidence for their effectiveness as disease-modifying drugs in knee osteoarthritis preclinical studies?—A systematic review from 2000 to 2021[J]. Animals,2021,11(6):1608−1608. doi: 10.3390/ani11061608
[31] 于庆贺, 曲戎梅, 张国炜, 等. 3种成软骨诱导培养基对单层培养和微球培养的人脂肪干细胞成软骨效果比较[J]. 中国临床解剖学杂志,2021,39(1):71−75. [YU Q H, QU R M, ZHANG G W, et al. Comparison of chondrogenic effects of three kinds of chondrogenic induction media on human adipose-derived stem cells in monolayer and microsphere cultured[J]. Chinese Journal of Clinical Anatomy,2021,39(1):71−75. YU Q H, QU R M, ZHANG G W, et al. Comparison of chondrogenic effects of three kinds of chondrogenic induction media on human adipose-derived stem cells in monolayer and microsphere cultured[J]. Chinese Journal of Clinical Anatomy, 2021, 39(1): 71-75
[32] 吴松, 王鑫, 张彦, 等. 高糖高脂饮食对兔膝关节软骨形态的影响[J]. 中国组织工程研究与临床康复,2009,13(33):6433−6438. [WU S, WANG X, ZHANG Y, et al. Effect of high-sugar and high-fat diet on the morphology of rabbit knee articular cartilage[J]. Chinese Journal of Tissue Engineering Research,2009,13(33):6433−6438. WU S, WANG X, ZHANG Y, et al. Effect of high-sugar and high-fat diet on the morphology of rabbit knee articular cartilage[J]. Chinese Journal of Tissue Engineering Research, 2009, 13(33): 6433-6438.
[33] OHTSUKI T, HATIPOGLU O F, ASANO K, et al. Induction of CEMIP in chondrocytes by inflammatory cytokines: Underlying mechanisms and potential involvement in osteoarthritis[J]. International Journal of Molecular Sciences,2020,21(9):3140. doi: 10.3390/ijms21093140
[34] PAN T T, PAN F, GAO W, et al. Involvement of macrophages and spinal microglia in osteoarthritis pain[J]. Current Rheumatology Reports,2021,23(5):1−7.
[35] HONG L, SHARP T, KHORSAND B, et al. Micro RNA-200c represses IL-6, IL-8, and CCL-5 expression and enhances osteogenic differentiation[J]. PloS One,2016,11(8):1−16.
[36] PHAM T M, ERICHSEN J L, KOWAL J M, et al. Elevation of pro-inflammatory cytokine levels following intra-articular fractures-a systematic review[J]. Cells,2021,10(4):1−9.
[37] FORTUNA R, HART D A, SHARKEY K A, et al. Effect of a prebiotic supplement on knee joint function, gut microbiota, and inflammation in adults with co-morbid obesity and knee osteoarthritis: study protocol for a randomized controlled trial[J]. Trials,2021,22(1):255. doi: 10.1186/s13063-021-05212-w
[38] JIN F, LIAO L, ZHU Y. MiR-467b alleviates lipopolysaccharide-induced inflammation through targeting STAT1 in chondrogenic ATDC5 cells[J]. International Journal of Immunogenetics,2021,48(5):435−442. doi: 10.1111/iji.12534





 下载:
下载:





 下载:
下载:
