Investigation of the Biogenic Amine Content in Jiangxi-made Sufu and Isolation and Identification of Amine-producing Bacteria
-
摘要: 采用高效液相色谱法对江西产腐乳生物胺含量水平进行调查分析,通过微生物学分离结合高效液相色谱确认,筛选出生物胺产生菌,并对其进行鉴定。结果表明,12种腐乳样品中总生物胺含量范围为68.5~1084.0 mg/kg,色胺、腐胺、组胺和酪胺是主要生物胺,其中腐胺和酪胺的含量较高。筛选出的9株产胺菌产生物胺的含量范围为93.8~369.2 mg/L。对产胺量较高的6株菌进行表型鉴定和基因型16S rDNA序列测定,得到耐热芽孢杆菌(Bacillus sporothermodurans)1株,鲁梅利杆菌(Rummeliibacillus stabekisii)1株,耐硼赖氨酸芽孢杆菌(Lysinacillus boronitolerans)3株和皮脂葡萄球菌(Staphylococcus piscifermentans)1株。研究结果对腐乳食用安全性评价提供了理论依据,为进一步探清如何抑制腐乳中产胺菌的活性提供了理论研究基础。Abstract: The biogenic amine Level in Jiangxi-made sufu was analyzed by high performance liquid chromatography (HPLC) and amine-producing bacteria were isolated and identified by microbiological methods combined with HPLC confirmation. The results showed that total biogenic amine level ranged from 68.5 to 1084.0 mg/kg in sufu samples. Major biogenic amines were tryptamine, putrescine, histamine and tyramine, among which putrescine and tyramine were of the highest level. Biogenic amine level produced by 9 amine-producing bacteria ranged from 93.8 to 369.2 mg/L. For six bacteria with relatively high amine productivity, phenotype and genotype 16S rDNA sequence determination had found one Bacillus sporothermodurans strain, one Rummeliibacillus stabekisii strain, three Lysinacillus boronitolerans strains and one Staphylococcus piscifermentans strain. The current research offered theoretical evidence for edible safety evaluation of sufu and served as research basis to investigate how to inhibit activity of amine-producing bacteria in sufu.
-
Keywords:
- sufu /
- biogenic amine /
- amine-producing bacteria /
- isolation /
- identification
-
腐乳是我国传统发酵豆制品,因其质地细腻、口感香醇、味道鲜美,是一种不可多得的佐餐佳品,同时含有人体所需要的多种微量元素,被称为“东方奶酪”[1]。研究表明,腐乳具有抗氧化、降胆固醇、降血压[2-3]等多种生理功能,且经过发酵之后,更容易被人体消化吸收。发酵食品中的微生物诸如芽孢杆菌属(Bacillus)、梭菌属(Clostridium)、乳酸杆菌属(Lactobacillus)和假单胞菌属(Pseudomonas)均能产生脱羧酶[4-5],使食品中的氨基酸脱羧产生生物胺。生物胺本身在机体中发挥多种生理功能,是正常的活性物质[6],但是当质量浓度过高身体就会出现偏头痛、胃部痉挛、呕吐、腹泻、过敏等中毒症状[7],其中毒性最大的是组胺和酪胺[8]。调查发现,腐乳、酱油、虾酱和干腌鱼等发酵食品中生物胺水平较高[9-10]。腐乳中丰富的游离氨基酸在微生物的作用下容易脱羧生成生物胺[11],并发生生物胺积累现象,且不同类型腐乳中生物胺的种类和含量存在明显差别[12],腐乳中常见的生物胺有6种:色胺、苯乙胺、腐胺、尸胺、组胺和酪胺[13]。
江西生产腐乳的历史悠久,但气候温湿,适合微生物繁殖,对腐乳食用安全产生不利影响。因此,本文采用高效液相色谱法对江西产腐乳生物胺含量水平进行调查分析,同时采用表型鉴定和基因型16S rDNA测序技术从产胺量较高的腐乳中分离鉴定具有产生物胺能力的菌株,从而对其食用安全性评价提供理论研究基础。
1. 材料与方法
1.1 材料与仪器
12种市售腐乳 产地均为江西,样品具体信息见表1;色胺、2-苯乙胺、腐胺、尸胺、组胺、章鱼胺、酪胺、亚精胺、精胺、1,7-二氨基庚烷、丹磺酰氯 纯度≥97%,坛墨质检标准物质中心;乙腈、丙酮 色谱纯,默克股份两合公司;L-组氨酸、L-酪氨酸、L-赖氨酸、L-鸟氨酸、L-色氨酸、L-苯丙氨酸、谷氨酸钠、5´-磷酸吡多醛、碳酸钙、溴甲酚紫(分析纯)、乙酸、乙酸铵(色谱纯) 上海麦克林生化科技有限公司;三氯乙酸、氢氧化钠、碳酸氢钠、氯化钠、乙醚 分析纯,西陇化工股份有限公司;Ezup柱式细菌基因组DNA抽提试剂盒、dNTP、PCR引物 上海生工生物工程有限公司;DreamTaq-TM DNA Polymerase MBI Fermentas公司;胰酪大豆胨琼脂(Trypticase Soy Agar,TSA)培养基、胰酪大豆胨液体(Trypticase Soy Broth,TSB)培养基、胰蛋白胨、酵母浸粉、琼脂粉 北京陆桥股份有限公司。
表 1 样品信息Table 1. Sample information编号 名称 产地 配料 1 豆腐乳 江西南昌 黄豆、辣椒、植物油、味精、食用盐、白酒、白砂糖、香辛料、食品添加剂:硫酸钠、脱氢乙酸钠 2A 茶油腐乳香辣味 江西吉安 水、黄豆、茶油、食用植物油、食用盐、辣椒粉、香辛料 3A 农家腐乳猛辣型 江西吉安 水、黄豆、植物油、食用盐、辣椒粉、香辛料 4B 红油腐乳香辣味 江西吉安 水、大豆、菜籽油、食用盐、白酒、辣椒、八角、食品添加剂:谷氨酸钠 5B 白腐乳原味 江西吉安 水、大豆、食用盐、白酒、食品添加剂:脱氢乙酸钠 6C 香辣腐乳 江西南昌 黄豆、植物油、辣椒、食盐、酒、香辛料 7C 茶油腐乳 江西南昌 黄豆、菜籽精炼油、山茶油、辣椒、食盐、酒、香辛料 8D 家乡豆腐乳 江西南昌 黄豆、水、食用大豆油、麻油、食用碘盐、辣椒、白酒、生姜、味精、香辛料 9D 豆腐乳家乡味 江西南昌 黄豆、水、食用大豆油、食用碘盐、辣椒、白酒、生姜、味精、香辛料 10 山茶油腐乳 江西吉安 黄豆、饮用水、山茶油、辣椒、食用盐、白酒、香辛料 11E 红油腐乳王 江西吉安 水、大豆、菜籽油、食用盐、辣椒、白酒、香辛料、味精 12E 茶油腐乳香辣味 江西吉安 水、大豆、菜籽油、山茶油、食用盐、辣椒、白酒、香辛料、味精 注:编号中的相同大写字母表示同一品牌不同系列样品;表4~表7同。 1260高效液相色谱仪 美国Agilent公司;Rotanta 460医用冷冻离心机 德高Hettich公司;DM1000显微镜 德国Leica公司;MJ-150-I生化培养箱 上海一恒科学仪器有限公司;HVA-85高温蒸汽灭菌器 日本HIRAYAMA制造公司;Veriti 96 Well Thermal Cycler PCR仪 美国Thermo Fisher公司;DYY-6C型电泳仪 北京六一生物科技有限公司;GenoSens 1880型凝胶成像仪 上海勤翔科学仪器有限公司。
1.2 实验方法
1.2.1 腐乳生物胺含量测定
1.2.1.1 生物胺标准溶液的配制
参照国标GB 5009.208-2016《食品安全国家标准 食品中生物胺的测定》第一法高效液相色谱法,配制生物胺的标准溶液和内标溶液,标准溶液浓度为1.0~50.0 mg/L。
1.2.1.2 样品的提取和衍生
生物胺的提取和衍生参考GB 5009.208-2016《食品安全国家标准 食品中生物胺的测定》和李大伟等[12]的方法有所改进。取5 g腐乳于25 mL离心管中,加入内标溶液,加入10 mL 50 mg/mL三氯乙酸溶液振荡提取30 min,4 ℃环境下6000 r/min离心10 min,转移上清液至25 mL容量瓶中,残渣用10 mL 50 mg/mL三氯乙酸溶液再提取1次,合并上清液并定容至刻度。
取0.5 mL上述溶液于15 mL离心管中,依次加入200 µL 2 mol/L氢氧化钠溶液、300 µL饱和碳酸氢钠溶液、1 mL 10 mg/mL丹磺酰氯溶液(溶剂为丙酮),涡旋数秒后置于60 ℃恒温水浴锅中衍生30 min,隔15 min振荡1次。取出,加入100 µL 50 mg/mL谷氨酸钠溶液(溶剂为饱和碳酸氢钠溶液),混匀后60 ℃恒温反应15 min。取出,冷却至室温,加入0.3 g氯化钠涡旋数秒,加入5 mL乙醚,振荡后静置分层,转移上层有机相(乙醚层)于15 mL离心管中,水相(下层)再萃取1次,合并2次乙醚萃取液,40 ℃水浴下氮气吹干。加入1 mL乙腈振荡混匀,使残留物溶解,0.22 μm 滤膜针头滤器过滤,待测定。标准溶液同法衍生。
1.2.1.3 高效液相色谱条件
色谱柱为Waters XBridge C18色谱柱(4.6 mm×250 mm,5 µm),紫外检测波长 254 nm,进样量20 μL,柱温35 ℃,流动相 A 为乙腈,流动相 B为含体积分数为0.1%乙酸的0.01 mol/L乙酸铵溶液,流速0.8 mL/min,梯度洗脱程序见表2。
表 2 梯度洗脱程序Table 2. Gradient elution procedures时间(min) 0 22 25 32 32.01 34 流动相A(%) 58 78 90 90 58 58 流动相B(%) 42 22 10 10 42 42 1.2.2 产生物胺菌株的筛选
1.2.2.1 培养基配制
生物胺初筛培养基(g/L):胰蛋白胨5.0、酵母浸粉5.0、氯化钠5.0、碳酸钙1.0、溴甲酚紫0.06、琼脂20、前体氨基酸(L-组氨酸、L-酪氨酸、L-赖氨酸、L-鸟氨酸、L-色氨酸、L-苯丙氨酸)各2.0、蒸馏水,pH 5.1~5.5,121 ℃高压灭菌15 min。
氨基酸TSB培养基(g/L):TSB 30、5´-磷酸吡多醛0.05、前体氨基酸(L-组氨酸、L-酪氨酸、L-赖氨酸、L-鸟氨酸、L-色氨酸、L-苯丙氨酸)各1.0、蒸馏水,121 ℃高压灭菌15 min。
1.2.2.2 产胺菌的分离纯化
取10 g腐乳于90 mL生理盐水中,充分匀质,制成1:10的样品悬液,取1 mL样品悬液以10倍梯度制成1:100和1:1000梯度浓度。各质量浓度悬液吸取100 µL样液分别涂布到生物胺初筛培养基上,36 ℃培养48 h。挑取平板上不同形态的蓝紫色菌落,在初筛培养基上多次划线分离,观察菌落形态特征,并接种至TSA平板上保存。
1.2.2.3 产胺菌的复筛
将上述纯化后的菌株接种于TSB液体培养基中,36 ℃培养24 h,取0.5 mL菌悬液至氨基酸TSB培养基中,36 ℃,160 r/min摇床培养72 h,取1 mL培养液,加入1 mL 50 mg/mL三氯乙酸溶液,振荡数秒,4 ℃环境下12000 r/min离心10 min,取0.5 mL上清液按1.2.1.2小节中样品处理方法测定生物胺含量。
1.2.3 产生物胺菌株的鉴定
1.2.3.1 产胺菌的形态学观察
观察菌株在TSA平板上的菌落形态,挑取单菌落进行革兰氏染色,用显微镜观察其大小、颜色、形状等特征。
1.2.3.2 产胺菌的分子生物学鉴定
总DNA的提取:按照Ezup 柱式细菌基因组DNA 抽提试剂盒说明书上的方法进行。
PCR扩增:采用细菌 16S rDNA 基因的通用引物,正向引物为 27F:5'-AGAGTTTGATCCTGGCTCAG -3',反向引物为 1492R:5'-GGTTACCTTGTTACGACTT-3';热循环参数:95 ℃预变性5 min,95 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸 90 s,循环30次后,72 ℃延伸10 min;将扩增产物进行电泳检测,目标物送至南昌科畅生物科技有限公司测序。
1.3 数据处理
实验重复3次,结果表示为“平均值±标准偏差”。采用SPSS Statistics V 19.0对实验数据进行统计分析,显著性水平设定为0.05。
2. 结果与分析
2.1 生物胺的含量测定
2.1.1 生物胺标曲和图谱
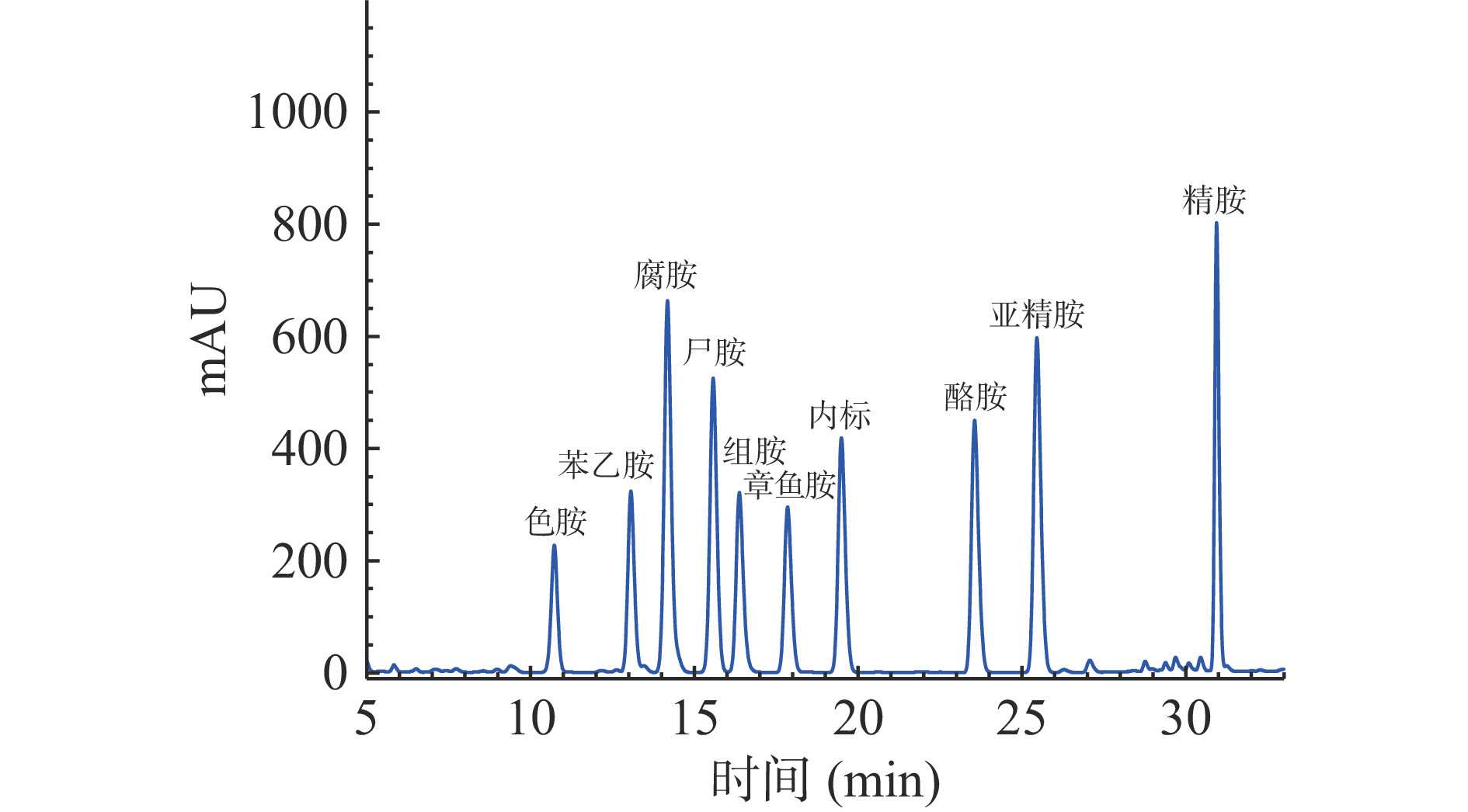
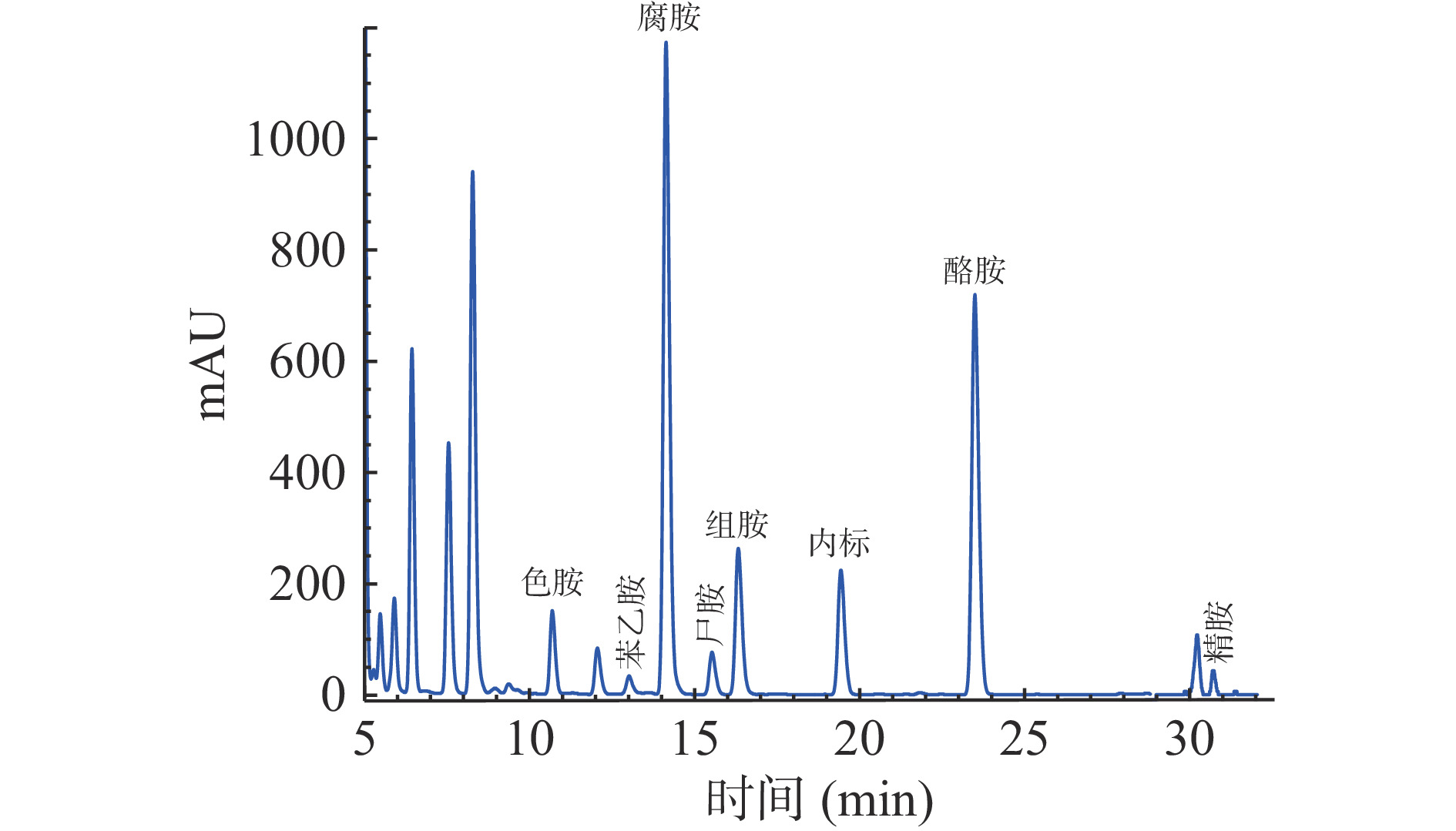
由图1~图2可以看出,标准品和样品中的9种生物胺和内标在32 min内得到较好分离,各生物胺的回归方程及相关系数如表3所示。结果表明,9种生物胺标准品,在1.0~50.0 mg/L范围内线性关系良好(r>0.998),说明用该方法来测定生物胺具有良好的可靠性。
表 3 生物胺的保留时间、回归方程和相关系数Table 3. Retention time, the regression equations and correlation coefficients of biogenic amines生物胺 保留时间(min) 回归方程 相关系数 色胺 10.722 Y=0.5257x+0.0016 0.9999 苯乙胺 13.057 Y=0.6156x+0.0063 0.9999 腐胺 14.176 Y=1.7395x+0.0107 0.9999 尸胺 15.569 Y=1.3790x+0.0003 0.9999 组胺 16.369 Y=0.7710x+0.0186 0.9990 章鱼胺 17.840 Y=0.7449x+0.0158 0.9998 酪胺 23.545 Y=1.0711x−0.0127 0.9998 亚精胺 25.448 Y=1.4346x+0.0008 0.9999 精胺 30.937 Y=1.3006x−0.0058 0.9999 2.1.2 腐乳样品中生物胺的含量水平
12种江西产腐乳的生物胺含量如表4所示,不同品牌的腐乳和同一品牌不同系列腐乳的生物胺含量存在显著性差异(P<0.05),这可能与添加的辅料混合物的种类、发酵菌种、储存条件、加工工艺条件和加工环境有关[17-18]。样品中共检测到7种生物胺,其中色胺、腐胺、组胺和酪胺是主要生物胺,所有样品中均检测到腐胺和酪胺,且这2种生物胺平均含量较高,此结果与刘振锋[19]的研究相符。12种腐乳中均未检测到章鱼胺和亚精胺。本次调查的腐乳样品中总生物胺含量范围为68.5~1084.0 mg/kg,其中2A、3A和12E 3个样品总生物胺含量均超过1000 mg/kg。文献[20-21]报道食品中的总生物胺含量超过1000 mg/kg对健康有风险,其中,毒性最大的组胺,在食品中允许的最大含量为50~100 mg/kg[22],当组胺摄入量为8~40、40~100和高于100 mg时分别可能引起轻度、中度和重度中毒[23]。此次调查中1、11E和12E 3个样品组胺含量均超过90 mg/kg,接近100 mg/kg的限值。食用发酵豆制品的国家主要集中在亚洲,然而亚洲各国对发酵豆制品中的生物胺含量没有统一的标准。因此,了解发酵豆制品中的生物胺含量能够规范发酵豆制品市场,提高发酵豆制品的安全性,为制定其相应的生物胺标准提供数据依据。
表 4 腐乳样品中生物胺含量 (mg/kg)Table 4. Contents of biogenic amines in sufu samples (mg/kg)编号 色胺 苯乙胺 腐胺 尸胺 组胺 章鱼胺 酪胺 亚精胺 精胺 总生物胺 1 66.7±1.7g 15.1±1.1ef 181.8±4.7i 14.6±0.8d 99.8±3.7a ND 208.4±3.7f ND ND 586.8±10.0f 2A 160.2±1.3a 42.3±1.7b 370.2±10.4d 5.7±0.7e 78.0±1.2d ND 431.7±11.7a ND ND 1084.0±22.8a 3A 89.3±2.9f 23.5±1.4d 411.5±8.4b 7.6±1.3e 71.1±1.6e ND 414.4±4.2b ND ND 1013.6±8.4b 4B 152.3±2.1b 35.8±3.4c 326.7±9.8f 5.1±0.6e 82.9±2.9c ND 192.5±3.2g ND ND 797.1±20.9d 5B 110.6±4.6d 13.7±1.9f 353.8±9.3e 18.5±1.7c 85.4±2.5c ND 385.7±6.9c ND ND 967.9±11.3c 6C ND ND 33.4±2.5j 24.8±2.2b ND ND 10.3±0.9k ND ND 68.5±5.6i 7C ND 6.4±0.9g 446.4±12.1a 41.4±2.5a 37.5±1.7g ND 50.2±2.0i ND 12.9±1.5 595.9±13.0f 8D 105.1±3.5e 25.3±2.2d 316.9±6.8f 6.0±0.6e 37.6±1.5g ND 343.4±9.7d ND ND 824.5±17.2d 9D 59.1±4.3h 18.0±2.3e 279.0±13.5g 7.2±1.4e 43.7±1.7f ND 328.3±8.4e ND ND 735.6±14.8e 10 ND ND 12.5±1.4k ND ND ND 119.4±2.3h ND ND 131.7±4.4h 11E 118.2±4.8c 45.8±2.7a 220.1±9.8h 40.2±2.1a 90.5±2.8b ND 26.7±1.9j ND ND 534.4±20.3g 12E 84.8±4.4f 23.2±1.1d 387.1±8.0c 14.8±1.7d 94.5±4.5b ND 421.7±21.8ab ND ND 1022.5±35.7b 注:ND表示未检出;同列的不同小写字母表示有显著性差异,P<0.05;表5同。 2.2 腐乳中产胺菌的分离鉴定
2.2.1 产胺菌的分离纯化
生物胺初筛培养基原理是基于培养基中含有多种氨基酸前体和溴甲酚紫显色剂,如果细菌能够将这些前体氨基酸脱羧即可生成碱性生物胺,而溴甲酚紫在碱性环境下显紫色,根据颜色变化即可分离出疑似生物胺产生菌[24]。挑取蓝紫色菌落划线接种于TSA培养基上纯化培养,从4种(2A、3A、5B、12E)生物胺含量较高的腐乳中初步分离筛选到12株单菌落。
2.2.2 产胺菌产胺能力的液相测定结果
经高效液相色谱确认,12株菌中有3株不产生物胺,其余9株产胺菌编号为F1~F9,其产胺情况如表5所示。每株菌能产2~3种生物胺,F2、F3、F5、F6、F8和F9的产胺能力较强,总生物胺含量范围为93.8~369.2 mg/L。其中,F2产苯乙胺、腐胺和酪胺能力最强,分别80.1、66.4和222.7 mg/L;F5、F8和F9均产色胺、腐胺和组胺,生物胺总量无显著差异(P>0.05);F6的色胺产生能力最强,为85.3 mg/L。虽然生物胺的积累可能与不同种的微生物有关,但也有研究报道相较于微生物的种类来说,其细菌菌株本身对于生物胺的形成有更大的影响,这可能是由于不同菌株的产氨基酸脱羧酶能力不同[25]。
表 5 菌株的生物胺生成情况 (mg/L)Table 5. Biogenic amine contents produced by strains (mg/L)编号 色胺 苯乙胺 腐胺 尸胺 组胺 章鱼胺 酪胺 亚精胺 精胺 总生物胺 F1-3A 3.8±0.6c ND 17.8±0.8d ND ND ND ND ND ND 21.5±0.6f F2-2A ND 80.1±2.1a 66.4±2.2a ND ND ND 222.7±5.1a ND ND 369.2±8.8a F3-2A ND 28.5±0.9c ND ND 37.9±1.7c ND 177.8±2.9b ND ND 244.1±2.9b F4-5B 3.3±0.6c ND 23.0±1.5bc ND ND ND ND ND ND 26.3±2.0ef F5-12E 25.8±1.7b ND 20.6±1.3d ND 47.3±1.1b ND ND ND ND 93.8±1.5d F6-12E 85.3±3.9a 56.8±2.9b ND ND ND ND 14.6±0.7c ND ND 156.7±7.5c F7-3A 6.1±0.6c ND 10.6±1.3e ND ND ND 14.1±0.9c ND ND 30.8±1.8e F8-3A 23.8±1.0b ND 24.2±0.4b ND 48.0±2.0b ND ND ND ND 96.0±1.0d F9-5B 23.1±2.0b ND 21.1±1.4cd ND 54.3±1.8a ND ND ND ND 98.5±3.4d 注:编号中“−”后面的序号表示来源于哪种腐乳;表6~表7同。 2.2.3 产胺菌的形态学鉴定
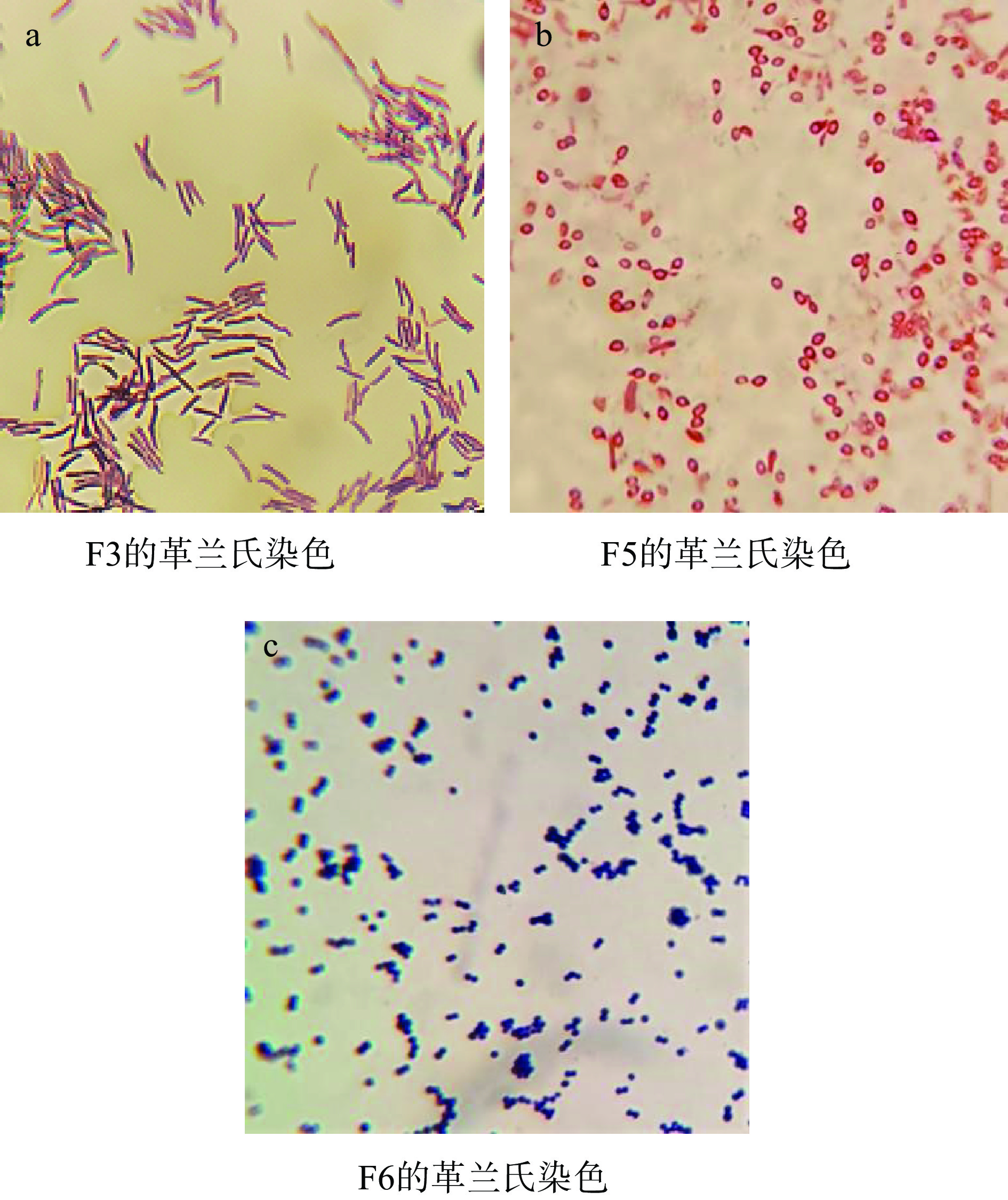
选择产胺量较高的6株菌,观察在TSA平板上的形态并进行革兰氏染色,结果如表6所示,结果表明,F3是革兰氏阳性杆菌、F6是革兰氏阳性葡萄球菌,其余都是革兰氏阳性芽孢杆菌。对革兰氏阳性杆菌、革兰氏阳性葡萄球菌、革兰氏阳性芽孢杆菌进行显微镜下观察菌落特征,结果如图3所示,从图3可以看出,革兰氏阳性杆菌呈正圆柱形,菌体大多平直,亦有稍弯曲的,排列分散存在,无一定排列形式,偶有成对或链状。革兰氏阳性芽孢杆菌呈圆形或卵圆形,单生或形成短链,有的直径大于菌体,使菌体膨大呈梭状,革兰氏阳性葡萄球菌形态为圆形,排列成葡萄串状。
表 6 菌株的形态学鉴定Table 6. Morphological identification of strains编号 TSA平板菌落形态 革兰氏染色结果 F2-2A 乳白色,近圆形,表面平坦,有光泽 革兰氏阳性芽孢杆菌 F3-2A 乳白色,近圆形,略隆起,边缘整齐 革兰氏阳性杆菌 F5-12E 微黄色,不规则,表面干燥有褶皱,边缘略不整齐 革兰氏阳性芽孢杆菌 F6-12E 乳白色,圆形,表面光泽湿润,边缘整齐 革兰氏阳性葡萄球菌 F8-3A 微黄色,不规则,表面干燥有褶皱,边缘略不整齐 革兰氏阳性芽孢杆菌 F9-5B 微黄色,不规则,表面干燥有褶皱,边缘略不整齐 革兰氏阳性芽孢杆菌 2.2.4 产胺菌的分子生物学鉴定
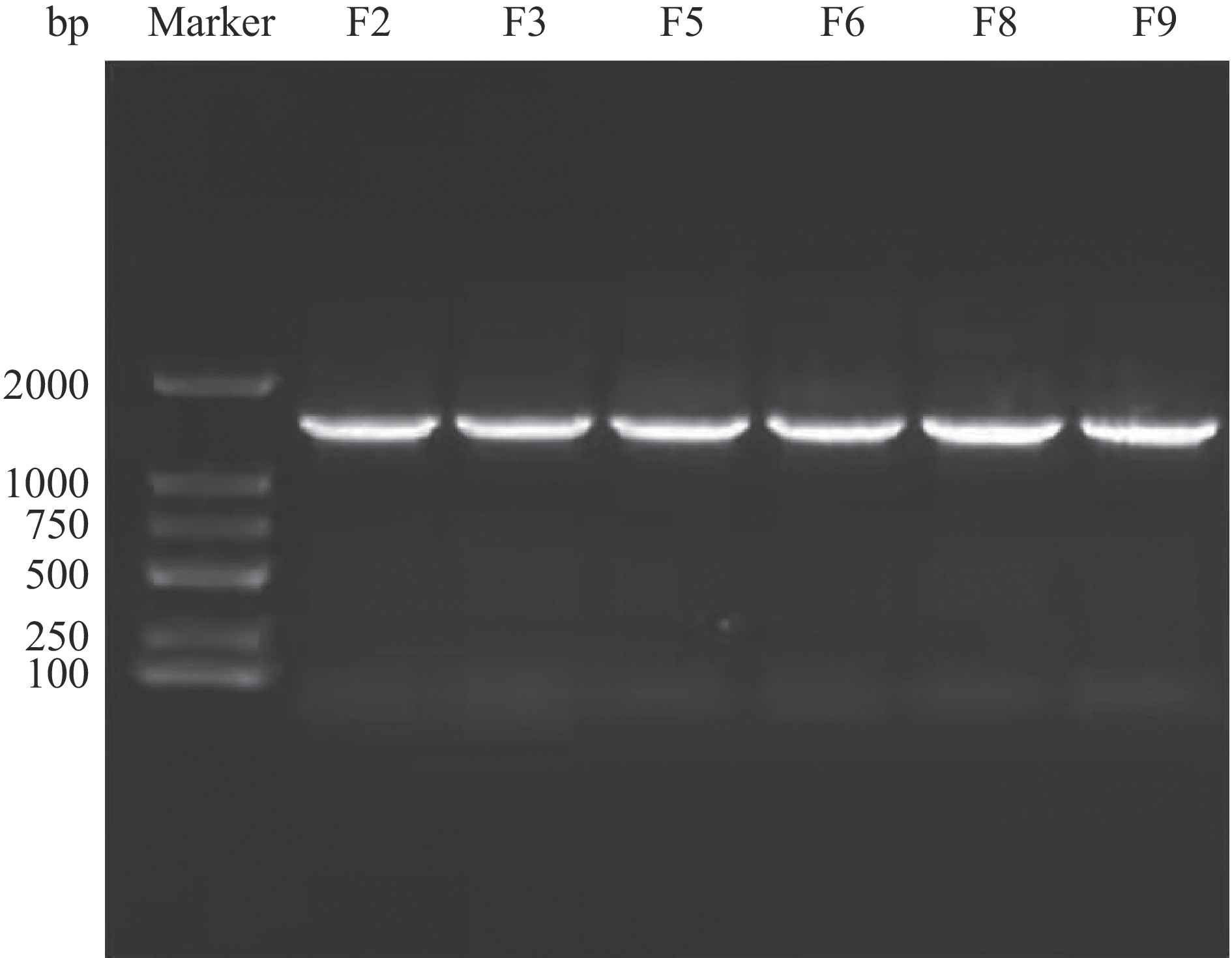
对6株高产生物胺菌株进行16S rDNA序列测定,PCR产物电泳图谱如图4所示,在1400 bp左右出现了清晰明亮的扩增条带,说明PCR扩增成功。
将上述的测序结果在NCBI-Blast数据库比对,其结果如表7所示。
表 7 16S rDNA 序列 Blast 比对Table 7. Blast analysis of 16S rDNA sequences菌株编号 鉴定结果 匹配度(%) F2-2A 耐热芽孢杆菌(Bacillus sporothermodurans) 97.57 F3-2A 鲁梅利杆菌(Rummeliibacillus stabekisii) 99.65 F5-12E 耐硼赖氨酸芽孢杆菌(Lysinacillus boronitolerans) 99.24 F6-12E 皮脂葡萄球菌(Staphylococcus piscifermentans) 99.72 F8-3A 耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans) 97.07 F9-5B 耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans) 99.24 胡鹏[26]介绍食品中生物胺的主要制造者是食品中的微生物,主要有芽孢杆菌属(Bacillus)、梭状芽孢杆菌属(Clostridium)、克雷白氏杆菌属(Klebsiella Trevisan)、变形杆菌属(Proteus)、沙门氏菌属(Salmonella)、假单胞菌属(Pseudomonas)、乳酸杆菌属(Lactobacillus)、链球菌属(Streptococcus)、微球菌属(Micrococcus cohn)等。本实验得到的6株高产生物胺菌株中有4株为芽孢杆菌属,其中F5、F8和F9同为耐硼赖氨酸芽孢杆菌,且分别来自不同品牌腐乳,其产胺种类和产胺能力相近,鲁梅利杆菌和皮脂葡萄球菌的产胺特性还鲜有报道。研究表明,原料中产生物胺微生物的种类和数量与其产品中生物胺含量密切相关[27],可通过调节温度、盐度及pH,抑制菌株生长活性,减少氨基酸脱羧酶表达,降低生物胺含量[28-29]。对于本实验分离鉴定出的产胺菌,明确影响其生长及产生物胺能力的理化因素,采取针对性措施降低腐乳中生物胺含量,是后续研究的方向。
传统发酵豆制品发酵过程中虽然有优势菌群起主导作用,但由于自然发酵、特殊的多工序、开放式或半开放式生产方式,实际上传统发酵豆制品生产是一个多菌种混菌发酵过程,微生物主要来自于曲种和环境[30]。腐乳中丰富的游离氨基酸和多菌种混菌发酵过程决定其高水平生物胺含量。可通过对加工过程制定良好操作规范,减少环境微生物,改进加工工艺,抑制产胺菌的活性来控制生物胺的产生,提高产品质量和食用安全性。
3. 结论
本研究的江西产腐乳样品中检测的生物胺含量范围为68.5~1084.0 mg/kg,其中2A、3A和12E 3个样品生物胺含量超过建议的1000 mg/kg限值。共检测出7种生物胺,所有腐乳样品腐胺和酪胺平均含量最高,不同品牌的腐乳和同一品牌不同系列的腐乳其生物胺含量存在显著性差异(P<0.05)。运用生物胺显色培养基初筛、高效液相色谱确认结合16S rDNA测序技术分离鉴定出6株高产生物胺的菌株,耐热芽孢杆菌(Bacillus sporothermodurans)1株,鲁梅利杆菌(Rummeliibacillus stabekisii)1株,耐硼赖氨酸芽孢杆菌(Lysinacillus boronitolerans)3株和皮脂葡萄球菌(Staphylococcus piscifermentans)1株。本研究为发酵豆制品中生物胺限量标准的制定以及进一步探清如何抑制腐乳中产胺菌的活性提供了理论研究基础。
-
表 1 样品信息
Table 1 Sample information
编号 名称 产地 配料 1 豆腐乳 江西南昌 黄豆、辣椒、植物油、味精、食用盐、白酒、白砂糖、香辛料、食品添加剂:硫酸钠、脱氢乙酸钠 2A 茶油腐乳香辣味 江西吉安 水、黄豆、茶油、食用植物油、食用盐、辣椒粉、香辛料 3A 农家腐乳猛辣型 江西吉安 水、黄豆、植物油、食用盐、辣椒粉、香辛料 4B 红油腐乳香辣味 江西吉安 水、大豆、菜籽油、食用盐、白酒、辣椒、八角、食品添加剂:谷氨酸钠 5B 白腐乳原味 江西吉安 水、大豆、食用盐、白酒、食品添加剂:脱氢乙酸钠 6C 香辣腐乳 江西南昌 黄豆、植物油、辣椒、食盐、酒、香辛料 7C 茶油腐乳 江西南昌 黄豆、菜籽精炼油、山茶油、辣椒、食盐、酒、香辛料 8D 家乡豆腐乳 江西南昌 黄豆、水、食用大豆油、麻油、食用碘盐、辣椒、白酒、生姜、味精、香辛料 9D 豆腐乳家乡味 江西南昌 黄豆、水、食用大豆油、食用碘盐、辣椒、白酒、生姜、味精、香辛料 10 山茶油腐乳 江西吉安 黄豆、饮用水、山茶油、辣椒、食用盐、白酒、香辛料 11E 红油腐乳王 江西吉安 水、大豆、菜籽油、食用盐、辣椒、白酒、香辛料、味精 12E 茶油腐乳香辣味 江西吉安 水、大豆、菜籽油、山茶油、食用盐、辣椒、白酒、香辛料、味精 注:编号中的相同大写字母表示同一品牌不同系列样品;表4~表7同。 表 2 梯度洗脱程序
Table 2 Gradient elution procedures
时间(min) 0 22 25 32 32.01 34 流动相A(%) 58 78 90 90 58 58 流动相B(%) 42 22 10 10 42 42 表 3 生物胺的保留时间、回归方程和相关系数
Table 3 Retention time, the regression equations and correlation coefficients of biogenic amines
生物胺 保留时间(min) 回归方程 相关系数 色胺 10.722 Y=0.5257x+0.0016 0.9999 苯乙胺 13.057 Y=0.6156x+0.0063 0.9999 腐胺 14.176 Y=1.7395x+0.0107 0.9999 尸胺 15.569 Y=1.3790x+0.0003 0.9999 组胺 16.369 Y=0.7710x+0.0186 0.9990 章鱼胺 17.840 Y=0.7449x+0.0158 0.9998 酪胺 23.545 Y=1.0711x−0.0127 0.9998 亚精胺 25.448 Y=1.4346x+0.0008 0.9999 精胺 30.937 Y=1.3006x−0.0058 0.9999 表 4 腐乳样品中生物胺含量 (mg/kg)
Table 4 Contents of biogenic amines in sufu samples (mg/kg)
编号 色胺 苯乙胺 腐胺 尸胺 组胺 章鱼胺 酪胺 亚精胺 精胺 总生物胺 1 66.7±1.7g 15.1±1.1ef 181.8±4.7i 14.6±0.8d 99.8±3.7a ND 208.4±3.7f ND ND 586.8±10.0f 2A 160.2±1.3a 42.3±1.7b 370.2±10.4d 5.7±0.7e 78.0±1.2d ND 431.7±11.7a ND ND 1084.0±22.8a 3A 89.3±2.9f 23.5±1.4d 411.5±8.4b 7.6±1.3e 71.1±1.6e ND 414.4±4.2b ND ND 1013.6±8.4b 4B 152.3±2.1b 35.8±3.4c 326.7±9.8f 5.1±0.6e 82.9±2.9c ND 192.5±3.2g ND ND 797.1±20.9d 5B 110.6±4.6d 13.7±1.9f 353.8±9.3e 18.5±1.7c 85.4±2.5c ND 385.7±6.9c ND ND 967.9±11.3c 6C ND ND 33.4±2.5j 24.8±2.2b ND ND 10.3±0.9k ND ND 68.5±5.6i 7C ND 6.4±0.9g 446.4±12.1a 41.4±2.5a 37.5±1.7g ND 50.2±2.0i ND 12.9±1.5 595.9±13.0f 8D 105.1±3.5e 25.3±2.2d 316.9±6.8f 6.0±0.6e 37.6±1.5g ND 343.4±9.7d ND ND 824.5±17.2d 9D 59.1±4.3h 18.0±2.3e 279.0±13.5g 7.2±1.4e 43.7±1.7f ND 328.3±8.4e ND ND 735.6±14.8e 10 ND ND 12.5±1.4k ND ND ND 119.4±2.3h ND ND 131.7±4.4h 11E 118.2±4.8c 45.8±2.7a 220.1±9.8h 40.2±2.1a 90.5±2.8b ND 26.7±1.9j ND ND 534.4±20.3g 12E 84.8±4.4f 23.2±1.1d 387.1±8.0c 14.8±1.7d 94.5±4.5b ND 421.7±21.8ab ND ND 1022.5±35.7b 注:ND表示未检出;同列的不同小写字母表示有显著性差异,P<0.05;表5同。 表 5 菌株的生物胺生成情况 (mg/L)
Table 5 Biogenic amine contents produced by strains (mg/L)
编号 色胺 苯乙胺 腐胺 尸胺 组胺 章鱼胺 酪胺 亚精胺 精胺 总生物胺 F1-3A 3.8±0.6c ND 17.8±0.8d ND ND ND ND ND ND 21.5±0.6f F2-2A ND 80.1±2.1a 66.4±2.2a ND ND ND 222.7±5.1a ND ND 369.2±8.8a F3-2A ND 28.5±0.9c ND ND 37.9±1.7c ND 177.8±2.9b ND ND 244.1±2.9b F4-5B 3.3±0.6c ND 23.0±1.5bc ND ND ND ND ND ND 26.3±2.0ef F5-12E 25.8±1.7b ND 20.6±1.3d ND 47.3±1.1b ND ND ND ND 93.8±1.5d F6-12E 85.3±3.9a 56.8±2.9b ND ND ND ND 14.6±0.7c ND ND 156.7±7.5c F7-3A 6.1±0.6c ND 10.6±1.3e ND ND ND 14.1±0.9c ND ND 30.8±1.8e F8-3A 23.8±1.0b ND 24.2±0.4b ND 48.0±2.0b ND ND ND ND 96.0±1.0d F9-5B 23.1±2.0b ND 21.1±1.4cd ND 54.3±1.8a ND ND ND ND 98.5±3.4d 注:编号中“−”后面的序号表示来源于哪种腐乳;表6~表7同。 表 6 菌株的形态学鉴定
Table 6 Morphological identification of strains
编号 TSA平板菌落形态 革兰氏染色结果 F2-2A 乳白色,近圆形,表面平坦,有光泽 革兰氏阳性芽孢杆菌 F3-2A 乳白色,近圆形,略隆起,边缘整齐 革兰氏阳性杆菌 F5-12E 微黄色,不规则,表面干燥有褶皱,边缘略不整齐 革兰氏阳性芽孢杆菌 F6-12E 乳白色,圆形,表面光泽湿润,边缘整齐 革兰氏阳性葡萄球菌 F8-3A 微黄色,不规则,表面干燥有褶皱,边缘略不整齐 革兰氏阳性芽孢杆菌 F9-5B 微黄色,不规则,表面干燥有褶皱,边缘略不整齐 革兰氏阳性芽孢杆菌 表 7 16S rDNA 序列 Blast 比对
Table 7 Blast analysis of 16S rDNA sequences
菌株编号 鉴定结果 匹配度(%) F2-2A 耐热芽孢杆菌(Bacillus sporothermodurans) 97.57 F3-2A 鲁梅利杆菌(Rummeliibacillus stabekisii) 99.65 F5-12E 耐硼赖氨酸芽孢杆菌(Lysinacillus boronitolerans) 99.24 F6-12E 皮脂葡萄球菌(Staphylococcus piscifermentans) 99.72 F8-3A 耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans) 97.07 F9-5B 耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans) 99.24 -
[1] 凃婧, 李笑梅. 腐乳相关研究及开发进展[J]. 大豆科技,2016(4):39−44. [TU J, LI X M. Related research and development progress in fermented bean curd[J]. Soybean Science & Technoloyg,2016(4):39−44. doi: 10.3969/j.issn.1674-3547.2016.04.013 TU J, LI X M. Related research and development progress in fermented bean curd[J]. Soybean Science & Technoloyg, 2016(4): 39-44. doi: 10.3969/j.issn.1674-3547.2016.04.013
[2] SHAO Y, WANG L, CHEN C S, et al. Antioxidant capacity of fermented soybeans and their protective effect on protein oxidation in largemouth bass (Micropterus salmoides) during repeated freezing-thawing (FT) treatments[J]. Lwt-Food Science and Technology,2018,91(5):213−221.
[3] SANJUKTA S, RAI A K. Production of bioactive peptides during soybean fermentation and their potential health benefits[J]. Trends in Food Science & Technology,2016,50:1−10.
[4] KUNG H F, LEE Y H, CHANG S C, et al. Histamine contents and histamine-forming bacteria in sufu products in Taiwan[J]. Food Control,2007,18(5):381−386. doi: 10.1016/j.foodcont.2006.02.012
[5] PARK Y K, LEE J H, MAH J H. Occurrence and reduction of biogenic amines in traditional Asian fermented soybean foods: A review[J]. Food Chemistry,2019,278:1−9. doi: 10.1016/j.foodchem.2018.11.045
[6] LIU K F, KUO H W, CHANG C C, et al. The intracellular signaling pathway of octopamine upregulating immune resistance functions in Penaeus monodon[J]. Fish & Shellfish Immunology,2019,92(67):188−195.
[7] FATIH Ö, HAMED I. The importance of lactic acid bacteria for the prevention of bacterial growth and their biogenic amines formation: A review[J]. Critical Reviews in Food Science and Nutrition,2018,58(10):1660−1670. doi: 10.1080/10408398.2016.1277972
[8] BODMER S, IMARK C, KNEUBUHL M. Biogenic amines in foods: Histamine and food processing[J]. Inflammation Research,1999,48(6):296−300. doi: 10.1007/s000110050463
[9] YANG B, TAN Y, KAN J Q. Regulation of quality and biogenic amine production during sufu fermentation by pure Mucor strains[J]. LWT-Food Science Technology,2020,117:108637. doi: 10.1016/j.lwt.2019.108637
[10] SANG X, MA X X, HAO H S, et al. Evaluation of biogenic amines and microbial composition in the Chinese traditional fermented food grasshopper sub shrimp paste[J]. LWT,2020,134(12):134−141.
[11] TEN B B, DAMINK C, JOOSTEN H M, et al. Occurrence and formation of biologically active amines in foods[J]. International Journal of Food Microbiology,1990,11(1):73−84. doi: 10.1016/0168-1605(90)90040-C
[12] 李大伟, 李丹丹, 梁静静, 等. 高效液相色谱法测定市售腐乳中生物胺的含量[J]. 食品研究与开发,2018(16):120−124,129. [LI D W, LI D D, LIANG J J, et al. Determination of biogenic amines in commercially sufu by high performance liquid chromatography[J]. Food Research and Development,2018(16):120−124,129. doi: 10.3969/j.issn.1005-6521.2018.16.022 LI D W, LI D D, LIANG J J, et al. Determination of biogenic amines in commercially sufu by high performance liquid chromatography[J]. Food Research and Development, 2018(16): 120-124, 129. doi: 10.3969/j.issn.1005-6521.2018.16.022
[13] QIU S, WANG Y, CHENG Y Q, et al. Reduction of biogenic amines in sufu by ethanol addition during ripening stage[J]. Food Chem,2018,239:1244−1252. doi: 10.1016/j.foodchem.2017.07.056
[14] 朱晓娟. 黄酒酒曲中生物胺产生菌的分离鉴定和分子检测[D]. 天津: 天津科技大学, 2018. ZHU X J. Isolation, indentification and molecule detection biogenic amines producing bacteria of rice wine QU [D]. Tianjin: Tianjin University of Science & Technology, 2018.
[15] 郝淑贤, 魏涯, 周婉君, 等. 鲭鱼生物胺生成菌的分离与鉴定[J]. 食品科学,2015,36(7):97−100. [HAO S X, WEI Y, ZHOU W J, et al. Isolation and identification of biogenic amine-producing bacteria in mackerel[J]. Food Science,2015,36(7):97−100. doi: 10.7506/spkx1002-6630-201507018 HAO S X, WEI Y, ZHOU W J, et al. Isolation and identification of biogenic amine-producing bacteria in mackerel [J]. Food Science, 2015, 36(7): 97-100. doi: 10.7506/spkx1002-6630-201507018
[16] 张凤杰, 王德良, 薛洁, 等. 黄酒酿造过程中优势细菌产生物胺的检测与评价[J]. 酿酒科技,2016(4):17−20,24. [ZHANG F J, WANG D L, XUE J, et al. Detection of biogenic amines produced by predominant bacteria in yellow rice wine brewing process[J]. Liquor-Making Science & Technology,2016(4):17−20,24. ZHANG F J, WANG D L, XUE J, et al. Detection of biogenic amines produced by predominant bacteria in yellow rice wine brewing process[J]. Liquor-Making Science & Technology, 2016 (4): 17-20, 24.
[17] RAFFAELLA P, SIMONE V, GIULIANA V. Biogenic amine pro-files and antioxidant properties of Italian red wines from different price categories[J]. Journal of Food Composition and Analysis,2016,46:7−14. doi: 10.1016/j.jfca.2015.09.014
[18] JING S G, TONG J L, FAI Z A, et al. Biogenic amines content and assessment of bacterial and fungal diversity in stinky tofu –A traditional fermented soy curd[J]. LWT-Food Science and Technology,2018,88:26−34. doi: 10.1016/j.lwt.2017.08.085
[19] 刘振锋. 腐乳和臭干中生物胺的研究[D]. 杭州: 浙江大学, 2011. LIU Z F. Studies on biogenic amines in fermented soybean products: Sufu (Furu) and stinky tofu (Chougan)[D]. Zhejiang: Zhejiang University, 2011.
[20] SANTOS M H S. Biogenic amines: Their importance in foods[J]. International Journal of Food Microbiology,1996,29(2-3):213−231. doi: 10.1016/0168-1605(95)00032-1
[21] ORDÓEZ J L, TRONCOSO A M, GARCÍA-PARRILLA M D C, et al. Recent trends in the determination of biogenic amines in fermented beverages-a review[J]. Analytica Chimica Acta,2016,939(10):10−25.
[22] 涂婷. 腐乳中生物胺调查及生产过程中变化研究[D]. 长沙: 湖南农业大学, 2013. TU T. Research on biogenic amines in fermented tofu and their variation during production procedure[D]. Changsha: Hunan Agricultural University, 2013.
[23] MAIJALA R, EEROLA S. Contaminant lactic acid bacteria of drysausages produce histamine and tyramine[J]. Meat Science,1993,35(3):387−395. doi: 10.1016/0309-1740(93)90043-H
[24] 宁伟杰, 曹传波. 酸碱指示剂在氨氮在线测量中的应用研究[J]. 分析仪器,2017(6):145−148. [NING W J, CAO C B. Research and application of acid-base indicator in online measurement of ammonia nitrogen[J]. Analytical Instrumentation,2017(6):145−148. doi: 10.3969/j.issn.1001-232x.2017.06.025 NING W J, CAO C B. Research and application of acid-base indicator in online measurement of ammonia nitrogen [J]. Analytical Instrumentation, 2017(6): 145-148. doi: 10.3969/j.issn.1001-232x.2017.06.025
[25] 赵中辉. 水产品贮藏中生物胺的变化及组胺形成机制的研究[D]. 青岛: 中国海洋大学, 2011. ZHAO Z H. Studies on changes of biogenic amines during the storage and mechanism of histamine formation in seafood[D]. Qingdao: Ocean University of China, 2011.
[26] 胡鹏. 传统毛霉型豆豉发酵过程中生物胺的变化及组胺生成机理的初步研究[D]. 重庆: 西南大学, 2014. HU P. Study on the biogenic amine content of China traditional fermented Douchi and formation mechanism research of histamine[D]. Chongqing: Southwest University, 2014.
[27] FADHLAOUI- ZIDJOSÉ K, CURIEL J A, LANDETA G, et al. Biogenic amine production by bacteria isolated from ice-preserved sardine and mackerel[J]. Food Control,2012,25(1):89−95. doi: 10.1016/j.foodcont.2011.10.032
[28] 李颖畅, 曹娜娜, 韩笑, 等. 贮藏过程中阿根廷鱿鱼生物胺的变化及产胺菌的分离鉴定[J]. 中国食品学报,2021,21(4):236−245. [LI Y C, CAO N N, HAN X, et al. Changes of biogenic amines in Illexargentinus during storage and isolation and identification of amine bacteria[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(4):236−245. LI Y C, CAO N N, HAN X, et al. Changes of biogenic amines in Illexargentinus during storage and isolation and identification of amine bacteria[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21 (4): 236-245.
[29] 张黎明, 章祎, 赵云松, 等. 腌鱼中产生物胺菌株的筛选、鉴定及其特性研究[J]. 中国食品学报,2021,21(7):291−299. [ZHANG L M, ZHANG Y, ZHAO Y S, et al. Screening, identification and characteristics of biogenic amines producing strains in salted fish[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(7):291−299. ZHANG L M, ZHANG Y, ZHAO Y S, et al. Screening, identification and characteristics of biogenic amines producing strains in salted fish[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21 (7): 291-299.
[30] 樊明涛. 发酵食品工艺学[M]. 北京: 科学出版社, 2017. FAN M T. Fermented food technology[M]. Beijing: Science Press, 2017.





 下载:
下载:
 下载:
下载:
