Investigation on the Hypoglycemic Effect of Aronia melanocarpa Fruit and Its Effect on Lipid Metabolism
-
摘要: 目的:探究黑果腺肋花楸果实(Aronia melanocarpa Fruit,AMF)的降血糖活性和对脂代谢的影响。方法:采用链脲佐菌素(streptozocin,STZ)法建立II型糖尿病(type 2 diabetes mellitus,T2DM)小鼠模型。将小鼠随机分为7组:模型组、盐酸二甲双胍组(40 mg/kg·bw)、AMF总黄酮组(75、150、300 mg/kg·bw)、AMF果汁组(10 mL/kg·bw)及空白对照组。检测各组对T2DM小鼠的生理指标、饮水量、采食量、脏器指数、空腹血糖值的影响,测定血清中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、丙二醛(MDA)、超氧化物岐化酶(SOD)含量,并对小鼠肝脏和胰腺组织进行病理学观察。结果:AMF总黄酮组和果汁组均对STZ诱导的T2DM小鼠具有显著的降血糖作用(P<0.05),能降低其脏器指数和TG、TC、LDL-C、HDL-C、MDA、SOD水平(P<0.05),修复小鼠胰腺和肝脏组织,AMF总黄酮组能显著改善T2DM小鼠“三多一少”症状(P<0.05)。AMF总黄酮高剂量组的效果最佳。结论:AMF对STZ诱导的T2DM小鼠具有降血糖、降血脂、修复胰腺和肝脏损伤的功效,作用机制可能与其调节氧化应激相关。Abstract: Objective: To investigate the hypoglycemic effect of Aronia melanocarpa fruit (AMF) and its effect on lipid metabolism. Methods: Use streptozotocin (STZ) to induce the type 2 diabetes mellitus (T2DM) mouse model. The models were randomly divided into 7 groups: The model group, the metformin hydrochloride group (40 mg/kg·bw), the AMF total flavonoids groups (75, 150, 300 mg/kg·bw) and the AMF juice group (10 mL/kg·bw), and the blank control group. This study detected the effects of each group on the physiological indices, water intake, food intake, organ index and fasting blood glucose values of the T2DM mice, tested the serum levels of triglyceride (TG), total cholesterol (TC), low-density lipoprotein (LDL-C), high-density lipoprotein (HDL-C), malondialdehyde (MDA) and superoxide dismutase (SOD), and performed pathological observations on the liver and pancreas tissues of the mice. Results: All the AMF total flavonoids groups and juice group had significant hypoglycemic effects on STZ-induced T2DM mice (P<0.05), their organ index and TG, TC, LDL-C, HDL-C, MDA, SOD levels (P<0.05) were reduced, and pancreatic and liver tissues were repaired. The AMF total flavonoid group could significantly improve the symptoms called "three polys and one loss" (polyuria, polydipsia, and polyphagia and weight loss) in T2DM mice (P<0.05). The AMF total flavonoids group had the best effect at high dose. Conclusion: AMF has the efficacy of hypoglycemia, hypolipidemia and repair of pancreatic and liver damage in STZ-induced T2DM mice, and the mechanism might be related to its regulation of oxidative stress.
-
黑果腺肋花楸Aronia melanocarpa (Michx.) Elliott(AM)为蔷薇科腺肋花楸属植物,原产于北美[1-2]。20世纪90年代引入中国,2018年黑果腺肋花楸果实被国家卫生健康委员会批准为新食品原料[3-4]。黑果腺肋花楸果实(AMF)中富含多类活性成分,如黄酮类化合物、有机酸、酚类、多糖等,营养价值丰富,具有抗炎、抗菌、抗氧化及调节免疫等功效[5-9]。AMF含有的黄酮类化合物以槲皮素及衍生物为主[10]。黄酮类化合物可通过抗氧化作用,使胰岛细胞功能恢复并且可改善Ⅱ型糖尿病(T2DM)的胰岛素抵抗[11-12]。AMF果汁具有一定的降血糖作用[13-14],但关于其所含的黄酮类化合物的降血糖作用研究尚无报道。
随着我国社会经济发展,目前我国已成为世界上糖尿病发病率最高的国家,其中T2DM占糖尿病患者90%以上[15-16]。T2DM是一种以高血糖为特征的代谢性疾病,主要病因为胰岛素分泌能力减弱、氧化应激的发生等,会导致肾脏、肝脏、胰腺的损害及血脂代谢异常等多种症状。现有的降糖西药主要通过增加胰岛素敏感性、促进胰岛素分泌进行治疗,但疗效不佳且长期使用会产生胃肠道不良反应、尿路感染等副作用[17-19]。因此,开发安全性高、副作用少的新型辅助降血糖功能性食品对防治T2DM颇具意义。而AMF作为一种具有抗T2DM潜力的新食品原料[13],开发前景良好。但目前对AMF降血糖作用的研究较少,且作用机制尚不明确,因此研究AMF改善T2DM的发展的作用及其机制,对进一步开发AMF和新型降糖食品十分有意义。
通过前期网络药理学的筛选,本实验将探究AMF总黄酮的降血糖活性。考察T2DM小鼠经灌胃给药及果汁后,其生理指标、饮水量、采食量、脏器指数、空腹血糖值、血清中SOD活性、MDA含量、脂代谢指标,以及肝脏、胰腺组织的变化,探究AMF的降糖功效及其对脂代谢的影响,为开发新型降糖功能性食品提供一定的参考。
1. 材料与方法
1.1 材料与仪器
黑果腺肋花楸果实 采自黑龙江佳木斯,经鉴定为正品;氯化钠注射液 杭州民生药业有限公司;盐酸二甲双胍缓释片 山东司邦得制药有限公司;链脲佐菌素(streptozocin,STZ) 索莱宝生物科技公司;甘油三酯(triglyceride,TG)测定试剂盒(A110-1-1)、总胆固醇(total cholesterol,TC)测定试剂盒(A111-1-1)、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)测定试剂盒(A113-1-1)、高密度脂蛋白(high density lipoprotein cholesterol,HDL-C)测定试剂盒(A112-1-1)、丙二醛(malonaldehyde,MDA)测定试剂盒(A003-1-2)、超氧化物岐化酶(superoxide dismutase,SOD)测定试剂盒(A001-3-2) 南京建成生物工程研究所;SPF级昆明(KM)雄性小鼠SCXK(吉)-2018-0007 18~22 g,60只,购自长春市亿斯实验动物技术有限责任公司;正常饲料 北京科奥协力饲料有限公司;高糖高脂饲料 南京盛民科研动物养殖场。
TGL-20BRS高速冷冻离心机 上海安亭科学仪器厂;Synergy HT全自动多功能酶标仪 上海浦春计量仪器有限公司;FA2004c型电子天平 上海越平科学仪器制造有限公司;GA-3型血糖仪及血糖试纸 三诺生物传感股份有限公司。
1.2 实验方法
1.2.1 样品制备
AMF果汁:取AMF经匀浆机5000 r/min匀浆10 min,于−4 ℃保存待用。
AMF总黄酮:取AMF 3318 g,用70%乙醇于95 ℃,料液比1:38(g/mL)的条件下回流提取93 min,合并提取液,减压浓缩即得AMF总黄酮浸膏。选用D101型大孔树脂,用10%乙醇溶解浸膏配制成60 µg/mL的供试品溶液,上样吸附12 h,用70%乙醇进行洗脱,洗脱体积为3 BV,收集洗脱液,浓缩得到总黄酮粉末,采用NaNO2-Al(NO3)3-NaOH显色法[20]测定总黄酮含量为512.6 mg/g。
1.2.2 模型的建立
所有KM小鼠(18~22 g)适应性喂养7 d,培养条件为相对湿度约55%,温度22 ℃,12 h的光/暗循环。随机抽8只为空白组,正常饲料喂养,其余小鼠分为6笼,每笼8只,高糖高脂饲料喂养。4周后,小鼠禁食不禁水12 h后腹腔注射70 mg/kg·bw STZ(用pH4.3柠檬酸-柠檬酸钠缓冲溶液冰浴配制)诱导T2DM模型。空白组注射等体积的柠檬酸-柠檬酸钠缓冲溶液。3 d后,断尾取血,测定空腹血糖值≥11.1 mmol/L,证明模型建立成功[20-22]。
1.2.3 动物分组
将造模成功的小鼠随机分为6组(n=8),即T2DM模型组、阳性组(盐酸二甲双胍40 mg/kg·bw)、AMF总黄酮低、中、高剂量组(75、150、300 mg/kg·bw)以及AMF果汁组(10 mL/kg·bw)。模型组及空白组灌胃生理盐水。每日早上9点灌胃给药,给药周期为28 d。实验期间,除空白组外,其余各实验组一直喂食高糖高脂饲料直至实验结束,以排除小鼠饮食影响。末次给药后,小鼠禁食不禁水24 h,眼球取血,脱颈椎处死。眼球血置于EP管中,离心,取上清,置于−80 ℃冰箱中冷冻保存[23]。实验按照中国科学技术部动物管理条例,并经佳木斯大学实验动物伦理委员会批准(批号:SCXK-2018-0007)。
1.2.4 观察小鼠生理指标
每日观察小鼠生理状态,并每周对小鼠的体重、空腹血糖值进行测定[24]。
1.2.5 小鼠饮水量及采食量测定
给药第4周每日灌胃前测定前1 d的小鼠饮水量、采食量[25]。
小鼠饮水量(mL/d/kg)=(初始水量−剩余水量)/小鼠体重 (1) 小鼠采食量(g/d/kg)=(初始饲料重量−剩余饲料重量)/小鼠体重 (2) 1.2.6 小鼠脏器指数的测定
处死小鼠后测定其脏器指数[26]。脏器指数计算公式为:
A=W/M (3) 式中:A:脏器指数;W:脏器重量(mg);M:小鼠体重(g)。
1.2.7 血清中SOD活性、MDA含量及脂代谢指标的测定
血脂四项测定:TG、TC、HDL-C、LDL-C均按试剂盒说明书进行检测。
抗氧化指标测定:MDA和SOD均按试剂盒说明书测定。
1.2.8 小鼠肝脏和胰腺组织病理学观察
小鼠处死后取肝脏、胰腺,放入0.9%生理盐水中洗净,用滤纸吸净表面水分,再放入4%多聚甲醛固定,无水乙醇脱水处理,石蜡包埋和切片(厚度为5 μm),苏木精-伊红(hematoxylin- eosinstaining,HE)染色,于显微镜下观察组织的病理变化[27]。
1.3 数据处理
结果以平均数±标准差表示,使用SPSS 16.0分析数据,P<0.05具有显著性差异,P<0.01具有极显著差异,P>0.05无统计学意义。
2. 结果与分析
2.1 小鼠生理指标结果
造模后空白组小鼠表现正常,精神良好。模型组小鼠毛色暗淡,精神萎靡。给药4周治疗后,各组小鼠状态都有所恢复。
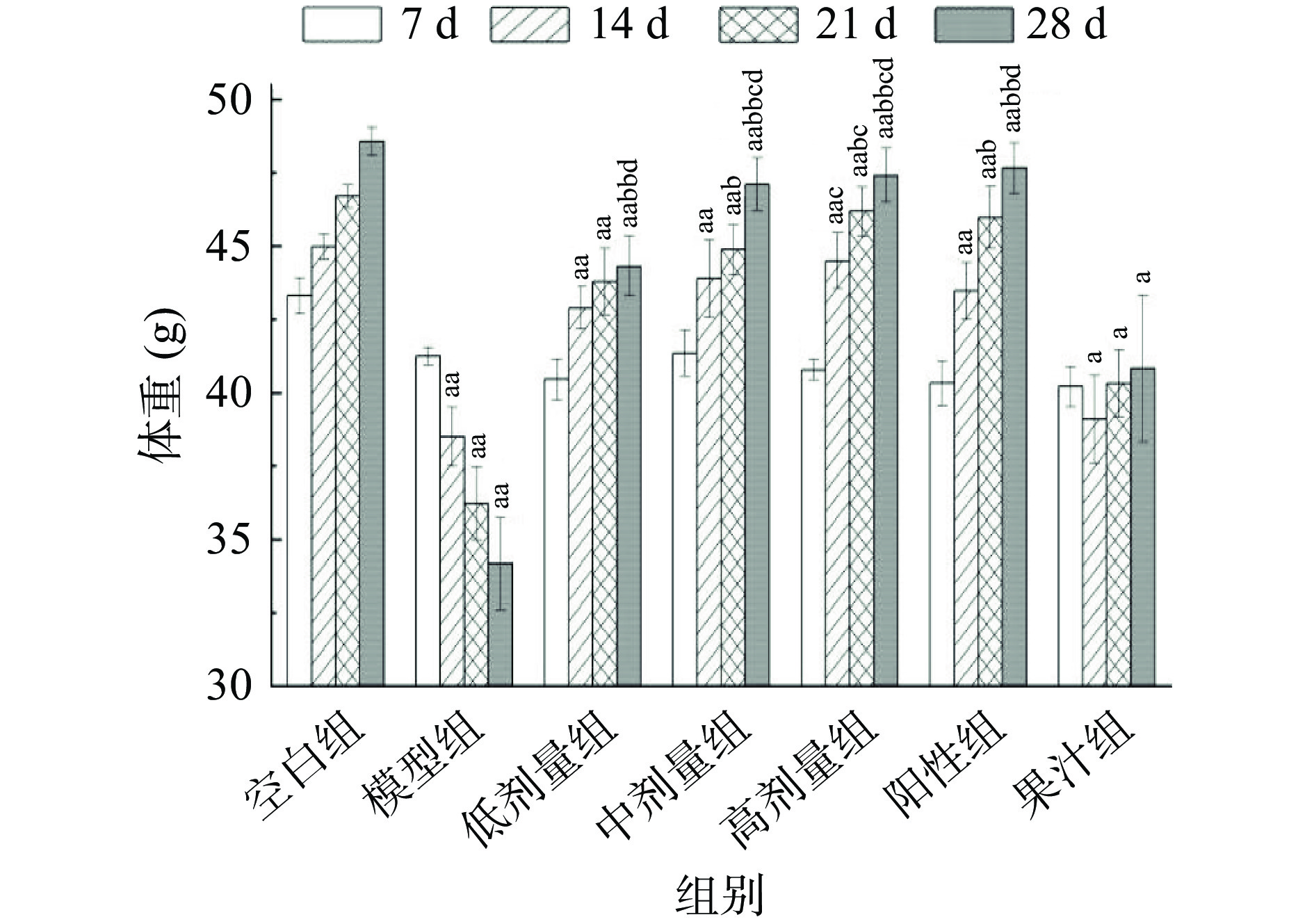
AMF对T2DM小鼠体重的影响见图1。模型组小鼠体重明显减轻(P<0.01),符合糖尿病“三多一少”的症状。给药治疗28 d后总黄酮低、中、高剂量组及果汁组的小鼠体重均较模型组显著增加(P<0.01),分别增加29.66%、37.83%、38.73%、19.46%。其中总黄酮各剂量组在28 d改善T2DM效果最好,以及果汁组体重呈先下降再上升的趋势,可能均与AMF作为功能性食品作用缓慢、起效时间长相关;高剂量组改善小鼠体重能力与阳性药无显著差异(P>0.05),优于其他各实验组。
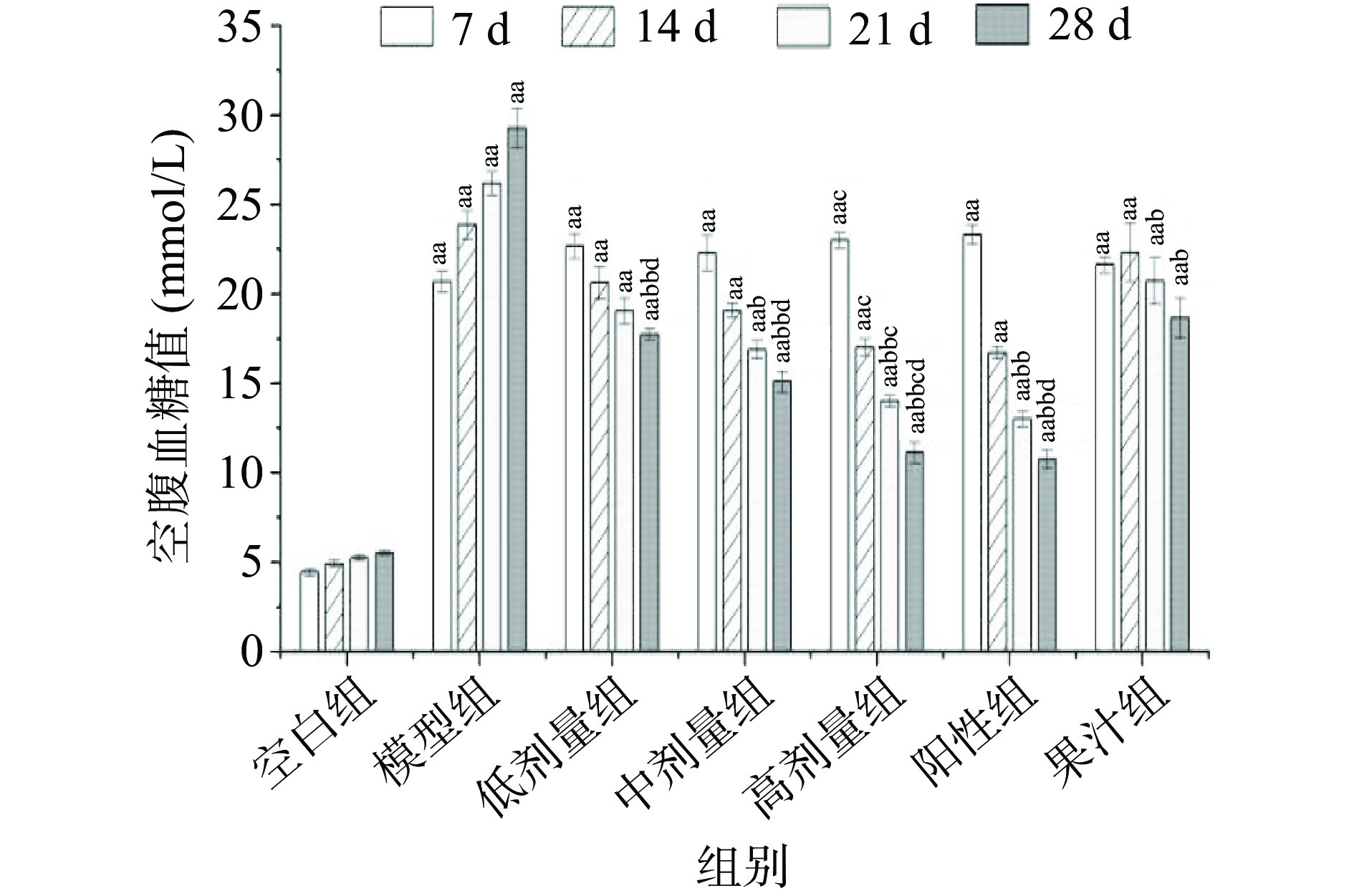
AMF对T2DM小鼠空腹血糖影响见图2。与空白组相比,造模后各组小鼠血糖明显上升(P<0.01),高于正常水平(11.1 mmol/L),并长期维持该水平,表示模型稳定。给药28 d各组小鼠T2DM症状得到明显改善,血糖值均显著或极显著下降(P<0.05或P<0.01),分别下降41.38%、48.36%、61.96%、63.26%、36.23%,其中高剂量组与阳性组血糖值差异不显著(P>0.05),表明AMF总黄酮具有良好的降血糖作用。结合Worsztynowicz等[28]的研究,AM果汁及总黄酮可能通过抑制α-glucosidase与α-Amylase活性改善血糖水平。Mu等[29]的研究也证明了AMF提取物具有一定的降血糖作用,将其结果与本研究进行比较,发现AMF总黄酮具有更好的降血糖作用。
2.2 实验组对小鼠饮水量与采食量的影响
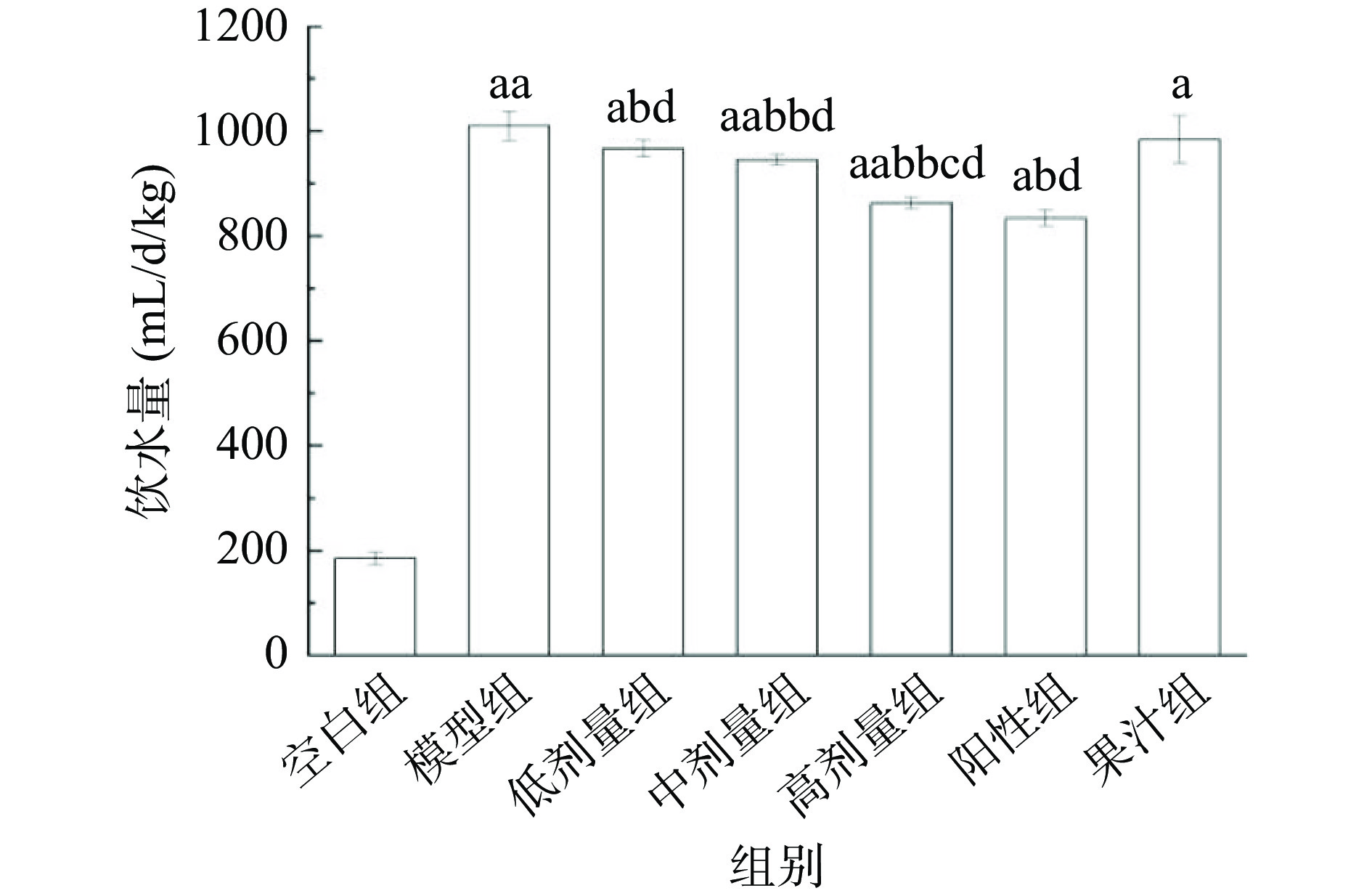
AMF对T2DM小鼠饮水量影响见图3。空白组小鼠饮水量为185.35 mL/d/kg;模型组小鼠多饮现象明显,较空白组增加了445.10%(P<0.01);与模型组相比,总黄酮各剂量组饮水量分别减少了4.32%、6.47%、14.63%(P<0.05或P<0.01);果汁组与模型组相比饮水量无统计学意义(P>0.05),可能为AMF作为功能性食品需要更长的时间起效相关;高剂量组饮水量与阳性组无统计学意义(P>0.05),表明AMF总黄酮高剂量组改善T2DM小鼠饮水能力与阳性组效果相似,能有效缓解T2DM导致的烦渴,且优于其他各组。
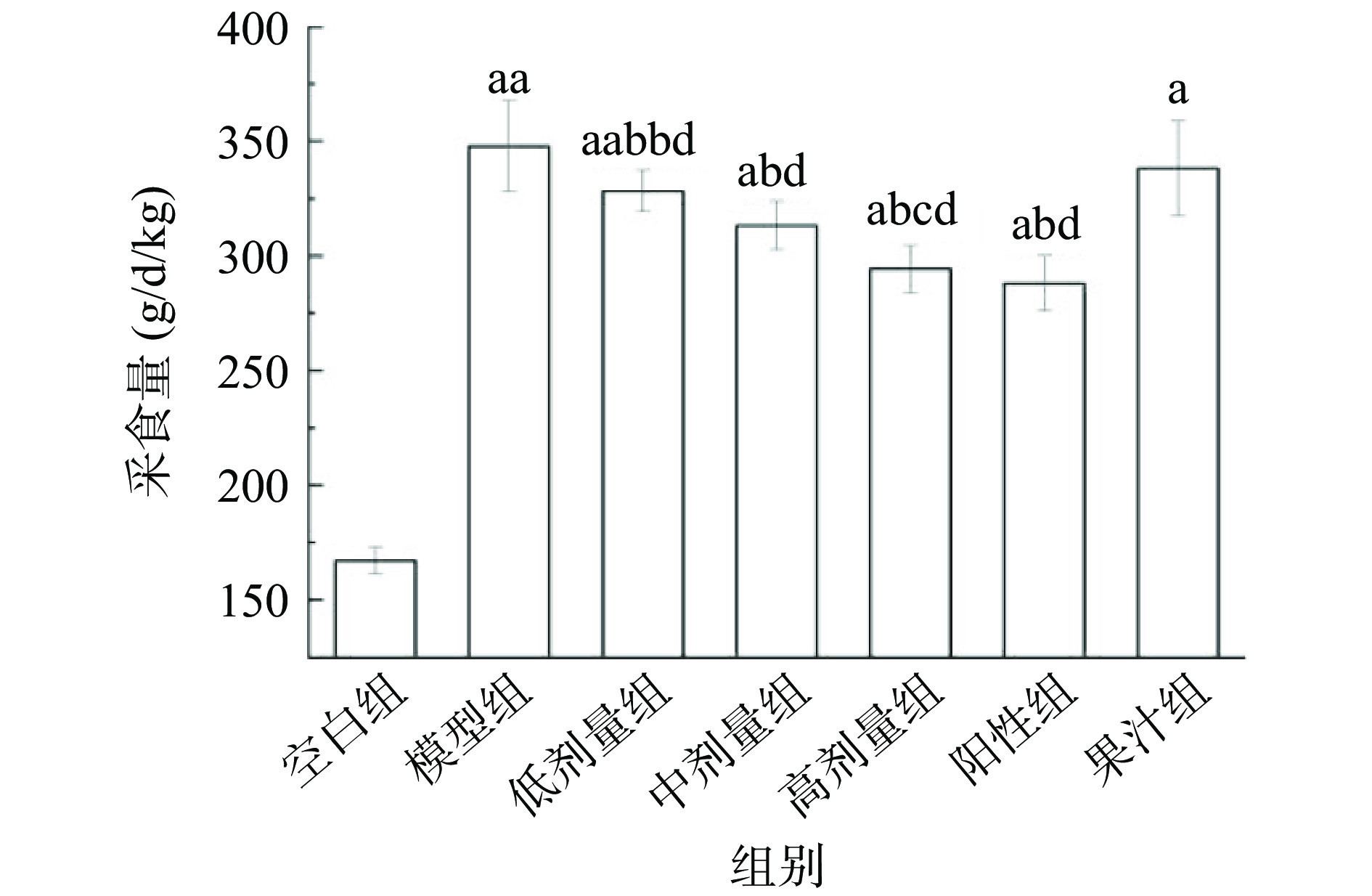
AMF对T2DM小鼠采食量影响见图4。空白组小鼠采食量为167.08 g/d/kg;模型组小鼠多食现象明显,与空白组相比增加了180.20%(P<0.01);与模型组相比,总黄酮各剂量组采食量分别减少了5.61%、9.94%、15.40%(P<0.05或P<0.01);果汁组与模型组相比采食量无统计学意义(P>0.05),改善效果不佳,可能需要给药更长时间观察效果;高剂量组采食量与阳性组无显著差异(P>0.05),表明AMF总黄酮高剂量组改善T2DM小鼠采食能力与阳性药相仿,能有效缓解T2DM导致的多食,且在各给药组中效果最佳。
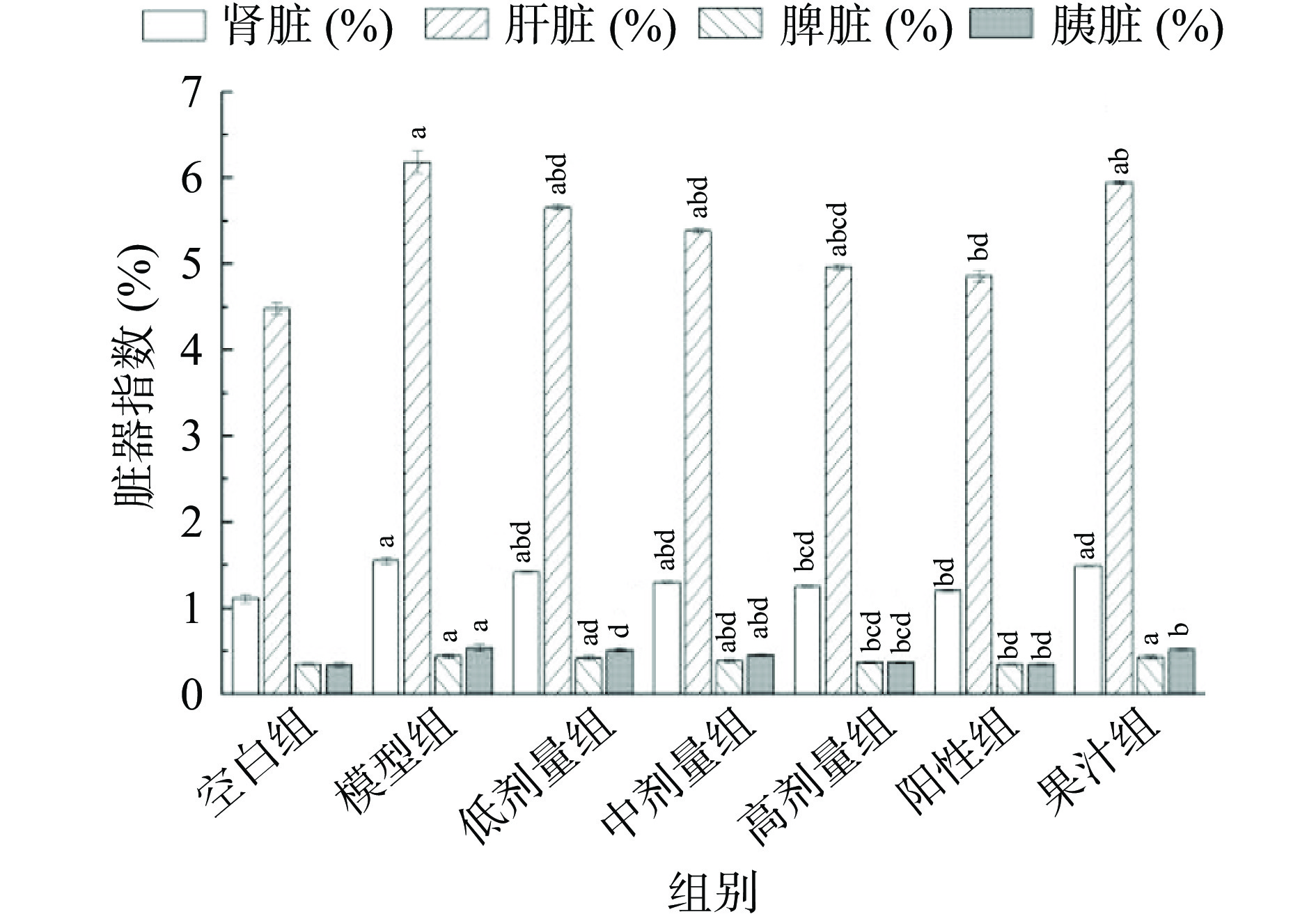
2.3 AMF对小鼠脏器指数的影响
T2DM病情发展会导致一系列并发症,而这些症状与体内器官病变密切相关,脏器指数可反应T2DM导致的脏器受损的程度。AMF对T2DM小鼠脏器指数的影响见图5。模型组小鼠的各脏器指数较空白组均显著增加(P<0.05),表明T2DM会造成小鼠脏器损伤,导致其出现肝脏肿大、肾脏水肿、脾脏及胰脏红肿,脏器指数上升。经给药后各组小鼠肝脏与肾脏指数均有恢复(P<0.05),且中、高剂量组胰脏、脾脏指数有所恢复(P<0.05)。表明AMF能在一定程度上治疗T2DM造成的脏器损伤,能改善肝脏功能促进对葡萄糖的分解,恢复脾脏功能提高T2DM小鼠免疫力,并缓解作为糖尿病并发症的肾脏、胰脏损伤。
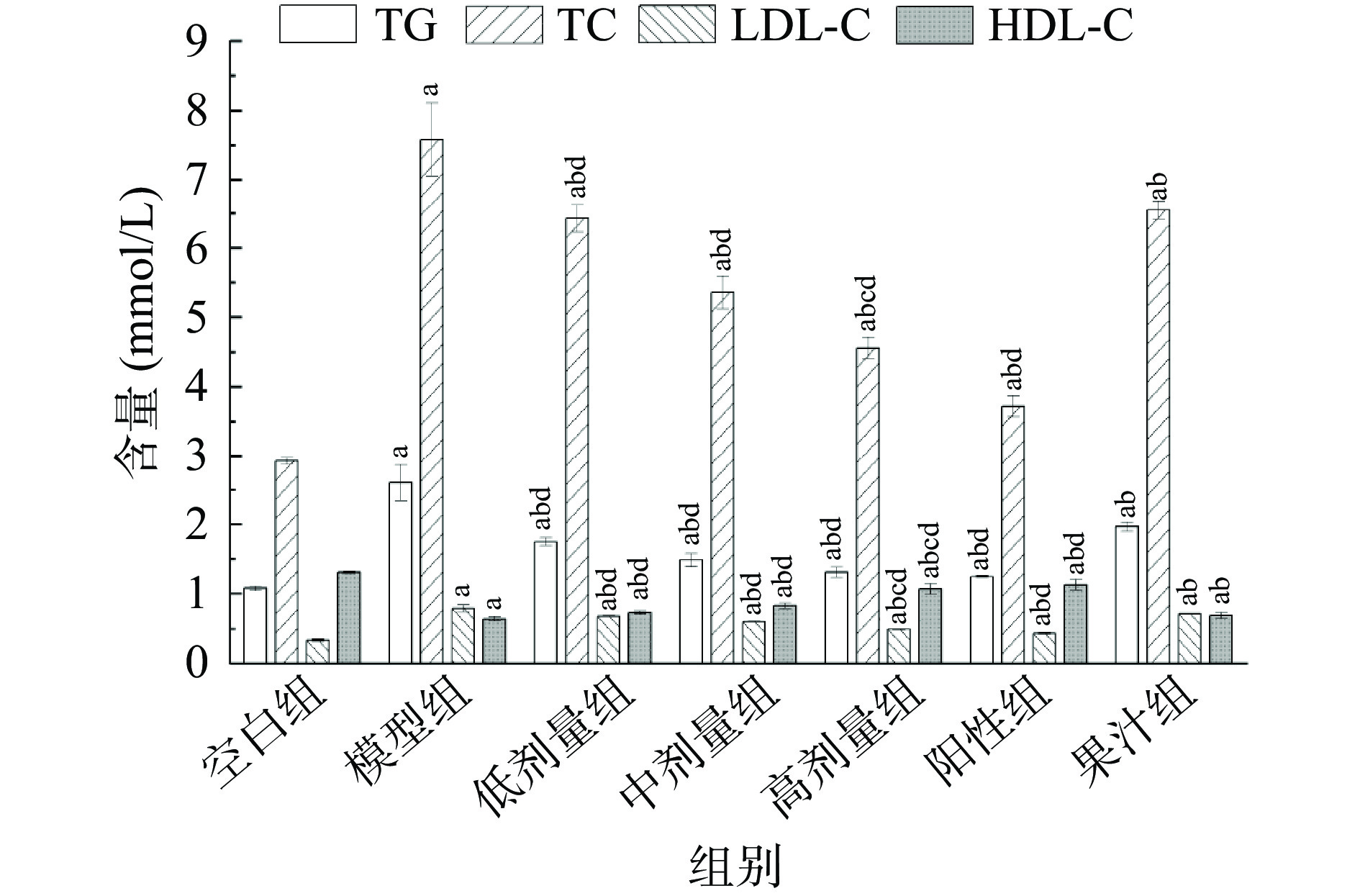
2.4 血清中SOD活性、MDA含量及脂代谢指标的变化
高脂血症是糖尿病的常见并发症,检测血脂四项的含量可间接反应小鼠糖尿病的程度。各组小鼠血清血脂四项含量变化见图6。由图6可知,模型组小鼠TG、TC和LDL-C高于空白组,而HDL-C显著下降(P<0.05)。给药各组血脂四项与模型组均有差异(P<0.05),表明给药组可改善血脂代谢,其中高剂量组在改善血脂代谢上接近阳性组(P>0.05),优于其余各组。
小鼠血清MDA和SOD含量见图7。与空白组相比,模型组小鼠MDA水平增高,SOD水平下降,证明小鼠产生氧化应激。给药后各组小鼠MDA均显著降低,SOD均显著增加(P<0.05),表明给药组可改善小鼠氧化应激,且高剂量组效果与阳性组无明显差异(P>0.05),优于其余各组。结合景怡等[30]的研究结果,可以推测AMF总黄酮可通过调节T2DM小鼠的血脂代谢和氧化应激水平来改善T2DM。
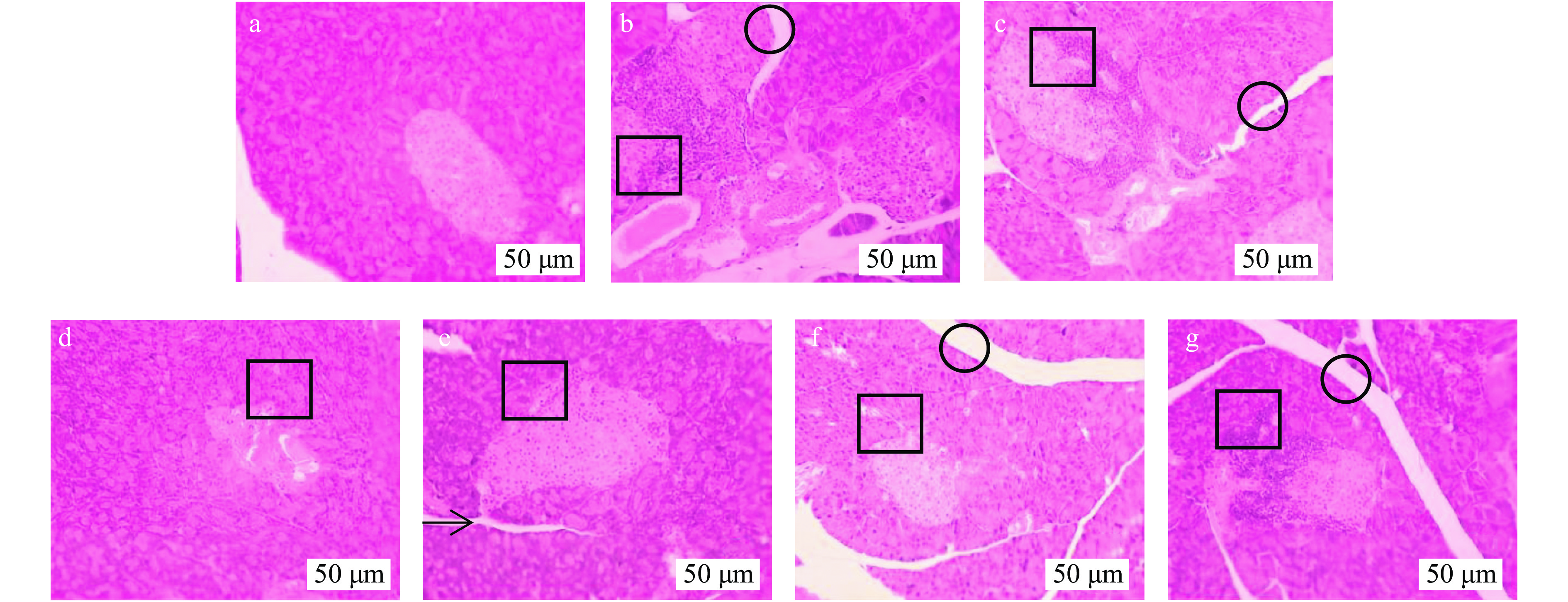
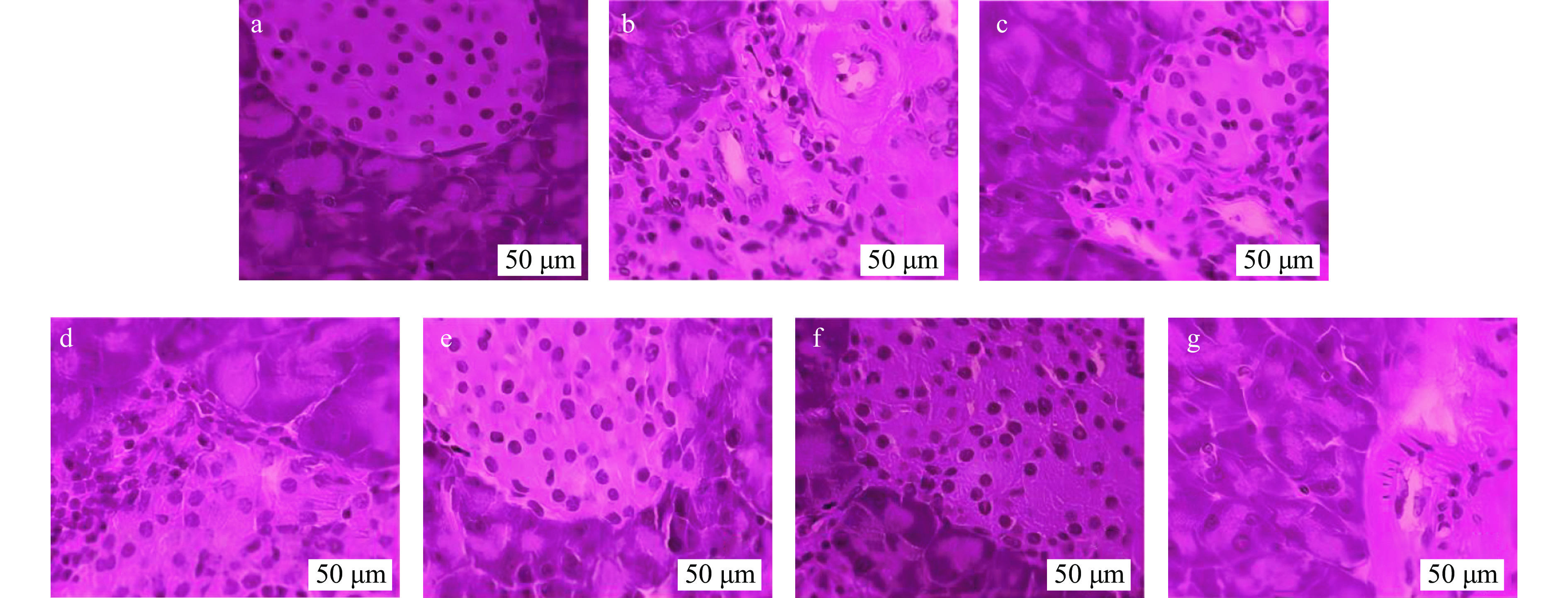
2.5 小鼠肝脏切片变化
各组小鼠肝脏HE染色后观察,由图8~图9可以看出,正常组肝细胞、肝细胞索及肝窦结构正常,无病变现象。模型组肝细胞损伤严重,排列松散,肝窦窄,肝索结构消失,符合T2DM造成的肝损伤。经给药治疗,中剂量组细胞损伤和局灶性坏死症状得到改善,肝窦较窄,高剂量及阳性组细胞形态较正常,排列紧密,肝窦清晰正常,肝索呈放射性排布,排列整齐,表明中、高剂量组均可改善T2DM导致的肝损伤,且高剂量组效果更佳。
2.6 小鼠胰脏切片变化
小鼠胰脏HE染色后,如图10~图11所示,正常组细胞成团,形状正常;模型组细胞形状明显改变,排列松散,可见细胞破裂;阳性组细胞尚规则,形状较正常;低剂量组、果汁组细胞无明显变化,改善效果不佳;总黄酮中、高剂量组细胞形态有所恢复。表明AMF具有一定的修复小鼠胰腺损伤的功效,并呈剂量依赖。
3. 讨论与结论
本实验考察了AMF总黄酮、果汁对T2DM小鼠的影响,并进行了对比分析。与模型组相比,总黄酮组小鼠精神状态有所恢复,体重减轻状态、进食量及饮水量有所改善,空腹血糖值明显下降,有效控制TC、TG、LDL-C、MDA含量升高,且使HDL-C、SOD含量显著升高(P<0.05),说明AMF总黄酮可通过提高SOD,降低MDA的活性改善氧化应激,调节血脂代谢,进而改善胰岛素抵抗,保护胰岛β细胞,从而达到降血糖作用,且糖尿病小鼠血脂紊乱现象有所改善。通过脏器指数与肝脏和胰腺病理形态学观察发现,与总黄酮中、低剂量组相比,高剂量组可以修复STZ诱导的T2DM小鼠的胰腺和肝脏,果汁组可在一定程度上改善STZ诱导T2DM小鼠症状,但效果弱于黄酮各剂量组(P<0.05)。综上,AMF可改善T2DM小鼠症状,AMF总黄酮高、中、低剂量组及果汁组相比,高剂量组效果最优,且在28 d效果最佳,说明其降糖效果温和;高剂量对T2DM小鼠起到良好的降糖效果。由于其是一种新食品,所以具有开发为降糖功能性食品与保健品的优秀潜力。
综上所述,AMF能通过调节氧化应激有效降低T2DM小鼠血糖,改善小鼠血脂紊乱,修复肝脏胰腺损伤,具有确切的降血糖作用,且降血糖作用与给药剂量呈一定的依赖性。但本实验未深入探究AMF总黄酮的降糖作用的通路,在后续实验当中课题组会进一步进行研究,为天然药物防治T2DM提供一定理论依据。
-
-
[1] 陈妍竹, 胡文忠, 姜爱丽, 等. 黑果腺肋花楸功能作用及食品加工研究进展[J]. 食品工业科技,2016,37(9):397−400. [CHEN Y Z, HU W Z, JIANG A L, et al. Research progress on the functional effects and food processing of Aronia melanocarpa[J]. Science and Technology of Food Industry,2016,37(9):397−400. doi: 10.13386/j.issn1002-0306.2016.09.071 [2] 刘丽娜. 浅谈发展黑果腺肋花楸的价值、问题与对策[J]. 防护林科技,2019(2):75−77. [LIU L N. Value, problems and countermeasures of developing Aronia melanocarpa[J]. Protection Forest Science and Technology,2019(2):75−77. [3] 罗猛. 黑果花楸丰产栽培技术[J]. 北方果树,2018(5):33−34. [LUO M. Aronia melanocarpa productive cultivation technology[J]. Northern Fruit Trees,2018(5):33−34. [4] 王朝辉. 富康源黑果花楸栽培技术[J]. 新农业,2015(3):36−38. [WANG C H. Fukangyuan Aronia melanocarpa cultivation technology[J]. New Agriculture,2015(3):36−38. [5] MAYERMIEBACH E, ADAMIUK M, BEHSNILIAN D. Stability of chokeberry bioactive polyphenols during juice processing and stabilization of a polyphenol-rich material from the by-product[J]. Agriculture,2012,2(3):244−258. doi: 10.3390/agriculture2030244
[6] 张衡锋, 汤庚国. 黑果腺肋花楸的植物学研究进展[J]. 天津农业科学,2018,24(6):5−9. [ZHANG H F, TANG G G. Progress in the botanical study of Aronia melanocarpa[J]. Tianjin Agricultural Science,2018,24(6):5−9. doi: 10.3969/j.issn.1006-6500.2018.06.002 [7] 张成霞, 韦庆翠, 徐秀琴, 等. 黑果腺肋花楸在泰州地区引种栽培适应性研究[J]. 湖南农业科学,2020(1):7−10. [ZHANG C X, WEI Q C, XU X Q, et al. Study on the adaptability of introducing cultivation of Aronia melanocarpa in Taizhou area[J]. Hunan Agricultural Science,2020(1):7−10. [8] 隋韶奕, 张素敏, 王雪松, 等. 黑果腺肋花楸-雪莲果混合型果酒酿造工艺研究[J]. 农业科技与装备,2020(2):45−47. [SUI S Y, ZHANG S M, WANG X S, et al. Research on the brewing process of Aronia melanocarpa-snow lily fruit mixed fruit wine[J]. Agricultural Technology and Equipment,2020(2):45−47. [9] 王凤, 王凤舞, 陈昕昕, 等. 黑果腺肋花楸脱涩及果酱的生产加工工艺[J]. 食品科技,2018,43(6):120−125. [WANG F, WANG F W, CHEN X X, et al. Processing of Aronia melanocarpa for astringency removal and jam production[J]. Food Science and Technology,2018,43(6):120−125. [10] 杨舒乔, 王迪, 高彦祥. 黑果腺肋花楸功能性研究进展及其应用[J]. 食品研究与开发,2021,42(13):206−213. [YANG S Q, WANG D, GAO Y X. Advances in studies on the function and application of Aronia melanocarpa[J]. Food Research and Development,2021,42(13):206−213. doi: 10.12161/j.issn.1005-6521.2021.13.030 [11] SHIRAKAWA J, TERAUCHI Y. Newer perspective on the coupling between glucose-mediated signaling and β-cell functionality[J]. Endocrine Journal,2020,67(1):1−8. doi: 10.1507/endocrj.EJ19-0335
[12] 范强, 杨丽霞, 薛燕芳, 等. 2型糖尿病氧化应激与单味中药干预研究[J]. 时珍国医国药,2017,28(7):1718−1721. [FAN Q, YANG L X, XUE Y F, et al. Study on oxidative stress and single herbal intervention in type 2 diabetes[J]. Lishizhen Medicine and Materia Medica Research,2017,28(7):1718−1721. [13] TAKAHASHI A, SHIMIZU H, OKAZAKI Y, et al. Anthocyaninrich phytochemicals from aronia fruits inhibit visceral fat accumulation and hyperglycemia in high-fat diet-induced dietary obese rats[J]. Journal of Oleo Science,2015,64(12):1243−1250. doi: 10.5650/jos.ess15181
[14] KOBUS Z, R N, WILCZYŃSKI K, et al. Effect of the black chokeberry (Aronia melanocarpa (Michx.) Elliott) juice acquisition method on the content of polyphenols and antioxidant activity[J]. PLoS One,2019,14(7):e0219585. doi: 10.1371/journal.pone.0219585
[15] CAMPBELL J E, NEWGARD C B. Mechanisms controlling pancreatic islet cell function in insulin secretion[J]. Nature Reviews Molecular Cell Biology,2021,48:1−17.
[16] 殷圆, 陆而立. 中医治疗特殊性糖尿病的研究进展[J]. 现代临床医学,2022,48(2):135−136, 148. [YIN Y, LU E L. Research progress of Chinese medicine in the treatment of specific diabetes mellitus[J]. Modern Clinical Medicine,2022,48(2):135−136, 148. doi: 10.11851/j.issn.1673-1557.2022.02.017 [17] RANDERIA S N, GREIG J A, THOMSON, et al. Inflammatory cytokines in type 2 diabetes mellitus as facilitators of hypercoagulation and abnormal clot formation[J]. Cardiovascular Diabetology,2019,18(72):1−15.
[18] 金斐, 朱丽云, 高永生, 等. 植物源活性成分降血糖作用及其机理研究进展[J]. 食品科学,2021,42(21):322−330. [JIN F, ZHU L Y, GAO Y S, et al. Advances in hypoglycemic effects of plant-derived active ingredients and their mechanisms[J]. Food Science,2021,42(21):322−330. [19] PRETORIUS E, BESTER J, VERMEULEN N, et al. Poorly controlled type 2 diabetes is accompanied by significant morphological and ultrastructural changes in both erythrocytes and in thrombin-generated fibrin: Implications for diagnostics[J]. Cardiovascular Diabetology,2017,14(1):30.
[20] 文培华, 颜怡冰, 王文君, 等. 虎耳草总黄酮含量测定及其抗氧化性[J]. 食品工业,2022,43(2):315−319. [WEN P H, YAN Y B, WANG W J, et al. Determination of the total flavonoid content and antioxidant properties of Euphorbia tigris[J]. Food Industry,2022,43(2):315−319. [21] DING Y, XU T, MAO G, et al. Di-(2-ethylhexyl) phthalate-induced hepatotoxicity exacerbated type 2 diabetes mellitus (T2DM) in female pubertal T2DM mice[J]. Food and Chemical Toxicology,2021(24):112003.
[22] 孙宏莱, 刘悦, 刘德江, 等. 毛水苏多糖对糖尿病小鼠肾脏的保护作用[J]. 食品工业科技,2021,42(17):373−380. [SUN H L, LIU Y, LIU D J, et al. Protective effect of trichosan on the kidney of diabetic mice[J]. Science and Technology of Food Industry,2021,42(17):373−380. [23] 李海云. 芪蛭降糖片对大鼠糖尿病综合症的防治作用[D]. 开封: 河南大学, 2019 LI H Y. Prevention and treatment of diabetes mellitus syndrome in rats by Astragalus vermicularis hypoglycemic tablets[D]. Kaifeng: Henan University, 2019.
[24] 王云威. 铁皮石斛多糖及复方剂对糖尿病小鼠降糖研究[D]. 太原: 山西大学, 2020 WANG Y W. Study on hypoglycemia of Dendrobium ironbark polysaccharide and compounding agents in diabetic mice[D]. Taiyuan: Shanxi University, 2020.
[25] 刘迪迪, 邱军强, 张华, 等. 红松松仁提取物对糖尿病小鼠的降血糖活性[J]. 中国食品学报,2019,19(7):20−28. [LIU D D, QIU J Q, ZHANG H, et al. Hypoglycemic activity of the extracts from korean pine nut on diabetic mice[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(7):20−28. doi: 10.16429/j.1009-7848.2019.07.003 [26] 陈丽莉, 刘月, 牛晓琪, 等. 黑树莓多酚对糖尿病小鼠血糖代谢的调控作用及机制研究[J]. 中草药,2021,52(17):5258−5266. [CHEN L L, LIU Y, NIU X Q, et al. Study on the regulatory effect and mechanism of black raspberry polyphenols on blood glucose metabolism in diabetic mice[J]. Chinese Herbal Medicine,2021,52(17):5258−5266. doi: 10.7501/j.issn.0253-2670.2021.17.018 [27] 徐立, 胡瑞斌, 李兆波, 等. STZ诱导糖尿病大鼠胰腺及肝脏石蜡切片HE染色改进方法[J]. 临床与实验病理学杂志,2019,35(9):1122−1124. [XU L, HU R B, LI Z B, et al. Improved HE staining of paraffin sections of pancreas and liver in STZ-induced diabetic rats[J]. Journal of Clinical and Experimental Pathology,2019,35(9):1122−1124. [28] WORSZTYNOWICZ P, MARTA NAPIERAŁA, A W B, et al. Pancreatic α-amylase and lipase inhibitory activity of polyphenolic compounds present in the extract of black chokeberry (Aronia melanocarpa L.)[J]. Process Biochemistry,2014,49(9):1457−1463. doi: 10.1016/j.procbio.2014.06.002
[29] MU J, XIN G, ZHANG B, et al. Beneficial effects of Aronia melanocarpa berry extract on hepatic insulin resistance in type 2 diabetes mellitus rats[J]. Journal of Food Science,2020,85(4):1307−1318. doi: 10.1111/1750-3841.15109
[30] 景怡, 景荣琴, 胡天惠. 玉米须总黄酮对糖尿病高脂血症大鼠血脂、血糖水平的影响及抗氧化作用[J]. 中药药理与临床,2011,27(2):85−86. [JING Y, JING R Q, HU T H. Effects of total flavonoids of corn mullein on blood lipid and blood glucose levels and antioxidant effects in diabetic hyperlipidemic rats[J]. Chinese Pharmacology and Clinical Practice,2011,27(2):85−86.








 下载:
下载:


 下载:
下载:
