Modulatory Effect of Polysaccharide from Artocarpus heterophyllus Lam. (Jackfruit) Pulp on Gut Microbiota in Mice
-
摘要: 为探究菠萝蜜多糖(JFP-Ps)对小鼠肠道菌群多样性及其结构的影响,将24只雄性昆明小鼠随机分为四组:对照组、JFP-Ps(50 mg/kg BW)组、JFP-Ps(100 mg/kg BW)组和JFP-Ps(200 mg/kg BW)组,连续灌喂2周后,收集新鲜小鼠粪便,提取粪便DNA扩增肠道菌群16S rRNA基因的V3~V4区,通过Illumina高通量测序技术研究菠萝蜜多糖对小鼠肠道菌群的调节作用。结果表明,JFP-Ps可通过调节拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)等肠道优势菌群的组成和结构,增加肠道菌群的多样性。通过属水平分析发现,JFP-Ps可增加拟杆菌属(Bacteroides)、异杆菌属(Allobaculum)、乳酸杆菌属(Lactobacillus)和副拟杆菌(Parabacteroides)等产SCFAs菌属的丰度,减少普雷沃菌属(Prevotella)等菌属丰度,发挥肠道微生物调节作用,改善宿主肠道微生态健康,研究结果为JFP-Ps在肠道益生产品的研发应用奠定理论基础。Abstract: The present study aimed to investigate the modulatory effect of polysaccharide from Artocarpus heterophyllus Lam. pulp (JFP-Ps) on the diversity and structure of gut microbiota in mice. 24 male Kunming mice were randomly divided into four groups: Control group, JFP-Ps (50 mg/kg BW) group, JFP-Ps (100 mg/kg BW) group and JFP-Ps (200 mg/kg BW) group. The colonic feces of mice were collected after treating with JFP-Ps in different doses for 2 weeks. Then the DNA was extracted and the V3~V4 region of the 16S rRNA gene of the intestinal flora was amplified. The regulatory effect of JFP-Ps on the gut microbiota of mice was studied using Illumina Miseq high-throughput sequencing technology. The results showed that Bacteroidetes and Firmicutes were the dominant intestinal flora, and JFP-Ps modulated the composition of Bacteroidetes and Firmicutes in comparison with the control group. At the genus level, the abundance of SCFAs-producing bacteria, including Bacteroides, Allobaculum, Lactobacillus and Parabacteroides were significantly increased in response to JFP-Ps treatment, but a significant decrease in Prevotella. These results indicated that JFP-Ps could improve the diversity of gut microbiota by regulating the composition and structure of dominant bacteria such as Bacteroidetes and Firmicutes. This study would provide a theoretical basis for JFP-Ps in intestinal prebiotics.
-
肠道是人体重要的消化吸收场所,特别是肠道内微生物,其所携带的基因数量约为已知人类基因组的150倍[1],被认为是人体的另一个“重要器官”[2]。肠道微生物参与了人体的基本生物学过程,如炎症性肠病、肥胖、糖尿病、酒精性肝病、癌症等诸多慢性疾病的发生发展均与肠道微生物紊乱密切相关[3-6]。食源性多糖可调节肠道微生物结构和改变肠道微环境(如降低肠道pH),刺激肠道组织中的巨噬细胞或淋巴细胞抵抗癌症等疾病[7],对人体肠道健康有着正向的调节作用。
菠萝蜜(Artocarpus heterophyllus Lam.)作为一种桑科木菠萝属热带果树,被冠以“热带珍果”、“热带水果皇后”的美称。菠萝蜜果肉含有丰富糖类化合物、蛋白质、氨基酸、多酚、脂肪酸、维生素、矿物质等营养成分,具有抗氧化、抗肿瘤、降血糖、降血脂、免疫调节等多种药理活性[8-9]。课题组前期研究证实,菠萝蜜多糖(polysaccharide from jackfruit pulp,JFP-Ps)主要由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸组成,平均分子量为1668 ku,具有较强的体外抗氧化活性及免疫调节等活性[10]。JFP-Ps的免疫增强活性可能与其促进小鼠脾淋巴细胞增殖、提高抗氧化活性及诱导细胞因子TNF-α、IFN-γ和IL-1β分泌水平有关[11]。
基于前期研究基础,本研究拟通过Illumina Miseq高通量测序平台对小鼠16S rRNA基因的V3~V4区进行定性分析,从操作分类单元(operational taxonomic unit,OTU)、不同水平物种组成分析、主成分分析(principal component analysis,PCA)、线性判别分析(linear discriminant analysis effect size,LEfSe)等方面,研究灌胃JFP-Ps两周后小鼠肠道菌群组成和结构的变化,初步探究JFP-Ps对小鼠肠道微生物的调节作用。研究结果将为其在动物疾病模型上的研究和肠道益生产品的研发应用奠定理论基础。
1. 材料与方法
1.1 材料与仪器
菠萝蜜多糖(polysaccharide from jackfruit pulp,JFP-Ps) 本课题组提供,由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸组成,平均分子量为1668 ku;清洁级雄性昆明小鼠(体质量20.0±2.0 g) 湖南斯莱克景达实验动物有限公司(生产许可证号:SCXK(湘)2016-0002);粪便DNA提取试剂盒 天根生物科技有限公司;琼脂糖 美国Invitrogen公司;Q5 DNA聚合酶(M0491L) 美国新英格兰生物实验室;DNA凝胶回收试剂盒 美国Axygen公司;PicoGreen双链DNA定量试剂盒 美国Invitrogen公司;TruSeq Nano DNA文库制备试剂盒 美国Illumina公司;其他化学试剂 均为分析纯。
微量分光光度计 美国Thermo Fisher Scientific公司;全波长扫描式多功能读数仪 美国BioTek公司;DYY-6C电泳仪 北京六一生物科技有限公司;Illumina MiSeq PE 250测序平台 美国Illumina公司。
1.2 实验方法
1.2.1 动物的饲养和分组
24只雄性昆明小鼠饲养于12 h光照/12 h黑暗循环室中,控制相对湿度为60%±10%,温度为23±2 ℃。适应性饲养一周,随机分为四组,对照组(灌胃与多糖组相同体积的蒸馏水)、JFP-Ps(50 mg/kg BW)组、JFP-Ps(100 mg/kg BW)组和JFP-Ps(200 mg/kg BW)组。实验小鼠每天灌胃1次,连续灌胃2周。所有动物实验严格遵照海南医学院动物实验伦理委员会规定(实验动物使用许可证:SYXK(琼)2017-0013)。
1.2.2 样品采集与提取
于实验第2周最后一天,采集新鲜小鼠粪便,液氮冷却,−80 ℃条件保存备用。
采用TIANamp粪便DNA试剂盒提取粪便DNA,微量分光光度计评估分离的DNA浓度和纯度,以0.8%琼脂糖凝胶电泳确认DNA完整性。
1.2.3 16S rRNA基因扩增
以粪便样品DNA为模板,正向引物338F:5'-ACTCCTACGGGAGGCAGCAG-3'和反向引物806R:5'-GGACTACHVGGGTWTCTAAT-3',PCR扩增V3~V4区16S rRNA。PCR反应体系:5 μL 5×反应缓冲液、5 μL 5×GC缓冲液、2 μL 2.5 mmol/L dNTP、1 μL 10 μmol/L正向引物、1 μL 10 μmol/L反向引物、2 μL模板、0.25 μL Q5 DNA聚合酶和8.75 μL ddH2O。扩增程序为:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸5 min。扩增产物采用2%琼脂糖凝胶电泳进行分析。进一步使用Axygen凝胶提取试剂盒纯化PCR产物,并根据Quant-it PicoGreen dsDNA分析试剂盒进行鉴定。DNA测序文库使用TruSeq Nano DNA LT Library Prep Kit构建。所有V3和V4区PCR产物在Illumina MiSeq PE 250平台上测序。
1.2.4 生物信息学分析
利用QIIME的UCLUST功能,选取高质量的序列数据,以97%的相似度聚类为可操作的分类单元(OTU)。采用Greengenes数据库(http://greengenes.secondgenome.com/)[12],作为OTU分类地位鉴定的模板序列,通过将OTU代表序列与对应数据库的模板序列相比对,获取每个OTU所对应的分类学信息。根据观测到的OTU数确定细菌的α多样性,包括稀疏曲线以及多样性指数。根据OTU划分获得每个样本在门和属分类水平上的群落组成结构和微生物类群数量。采用未加权UniFrac主成分分析、未加权UniFrac组间差异比较分析,在QIIME和R软件中进行β多样性分析。利用偏最小二乘法判别分析和LEfSe分析进行菌群比较以及组间差异分析。最后根据预测得到的各功能类群在各样本中的丰度分布,使用R软件计算各样本(组)共有功能类群的数量,并通过Venn图直观地呈现各组所共有和独有的功能类群所占的比例。利用PICRUSt将现有的16S rRNA基因测序数据与代谢功能已知的微生物参考基因组数据库相对比,预测分析JFP-Ps对菌群代谢功能的影响。
1.3 数据处理
实验结果均以平均值±标准差来表示。使用SPSS 20软件进行统计学分析。组间比较采用单因素方差分析,然后进行Dunnett多重比较检验。P<0.05被认为具有统计学意义。采用Origin 9.9.0软件进行绘图。
2. 结果与分析
2.1 JFP-Ps对小鼠肠道菌群的多样性分析
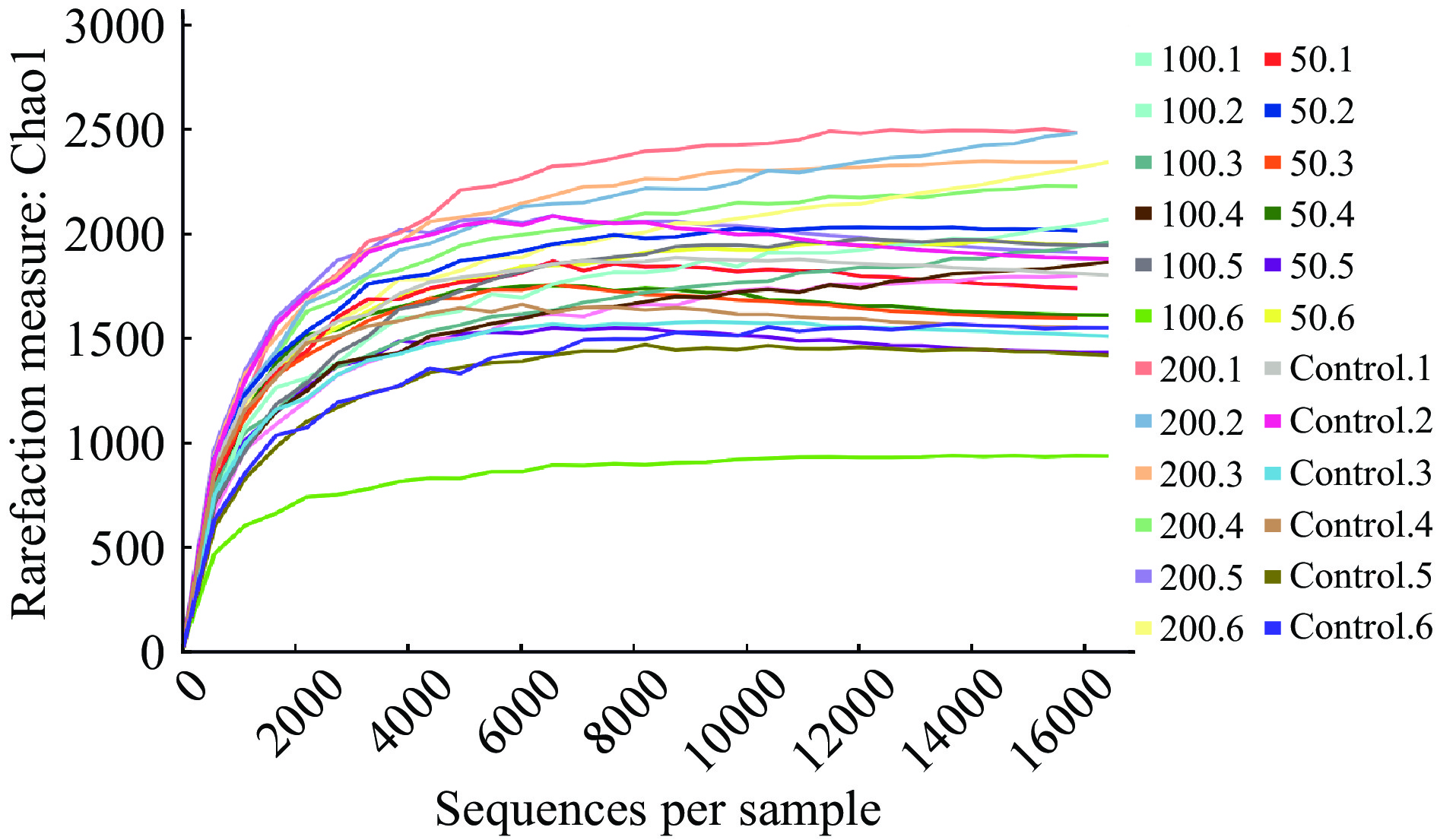
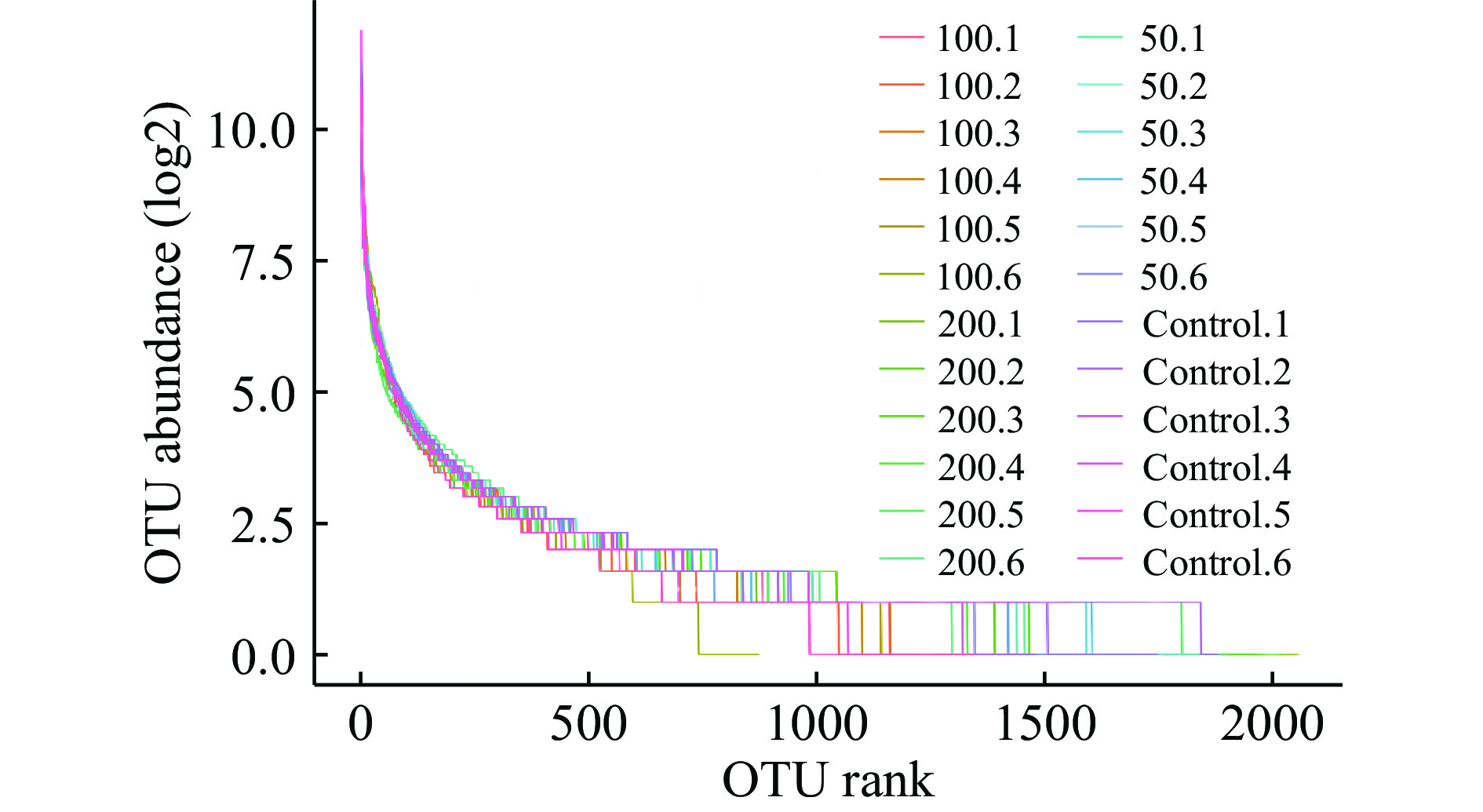
如图1所示,随着样本量的增加,稀释曲线呈上升的趋势,但上升的速度逐渐降低,最后成为一条比较平缓的曲线,达到Chao1平台期。随着测序样品数量的增加,OTU的数量越来越有限,直到达到饱和点,这表明测序的深度已经覆盖了检测样品中的所有物种。通过物种等级丰度曲线评估物种丰富度和均匀度,如图2所示,物种丰度等级曲线长且平滑程度高,进一步证实了本研究中样本的物种丰富度高,且分布均匀。
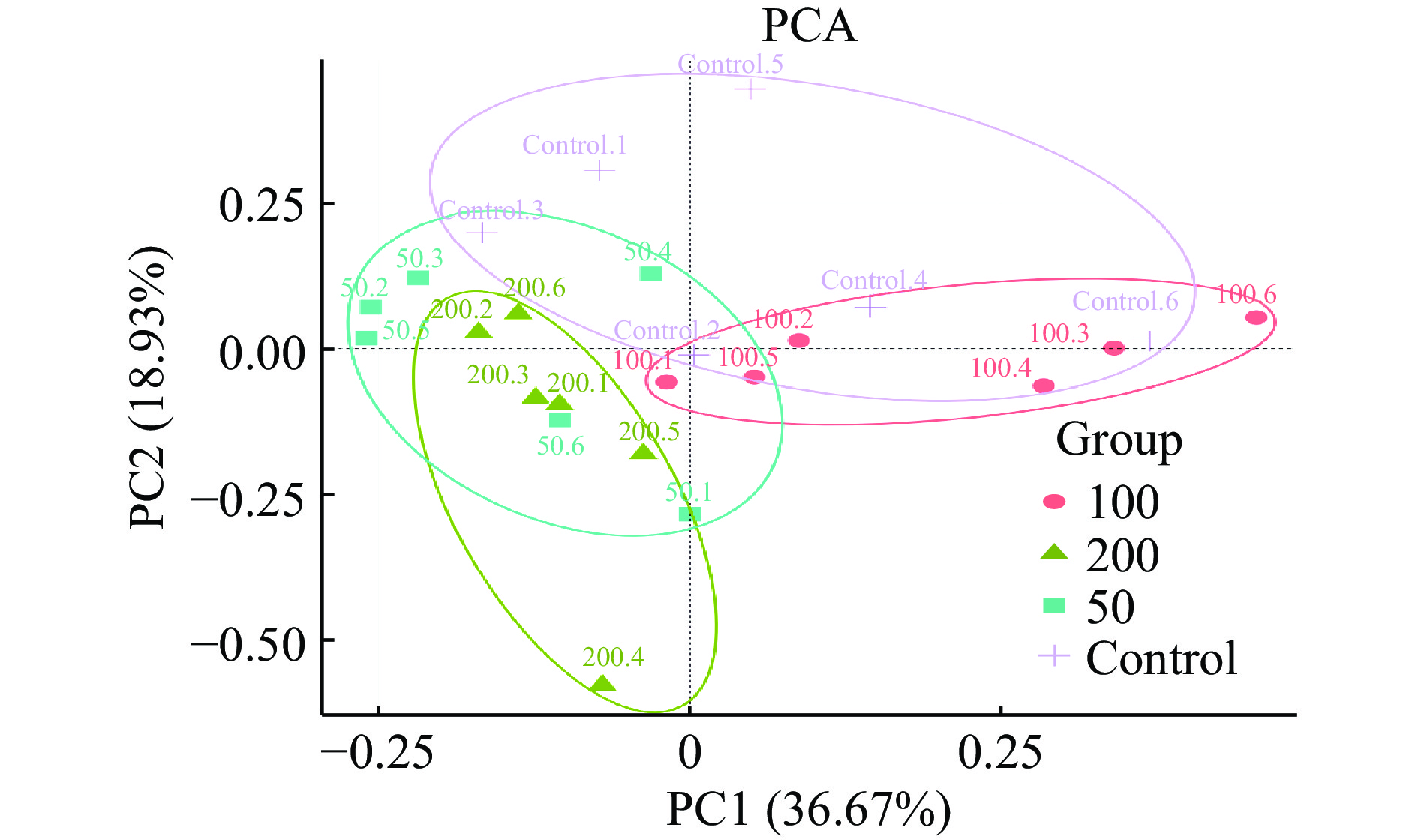
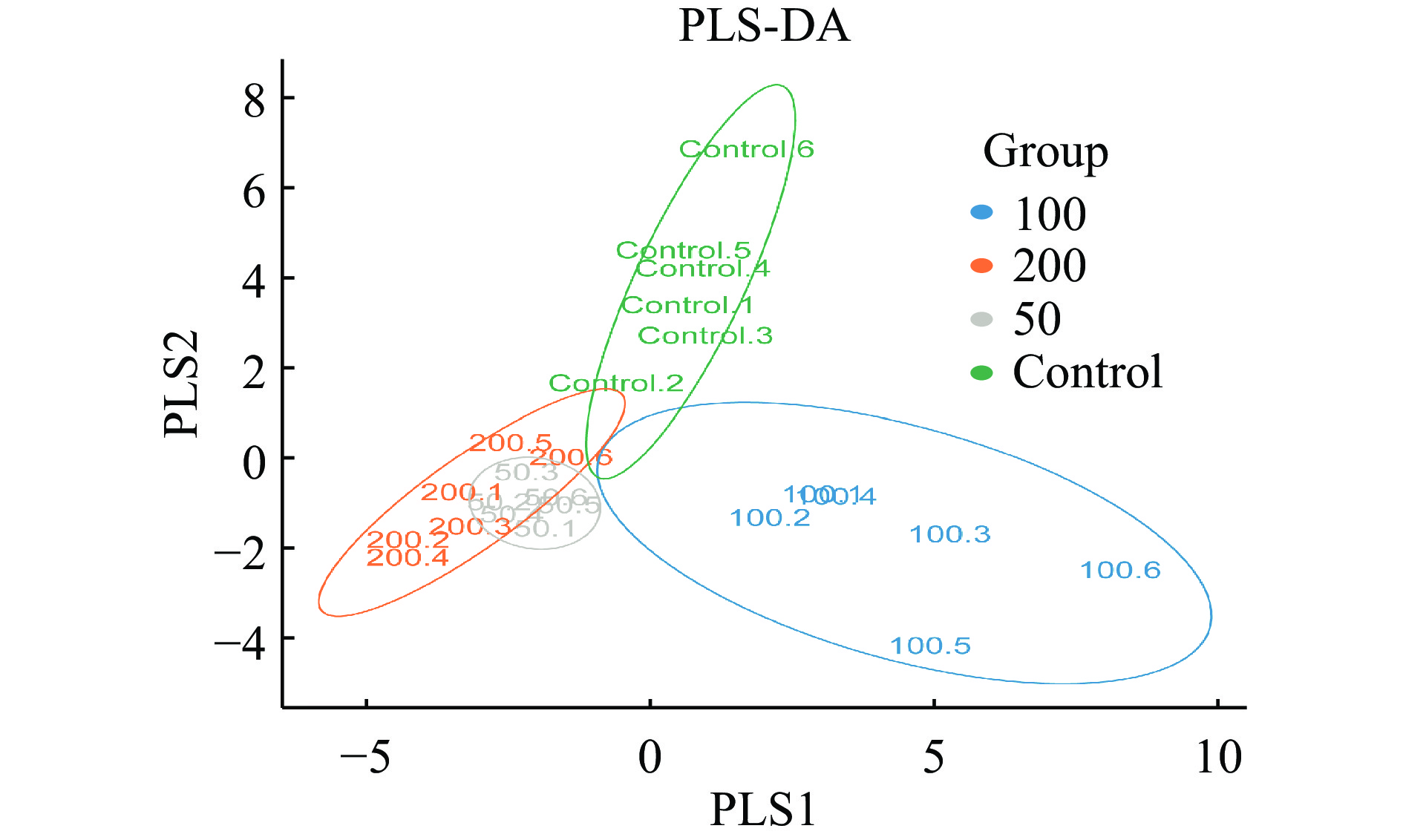
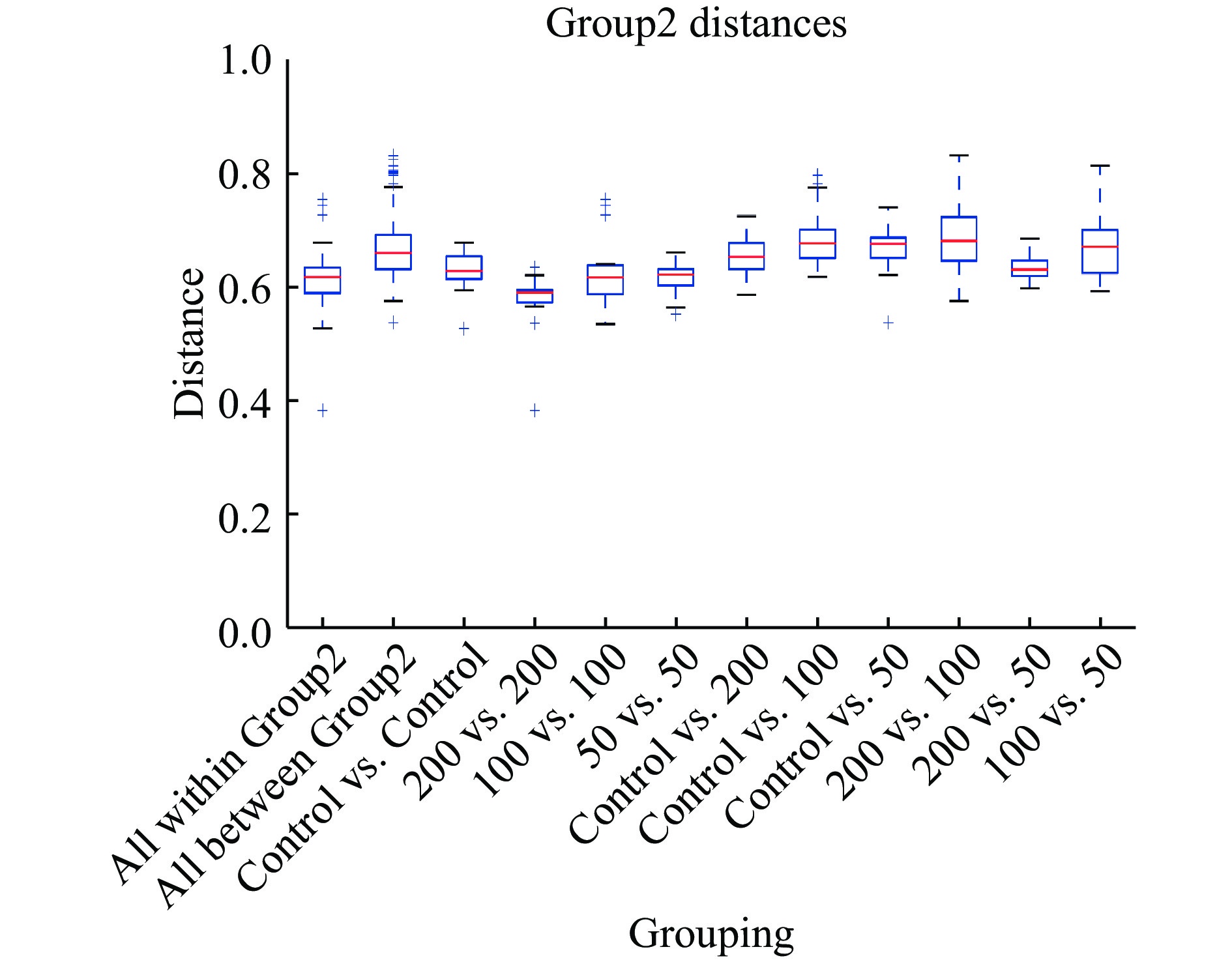
为评估不同浓度菠萝蜜多糖对微生物群落组成的影响,PCA结果如图3所示,JFP-Ps(200 mg/kg BW)组与对照组明显分离,表明JFP-Ps能够显著(P<0.05) 调节小鼠肠道菌群的组成和数量。PLS-DA结果显示,JFP-Ps组和对照组小鼠肠道微生物结构具有明显的组间差异(图4)。经过对组内和组间差异的比较和分析,所有组间差异均大于组内差异(图5)。
2.2 JFP-Ps对小鼠肠道菌群物种组成分析
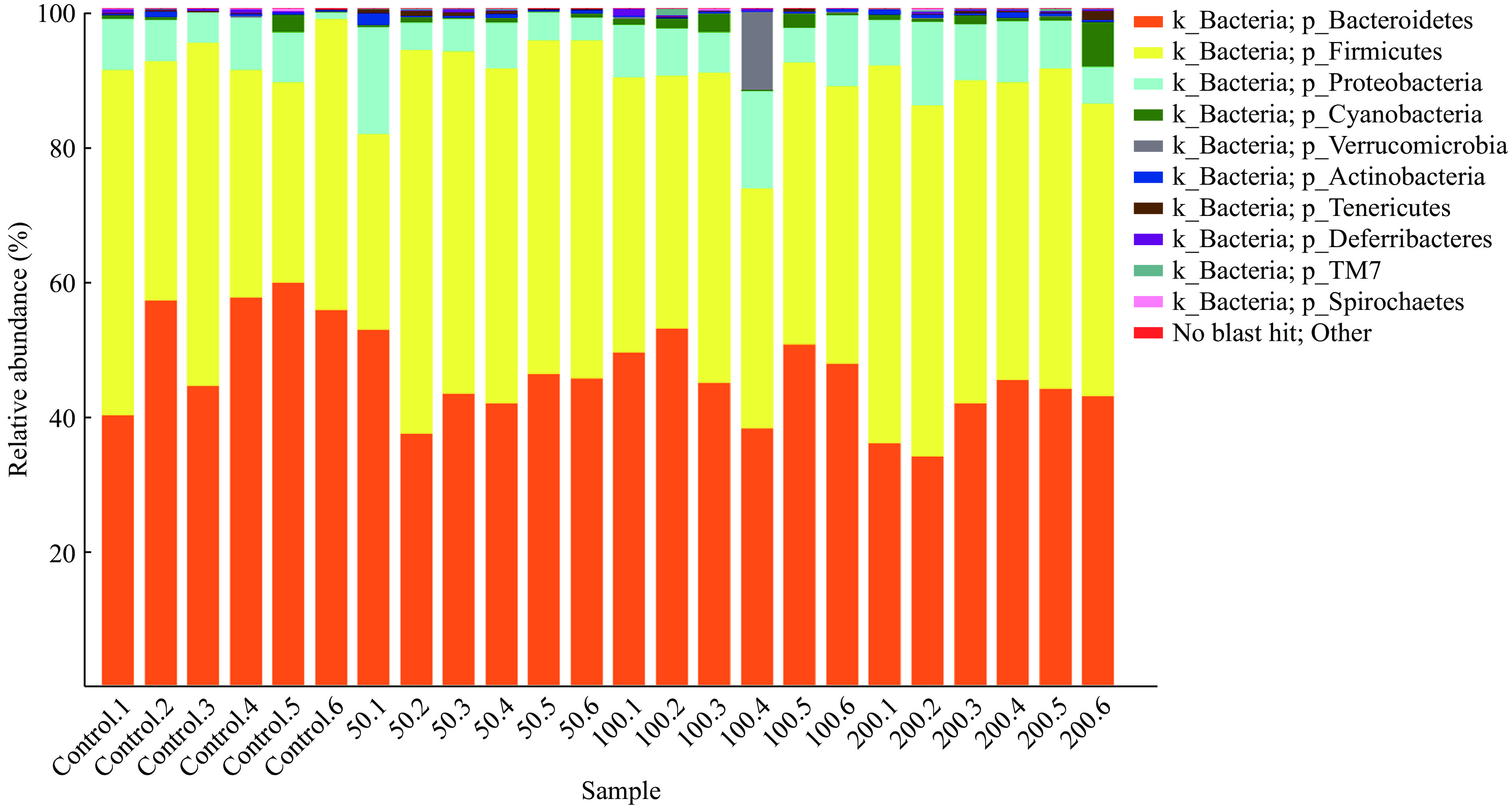
JFP-Ps在门水平上对小鼠肠道菌群组成的影响如图6所示,各组小鼠肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)、脱铁杆菌门(Deferribacteria)、螺旋体门(Spirochaetes)和TM7等10种菌门构成,其中拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)为肠道优势菌群,在肠道菌群中所占的比例分别为46.15%和44.04%(表1)。
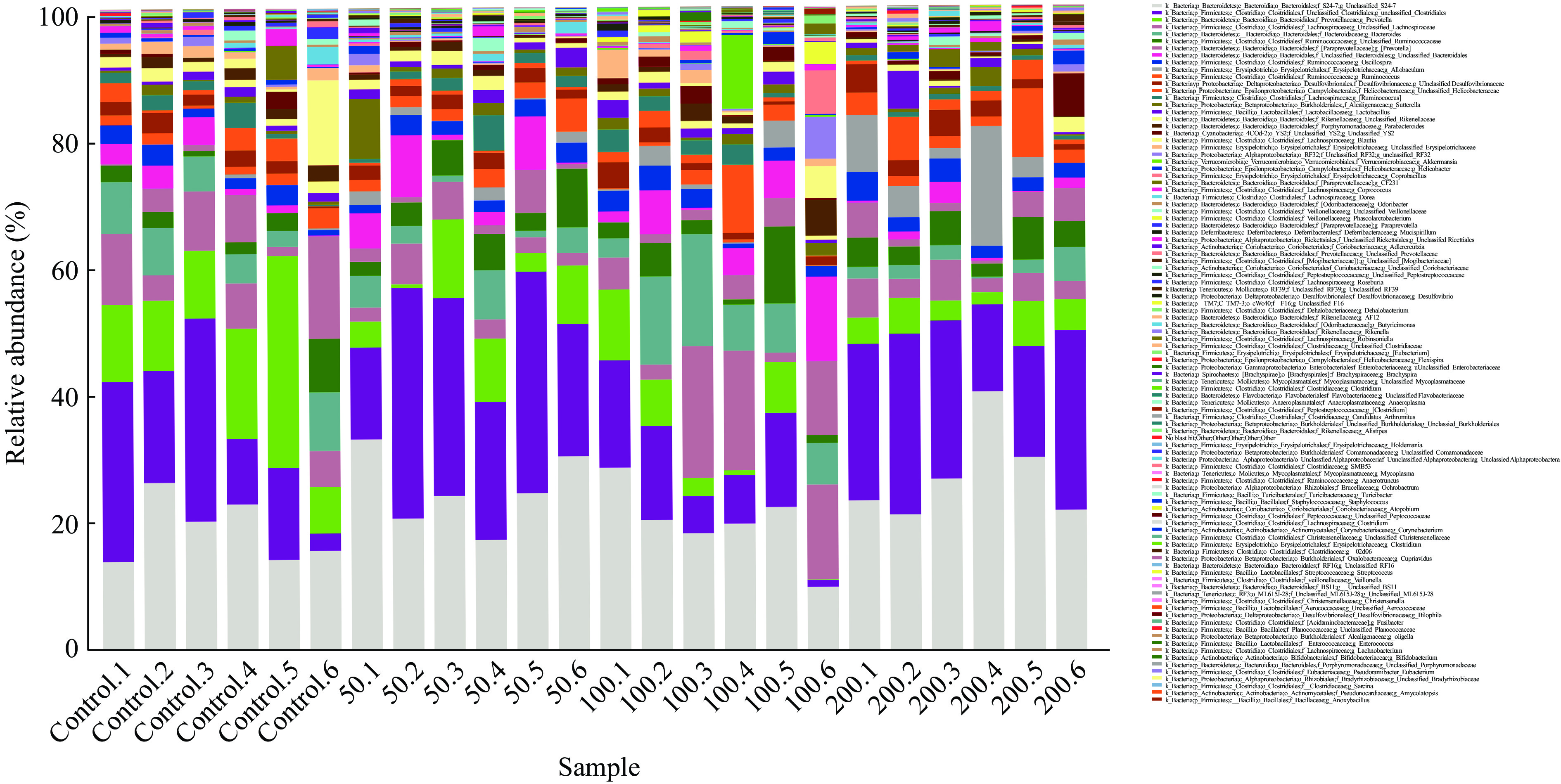
表 1 基于门水平的肠道菌群占比(%)Table 1. Proportion of intestinal microorganisms at phylum level (%)分类 总数 对照组 JFP-Ps(50 mg/kg BW) JFP-Ps(100 mg/kg BW) JFP-Ps(200 mg/kg BW) Bacteroidetes 46.15±7.02 52.34±8.08 44.44±5.09* 47.18±5.25 40.65±4.59** Firmicutes 44.04±7.74 40.40±9.09 47.34±9.47 40.22±3.59 48.19±4.83 Proteobacteria 7.16±3.36 5.70±2.57 6.46±4.69 8.39±3.44 8.09±2.37 Cyanobacteria 1.04±1.42 0.65±1.04 0.49±0.28 1.32±1.02 1.71±2.42 Verrucomicrobia 0.53±2.34 0.03±0.07 0.02±0.04 2.02±4.64 0.03±0.06 Actinobacteria 0.39±0.36 0.31±0.26 0.52±0.63 0.21±0.11 0.52±0.18 Tenericutes 0.25±0.28 0.07±0.06 0.46±0.15* 0.12±0.14 0.35±0.44 Deferribacteres 0.23±0.25 0.33±0.21 0.13±0.16 0.28±0.42 0.20±0.08 TM7 0.13±0.21 0.03±0.05 0.12±0.11 0.17±0.40 0.20±0.08 Spirochaetes 0.06±0.10 0.11±0.14 0.02±0.03 0.06±0.11 0.05±0.11 Other 0.02±0.04 0.05±0.07 0.01±0.01 0.01±0.01 0.02±0.02 注:与对照组比较,*表示差异显著,P<0.05;**表示差异极显著,P<0.01;表2同。 如图7所示,在属水平上,各组小鼠肠道菌群主要由普雷沃菌属(Prevotella)、拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcus)、颤螺菌属(Oscillospira)、异杆菌属(Allobaculum)、乳酸杆菌属(Lactobacillus)和副拟杆菌(Parabacteroides)等菌属构成。与对照组相比,JFP-Ps(50 mg/kg BW和200 mg/kg BW)组中瘤胃球菌属(Ruminococcus)、颤螺菌属(Oscillospira)、异杆菌属(Allobaculum)和乳酸杆菌属(Lactobacillus)等菌属水平增加,普雷沃菌属(Prevotella)和帕拉普氏菌属(Paraprevotella)等菌属水平减少。但JFP-Ps(100 mg/kg BW)组中拟杆菌属(Bacteroides)和副拟杆菌(Parabacteroides)等菌属丰度增加,JFP-Ps(200 mg/kg BW)组显著增加了异杆菌属(Allobaculum)的丰度(表2)。结果表明,JFP-Ps可以改变小鼠肠道菌属丰度。
表 2 基于属水平的肠道菌群占比(%)Table 2. Proportion of intestinal microorganisms at genus level (%)分类 对照组 JFP-Ps(50 mg/kg BW) JFP-Ps(100 mg/kg BW) JFP-Ps(200 mg/kg BW) Prevotella 19.87±8.51 8.40±4.03** 8.75±3.55** 7.31±3.41** Bacteroides 6.17±2.48 3.55±2.55 9.25±5.31 2.31±1.64* Ruminococcus 3.35±1.16 4.73±2.39 2.98±1.52 4.26±3.56 Oscillospira 2.16±1.03 2.33±0.73 2.37±1.15 2.75±1.02 Allobaculum 0.16±0.10 1.22±0.36 1.41±0.72 6.20±2.79** Sutterella 0.68±0.21 2.55±1.38 1.39±0.23 1.14±0.39 Lactobacillus 0.98±0.19 1.53±0.37 1.42±0.34 1.59±0.87 Parabacteroides 1.46±0.29 0.71±0.20 1.93±0.81 0.24±0.09 Blautia 2.53±2.15 0.04±0.03 0.98±0.80 0.07±0.03 Paraprevotella 0.58±0.26 0.16±0.08 0.27±0.16 0.13±0.06 Others 62.06±5.07 74.76±8.08 69.26±2.28 73.98±6.23 2.3 JFP-Ps对小鼠肠道菌群物种差异性分析
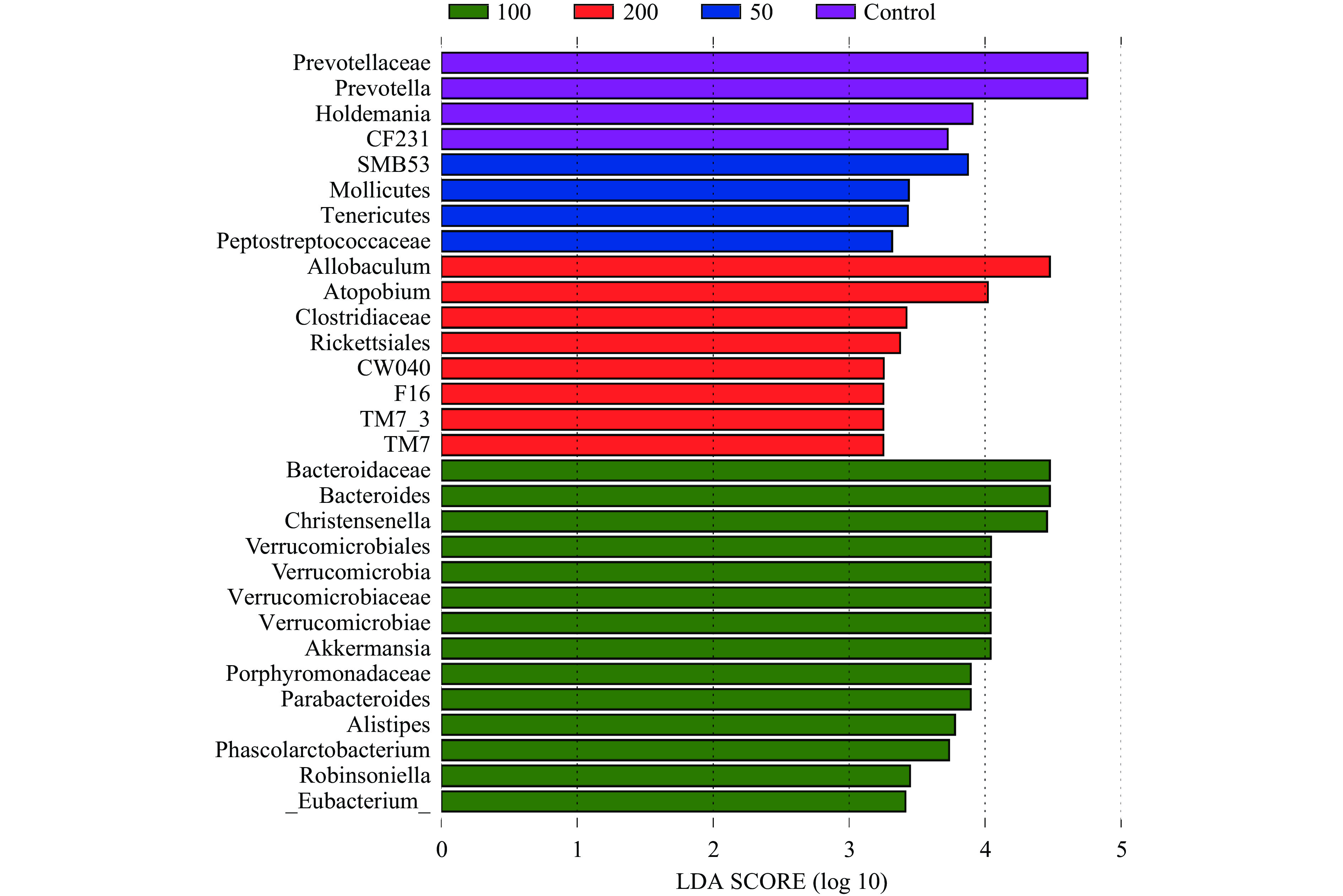
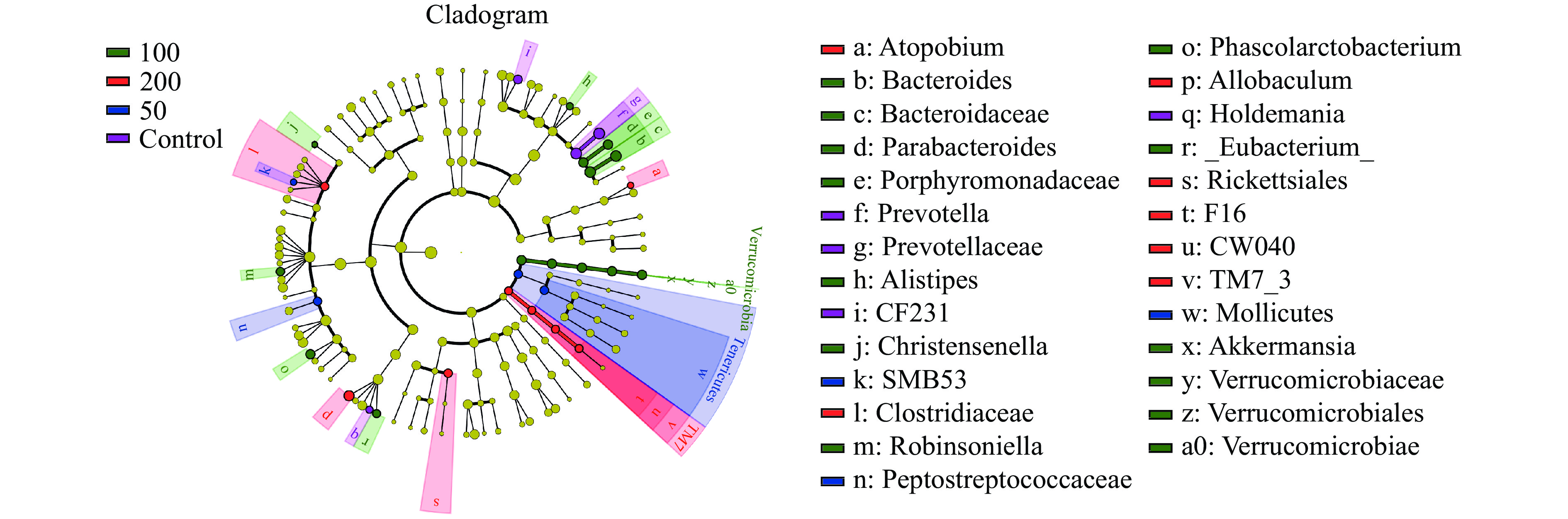
线性判别分析(LDA)如图8所示,对照组、JFP-Ps(50 mg/kg BW,100 mg/kg BW,200 mg/kg BW)组分别有4,4,14,8种关键微生物类群。对照组中小鼠肠道菌群差异物种主要属于拟杆菌门(Prevotella、CF231和Prevotellaceae)和厚壁菌门(Holdemania);JFP-Ps(50 mg/kg BW)组中小鼠肠道菌群差异物种主要属于软壁菌门(Tenericutes和Mollicutes)和拟杆菌门(Peptostreptococcaceae和SMB53)。JFP-Ps(100 mg/kg BW)组中小鼠肠道菌群差异物种主要属于拟杆菌门(Bacteroides、Bacteroidaceae、Porphyromonadaceae、Parabacteroides和Alistipes),疣微菌门(Verrucomicrobiaceae、
Akkermansia、Verrucomicrobiae、Verrucomicrobia和Verrucomicrobiales)和厚壁菌门(Christensenella、Phascolarctobacterium、Robinsoniella和_Eubacterium_)。JFP-Ps(200 mg/kg BW)组中小鼠肠道菌群差异物种主要属于TM7(TM7_3、TM7、CW040和F16),厚壁菌门(Allobaculum、Clostridiaceae)、变形菌门(Rickettsiales)和放线菌门(Atopobium)。JFP-Ps增加了肠道菌群的多样性,通过将这种差异折射到各个层级结构的分类树上,如图9进化分支图所示,JFP-Ps的干预导致物种间丰度差异显著的菌门分别为Verrucomicrobia、Tenericutes、TM7(P<0.05)。 2.4 JFP-Ps对肠道菌群代谢功能的影响
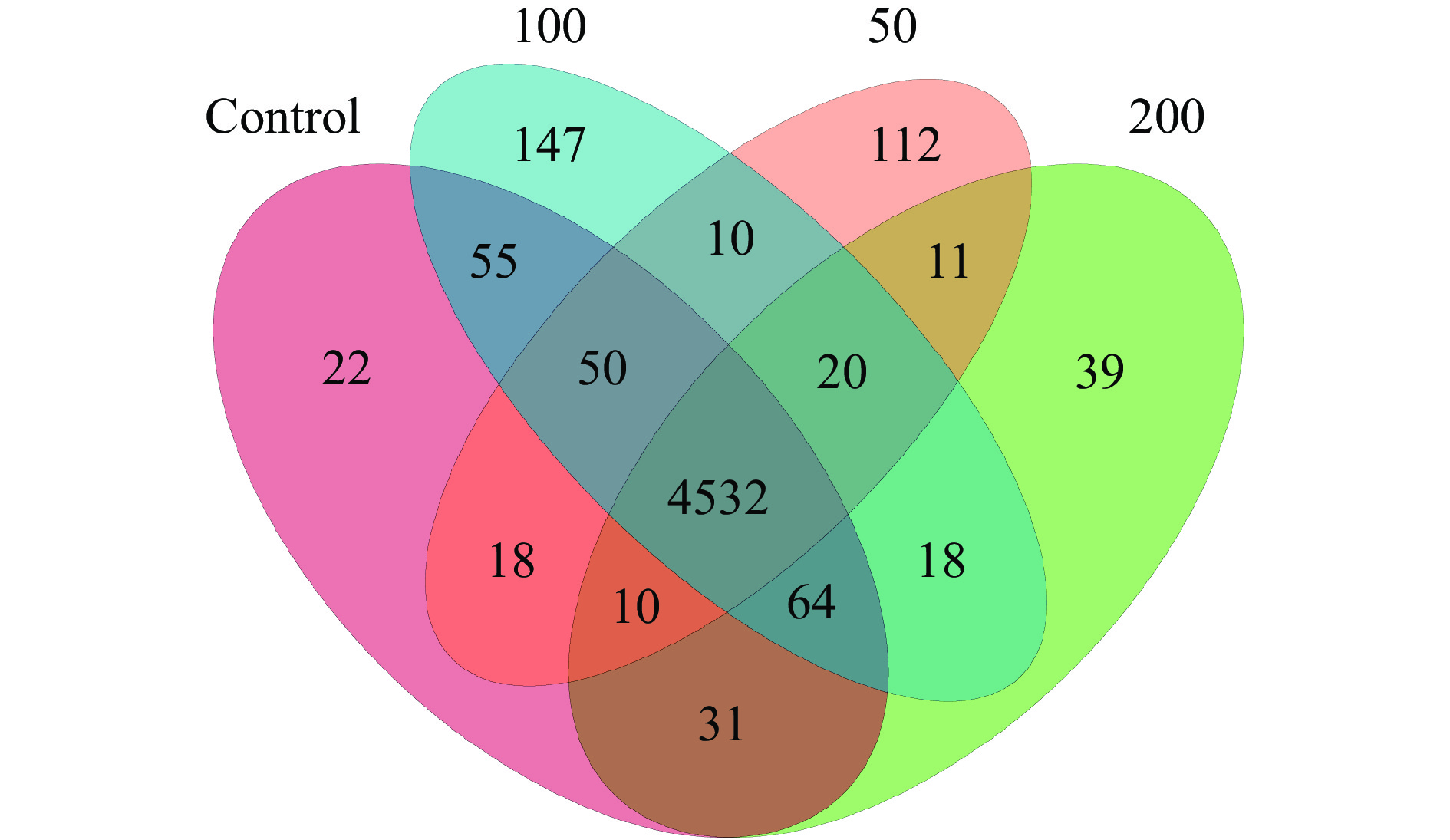
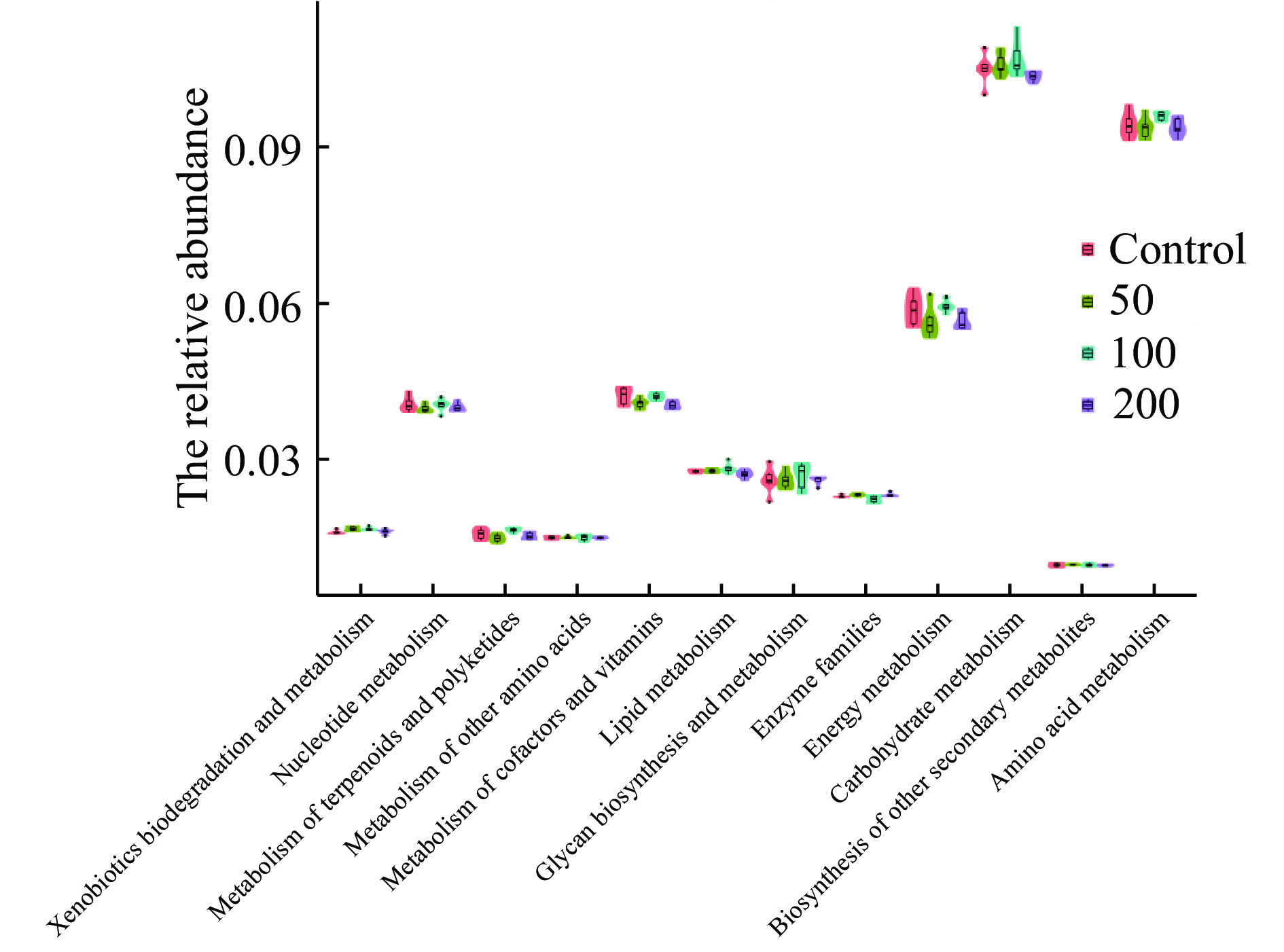
根据PICRUSt功能预测,对照组和JFP-Ps处理组共享4532个功能类群,同时,对照组,JFP-Ps(50 mg/kg BW、100 mg/kg BW、200 mg/kg BW)组分别拥有22、112、147、39个独有的功能类群(图10)。表明JFP-Ps可以增加肠道微生物功能类群的数量。将16S rRNA基因测序数据与代谢功能已知的微生物参考基因组数据库进行对比,如图11结果所示,肠道微生物群参与了碳水化合物、氨基酸、能量、核苷酸、辅助因子以及维生素等物质的代谢过程,其中,参与碳水化合物代谢的肠道微生物丰度最高。
3. 讨论
肠道微生物对于人体的新陈代谢和免疫调节至关重要[13-14]。肠道微生物的优势菌群主要包括拟杆菌门和厚壁菌门,其编码了大量的碳水化合物活性酶(CAZymes),并将大部分碳水化合物降解为能量和营养物质[15]。高脂肪饮食能够增加小鼠体内厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)的比率,并降低疣微菌门(Verrucomicrobia)的比例,补充来自萝卜叶的多糖成分(PRG)能够恢复肠道菌群的组成[16-17]。肠道菌群的丰富度和多样性与肠道相关疾病通常呈负相关[18],拟杆菌门(Bacteroidetes)是肠道微生物维持机体健康状态和稳态的主要参与者,在免疫失调、代谢综合征等疾病中具有积极的作用[19],厚壁菌门(Firmicutes)丰度的降低会导致肝脂质代谢增强[20]。基于门水平的肠道菌群组成分析表明,JFP-Ps能够调节厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)菌群组成,提高了肠道菌群的多样性和丰富度,这与Li等[21]的研究结果一致。本研究表明JFP-Ps能够调节厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的丰度,提高肠道菌群的多样性,从而有效的促进人体健康。
在微生物多样性研究中,相似程度大于97%的序列可归类一个可操作分类单元(OTU),选择具有代表性的序列进行物种注释[22]。本研究发现,实验小鼠肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)、脱铁杆菌门(Deferribacteria)、螺旋体门(Spirochaetes)和TM7等10种菌门构成。Feng等[23]发现在门水平上,肠道中主要有10种厌氧微生物,与本研究结果相似。
普雷沃菌属(Prevotella)可以分解碳水化合物,从而导致总SCFAs和丙酸盐的产量更高[24],其与宿主肥胖存在正相关[25],并且可诱导肠道炎症和口腔炎症等多种疾病[26]。研究表明,异杆菌属(Allobaculum)的丰度与ANGPTL4的表达呈正相关[27] ,血管生成素样蛋白4(ANGPTL4)是脂质代谢的关键调节剂,也是肠道微生物群和脂肪沉积的循环介质。颤螺菌属(Oscillospira)与肠道菌群多样性呈正相关,其丰度可以用于预测低体重指数[28]。低聚半乳糖对维持大鼠肠屏障功能有明显作用,这可能与益生菌乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)的数量增加有关[29]。拟杆菌属(Bacteroides)可以使胆盐水解,将结合型胆汁酸转化为非结合型胆汁酸,并通过相关信号通路的转导发挥其潜在的代谢调节作用[30]。瘤胃球菌属(Ruminococcus)、劳特氏菌属(Blautia)、乳酸杆菌属(Lactobacillus)和颤螺菌属(Oscillospira)是一类产SCFAs菌群[31-32]。SCFAs作为重要的菌群代谢产物,可以驱动宿主与肠道微生物之间的相互作用[33],并与G蛋白偶联受体结合提高宿主免疫力,为上皮细胞提供能量以刺激细胞增殖、分化和成熟,减少细胞的凋亡[34]。在属水平上,进一步通过差异分析,筛选出JFP-Ps显著调控的菌群。本研究发现,JFP-Ps可使小鼠肠道中菌属丰度发生改变,不同程度增加拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcus)、颤螺菌属(Oscillospira)、异杆菌属(Allobaculum)、乳酸杆菌属(Lactobacillus)和副拟杆菌(Parabacteroides)等分解碳水化合物菌属及产SCFAs菌属的丰度。本研究进一步通过PICRUSt功能预测发现参与碳水化合物代谢的肠道微生物类群的丰度最多,这与Yang等[35]的研究结果一致。
综上所述,JFP-Ps可通过调节拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)等肠道优势菌群的组成和结构,增加肠道菌群的多样性,通过改变肠道中分解碳水化合物菌属和产SCFAs菌属的丰度,发挥肠道微生物调节作用,改善宿主肠道微生态健康,研究结果为JFP-Ps在肠道益生产品的研发应用奠定理论基础。
-
表 1 基于门水平的肠道菌群占比(%)
Table 1 Proportion of intestinal microorganisms at phylum level (%)
分类 总数 对照组 JFP-Ps(50 mg/kg BW) JFP-Ps(100 mg/kg BW) JFP-Ps(200 mg/kg BW) Bacteroidetes 46.15±7.02 52.34±8.08 44.44±5.09* 47.18±5.25 40.65±4.59** Firmicutes 44.04±7.74 40.40±9.09 47.34±9.47 40.22±3.59 48.19±4.83 Proteobacteria 7.16±3.36 5.70±2.57 6.46±4.69 8.39±3.44 8.09±2.37 Cyanobacteria 1.04±1.42 0.65±1.04 0.49±0.28 1.32±1.02 1.71±2.42 Verrucomicrobia 0.53±2.34 0.03±0.07 0.02±0.04 2.02±4.64 0.03±0.06 Actinobacteria 0.39±0.36 0.31±0.26 0.52±0.63 0.21±0.11 0.52±0.18 Tenericutes 0.25±0.28 0.07±0.06 0.46±0.15* 0.12±0.14 0.35±0.44 Deferribacteres 0.23±0.25 0.33±0.21 0.13±0.16 0.28±0.42 0.20±0.08 TM7 0.13±0.21 0.03±0.05 0.12±0.11 0.17±0.40 0.20±0.08 Spirochaetes 0.06±0.10 0.11±0.14 0.02±0.03 0.06±0.11 0.05±0.11 Other 0.02±0.04 0.05±0.07 0.01±0.01 0.01±0.01 0.02±0.02 注:与对照组比较,*表示差异显著,P<0.05;**表示差异极显著,P<0.01;表2同。 表 2 基于属水平的肠道菌群占比(%)
Table 2 Proportion of intestinal microorganisms at genus level (%)
分类 对照组 JFP-Ps(50 mg/kg BW) JFP-Ps(100 mg/kg BW) JFP-Ps(200 mg/kg BW) Prevotella 19.87±8.51 8.40±4.03** 8.75±3.55** 7.31±3.41** Bacteroides 6.17±2.48 3.55±2.55 9.25±5.31 2.31±1.64* Ruminococcus 3.35±1.16 4.73±2.39 2.98±1.52 4.26±3.56 Oscillospira 2.16±1.03 2.33±0.73 2.37±1.15 2.75±1.02 Allobaculum 0.16±0.10 1.22±0.36 1.41±0.72 6.20±2.79** Sutterella 0.68±0.21 2.55±1.38 1.39±0.23 1.14±0.39 Lactobacillus 0.98±0.19 1.53±0.37 1.42±0.34 1.59±0.87 Parabacteroides 1.46±0.29 0.71±0.20 1.93±0.81 0.24±0.09 Blautia 2.53±2.15 0.04±0.03 0.98±0.80 0.07±0.03 Paraprevotella 0.58±0.26 0.16±0.08 0.27±0.16 0.13±0.06 Others 62.06±5.07 74.76±8.08 69.26±2.28 73.98±6.23 -
[1] URSELL L K, HAISER H J, TREUREN W V, et al. The intestinal metabolome: An intersection between microbiota and host[J]. Gastroenterology,2014,146(6):1470−1476. doi: 10.1053/j.gastro.2014.03.001
[2] O'HARA A M, SHANAHAN F. The gut flora as a forgotten organ[J]. EMBO Reports,2006,7(7):688−693. doi: 10.1038/sj.embor.7400731
[3] BEHARY J, AMORIM N, JIANG X, et al. Gut microbiota impact on the peripheral immune response in non-alcoholic fatty liver disease related hepatocellular carcinoma[J]. Nature Communications, 2021, 12(1).
[4] CAO S, ZHAO C, XU X, et al. Dietary plants, gut microbiota, and obesity: Effects and mechanisms[J]. Trends in Food Science & Technology,2019,92:194−204.
[5] CHASSAING B, KOREN O, GOODRICH J K, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J]. Nature (London),2015,519(7541):92. doi: 10.1038/nature14232
[6] BAJAJ J S. Alcohol, liver disease and the gut microbiota[J]. Nature Reviews. Gastroenterology & hepatology,2019,16(4):235−246.
[7] HUANG X, NIE S, XIE M. Interaction between gut immunity and polysaccharides[J]. Critical Reviews in Food Science and Nutrition,2017,57(14):2943−2955. doi: 10.1080/10408398.2015.1079165
[8] ZHANG Y J, ZHU K X, HE S Z, et al. Characterizations of high purity starches isolated from five different jackfruit cultivars[J]. Food Hydrocolloids,2016,52:785−794. doi: 10.1016/j.foodhyd.2015.07.037
[9] OMAR H S, EL-BESHBISHY H A, MOUSSA Z, et al. Antioxidant activity of Artocarpus heterophyllus Lam. (jackfruit) leaf extracts: Remarkable attenuations of hyperglycemia and hyperlipidemia in streptozotocin-diabetic rats[J]. The Scientific World Journal,2011,11:788−800. doi: 10.1100/tsw.2011.71
[10] ZHU K X, ZHANG Y J, NIE S P, et al. Physicochemical properties and in vitro antioxidant activities of polysaccharide from Artocarpus heterophyllus Lam. pulp[J]. Carbohydrate Polymers,2017,155:354−361. doi: 10.1016/j.carbpol.2016.08.074
[11] 朱科学, 王颖倩, 张彦军, 等. 菠萝蜜多糖对脾淋巴细胞抗氧化作用及免疫功能的影响[J]. 食品科学,2017,38(23):207−212. [ZHU K X, WANG Y Q, ZHANG Y J, et al. Antioxidant and immunoenhancing activity of polysaccharide from Artocarpus heterophyllus Lam. on spleen lymphocytes[J]. Food Science,2017,38(23):207−212. [12] DESANTIS T Z, HUGENHOLTZ P, LARSEN N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology,2006,72(7):5069−5072. doi: 10.1128/AEM.03006-05
[13] LAVELLE A, SOKOL H. Gut microbiota-derived metabolites as key actors in inflammatory bowel disease[J]. Nature Reviews Gastroenterology & Hepatology,2020,17(4):223−237.
[14] PRAVEEN M A, PARVATHY K R K, BALASUBRAMANIAN P, et al. An overview of extraction and purification techniques of seaweed dietary fibers for immunomodulation on gut microbiota[J]. Trends in Food Science & Technology,2019,92:46−64.
[15] PAYLING L, FRASER K, LOVEDAY S M, et al. The effects of carbohydrate structure on the composition and functionality of the human gut microbiota[J]. Trends in Food Science & Technology,2020,97:233−248.
[16] DO M H, LEE H, OH M, et al. Polysaccharide fraction from greens of Raphanus sativus alleviates high fat diet-induced obesity[J]. Food Chemistry,2021,343:128395. doi: 10.1016/j.foodchem.2020.128395
[17] CROVESY L, MASTERSON D, ROSADO E L. Profile of the gut microbiota of adults with obesity: A systematic review[J]. European Journal of Clinical Nutrition,2020,74(9):1251−1262. doi: 10.1038/s41430-020-0607-6
[18] NEELIS E, KONING B, RINGS E, et al. The gut microbiome in patients with intestinal failure: Current evidence and implications for clinical practice[J]. Journal of Parenteral and Enteral Nutrition,2019,43(2):194−205. doi: 10.1002/jpen.1423
[19] GIBIINO G, LOPETUSO L R, SCALDAFERRI F, et al. Exploring bacteroidetes: Metabolic key points and immunological tricks of our gut commensals[J]. Digestive and Liver Disease,2018,50(7):635−639. doi: 10.1016/j.dld.2018.03.016
[20] CHEN Y, CHIU C, HUNG S, et al. Gnotobiotic mice inoculated with Firmicutes, but not Bacteroidetes, deteriorate nonalcoholic fatty liver disease severity by modulating hepatic lipid metabolism[J]. Nutrition Research,2019,69:20−29. doi: 10.1016/j.nutres.2019.07.001
[21] LI S, QI Y, CHEN L, et al. Effects of Panax ginseng polysaccharides on the gut microbiota in mice with antibiotic-associated diarrhea[J]. International Journal of Biological Macromolecules,2019,124:931−937. doi: 10.1016/j.ijbiomac.2018.11.271
[22] BOKULICH N A, SUBRAMANIAN S, FAITH J J, et al. Quality-filtering vastly improves diversity estimates from illumina amplicon sequencing[J]. Nature Methods,2013,10(1):57−59. doi: 10.1038/nmeth.2276
[23] FENG W W, LIU J, TAN Y Z, et al. Polysaccharides from Atractylodes macrocephala Koidz. ameliorate ulcerative colitis via extensive modification of gut microbiota and host metabolism[J]. Food Research International,2020,138:109777. doi: 10.1016/j.foodres.2020.109777
[24] CHRISTENSEN L, VUHOLM S, ROAGER H M, et al. Prevotella abundance predicts weight loss success in healthy, overweight adults consuming a whole-grain diet ad libitum: A post hoc analysis of a 6-wk randomized controlled trial[J]. The Journal of Nutrition,2019,149(12):2174−2181. doi: 10.1093/jn/nxz198
[25] REN W, YAN H L, YU B, et al. Prevotella-rich enterotype may benefit gut health in finishing pigs fed diet with a high amylose-to-amylopectin ratio[J]. Animal Nutrition,2021,7(2):400−411. doi: 10.1016/j.aninu.2020.08.007
[26] LEY R E. Gut microbiota in 2015: Prevotella in the gut: Choose carefully[J]. Nature Reviews Gastroenterology & Hepatology,2016,13(2):69−70.
[27] ZHENG Z B, LYU W T, REN Y, et al. Allobaculum involves in the modulation of intestinal ANGPTLT4 expression in mice treated by high-fat diet[J]. Frontiers in Nutrition,2021:8.
[28] KONIKOFF T, GOPHNA U. Oscillospira: A central, enigmatic component of the human gut microbiota[J]. Trends in Microbiology,2016,24(7):523−524. doi: 10.1016/j.tim.2016.02.015
[29] ZHONG Y, CAI D, CAI W, et al. Protective effect of galactooligosaccharide-supplemented enteral nutrition on intestinal barrier function in rats with severe acute pancreatitis[J]. Clinical Nutrition,2009,28(5):575−580. doi: 10.1016/j.clnu.2009.04.026
[30] JIA W, RAJANI C, XU H X, et al. Gut microbiota alterations are distinct for primary colorectal cancer and hepatocellular carcinoma[J]. Protein & Cell,2021,12(5):374−393.
[31] XIE Y T, WANG C, ZHAO D, et al. Processing method altered mouse intestinal morphology and microbial composition by affecting digestion of meat proteins[J]. Frontiers in Microbiology,2020:11.
[32] YUAN X, XUE J, TAN Y, et al. Albuca Bracteate polysaccharides synergistically enhance the anti-tumor efficacy of 5-fluorouracil against colorectal cancer by modulating beta-catenin signaling and intestinal flora[J]. Frontiers in Pharmacology,2021,12:736627. doi: 10.3389/fphar.2021.736627
[33] BLACHER E, LEVY M, TATIROVSKY E, et al. Microbiome-modulated metabolites at the interface of host immunity[J]. The Journal of Immunology,2017,198(2):572−580. doi: 10.4049/jimmunol.1601247
[34] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites[J]. Cell,2016,165(6):1332−1345. doi: 10.1016/j.cell.2016.05.041
[35] YANG X M, LI S N, WANG C, et al. Whole and polysaccharide powdered Sporisorium reilianum improves DSS-induced colitis in BALB/c mice by modulating gut microbiota[J]. Journal of Functional Foods,2021,79:104409. doi: 10.1016/j.jff.2021.104409





 下载:
下载:
 下载:
下载:
