Research Progress on Extraction, Purification and Functional Activity of Seabuckthorn Flavonoids
-
摘要: 沙棘作为药食同源的植物,其主要的功能性成分为黄酮类物质,是优质的黄酮来源。本文归纳整理了已发表的相关文献资料,对沙棘黄酮类物质提取纯化方法的原理及特点、结构及检测方法进行了对比分析,介绍了沙棘黄酮类物质的代谢特征,并从调节肠道微生态的角度阐述了沙棘黄酮抗病毒、抗炎、保护肝脏、改善肥胖和降血糖等多种生理功能的作用机制。总结发现沙棘黄酮虽然具有多种生理功能,但其低生物利用度与生理功效之间的机制机理尚未完全阐明,应关注沙棘黄酮的功能机理和应用研究,以促进沙棘黄酮的开发利用和沙棘的精深加工。Abstract: As a kind of medicinal and edible plant, sea buckthorn is a high-quality source of flavonoids, and its main functional component is flavonoids. In this paper, the published literature is sorted out to compare and analyze the different extraction and purification methods, and structural detection methods of seabuckthorn flavonoids. In addition, the physiological metabolism of seabuckthorn flavonoids is summarized, and the mechanisms of action on various physiological functions such as anti-virus, anti-inflammatory, liver protection, obesity improvement and hypoglycemia are described from the perspective of regulating intestinal micro-ecology. Although seabuckthorn flavonoids have various physiological functions, the underlying mechanism between its low bioavailability and the physiological effects has not been fully elucidated. It is necessary to focus on the related research area for promoting the development, utilization, and deep processing of sea buckthorn.
-
沙棘(Hippophae rhamnoides L.)又称沙枣、吉汉、酸柳、达普等,属于胡颓子科沙棘属的一种落叶性灌木或乔木,具有药食同源性。沙棘原产于欧洲和亚洲,目前在世界广泛种植,大部分生长于北欧、中国、蒙古、俄罗斯和加拿大,在我国西南、西北、华北及东北等地均有分布。沙棘营养丰富,含有维生素E、C、K、A、B、P,氨基酸,脂肪酸(饱和、不饱和脂肪酸),有机酸,挥发油,类胡萝卜素,甾类化合物,黄酮,多酚,植物蛋白和脂肪等多种营养成分。多项研究已显示沙棘具有广泛的药理作用,如免疫调节、抗氧化、护肝、抗动脉粥样硬化、抗菌和治疗代谢性疾病等[1-2]。
在沙棘的各种营养成分中,黄酮类化合物是主要功能性成分之一。黄酮类化合物是植物体内的次生代谢产物,主要存在于植物的果实、根、茎、叶等部位,在植物体内多数与糖结合成苷类,少数以游离苷元形式存在。沙棘中的黄酮类化合物包含黄酮醇类、黄烷醇类等多种化学物质,其黄酮的种类和含量因其产地、品种和部位而异,王春艳[3]研究发现,沙棘果实和沙棘种子黄酮的含量分别为14.62和2.48 mg/100 g。白晓州等[4]比较了不同品种沙棘果渣中的营养成分,发现亚种沙棘果渣中的总黄酮含量最高,达到3.19%;其次为江孜沙棘果渣,总黄酮含量为2.56%。
沙棘是一种我国传统的药食同源植物,其提取物已被广泛应用于食品、药品等领域,尤其在医学产品应用上起到了积极作用。我国沙棘资源丰富,但目前沙棘市售产品以沙棘油、沙棘果汁饮料、沙棘果酒等为主,在营养功能食品、膳食补充剂、保健食品等领域的沙棘产品有待开发,这可能与沙棘部分活性物质的作用机制尚未完全阐述清楚有关。研究显示,肠道微生态与人类多种疾病的发生密切相关,肠道菌群的紊乱会改变宿主共生细菌和机体新陈代谢和免疫功能,引起肥胖、糖尿病、炎症、脂肪肝等多种代谢疾病,而膳食是影响肠道菌群结构组成及其代谢产物的主要因素,食用黄酮类化合物作为营养补充剂有助于调节肠道微生态,其摄入量与代谢疾病发生率之间呈现显著负相关[5-6]。经研究证明植物黄酮的生物利用度较低,在被人体摄入后,通过肠道微生物的分解代谢转变为小分子的单酚酸进一步被机体吸收。目前,已有多篇文献报道了沙棘黄酮类物质的抗氧化活性、抗炎活性、抑制肿瘤生长、改善心血管疾病、改善肾脏纤维化等多种生理活性[7-11],其多种生理功能与低生物利用度形成鲜明对比,但未见有关沙棘黄酮对肠道菌群调节作用的系统阐述,需进一步挖掘沙棘黄酮的作用机制和功能物质基础,以及其作为益生元的功能机制。本综述主要介绍了沙棘黄酮的提取纯化工艺和检测方法,并且以肠道菌群为新视角论述其生理功能的潜在作用机制,旨在为沙棘资源的研究和开发应用提供理论参考。
1. 沙棘黄酮类物质提取及纯化工艺
1.1 沙棘黄酮类物质提取方法
沙棘黄酮类物质提取方法包括有机溶剂提取法、酶法辅助提取、超声波辅助提取、微波辅助提取法以及新兴的提取分离技术如超临界流体萃取、亚临界水萃取以及离子液体萃取法等,表1对沙棘黄酮类物质不同提取方法及提取率进行了汇总。周欣等[12]概括和简单比较了溶剂提取法、微波提取法、索氏提取法、普通超声提取法、超声循环提取法、匀浆法和超声微波双辅助提取法7种沙棘叶和沙棘果实中总黄酮的提取工艺,对比发现有机溶剂提取法提取率较高,但耗时较长,在缺少设备的情况下,匀浆法能够缩短提取时间、提高提取率;索氏提取法更适用于实验室进行提取;微波辅助提取法、超声波辅助提取和超声波微波双辅助提取法操作更简单、更省时,其中超声波微波双辅助提取方法得到的沙棘黄酮的提取率更高,更适合规模化生产。
表 1 沙棘黄酮不同提取方法汇总表Table 1. Summary of different extraction methods of seabuckthorn flavonoids来源 沙棘产地 提取方法 料液比(g/mL) 提取溶剂 提取温度(℃) 提取
时间提取
次数其他条件 提取率(%) 沙棘果粉 吉林省蛟河市 有机溶剂提取 1:60 90%乙醇 80 2 h 3 − 2.665[18] 沙棘果粉 郴州市老百姓大药房 微波辅助提取 1:25 80%乙醇 − 90 s 1 微波功率400 W 4.99[19] 沙棘叶 祁州药材堂 有机溶剂提取 1:10、1:8 50%乙醇 80 2、1.5 h 2 − 1.852[20] 沙棘叶 印度 超临界CO2萃取 1:5 20%乙醇 50 − 3 压力200 bar 1.771[13] 沙棘叶 印度 亚临界水萃取 2:33 水 200 15 min 3 − 49.20[15] 大果沙棘果渣 黑河市孙吴县 酶法提取 1:20 71.4%乙醇 50 2 h 1 纤维素酶(10 U/mg)
用量0.85 mg/mL,
酶解温度50.9℃,pH5.1,
酶解时间2 h。0.898[21] 沙棘籽粕 山西省岢岚县酸溜溜饮料厂 超声波辅助提取 1:30 59%乙醇 54 20 min 2 超声波功率60 W 7.11[22] 超临界流体萃取技术是一种新型绿色的萃取技术,是使用处于超临界状态的流体作为萃取溶剂,如乙烯、二氧化碳、乙烷、甲醇、乙醇、乙酸乙酯、水等。由于二氧化碳价格经济、无毒且是惰性气体,因此常被用于超临界流体萃取技术。Jayashankar等[13]采用超临界二氧化碳萃取技术从沙棘叶中提取黄酮,使用20%的乙醇作为夹带剂,在压力为200 bar、提取温度为50 ℃的条件下沙棘叶黄酮的提取率为1.771%。虽然超临界流体萃取技术在天然植物活性成分提取方面具有无损提取等优点,但由于提取原料的复杂性,在实际生产过程中使用单一萃取剂难以实现有效萃取,需要结合原料特性对萃取工艺进行摸索,因提取成本较高等问题在沙棘黄酮提取中应用较少。
亚临界水是指在一定的压力条件下,将水温调节在100~374 ℃(后者是水的临界温度),使水在亚临界液态条件下极性随温度的变化而变化[14]。亚临界水萃取技术可以通过调整温度和压力来改变水的极性,如在较低温度下提取极性大的化合物,在较高温度下提取极性小的化合物等。Kumar等[15]采用亚临界水萃取技术对沙棘叶中的黄酮进行提取,结果表明与浸渍法(15.41%)和索氏抽提法(31.65%)相比,亚临界水萃取法提取最优(49.20%)。该方法消耗溶剂少,提取时间较短,是一种经济绿色的提取技术,但也存在产品纯度较低的问题,需要与超声波等其他技术相联用。
离子液体是由有机阳离子和无机或有机阴离子组成的有机盐溶液,作为替代传统挥发性有机溶剂的新型绿色溶剂,具有熔点低、热稳定性高、溶解性好、蒸气压低、极性可控、毒性低、可回收等优点[16]。与用于萃取的传统有机溶剂相比,离子液体更加环保,因此常被用于从天然产物中提取生物活性成分,如黄酮、多糖、酚类物质等。研究发现,用离子液体萃取后,与传统萃取技术相比,沙棘叶中芦丁、异鼠李素、槲皮素和山奈酚的提取率提高,且提取时间缩短[17]。
目前,沙棘黄酮类化合物的提取技术仍存在提取率低、纯度低以及操作繁琐等诸多问题,新兴的提取技术研究相对较少,需进一步优化沙棘黄酮的提取技术,加大新兴技术的研究和在工业生产中的应用,研发更简单、有效、经济的沙棘黄酮提取方法,为其产业化及相关产品的研发奠定基础。
1.2 沙棘黄酮类化合物的分离纯化
沙棘黄酮类化合物的分离纯化是提高沙棘黄酮类物质的纯度,以更好地发挥其生理功效的重要步骤。目前,常用的黄酮类化合物的分离纯化方法包括大孔吸附树脂纯化法、硅胶柱色谱法、薄层层析法、高速逆流色谱分离法、膜分离法、超临界CO2萃取法、双水相萃取法等。张程慧等[23]对沙棘黄酮大孔吸附树脂纯化法、硅胶柱色谱法、薄层层析法、高速逆流色谱分离法和膜分离法5种分离纯化方法进行了综述和概括,其中大孔吸附树脂选择性好、操作条件温和、可重复使用,常被用于工业上大批量分离纯化黄酮,大孔吸附树脂类型的选择、定向合成树脂的应用也是研究热点内容;薄层层析法在沙棘黄酮的检测、鉴定方面应用较多,单独进行分离纯化的研究较少;柱色谱法中近年较广泛应用的是闪式硅胶柱色谱,其在沙棘黄酮分离纯化方面的研究有待加强;与常规纯化方法相比,高速逆流色谱的主要优势是进样量大、回收率高;膜分离技术是近几十年来迅速发展起来的一种新型高效分离技术,主要利用半透膜选择透过性的原理实现物质的分离,具有能耗低、单级分离效率高、工艺简单、对环境无污染等优点,但关于膜分离技术在沙棘黄酮类化合物的应用研究资料较少,后续可加强此方面的研究,得到适合沙棘黄酮类化合物的膜分离方法。周欣等[12]对大孔吸附树脂法、膜过滤法和聚酰胺洗脱法3种沙棘总黄酮的分离纯化方法进行了比较,其中聚酰胺洗脱法是利用氢键吸附作用实现物质的分离纯化,其作用效果取决于羟基的数量,并指出关于聚酰胺洗脱法和膜分离法在沙棘总黄酮的分离纯化中的应用有待加强。
相对于银杏黄酮、葛根总黄酮、大豆异黄酮等广泛应用的植物黄酮,沙棘黄酮类物质的分离纯化尚未形成系统的研究。目前市面上的沙棘黄酮类物质存在纯度低而难以发挥其功效的问题,开发工艺简单、安全高效、能耗较低的分离纯化方法制备高生物活性的沙棘黄酮类化合物是未来的研究重点。此外,可以将高速逆流色谱分离法、超临界CO2萃取法等分离纯化方法与纳米微胶囊技术等新技术相结合,以提高沙棘高深加工技术水平和促进沙棘高端产品的开发。
2. 沙棘黄酮类物质的检测方法及结构分析
沙棘黄酮类物质的检测和分析方法包括紫外分光光度法、高效液相色谱分析法、高效液相色谱-质谱分析法和核磁共振法。沙棘黄酮类化合物的代表物质及检测方法如表2所示。目前已从沙棘属植物中分离出近50余种黄酮类化合物,主要以芦丁、槲皮素、山奈酚、异鼠李素、儿茶素和杨梅素等为苷元,与葡萄糖、鼠李糖等糖元结合成苷[24]。
表 2 沙棘黄酮类代表物质结构及检测方法Table 2. Structures and detection methods of representative substances of seabuckthorn flavonoids结构式 名称 检测方法 保留时间/
二级质谱离子检测条件 
芦丁 高效液相色谱[17]
高效液相色谱-
质谱[28-29]5.00 min
母离子(m/z 609.0),
子离子(m/z 207.9)a.高效液相色谱法:流动相为甲醇-乙腈-水(40:15:45);检测波长为
368 nm;流速为1.0 mL/min;进样量为
10 μL,等度洗脱。
槲皮素 高效液相色谱[17]
高效液相色谱-
质谱[28-29]11.00 min
母离子(m/z 308.8),
子离子(m/z 151.0)
山奈酚 高效液相色谱[17]
高效液相色谱-
质谱[28-29]7.10 min
母离子(m/z 284.8),
子离子(m/z 150.8)
异鼠李素 高效液相色谱[17]
高效液相色谱-
质谱[28-29]12.20 min
母离子(m/z 315.0),
子离子(m/z 300.1)
没食子酸 高效液相色谱-
质谱[28-29]母离子(m/z 169.1),
子离子(m/z 125.0)b.高效液相色谱-质谱检测方法1:①色谱条件:流动相A为含0.1%甲酸的甲醇溶液,流动相B为乙腈-甲醇(75:25);流速为1 mL/min,梯度洗脱,进样量为2 μL;②质谱条件:电喷雾离子源,负离子模式 (ESI−)。 
槲皮素-3-葡萄糖苷 高效液相色谱-
质谱[29]母离子(m/z 463.1),
子离子(m/z 301.0)
杨梅素 高效液相色谱-
质谱[28]母离子(m/z 316.9),
子离子(m/z 137.0)
金丝桃苷 高效液相色谱-
质谱[28]母离子(m/z 463.0);
子离子(m/z 270.9)
木犀草素 高效液相色谱-
质谱[29]母离子(m/z 284.7),
子离子(m/z 135.8)c.高效液相色谱-质谱检测方法2:色谱条件:流动相A为0.1%甲酸,流动相B为甲醇,70%B等度洗脱,流速为
0.2 mL/min,进样量为2 μL;质谱条件:电喷雾离子源,负离子模式(ESI−);扫描方式为多反应监测(MRM)模式。
柚皮苷 高效液相色谱-
质谱[29]母离子(m/z 579.5),
子离子(m/z 116.0)
柚皮素 高效液相色谱-
质谱[29]母离子(m/z 271.0),
子离子(m/z 119.0)
表儿茶素没食子酸酯 高效液相色谱-
质谱[29]母离子(m/z 442.3),
子离子(m/z 289.2)紫外分光光度法的测定原理是黄酮类化合物有在紫外光谱300~550 nm产生吸收带的环肉桂酰类物质和240~280 nm产生吸收带的环苯酰类物质,通过测定溶液在光谱区的吸光度定量计算出目标物质的浓度[25],该方法灵敏度高,重复性好,适用于测定沙棘中总黄酮的含量。
高效液相色谱分析法和高效液相色谱-质谱分析法具有干扰少、重现性好、分析速度快、灵敏度高等优点,更适合测定沙棘黄酮类物质的结构测定。高效液相色谱法测定沙棘中黄酮类物质主要集中于芦丁和异鼠李素的检测,但并不能反映沙棘中所有的黄酮类成分,极大制约了沙棘黄酮药用机理的研究[26],而高效液相色谱-质谱分析法能够快速、准确对物质进行定量分析,有利于发现提取物中的目标微量成分,实现对沙棘黄酮类化合物的高通量测定。
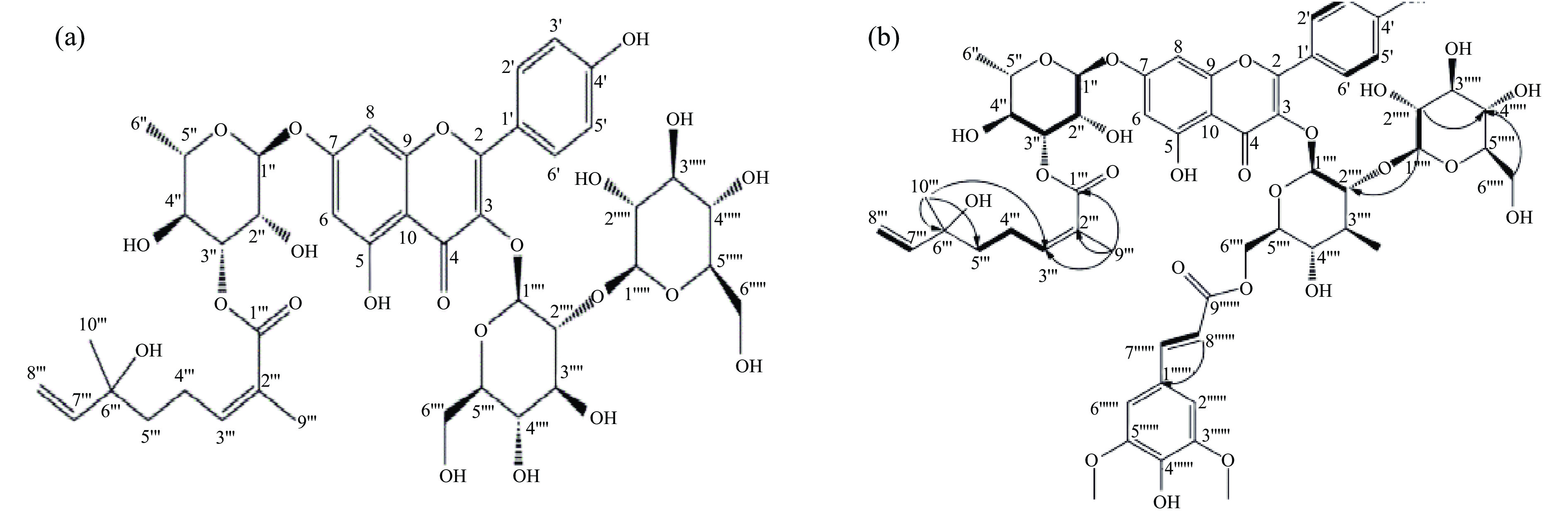
核磁共振法如今已成为黄酮类化合物结构分析的一种重要方法。无水氘溶解范围广,各质子信号峰分辨率高,对鉴别黄酮母核上的酚羟基是一个理想的溶剂,因此在核磁共振中常用无水氘替代二甲基亚砜作为溶剂。Zhou等[27]用逆流色谱法纯化沙棘籽粕中的黄酮苷并采用核磁共振法进行鉴定,发现了两种新的沙棘黄酮化合物,分别为3-O-β-D-槐糖基山奈酚-7-O-{3-O-[2(E)-2,6-二甲基-6-羟基辛-2,7-二烯酰基]}-α-L-鼠李糖苷和沙巴酮(如图1)。核磁共振法方法准确、重现性好、回收率高且简单易操作,还可以节约大量试剂、污染小,是一种很有潜力的测定方法,但目前国内采用核磁共振法测定沙棘黄酮的文献报道较少,可加强此方面的研究。
3. 沙棘黄酮类物质的生理代谢
植物黄酮类物质大多以糖基化或苷元杂环分子形态存在,经人体摄入后,只有5%~10%被直接吸收,因其有限吸收、全身代谢和排泄快速而具有较低的生物利用度,但大部分在小肠中未被吸收的黄酮类化合物在结肠中经过肠道微生物分解代谢可转化为小分子的单酚酸(如图2)。与黄酮类化合物母体相比,其肠道菌群代谢产生的单酚酸的生物利用度更高,更容易被人体吸收,在人体血浆中的含量可达到微摩尔浓度[6]。
沙棘黄酮类物质主要活性物质包括芦丁、槲皮素、山奈酚、异鼠李素、杨梅素等黄酮醇类,儿茶素表、儿茶素等黄烷醇类,柚皮素、二氢杨梅素等二氢黄酮类,以及原花青素B1等花青素类成分[30]。研究发现,槲皮素在链球菌S-2、乳酸菌L-2、双歧杆菌B-9和拟杆菌JY-6等肠道菌群的作用下,能够转化成3,4-二羟基苯乙酸、4-羟基苯甲酸等小分子,进而被人体吸收利用,其中小分子3,4-二羟基苯乙酸能够改善胰岛素分泌、葡萄糖代谢,以及乙酰氨基酚诱导引起的小鼠肝损伤[31-33]。植物黄酮类物质的吸收代谢是多种肠道微生物相互作用、协同合作完成的复杂过程,肠道微生物能够促进黄酮类物质转化为具有生物活性的代谢小分子,提高黄酮类物质在机体内的代谢吸收、生物利用度及生理活性。因此,沙棘黄酮类物质在人体内产生多种生理功能可依赖于肠道微生物的分解代谢作用,主要通过改变肠道菌群的结构及酶系统分解代谢不同生物活性小分子进而对人体健康产生影响,但其作为益生元的功能机制还需进一步研究。
4. 沙棘黄酮类物质的生理功能
植物黄酮类化合物被人体摄入后,经肠道微生物代谢为小分子的单酚酸等代谢产物,这些代谢物质与机体组织细胞表面的特定受体相结合,对多个基因的表达及其信号通路产生影响[34-35]。大量研究表明,黄酮类化合物能通过调节肠道菌群发挥其抗氧化、抗炎、调节血糖、降血脂等多种生理活性,从而预防多种疾病[36]。沙棘黄酮作为良好的植物黄酮来源,许多研究通过细胞模型、动物模型等方法证明沙棘黄酮的抗病毒、抗炎、保护肝脏、改善肥胖和降血糖等生理功效及其对肠道微生物的调节作用,但相关机制机理仍需深入挖掘。
4.1 抗病毒
在植物酚类化合物等次生代谢产物中,黄酮类化合物在针对人类和动物疾病的药用增强特性方面发挥着重要的作用[37]。研究发现,黄酮类化合物通过肠道微生物在抵抗严重的流感病毒感染中发挥着重要作用,黄酮类化合物经过肠道微生物-酪酸梭状芽孢杆菌降解后产生代谢物-脱氨基酪氨酸,其被人体吸收后能够刺激I型干扰素信号通路,诱导干扰素刺激基因(Interferon-Stimulated Gene,ISG)上调表达,从而增强机体巨噬细胞的天然抗病毒免疫反应和调节抗原呈递细胞以及T细胞的功能[38-39]。沙棘是富含抗病毒活性黄酮类化合物的重要药用植物之一,与抗流感药物奥司他韦相比,沙棘乙酸乙酯提取物和甲醇提取物都表现出更强的抗流感病毒活性,进一步分析发现沙棘叶提取物中的黄酮苷元和黄酮单糖苷与抗病毒活性高度相关,其中黄酮单糖苷可通过抑制病毒复制的初始阶段发挥较强的抗病毒活性[40-41]。通过网络药理学结合计算机模拟分子对接方法筛选得到藏药五味沙棘散治疗新型冠状病毒肺炎的主要活性成分是4个黄酮类物质(山奈酚、槲皮素、甘草苷和甘草异黄烷酮),其与新型冠状病毒的靶点结合力最强,通过“多成分-多靶点”的作用方式调节多条信号通路,达到对新型冠状病毒肺炎的潜在治疗功效[42]。
4.2 抗炎活性
近年来,药用植物及其生物活性成分作为免疫调节剂的免疫疗法已有逐渐替代药物治疗等传统疗法的发展趋势[43],植物提取物作为免疫调节剂,具有易获得、制备方法简单、副作用较小且较强功效作用等优势。研究证明机体炎症反应与肠道微生物密切相关,脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁组成成分,肠道菌群紊乱会加剧LPS内毒素刺激机体分泌肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-4(IL-4)和白细胞介素-13(IL-13)以及蛋白酶激活受体-2(proteinase activated receptor-2,PAR-2)等细胞因子破坏肠道屏障,导致组织炎症发生并引起免疫反应[5]。Sun等[44]研究发现黄酮类化合物-杨梅素通过调节产丁酸的肠道微生物(异杆菌属(Allobaculum sp.)、诺卡氏菌科(Nocardiaceae)、毛螺菌科(Lachnospiraceae)等)和保护肠道屏障功能来降低炎症的发生。研究显示,沙棘黄酮可抑制细胞内一氧化氮(NO)产生和TNF-α、IL-6、环氧化酶-2(COX-2)等促炎因子的分泌,同时,沙棘黄酮能够促进肠道紧密连接蛋白中闭锁连接蛋白1(ZO-1)和闭合蛋白(Occludin)mRNA的表达,修复肠粘膜,并通过抑制NLRP3炎性小体及相关分子的信号通路发挥抗炎作用[45-46],沙棘黄酮可作为植物抗炎剂的重要来源。
4.3 保护肝脏
久坐不动的生活方式、饮食热量过剩和过度肥胖均会引起肝脏脂肪合成代谢失调以及游离脂肪酸过量沉积,导致肝损伤。随着大数据和循证医学的发展,天然药物活性成分在保护肝脏方面的独特药理活性得到进一步挖掘[47]。黄酮类化合物由于其广泛的药理作用和低毒性受到国内外学者的关注,研究表明,摄入富含黄酮类化合物的食物有益于肝脏的保护[6,48]。基于肝脏脂肪变性的动物模型,研究证明黄酮类化合物经过肠道微生物分解产生的3,4-二羟基苯甲酸、3,4,5-三羟基苯甲酸、3,5-二甲氧基-4-羟基苯甲酸等代谢物,通过改变肝脏脂质代谢来改善脂肪肝症状[6]。沙棘黄酮可以降低非酒精性脂肪肝模型大鼠血清中的谷丙转氨酶、谷草转氨酶水平以及肝组织中的游离脂肪酸、胆固醇、甘油三酯的含量,并通过激活蛋白激酶(Adenosine 5'-monophosphate (AMP)-activated protein kinase,AMPK)-过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)信号通路减少脂质的堆积来缓解大鼠非酒精性脂肪肝的损伤情况[49]。此外,沙棘黄酮能够降低肝脏中p65核转录因子(nuclear factor-κ-gene binding,NF-κB)、p38有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)和转化生长因子(TGF)β激活激酶1(TAK-1)的蛋白和mRNA表达,改善酒精性脂肪肝小鼠的肝脏损伤,同时,16S RNA基因高通量测序结果显示,沙棘黄酮可有效提高酒精性肝脏损伤小鼠肠道菌群的丰富度和均匀度,改善肠道菌群紊乱[50]。
4.4 改善肥胖
目前,超重和肥胖已成为全球流行趋势,在我国超重和肥胖也逐渐成为不容忽视的公共健康问题。肥胖是由于能量摄入大于能量消耗而引起的脂肪过度积累现象,与血脂异常、胰岛素抵抗和非酒精性脂肪肝病等多种慢性疾病密切相关[51]。膳食补充富含黄酮的植物活性物质可以重塑肠道菌群的结构组成,保护肠道健康,从而对高脂膳食引起的肥胖进行有效干预[52]。基于肥胖动物模型,研究证明植物黄酮类化合物经肠道微生物分解产生的对羟基苯丙酸、4-羟基乙酸、4-羟基甲氧基苯甲酸等代谢物抑制肝脏脂肪生成,诱导脂肪组织中的产热因子(解偶联蛋白1和PPARγ辅助活化因子1-α)上调表达促进脂肪分解,改善高脂饮食引起的肥胖症状[6]。此外,黄酮类化合物对机体脂肪代谢的调控还可通过介导miRNAs、肝脏组织腺苷酸活化AMPK通路、有丝分裂克隆扩增(mitotic clonal expansion,MCE)和神经系统等途径影响脂肪代谢相关基因及转录因子的表达[53]。研究发现,沙棘籽黄酮提取物能明显降低高脂饮食诱导的肥胖小鼠的体重、肝脏脂肪积累和血清甘油三酯水平,抑制肥胖引起的慢性炎症反应,通过分子水平检测证明沙棘籽黄酮提取物对肥胖的改善作用与抑制PPARγ的表达有关,其中含量最高的两种成分异鼠李素和山奈酚能够有效促进脂肪分解[54]。沙棘叶黄酮类糖苷提取物通过抑制高脂肪饮食小鼠脂肪组织中脂肪的合成和吸收来降低肥胖,同时促进能量消耗,此外,沙棘叶黄酮类糖苷提取物能够改善饮食诱导的肥胖及其代谢并发症(如血脂异常、炎症、肝脂肪变性等)的有害影响,从而调节肥胖引起的代谢紊乱[55]。
4.5 降血糖作用
随着生活水平提高、老龄化加剧以及肥胖人群的增加,糖尿病患者也呈现逐年增加的趋势。据报道[56],我国成人中超过1/3(35.2%)人群处于糖尿病前期,而用于临床治疗的降血糖药物具有胃肠不良反应等副作用,更安全有效的降血糖植物活性成分受到广泛关注[57]。在2型糖尿病动物模型中,黄酮类化合物经肠道菌群分解产生的3,4-二羟基苯甲酸、3,4,5-三羟基苯甲酸、4-羟基-3-甲氧基苯甲酸等代谢物,通过调节胰岛素受体底物1(Insulin Receptor Substrate 1,IRS1)和蛋白激酶B(protein kinase B,PKB)磷酸化增加机体胰岛素敏感性,通过降低蛋白酪氨酸磷酸酶1B(ProteinTyrosine Phosphatase-1B,PTP-1B)的活性改善葡萄糖稳态和胰岛素抵抗[6]。沙棘黄酮是降血糖植物活性物质之一,相关研究证明沙棘叶黄酮类糖苷提取物通过降低葡萄糖-6-磷酸酶的活性、抑制促炎因子(TNF-α、IL-6和IL-12)和糖异生来预防胰岛素抵抗和改善葡萄糖耐量,降低机体血糖水平[45]。此外,沙棘果渣总黄酮能够显著降低高血糖模型小鼠空腹血糖值,发挥降血糖作用[58]。康莹[59]研究表明沙棘叶黄酮提取物能够显著增加胰岛素抵抗模型HepG2细胞对葡萄糖的消耗量,证明沙棘黄酮的降糖活性及其对糖尿病的潜在防治作用。以上结果说明沙棘黄酮作为降血糖的植物活性成分可用于低血糖生成指数产品的研发与应用,但其作用机制机理仍需深入探究。
5. 展望
我国沙棘种植面积大、种类繁多、资源丰富,沙棘作为药食同源植物具有优质的深度开发和综合利用价值,目前,沙棘产品的开发覆盖了药品、食品、保健品等多个领域。沙棘黄酮含有多种小分子功能成分,其中主要成分槲皮素和异鼠李素在医药、功能食品开发方面具有重要作用,但目前研究大多仅集中于沙棘黄酮的体外功能评价。沙棘黄酮作为良好开发潜质的植物功能物质,未来研究可着重阐明沙棘黄酮低生物利用度与不同药理活性间分子机制,基于肠道微生物采用宏基因组、蛋白质组、转录组、代谢组等多组学技术明确沙棘黄酮的功效机理和临床应用,深入挖掘沙棘黄酮的益生元功能,开发显著提高沙棘黄酮生物利用度的方法技术,促进植物黄酮类化合物的精准营养研究和个性化营养膳食开发,推进沙棘等药食同源资源的高值化利用和产业化发展,助力精准营养调控技术和未来功能食品创制发展。
-
表 1 沙棘黄酮不同提取方法汇总表
Table 1 Summary of different extraction methods of seabuckthorn flavonoids
来源 沙棘产地 提取方法 料液比(g/mL) 提取溶剂 提取温度(℃) 提取
时间提取
次数其他条件 提取率(%) 沙棘果粉 吉林省蛟河市 有机溶剂提取 1:60 90%乙醇 80 2 h 3 − 2.665[18] 沙棘果粉 郴州市老百姓大药房 微波辅助提取 1:25 80%乙醇 − 90 s 1 微波功率400 W 4.99[19] 沙棘叶 祁州药材堂 有机溶剂提取 1:10、1:8 50%乙醇 80 2、1.5 h 2 − 1.852[20] 沙棘叶 印度 超临界CO2萃取 1:5 20%乙醇 50 − 3 压力200 bar 1.771[13] 沙棘叶 印度 亚临界水萃取 2:33 水 200 15 min 3 − 49.20[15] 大果沙棘果渣 黑河市孙吴县 酶法提取 1:20 71.4%乙醇 50 2 h 1 纤维素酶(10 U/mg)
用量0.85 mg/mL,
酶解温度50.9℃,pH5.1,
酶解时间2 h。0.898[21] 沙棘籽粕 山西省岢岚县酸溜溜饮料厂 超声波辅助提取 1:30 59%乙醇 54 20 min 2 超声波功率60 W 7.11[22] 表 2 沙棘黄酮类代表物质结构及检测方法
Table 2 Structures and detection methods of representative substances of seabuckthorn flavonoids
结构式 名称 检测方法 保留时间/
二级质谱离子检测条件 
芦丁 高效液相色谱[17]
高效液相色谱-
质谱[28-29]5.00 min
母离子(m/z 609.0),
子离子(m/z 207.9)a.高效液相色谱法:流动相为甲醇-乙腈-水(40:15:45);检测波长为
368 nm;流速为1.0 mL/min;进样量为
10 μL,等度洗脱。
槲皮素 高效液相色谱[17]
高效液相色谱-
质谱[28-29]11.00 min
母离子(m/z 308.8),
子离子(m/z 151.0)
山奈酚 高效液相色谱[17]
高效液相色谱-
质谱[28-29]7.10 min
母离子(m/z 284.8),
子离子(m/z 150.8)
异鼠李素 高效液相色谱[17]
高效液相色谱-
质谱[28-29]12.20 min
母离子(m/z 315.0),
子离子(m/z 300.1)
没食子酸 高效液相色谱-
质谱[28-29]母离子(m/z 169.1),
子离子(m/z 125.0)b.高效液相色谱-质谱检测方法1:①色谱条件:流动相A为含0.1%甲酸的甲醇溶液,流动相B为乙腈-甲醇(75:25);流速为1 mL/min,梯度洗脱,进样量为2 μL;②质谱条件:电喷雾离子源,负离子模式 (ESI−)。 
槲皮素-3-葡萄糖苷 高效液相色谱-
质谱[29]母离子(m/z 463.1),
子离子(m/z 301.0)
杨梅素 高效液相色谱-
质谱[28]母离子(m/z 316.9),
子离子(m/z 137.0)
金丝桃苷 高效液相色谱-
质谱[28]母离子(m/z 463.0);
子离子(m/z 270.9)
木犀草素 高效液相色谱-
质谱[29]母离子(m/z 284.7),
子离子(m/z 135.8)c.高效液相色谱-质谱检测方法2:色谱条件:流动相A为0.1%甲酸,流动相B为甲醇,70%B等度洗脱,流速为
0.2 mL/min,进样量为2 μL;质谱条件:电喷雾离子源,负离子模式(ESI−);扫描方式为多反应监测(MRM)模式。
柚皮苷 高效液相色谱-
质谱[29]母离子(m/z 579.5),
子离子(m/z 116.0)
柚皮素 高效液相色谱-
质谱[29]母离子(m/z 271.0),
子离子(m/z 119.0)
表儿茶素没食子酸酯 高效液相色谱-
质谱[29]母离子(m/z 442.3),
子离子(m/z 289.2) -
[1] PICHIAH P B, MOON H J, PARK J E, et al. Ethanolic extract of seabuckthorn (Hippophae rhamnoides L.) prevents high-fat diet-induced obesity in mice through down-regulation of adipogenic and lipogenic gene expression[J]. Nutrition Research,2012,32(11):856−864. doi: 10.1016/j.nutres.2012.09.015
[2] OLAS B. The beneficial health aspects of sea buckthorn (Elaeagnus rhamnoides (L.) A. Nelson) oil[J]. Journal of Ethnopharmacology,2018,213:183−190.
[3] 王春艳. 沙棘品种(系)果实营养成分比较分析研究[J]. 沙棘,2005(2):20−23. [WANG C Y. Comparative analysis of fruit nutritional components of Seabuckthorn varieties (lines)[J]. Sea Buckthorn,2005(2):20−23. [4] 白晓州, 韩小存, 张镒飞. 不同种类的沙棘果渣营养成分及抗氧化活性研究[J]. 食品研究与开发,2018,39(23):179−183. [BAI X Z, HAN X C, ZHANG Y F. Study on the antioxidant activity of different kinds of seabuckthorn pomes[J]. Food Research and Development,2018,39(23):179−183. [5] FEREIRA R, MENDONA L, RIBEIRO C, et al. Relationship between intestinal microbiota, diet and biological systems: An integrated view[J]. Critical Reviews in Food Science and Nutrition,2020(4):1−21.
[6] OSBORN L J, CLAESEN J, BROWN J M. Microbial flavonoid metabolism: A cardiometabolic disease perspective[J]. Annual Review of Nutrition,2021,41:433−454. doi: 10.1146/annurev-nutr-120420-030424
[7] 邢津津. 西藏林芝沙棘成分分析、黄酮提取优化及抗氧化性研究[D]. 林芝: 西藏农牧学院, 2021 XING J J. Extraction optimization and antioxidant activity of flavonoids from Hippophae rhamnoides in Nyingchi, Tibet[D]. Linzhi: Xizang Agriculture and Animal Husbandry University, 2021.
[8] REN Q C, LI X H, LI Q Y, et al. Total flavonoids from sea buckthorn ameliorates lipopolysaccharide/cigarette smoke-induced airway inflammation[J]. Phytotherapy Research,2019,33(8):2102−2117. doi: 10.1002/ptr.6404
[9] 贾丛, 杜亚蓉, 孙坤. 沙棘总黄酮抑制肺癌A549增殖和迁移作用及机理[J]. 天然产物研究与开发,2020,32(6):937−945,952. [JIA C, DU Y R, SUN K. Effects of total flavonoids of hippophae rhamnoides on proliferation and migration of A549 in lung cancer[J]. Natural Products Research and Development,2020,32(6):937−945,952. [10] 焦艳, 谢世静, 李喆. 沙棘黄酮对大鼠动脉粥样硬化斑块的影响及作用机制[J]. 中国老年学杂志,2022,42(6):1472−1475. [JIAO Y, XIE S J, LI Z. Effects of flavonoids from Hippophae rhamnoides on atherosclerotic plaque in rats and its mechanism[J]. Chinese Journal of Gerontology,2022,42(6):1472−1475. [11] 李艺文, 唐志书, 张珍, 等. 沙棘总黄酮抗单侧输尿管梗阻大鼠肾脏纤维化作用及机制[J]. 中南药学,2021,19(5):845−850. [LI Y W, TANG Z S, ZHANG Z, et al. Effect and mechanism of total flavonoids of Hippophae rhamnoides on renal fibrosis in rats with unilateral ureteral obstruction[J]. Central South Pharmacy,2021,19(5):845−850. [12] 周欣, 卫培峰, 王丽平, 等. 沙棘叶和果实中总黄酮提纯工艺研究进展[J]. 亚太传统医药,2019,15(3):188−190. [ZHOU X, WEI P F, WANG L P, et al. Advances in the purification process of total flavonoids from sea buckthorn leaves and fruits[J]. Asia-Pacific Traditional Medicine,2019,15(3):188−190. [13] JAYASHANKAR B, MISHRA K P, KUMAR M S Y, et al. A supercritical CO2 extract from seabuckthorn leaves inhibits pro-inflammatory mediators via inhibition of mitogen activated protein kinase p38 and transcription factor nuclear factor-kappaB[J]. International Immunopharmacology,2012,13(4):461−467. doi: 10.1016/j.intimp.2012.05.011
[14] 蔡锦源, 王萌璇, 唐念, 等. 亚临界水萃取技术及其在有效成分提取和分析领域中的应用[J]. 应用化工,2017,46(6):1210−1213. [CAI J Y, WANG M X, TANG N, et al. Subcritical water extraction technology and its application in extraction and analysis of active components[J]. Applied Chemical Industry,2017,46(6):1210−1213. [15] KUMAR M S, DUTTA R, PRASAD D, et al. Subcritical water extraction of antioxidant compounds from seabuckthorn (Hippophae rhamnoides) leaves for the comparative evaluation of antioxidant activity[J]. Food Chemistry,2011,127(3):1309−1316.
[16] XIAO J, CHEN G, LI N. Ionic liquid solutions as a green tool for the extraction and isolation of natural products[J]. Molecules,2018,23(7):1765. doi: 10.3390/molecules23071765
[17] LI C Y, ZHANG J J, ZHAO C J, et al. Separation of the main flavonoids and essential oil from seabuckthorn leaves by ultrasonic/microwave-assisted simultaneous distillation extraction[J]. Royal Society Open Science,2018,5(7):180133. doi: 10.1098/rsos.180133
[18] 樊旭, 周鸿立. 响应面法优化沙棘黄酮的提取和抗氧化活性的研究[J]. 河南工业大学学报(自然科学版),2018,39(4):85−90. [FAN X, ZHOU H L. Optimization of flavonoids extraction and antioxidant activity of Hippophae rhamnoides by response surface methodology[J]. Journal of Henan University of Technology (Natural Science edition),2018,39(4):85−90. [19] 冯纪南, 黄海英, 邓斌. 微波辅助提取沙棘总黄酮的工艺研究[J]. 安徽农业科学,2011,39(26):15952−15953,15955. [FENG J N, HUANG H Y, DENG B. Microwave-assisted extraction of total flavonoids from Hippophae rhamnoides[J]. Journal of Anhui Agricultural Sciences,2011,39(26):15952−15953,15955. [20] 黄彬彬. 沙棘叶总黄酮的精制工艺及抗氧化性能研究[D]. 厦门: 华侨大学, 2016 HUANG B B. Study on purification technology and antioxidant activity of total flavonoids from seabuckthorn leaves[D]. Xiamen: Huaqiao University, 2016.
[21] 焦岩. 大果沙棘黄酮分离纯化及生物活性研究[D]. 哈尔滨: 东北林业大学, 2010 JIAO Y. Solation, purification and biological activity of flavonoids from Hippophae rhamnoides[D]. Harbin: Northeast Forestry University, 2010.
[22] 张海容, 史振华. 响应面法优化超声波辅助提取沙棘籽粕中黄酮工艺[J]. 中国油脂,2017,42(3):117−121. [ZHANG H R, SHI Z H. Optimization of ultrasonic-assisted extraction of flavonoids from seabuckthorn seed meal by response surface methodology[J]. China Oils and Fats,2017,42(3):117−121. [23] 张程慧, 祁玉霞, 冯叙桥. 沙棘黄酮分离纯化方法的研究进展[J]. 保鲜与加工,2019,19(4):201−206. [ZHANG C H, QI Y X, FENG X Q. Research progress on isolation and purification methods of flavonoids from Hippophae rhamnoides[J]. Preservation and Processing,2019,19(4):201−206. [24] 周浩楠, 胡娜, 董琦, 等. 沙棘化学成分及药理作用的研究进展[J]. 华西药学杂志,2020,35(2):211. [ZHOU H N, HU N, DONG Q, et al. Research progress on the chemical composition and pharmacological action of Hippophae rhamnoides[J]. West China Journal of Pharmaceutical Sciences,2020,35(2):211. [25] 魏永生, 王永宁, 石玉平, 等. 分光光度法测定总黄酮含量的实验条件研究[J]. 青海大学学报(自然科学版),2003(3):61−63. [WEI Y S, WANG Y N, SHI Y P, et al. Determination of total flavonoids by spectrophotometry[J]. Journal of Qinghai University (Natural Science Edition),2003(3):61−63. [26] 郝娟. 沙棘果实和叶片中黄酮类物质测定方法研究进展[J]. 食品安全导刊,2021(18):81−83. [HAO J. Progress in the determination of flavonoids in seabuckthorn fruits and leaves[J]. Food Safety Guide,2021(18):81−83. [27] ZHOU W, YUAN Z, LI G, et al. Isolation and structure determination of a new flavone glycoside from seed residues of seabuckthorn (Hippophae rhamnoides L.)[J]. Natural Product Research,2018,32(8):892−897. doi: 10.1080/14786419.2017.1366481
[28] KUMAR M S Y, TITPUDE R J, MAHESHWARI D T, et al. Antioxidant and antimicrobial properties of phenolic rich fraction of seabuckthorn (Hippophae rhamnoides L.) leaves in vitro[J]. Food Chemistry,2013,141(4):3443−50. doi: 10.1016/j.foodchem.2013.06.057
[29] 蔡爽, 阮成江, 杜维, 等. 高效液相色谱-串联质谱法同时测定沙棘中的11种黄酮类物质[J]. 分析科学学报,2019,35(3):311−316. [CAI S, RUAN C J, DU W, et al. Simultaneous determination of 11 flavonoids in Hippophae rhamnoides by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Science,2019,35(3):311−316. [30] 孙燕, 冯峰, 张峰, 等. 基于 UPLC-Q-Exactive 技术结合 OTCML数据库快速分析沙棘的功效成分[J]. 天然产物研究与开发,2019,31(7):1192−1202. [SUN Y, FENG F, ZHANG F, et al. Rapid analysis of functional components of Hippophae rhamnoides by UPLC-Q-exactive and OTCML database[J]. Natural Product Research and Development,2019,31(7):1192−1202. [31] SANTANGELO R, SILVESTRINI A, MANCUSO C. Ginsenosides, catechins, quercetin and gut microbiota: Current evidence of challenging interactions[J]. Food and Chemical Toxicology,2019,123:42−49. doi: 10.1016/j.fct.2018.10.042
[32] CARROSCO-POZO C, GOTTELAND M, CASILLO R L, et al. 3, 4-Dihydroxyphenylacetic acid, a microbiota-derived metabolite of quercetin, protects against pancreatic β-cells dysfunction induced by high cholesterol[J]. Experimental Cell Research,2015,334(2):270−282. doi: 10.1016/j.yexcr.2015.03.021
[33] XUE H, XIE W, JIANG Z, et al. 3, 4-Dihydroxyphenylacetic acid, a microbiota-derived metabolite of quercetin, attenuates acetaminophen (APAP)-induced liver injury through activation of Nrf-2[J]. Xenobiotica,2016,46(10):931−939. doi: 10.3109/00498254.2016.1140847
[34] 杨艳, 杨荣玲, 邹宇晓, 等. 肠道微生物菌群生物转化天然多酚类化合物研究进展[J]. 食品科学,2014,35(17):319−325. [YANG Y, YANG R L, ZOU Y X, et al. Recent advances in biotransformation of natural polyphenolsby gut microflora[J]. Food Science,2014,35(17):319−325. [35] ESSER D, GELEIJNSE J M, MATUALATUPAUW J C, et al. Pure flavonoid epicatechin and whole genome gene expression profiles in circulating immune cells in adults with elevated blood pressure: A randomised double -blind, placebo -controlled, crossover trial[J]. PLoS One,2018,13(4):e0194229. doi: 10.1371/journal.pone.0194229
[36] 李涛, 李绮丽, 张群, 等. 基于肠道菌群的黄酮类化合物生理功能研究进展[J]. 中国食品学报,2022,22(2):357−368. [LI T, LI Q L, ZHANG Q, et al. Research progress on physiological functions of flavonoids based on gut microbes[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(2):357−368. [37] WILLIAMS R J, SPENCER J P, RICE-EVANS C. Flavonoids: antioxidants or signalling molecules?[J]. Free Radical Biology and Medicine,2004,36:838−849. doi: 10.1016/j.freeradbiomed.2004.01.001
[38] STEED A L, CHRISTOPHI G P, KAIKO G E, et al. The microbial metabolite desaminotyrosine protects from influenza through type I interferon[J]. Science,2017,357(6350):498−502. doi: 10.1126/science.aam5336
[39] 丰茂秀, 崔清华, 刘苗苗, 等. 黄酮类化合物抗甲型流感病毒活性研究进展[J]. 中华中医药学刊,2021,39(3):151−155. [FENG M X, CUI Q H, LIU M M, et al. Research progress on activity of flavonoids against influenza A virus[J]. Chinese Journal of Traditional Chinese Medicine,2021,39(3):151−155. [40] SHAHRAJABIAN M H, SUN W L, CHENG Q. The importance of flavonoids and phytochemicals of medicinal plants with antiviral activities[J]. Mini-Reviews in Organic Chemistry,2022,19:293−318. doi: 10.2174/1570178618666210707161025
[41] ENKHTAIVAN G, JOHN K M, PANDURANGAN M, et al. Extreme effects of Seabuckthorn extracts on influenza viruses and human cancer cells and correlation between flavonol glycosides and biological activities of extracts[J]. Saudi Journal of Biological Sciences,2017,24:1646−1656. doi: 10.1016/j.sjbs.2016.01.004
[42] 刘川, 苏锦松, 李轩豪, 等. 基于网络药理学和分子对接法筛选藏药五味沙棘散治疗新型冠状病毒肺炎(COVID-19)活性成分的研究[J]. 世界科学技术-中医药现代化,2020,22(3):632−641. [LIU C, SU J S, LI X H, et al. Screening of active ingredients of Tibetan medicine Wuwei sea-buckthorn powder for the treatment of COVID-19 based on Network pharmacology and molecular docking method[J]. World Science and Technology-Modernization of Traditional Chinese Medicine,2020,22(3):632−641. [43] ZHANG A, HUI S, WANG X. Recent advances in natural products from plants for treatment of liver diseases[J]. European Journal of Medicinal Chemistry,2013,63(33):570−577.
[44] SUN W L, LI X Y, DOU H Y, et al. Myricetin supplementation decreases hepatic lipid synthesis and inflammation by modulating gut microbiota[J]. Cell Reports,2021,36:109641. doi: 10.1016/j.celrep.2021.109641
[45] 付依依, 王永霞, 李月, 等. 大果沙棘中黄酮的体外抗炎及抗氧化活性研究[J]. 中国食品添加剂,2021,32(10):67−74. [FU Y Y, WANG Y X, LI Y, et al. Study on anti-inflammatory and antioxidant activities of flavonoids from Hippophae rhamnoides[J]. China Food Additives,2021,32(10):67−74. [46] 徐凤英. 沙棘叶总黄酮对DSS诱导的小鼠溃疡性结肠炎的缓减作用及机制研究[D]. 呼和浩特: 内蒙古医科大学, 2020 XU F Y. Effects of total flavonoids from seabuckthorn leaves on DSS induced ulcerative colitis in mice and its mechanism[D]. Hohhot: Inner Mongolia Medical University, 2020.
[47] 李军民, 高秉红, 李平. 抗肝损伤天然药物活性成分研究进展[J]. 中国药业,2021,30(24):128−134. [LI J M, GAO B H, LI P. Research progress of active ingredients of natural medicines against hepatic injury[J]. China Pharmaceuticals,2021,30(24):128−134. [48] 欧阳香, 程虹毓, 胡伟琼, 等. 黄酮类化合物抗酒精性肝损伤作用及机制研究进展[J]. 中国药理学通报,2020,36(9):1200−1205. [OUYANG X, CHENG H Y, HU W Q, et al. Research progress on the anti-alcoholic liver injury effects and mechanism of flavonoids[J]. Chinese Pharmacological Bulletin,2020,36(9):1200−1205. [49] 李欣益, 王昕旭, 颜妍, 等. 沙棘黄酮对于大鼠非酒精性脂肪肝病的改善作用及机制研究[C]//上海: 第十三届全国免疫学学术大会, 2018 LI X Y, WANG X X, YAN Y, et al. Ameliorative effect and mechanism of sea buckthorn flavonoids on nonalcoholic fatty liver disease in rats[C]//Shanghai: The 13th National Congress of Immunology, 2018.
[50] ZHAO H, KONG L Z, SHAO M T, et al. Protective effect of flavonoids extract of Hippophae rhamnoides L. on alcoholic fatty liver disease through regulating intestinal flora and inhibiting TAK1/p38MAPK/p65NF-κB pathway[J]. Journal of Ethnopharmacology,2022,292:115225. doi: 10.1016/j.jep.2022.115225
[51] POPKIN B M, ADIR L S, NG S W. Global nutrition transition and the pandemic of obesity in developing countries[J]. Nutrition Reviews,2012,70(4):256−256. doi: 10.1111/j.1753-4887.2012.00483.x
[52] 俞玥, 李占明, 叶华, 等. 植物黄酮重塑肠道菌群干预高脂膳食肥胖的研究进展[J]. 江苏科技大学学报(自然科学版),2021,35(5):87−94. [YU Y, LI Z M, YE H, et al. Gut microbiota reconstruction by dietary flavonoids improves high-fat-diet induced obesity and inflammation[J]. Journal of Jiangsu University of Science and Technology (Natural Science Edition),2021,35(5):87−94. [53] 钟港, 陈东. 黄酮类化合物在脂肪代谢中的作用机制研究进展[J]. 动物营养学报,2022,34(6):1−12. [ZHONG G, CHEN D. Research progress on the mechanism of flavonoids in fat metabolism[J]. Chinese Journal of Animal Nutrition,2022,34(6):1−12. [54] 杨鑫. 沙棘籽黄酮对机体脂代谢的调控及机理探究[D]. 上海: 华东师范大学, 2016 YANG X. Study on the regulation and mechanism of seabuckthorn seed flavonoids on lipid metabolism[D]. Shanghai: East China Normal University, 2016.
[55] KWON E Y, LEE J, KIM Y J, et al. Seabuckthorn leaves extract and flavonoid glycosides extract from seabuckthorn leaves ameliorates adiposity, hepatic steatosis, insulin resistance, and inflammation in diet-induced obesity[J]. Nutrients,2017,9(6):569. doi: 10.3390/nu9060569
[56] LI Y, TENG D, SHI X, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study[J]. BMJ-British Medical Journal,2020,369:m997.
[57] 王雪竹. 天然产物中降血糖功能因子研究进展[J]. 河南预防医学杂志,2018,29(4):241−243. [WANG X Z. Research progress on hypoglycemic function factors of natural product[J]. Henan Journal of Preventive Medicine,2018,29(4):241−243. [58] 孙琛, 冯野, 谢培, 等. 沙棘果渣总黄酮的降血脂及降血糖作用[J]. 世界中医药,2018,13(1):142−145. [SUN C, FENG Y, XIE P, et al. Effects of total flavonoids from seabuckthorn fruit residue on blood lipid and blood glucose[J]. World Traditional Chinese Medicine,2018,13(1):142−145. [59] 康莹. 中国沙棘叶黄酮提取精制工艺优化及其活性的初步评价[D]. 北京: 北京中医药大学, 2019 KANG Y. Extraction and purification of flavonoids from seabuckthorn leaves in China and preliminary evaluation of their activity[D]. Beijing: Beijing University of Traditional Chinese Medicine, 2019.





 下载:
下载:

 下载:
下载:
