Properties and Characterization of Cross-linked Purple Potato Starch with Different Degrees of Substitution
-
摘要: 为探究不同取代度对交联淀粉的影响,本文以紫薯淀粉为原料,以三偏磷酸钠和三聚磷酸钠混合物为交联剂,制备了交联紫薯淀粉,并对不同取代度(0.0053~0.0212)交联紫薯淀粉进行了性能测定及表征。结果表明:随着取代度的增加,交联紫薯淀粉的透明度和溶解度上升,膨胀度下降,冻融稳定性增加。紫薯淀粉颗粒的表面完整光滑,而交联紫薯淀粉颗粒则呈现剥离状外观,颗粒之间作用力增强,黏连聚集现象明显。所有样品的结晶类型均为C型结晶,交联紫薯淀粉平均粒径与紫薯淀粉相比差异不显著,但结晶度则随取代度升高而逐渐下降,且交联紫薯淀粉所带负电荷也随取代度升高而逐渐增多。因此,与紫薯淀粉相比,交联紫薯淀粉的多种性能均有所提升,且与取代度关系密切,这为紫薯资源的深入开发提供了理论依据。Abstract: In this study, cross-linked purple potato starch was prepared from purple potato starch and a mixture of sodium tripolyphosphate and sodium trimetaphosphate as crosslinking agent, aiming at studying the effect of different degrees of substitution (0.0053~0.0212) on cross-linked starch, determining and characterizing the properties of cross-linked purple potato starch with different degrees of substitution. The results showed that with the increase of degree of substitution, the cross-linked purple potato starch of transparency and solubility degree boosted, swelling degree decreased, and freezing-thaw stability increased. The surface of purple potato starch was intact and smooth, but the cross-linked purple potato starch presented a stripped-off appearance. The force of interparticle of cross-linked purple potato starch increased, and the adhesion and aggregation of cross-linked purple potato starch represented obviously. All the crystallization of samples was C-type, the average particle size of cross-linked purple potato starch was not significantly different compared with purple potato starch, but the crystallinity decreased with the increase of degree of substitution. The negative charge of cross-linked purple potato starch also increased with the increased degree of substitution. Therefore, the properties of cross-linked purple potato starch were greatly improved compared with purple potato starch and were closely associated with degree of substitution, which provided theoretical basis for the further development of purple potato resources.
-
紫薯(Ipomoea batatas L, LAM)又称黑薯,属于旋花科的根茎作物,相比其他甘薯类,紫薯富含花青素、淀粉和硒等物质,具有重要的医用价值和保健功能[1]。紫薯富含淀粉,由直链淀粉和支链淀粉两种葡聚糖聚合物组成,淀粉的理化性质与其结构密切相关[2]。目前有研究表明,紫薯淀粉颗粒之间的作用力小[3],在结构上相对不稳定,这在一定程度上限制了紫薯深加工产品的延伸。为了进一步提高天然淀粉性能,通常使用交联剂对淀粉进行改性。目前经常使用的交联剂有氯丙醇、环氧氯丙烷以及三偏磷酸钠和三聚磷酸钠形成的磷酸盐混合物,其中三偏磷酸钠被认为是无毒有效的淀粉改性剂,反应温和并且易于操控[4],且淀粉易与磷酸盐发生反应,即使取代程度很低,也能明显提高天然淀粉的理化性质[5]。交联反应作为淀粉改性方法之一,通过含有二元或多元官能团的交联剂与淀粉分子发生羟基反应,生成一种具有二酯基、二醚键等基团的淀粉衍生物,因其具有更强的热稳定性、酸耐受性、抗剪切性等[6]而在食品工业中广泛应用。
在淀粉品质标准中,取代度是反应淀粉改性程度的重要指标之一。它是指淀粉葡萄糖单位上被取代羟基的平均数量[7],可分为低、中、高等不同取代程度。近年来,国内外在不同取代度对改性淀粉性质影响的研究方面有部分报道。Bendoraitiene等[8]在不同取代度对交联淀粉生物降解性影响的研究中表明,相比原淀粉,低取代度的交联淀粉可提高其生物降解性,而过高取代度的交联淀粉生物降解性下降。葛亚芳[9]研究三种不同取代度对玉米交联淀粉性能的影响,随着取代度的升高,交联淀粉的溶胀力、乳化能力、溶解度等性能也随之提高。Mathew等[10]研究改性淀粉在不同取代度下的理化表征,发现改性淀粉的微观结构随着取代度的增加其网络结构变得更加紧密。由此可见,不同取代度对于交联淀粉的理化性质和功能特性影响不同。
目前,关于紫薯淀粉的研究主要集中在其结构和性质方面,而有关交联紫薯淀粉的研究鲜有报道。因此,本文以紫薯为原材料,选用三偏磷酸钠和三聚磷酸钠混合物为交联剂,以取代度为指标,对比原淀粉研究三种不同取代度对交联紫薯淀粉的影响,并对其颗粒形态、结晶性质、微观结构及理化性能进行测定,以期为新型高品质改性淀粉的制备和开发提供理论指导。
1. 材料与方法
1.1 材料与仪器
紫薯淀粉 福建漳州六鳌原厂地;无水硫酸钠、盐酸、氢氧化钠、无水乙醇(分析纯) 国药集团化学试剂有限公司;三偏磷酸钠、三聚磷酸钠(分析纯) 上海麦克林生化科技股份有限公司。
FA2104电子天平 天津方瑞仪器生产有限公司;DF-101S集热式恒温加热磁力搅拌器 上海力辰科技有限公司;SHZ-D(Ⅲ)循环水式真空泵 常州市金坛友联仪器研究所;Avanti J-E多用途高效离心机 美国Beckman Coulter公司;DGX-80电热鼓风干燥箱 福州精科仪器生产有限公司;SHA-C数显水浴恒温振荡器 厦门精艺兴业科技有限公司;FDU-1200冷冻干燥机 厦门精艺兴业科技有限公司;Nova NanoSEM 230场发射扫描电子显微镜 美国FEI 公司;Bruker VERTEX 70傅里叶变换红外光谱仪 美国布鲁克光谱仪器公司;FW-4A粉末压片机 北京有信科仪科技有限公司;Ultima IVX射线衍射仪(XRD) 日本理学科技有限公司;CX21FS1光学显微镜 日本Olympus公司;Omni多角度粒度与高灵敏度Zeta电位分析仪 美国布鲁克光谱仪器公司。
1.2 实验方法
1.2.1 交联紫薯淀粉的制备
准确称取10 g紫薯淀粉(purple potato starch,PS),加入一定量的蒸馏水后,添加1% Na2SO4搅拌磁力搅拌1 h,使其成为淀粉乳,再添加不同量的三偏磷酸钠(STMP)和三聚磷酸钠(STPP)混合物(STMP:STPP=99:1)继续搅拌1 h后,加入0.2 mol/L的NaOH溶液调节pH至10,于数显水浴恒温振荡器中反应4.5 h。反应结束后,用0.2 mol/L HCl调节pH至中性,继续搅拌0.5 h。离心使沉淀物与上层悬浊液基本分离,取下层沉淀,用蒸馏水和乙醇分别洗涤5次,过滤,将沉淀物于−80 ℃下预冻12 h后真空冷冻干燥[11]。干燥结束后,研磨过100目筛得到交联紫薯淀粉(cross-linked purple potato starch,CPPS)。并对交联后淀粉中结合磷含量以及取代度进行测定。
1.2.2 结合磷含量测定及取代度的计算
参照GB 5009.87-2016《食品安全国家标准 食品中磷的测定》绘制标准曲线。标准曲线方程为:y=0.01737x−0.00267,相关系数R2=0.9989。
准确称取0.5 g的CPPS于100 mL蒸馏水中,并适当搅拌使其成为溶液并不出现明显沉淀,配制成浓度为0.005 g/mL的交联淀粉液,装入石英比色皿后,在波长为825 nm处测定其吸光值,根据线性回归方程计算出对应的磷含量及国标中的公式换算成淀粉中的结合磷含量。
根据Passauer等[12]的方法计算取代度DS,具体计算公式如下:
DS=162×结合磷含量3100−102×结合磷含量 式中:162表示单体淀粉单元的分子量;3100表示磷的分子量乘以100;102表示单磷酸取代基的质量。
1.2.3 理化性质的测定
1.2.3.1 透明度
参照杨秋歌等[13]的方法,分别将PS和不同取代度CPPS(1 g)与99 mL蒸馏水混合,置于沸水浴中加热25 min,使其完全糊化。再加入一定量的蒸馏水定容至原体积,使其冷却至25 °C。参照唐洪波等[14]的方法,以蒸馏水为空白,在620 nm处通过紫外分光光度计测定淀粉糊的透光率,以透光率表示淀粉糊的透明度。
1.2.3.2 溶解度及膨胀度
参照Sukhija等[15]的方法并适当修改。分别将PS和不同取代度CPPS(1 g)配制成0.02 g/mL的悬浮液,在恒定搅拌下将其加热至50、60、70、80和90 ℃后持续20 min,然后冷却至25 ℃。淀粉悬浮液以4000 r/min的速度离心20 min。再分离上清液后干燥,测定水溶性淀粉的重量后,计算其溶解度[16]。膨胀度和溶解度分别按以下公式计算:
溶解度(%)=可溶性淀粉重量干淀粉重量×100 膨胀度(%)=淀粉糊沉淀物重量干淀粉重量×(100−溶解度)×100 1.2.3.3 冻融稳定性
以析水率表示。参照Hu等[16]的方法并适当修改,分别取3%的PS和CPPS淀粉悬浮液,在100 °C加热20 min后冷却至25 °C称重。于−15 °C下冷冻12 h,在室温下解冻5 h。此冻融过程重复4次,每次循环后均取样4000 r/min离心15 min,滤去上清液,对剩余淀粉糊进行称重。析水率计算公式为:
析水率(%)=(原淀粉糊重量−残留淀粉糊重量)干淀粉重量×100 1.2.4 微观结构的测定
参照Hu等[16]的方法并适当修改,在载玻片上放少量样品,在淀粉表面滴1滴蒸馏水使其分散均匀,覆上盖玻片后,置于光学显微镜下观察。同时,将淀粉样品均匀涂抹在物台上的双面胶带上,再用加速到20 kV的电子枪向干燥的淀粉上喷金后,置于电子显微镜下观察。
1.2.5 傅里叶红外光谱的测定
参照Liu等[17]的方法并适当修改,分别将PS和不同取代度CPPS分别同KBr混合后压片,使用傅里叶变换红外光谱仪测定红外吸收光谱,设定其扫描范围为4000~400 cm−1,分辨率为4 cm−1,平均扫描64次。
1.2.6 X射线衍射(XRD)的测定
参照刘燕[18]的方法并适当修改,采用X光衍射仪获得样品的衍射图谱,配置铜灯辐射,操作条件为:特征射线Cuka(1.5418 Å),Ni片滤波,额定输出功率为3 kW,测量范围(2θ)=10°~40°。结晶度参照以下公式进行计算:
结晶度(%)=结晶区域面积总面积×100 1.2.7 粒径的测定
参照白礼涛[19]的方法并适当修改,采用多角度粒度与高灵敏度Zeta电位分析仪测定PS和不同交联度CPPS的颗粒大小,在蒸馏水中加入适量的粉末并使其分散均匀,样品在仪器达到折光率1.330后开始测试,每次实验重复三次,取平均值。
1.2.8 ζ-电位的测定
参照Dong等[20]的方法并适当修改,利用多角度粒度与高灵敏度Zeta电位分析仪分别测定浓度为0.05%的PS和不同交联度CPPS在各pH(3、3.5、4、4.5、5、5.5、6、6.5、7)下的ζ-电位,先用盐酸(0.1~2 mol/L)将样品调节至所需的pH,装入比色皿中测定ζ-电位。
1.3 数据处理
所有实验重复三次,使用SPSS 26.0对实验数据进行显著性差异分析,使用Origin 2019b软件进行图片的排版和绘制。
2. 结果与分析
2.1 不同交联淀粉吸光值、结合磷含量与取代度
由三偏磷酸钠和三聚磷酸钠作为交联剂所得交联淀粉为一种淀粉磷酸酯,应满足GB/T29926-2013《食品安全国家标准 食品添加剂 磷酸酯双淀粉》中规定磷含量上限为0.4%。本研究紫薯淀粉通过添加不同剂量的交联剂,得到交联紫薯淀粉具有不同的结合磷含量,定义为CPPS1、CPPS2和CPPS3。通过测定不同交联淀粉吸光值,相应的结合磷含量和取代度的计算结果如表1所示。由表1可以看出,交联淀粉的取代度随着结合磷含量的增加而升高,这主要是因为交联反应的发生破坏了天然淀粉的原有结构,支链淀粉含量增加[6],随着交联剂添加量的增加,天然淀粉中的羟基不断被磷酸基团取代,因此取代度升高。
表 1 不同交联淀粉的吸光值、结合磷含量及取代度Table 1. Absorbance, bound phosphorus content and degree of substitution in different cross-linked starch指标 CPPS1 CPPS2 CPPS3 吸光值 0.140 0.335 0.700 结合磷含量(m/m,%) 0.100 0.200 0.393 取代度 0.0053 0.0106 0.0212 2.2 不同取代度CPPS的理化性质
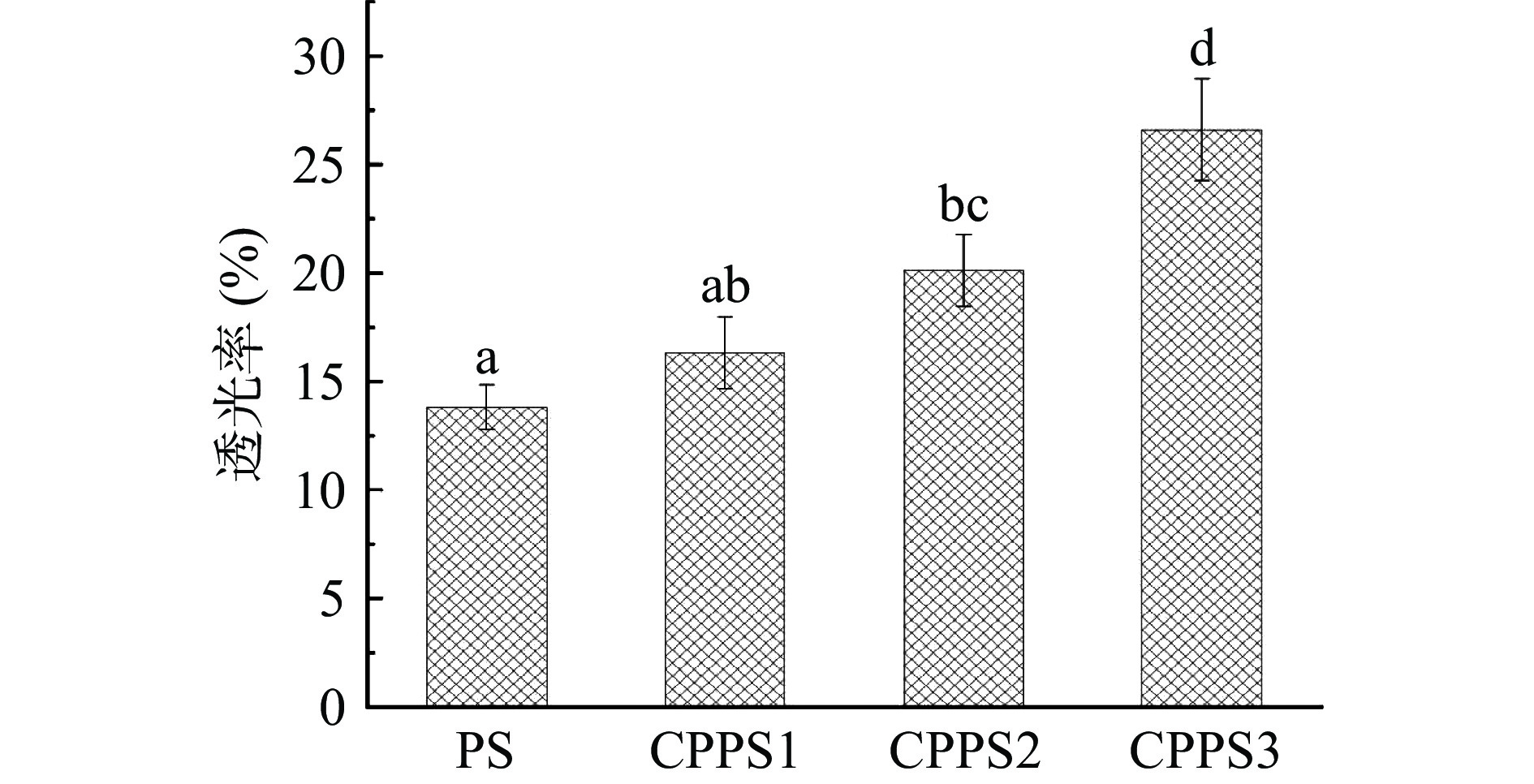
2.2.1 不同取代度CPPS的透明度
淀粉糊的透光率与其透明度呈正相关关系[14]。不同取代度CPPS的透明度结果如图1所示。其中,PS(DS=0.0000)的透光率为13.8%,而经过交联剂处理后CPPS2和CPPS3的透明度显著高于PS(P<0.05),取代度增加,透明度随之升高。这一结果同Hu等[21]的研究结果类似,CPPS中的磷酸基团是导致其具有较高透明度的主要原因,而CPPS的透明度也随着磷酸基团含量的增加而提高。这可能是因为CPPS中的磷酸基团阻止了淀粉分子间通过氢键的缔合作用,且磷酸基团中负电荷提供的斥力作用削弱了淀粉链之间的结合力,增加了光的透射,并减少了光的散射和反射[22]。透明度是体现淀粉类产品的重要外观特征之一[23],本研究中CPPS交联淀粉透明度的提高,可有效扩大该类淀粉产品的应用范围,并有望提高产品的可接受性。
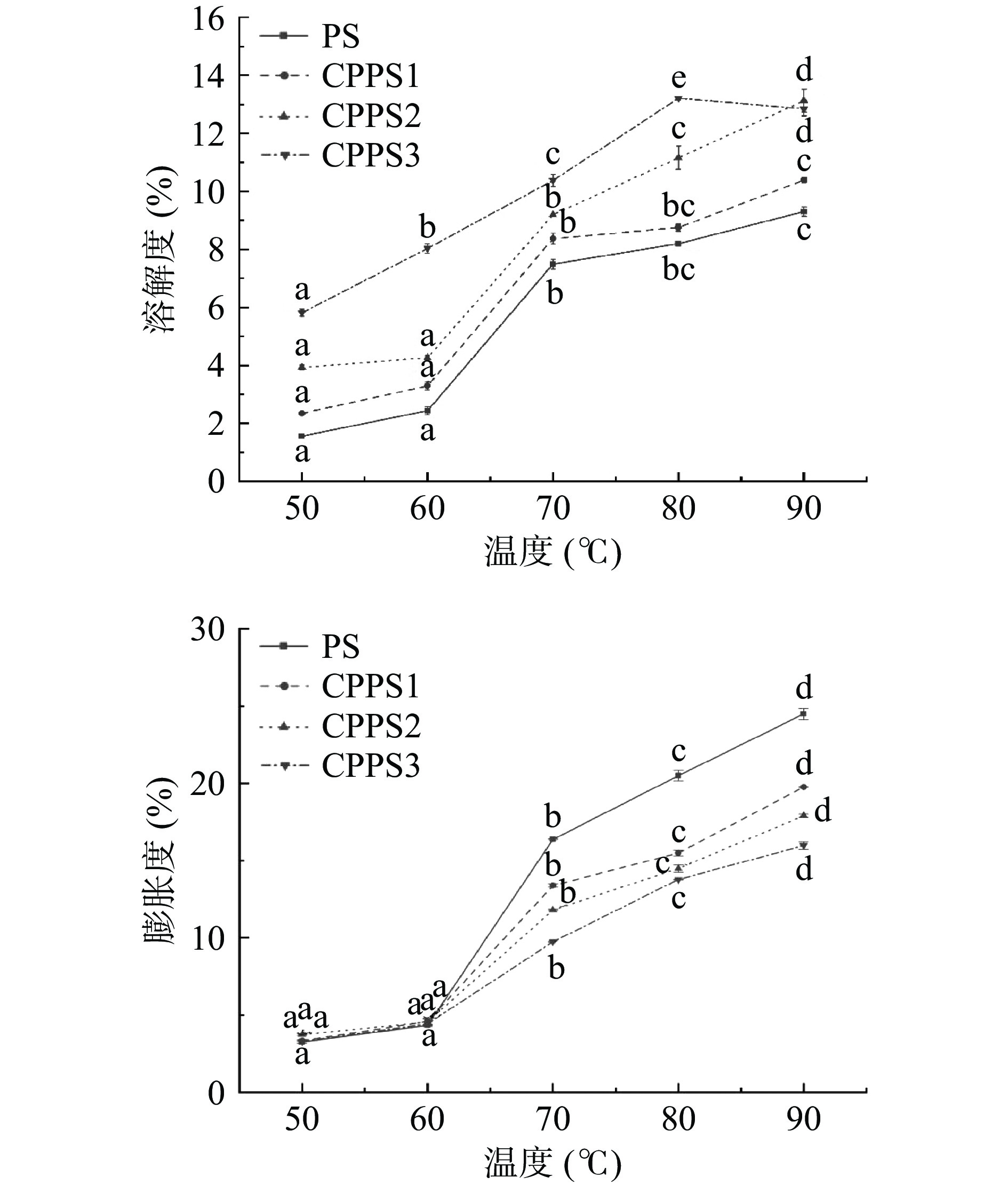
2.2.2 不同取代度CPPS的溶解度和膨胀度
衡量淀粉与水之间作用大小可以用溶解度与膨胀力来表示。由图2可知,一方面随着CPPS的交联程度上升,其溶解度逐渐上升。这主要是淀粉颗粒结构在改性过程中受到破坏,磷酸基的引入增加了淀粉颗粒的亲水性,使其溶解度上升[16];另一方面,温度越高,无论是PS还是CPPS,溶解度都得到了显著提升(P<0.05),特别在60~70 ℃间的溶解度提升最为显著(P<0.05)。这可能是由于温度上升使某些不溶性大分子分解形成可溶性小分子[24]。图中取代度最高的CPPS3在90 ℃时溶解度较80 ℃时反而更小,推测其原因在于紫薯淀粉的交联在该取代度下已达到饱和,磷酸键在高温情况下发生了断裂及重新缔合,新磷酸键的形成再次降低了淀粉的溶解度[24]。交联淀粉溶解度的增加能提高其保水能力,可应用于肉类和奶制品的加工,从而改善产品的适口性[25]。
膨胀度的变化趋势同溶解度大致相同,无论是PS还是CPPS,在70 ℃的膨胀度较60 ℃时提升显著(P<0.05)。原因在于,随着温度的增加,淀粉颗粒不断受热膨胀[26],且磷酸基团的加入降低了分子间的作用力[27],从而增加了CPPS的膨胀度。与天然淀粉相比,CPPS的膨胀度降低,这是因为在交联过程中淀粉颗粒内部结构解体,使得交联剂可以穿透颗粒内部,从而加强了与淀粉氢键的结合力[15]。交联淀粉膨胀能力的下降可以防止淀粉分子表面的破裂,从而提高产品在烹饪过程中的质地[28]。
2.2.3 不同取代度CPPS的冻融稳定性
析水率的高低反映了淀粉冻融稳定性的好坏,析水率低则表明冻融稳定性好[29]。不同取代度CPPS的冻融稳定性结果如表2所示,随着循环次数的增加,样品的析水率逐渐增大,由此可知PS和CPPS的冻融稳定性与其析水率有关。这主要是因为在冻融过程中,温度的变化使淀粉分子之间的作用力加强,导致淀粉分子形成平行的凝胶束,凝胶中的水分子被大量挤出,导致冻融稳定性变差[30-31]。与此同时,随着交联程度的增加,具有高取代度的CPPS3在经冻融循环后,析水率在第2次与第3次之间及第3次与第4次之间均有差异不显著的现象(P>0.05)。此外,所有CPPS样品在每一次冻融循环后的析水率均远低于PS。这与Hu等[16]的报道一致,一方面磷酸键的形成使得交联淀粉内部形成不同稳定的网状立体结构,另一方面,淀粉分子的重排和缔合被磷酸基团之间的静电斥力所阻碍,促进了淀粉分子的水化,削弱了分子间的结合力,使得冻融过程不容易破坏其结构。
表 2 紫薯淀粉和不同取代度交联紫薯淀粉的冻融稳定性Table 2. Freeze-thaw stability of PS and CPPS with different degrees of substitution样品 析水率(%) 循环1次 循环2次 循环3次 循环4次 PS 31.62±1.15Ac 36.93±0.93Bc 43.16±1.26Cc 51.43±1.70Dd CPPS1 26.02±0.78Ab 24.80±1.68Aa 28.44±1.61Ba 33.12±1.74Cb CPPS2 21.06±1.82Aa 28.72±1.69Bb 33.07±2.74Cb 35.76±9.54Cc CPPS3 23.14±2.47Aa 28.95±1.43Bb 31.22±2.57BCb 32.31±2.67Ca 注: 表中不同大写字母表示同行数据差异显著(P<0.05);不同小写字母表示同列数据差异显著(P<0.05)。 交联淀粉冻融稳定性的增加可以改善食品在冷冻或融化后的品质,适于冷冻食品的应用[32],如面团在冷冻过程中,由于冰晶的形成其面筋结构会受到破坏,而添加磷酸酯淀粉能有效延缓冷冻面团的老化,提高面团的品质,且取代度高的磷酸酯淀粉更能明显地延缓面团的老化现象[33]。
2.3 不同取代度CPPS的微观结构
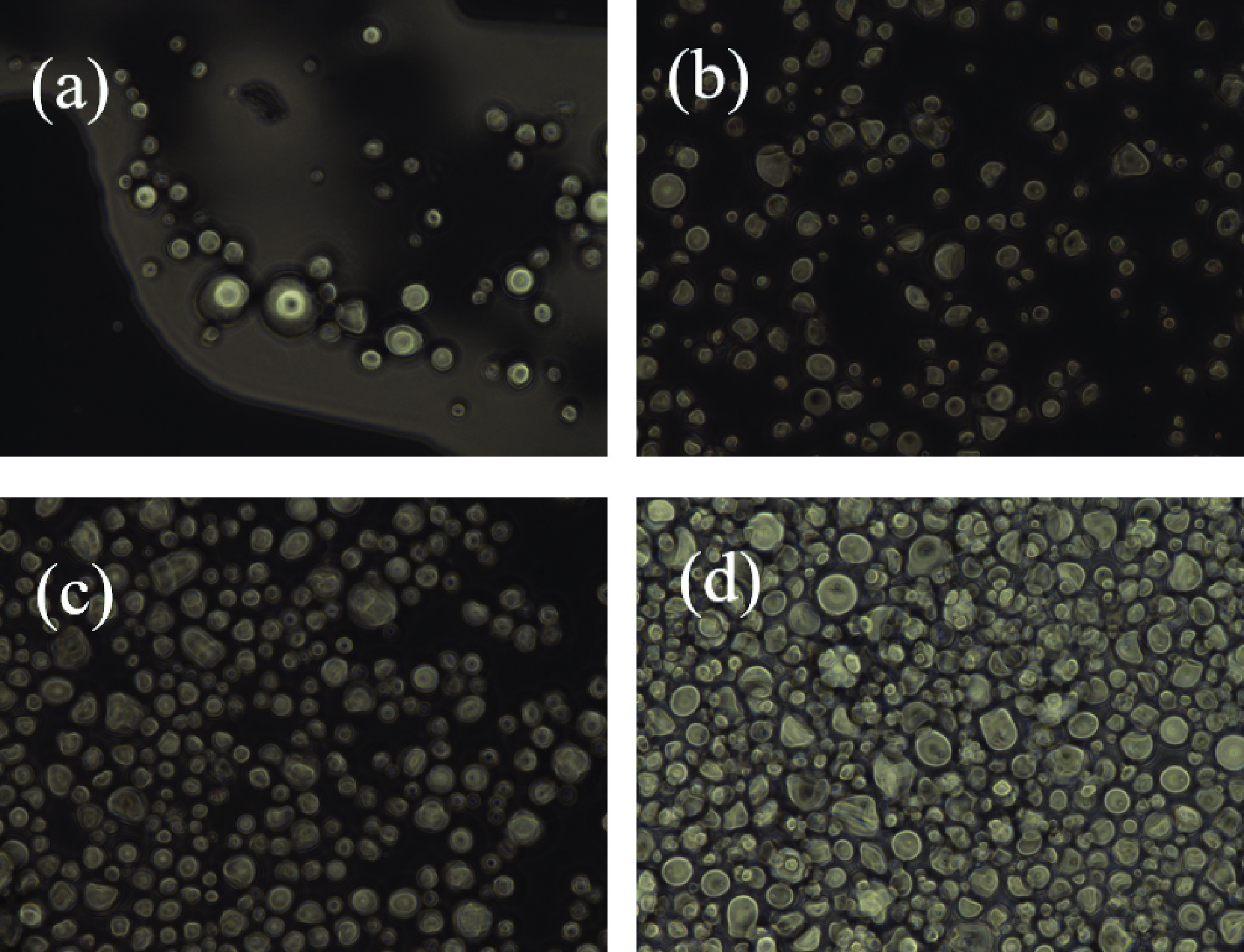
不同取代度CPPS的光学和电子显微观察结果分别如图3和图4所示。由图3a可知,尚未进行交联改性的PS在水溶液中呈游离状态,淀粉颗粒的间距较大,并不出现集中分布的现象。但随着交联剂的加入,CPPS取代度增加,淀粉在水溶液中的排布逐渐密集起来,取代度越高,密集程度越大(图3b、c、d)。图3d为安全限额下取代度最高的CPPS,可以明显观察到,在粒径较大淀粉颗粒的周围围绕着较多小淀粉颗粒,磷酸键的形成使得淀粉颗粒之间形成“架桥”,将分子连接起来。不仅如此,PS在水溶液中的颗粒形态较为完整,可以明显观察到较为光滑和完整的圆弧状态,而CPPS的颗粒形态大小不一,随着取代度的增大而渐变为不规则形状[21]。
![]() 图 3 紫薯淀粉和不同取代度交联紫薯淀粉的光学显微照片(×400)注:(a)~(d)分别为PS、CPPS1、CPPS2和CPPS3;图4同。Figure 3. Optical microscope photographs of PS and CPPS with different degrees of substitution (×400)
图 3 紫薯淀粉和不同取代度交联紫薯淀粉的光学显微照片(×400)注:(a)~(d)分别为PS、CPPS1、CPPS2和CPPS3;图4同。Figure 3. Optical microscope photographs of PS and CPPS with different degrees of substitution (×400)图 4 为 PS 和 CPPS 的扫描电镜结果。PS 的颗粒完整且光滑,表面可能黏附着少许的杂质,但总体无明显裂痕(图4a)。随着交联淀粉取代度的提高,颗粒的表面呈现剥离状外观,小分子颗粒之间相互连接,不断聚集形成较大的粒团,大分子颗粒表面吸附着更多小分子颗粒(图4b、c、d)。这说明取代度越高的CPPS,自聚集和吸附能力越强,颗粒之间的作用力越大。在低交联情况下,交联反应可能只发生在淀粉颗粒的表面;而在高交联情况下,淀粉颗粒之间相互粘黏,淀粉颗粒不断聚集,形成越来越大的团块状结构[16]。因此,从扫描电镜结果可以看出,磷酸二酯交联反应不会明显破坏淀粉颗粒的表面形态,随着交联剂含量的增加,交联淀粉的取代度提高。
2.4 不同取代度CPPS的傅里叶红外光谱分析
PS和不同取代度CPPS的傅里叶红外光谱如图5所示。3402.36 cm−1处的宽峰处由于O-H键的伸缩振动引起,2924.02 cm−1处的峰由C-H键的不对称伸展引起,1621.43 cm−1处的峰由H-O-H键的伸缩振动引起[31],不同取代度的CPPS在以上波数处形成的峰强度与PS相比变化不大,说明酯化反应并未改变PS上其他基团的特征吸收峰,未破坏PS的原有结构。995~1050 cm−1是P-O-C伸缩振动吸收带[34-35],随着磷酸基团的引入,可以明显观察到该处CPPS的吸收峰强度增大。这可能是因为淀粉分子羟基上的氢键被磷酸基取代,使淀粉分子中的羟基转变为磷酸二酯键,而原特征吸收峰仍然被保持。这证实了紫薯淀粉交联反应的发生,且没有破坏淀粉分子的基本化学结构。
2.5 不同取代度CPPS的X射线衍射分析
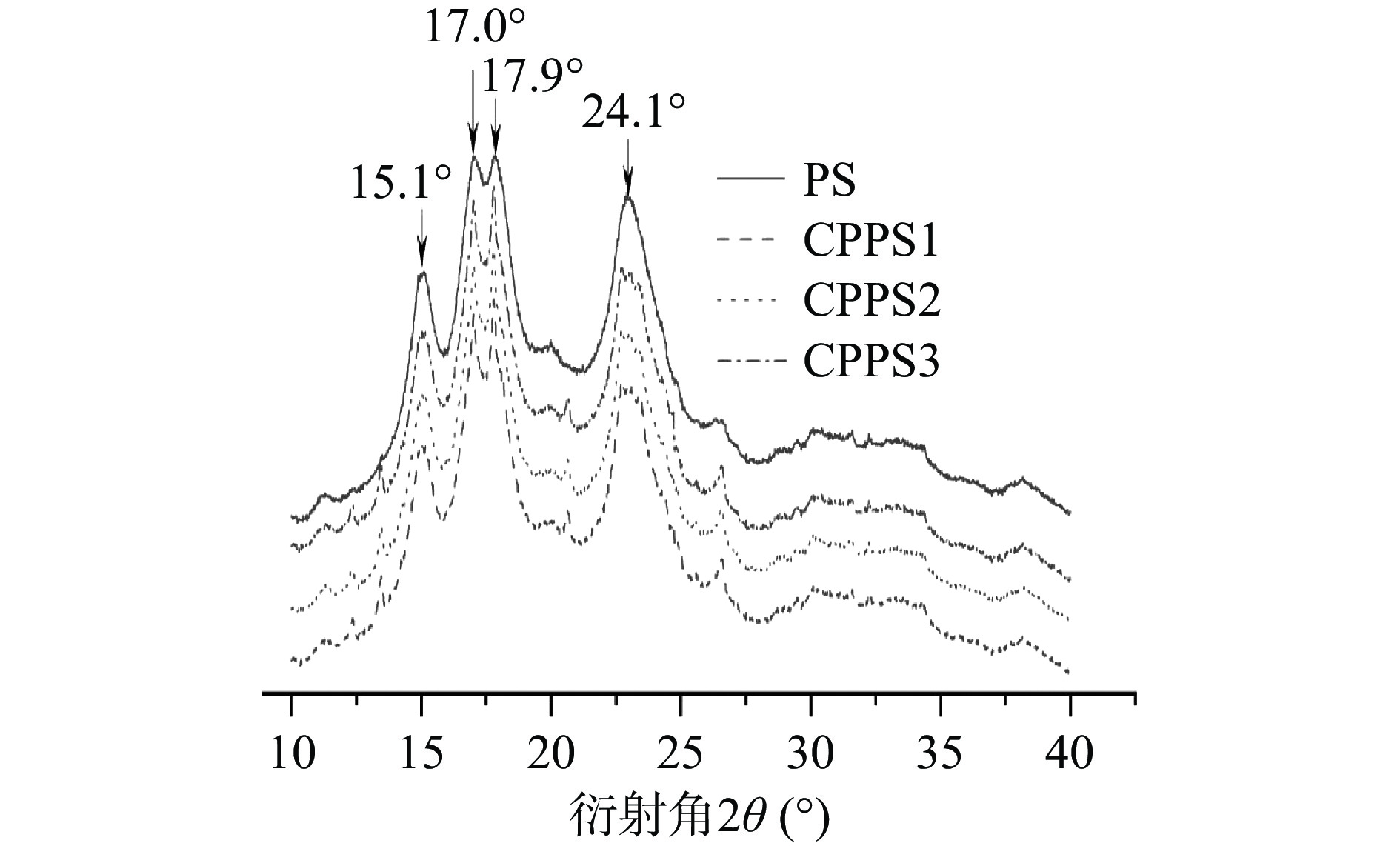
不同取代度交联淀粉的X-射线衍射图如图6所示。如图可以看出,无论是PS还是CPPS,衍射曲线均存在弥漫峰和尖峰,这表明交联淀粉中同时存在非结晶结构和结晶结构。PS在2θ为15.1°、17.0°、17.9°和24.1°处出现了明显的衍射峰,而CPPS的峰形在以上位置与PS相比变化不大,说明在交联反应后,淀粉的晶体类型未发生变化,仍为C型结晶。而CPPS的结晶度较PS有所下降(表3),说明交联反应发生在淀粉的无定型区域和结晶区域,对淀粉的结晶特性也有影响,但这种影响并不突出。因此,在安全限额内的交联剂可导致交联淀粉结晶度降低,结晶区域虽有破坏,但是未改变原有淀粉晶型。
表 3 紫薯淀粉和不同取代度交联紫薯淀粉的结晶度Table 3. Crystallinity of PS and CPPS with different degrees of substitution样品 结晶度(%) PS 30.15c CPPS1 29.66bc CPPS2 29.16b CPPS3 28.96a 注:表中不同小写字母表示同列数据差异显著(P<0.05)。 2.6 不同取代度CPPS的粒径分析
根据粒径的大小将淀粉颗粒分为大颗粒(直径一般大于10 μm)和小颗粒(直径一般小于10 μm)[36]。不同取代度交联淀粉的粒径分布如图7所示。可以明显看出,这四类淀粉的主要粒径均分布在5~100 μm之间,其中PS的平均粒径为16.89 μm,这与陈洁[37]的研究结论相似。随着交联淀粉取代度的增加,其粒径变化呈现规律性增大趋势,CPPS1~CPPS3的平均粒径分别为17.05、17.26和17.68 μm(表4)。这些数据表明,PS和CPPS平均粒径差异不大,其直径大于10 μm,主要为大颗粒淀粉。这可能是交联反应在淀粉分子上引入了带负电的磷酸基团,且在一定程度上破坏了淀粉分子之间的氢键,当淀粉分散在蒸馏水中测粒径时,CPPS较原淀粉更容易吸水膨胀[38]。
表 4 紫薯淀粉和不同取代度交联紫薯淀粉的平均粒径Table 4. Mean particle size of PS and CPPS with different degrees of substitution样品 平均粒径(μm) PS 16.89 CPPS1 17.05 CPPS2 17.26 CPPS3 17.68 2.7 不同取代度CPPS的 电位分析
Zeta电位是判断分散体系是否稳定的方法,当电位绝对值越高,则表明体系越稳定,分散体系稳定性与其表面状态和颗粒大小有关[39]。不同取代度交联淀粉的电位随pH变化分布如图8所示。由图可知,在pH为3.0~7.0时,PS和三种CPPS的电荷数均小于0,说明带负电荷;且随着pH的增大,四种淀粉所带负电荷均有所增加;取代度越高,负电荷越多。其原因可能是交联淀粉为长链分子,磷酸基团的引入使淀粉颗粒上的负电荷数量增加[40],淀粉中的磷酸基团数量随着交联剂浓度的增大而增加,负电荷也随之增多。
3. 结论
本研究采用磷酸化交联法制备不同取代度的交联紫薯淀粉,并对其结构性能进行了表征。结果表明,紫薯淀粉经过交联后其理化性质发生显著性变化,且与取代度有关。随着取代度的提高,CPPS透明度、溶解度及冻融稳定性较原淀粉均显著提高,膨胀度下降;CPPS颗粒形貌为剥离状外观,交联度大的颗粒呈现团块状结构;FT-IR检测发现CPPS在995~1050 cm−1出现特征吸收峰,淀粉分子基本化学结构未被破坏,证实了交联反应的发生;紫薯淀粉经过交联反应后均带负电荷,其晶体类型仍为C型结晶,但结晶度下降,三种取代度CPPS的平均粒径分别为17.05、17.26和17.68 μm,为大颗粒淀粉。此结果证实了交联反应可有效改善紫薯淀粉的理化性能,且与交联度关系密切。本研究结果可为紫薯淀粉的改性研究提供理论依据,为紫薯资源的进一步开发利用提供技术支持。
-
图 3 紫薯淀粉和不同取代度交联紫薯淀粉的光学显微照片(×400)
注:(a)~(d)分别为PS、CPPS1、CPPS2和CPPS3;图4同。
Figure 3. Optical microscope photographs of PS and CPPS with different degrees of substitution (×400)
表 1 不同交联淀粉的吸光值、结合磷含量及取代度
Table 1 Absorbance, bound phosphorus content and degree of substitution in different cross-linked starch
指标 CPPS1 CPPS2 CPPS3 吸光值 0.140 0.335 0.700 结合磷含量(m/m,%) 0.100 0.200 0.393 取代度 0.0053 0.0106 0.0212 表 2 紫薯淀粉和不同取代度交联紫薯淀粉的冻融稳定性
Table 2 Freeze-thaw stability of PS and CPPS with different degrees of substitution
样品 析水率(%) 循环1次 循环2次 循环3次 循环4次 PS 31.62±1.15Ac 36.93±0.93Bc 43.16±1.26Cc 51.43±1.70Dd CPPS1 26.02±0.78Ab 24.80±1.68Aa 28.44±1.61Ba 33.12±1.74Cb CPPS2 21.06±1.82Aa 28.72±1.69Bb 33.07±2.74Cb 35.76±9.54Cc CPPS3 23.14±2.47Aa 28.95±1.43Bb 31.22±2.57BCb 32.31±2.67Ca 注: 表中不同大写字母表示同行数据差异显著(P<0.05);不同小写字母表示同列数据差异显著(P<0.05)。 表 3 紫薯淀粉和不同取代度交联紫薯淀粉的结晶度
Table 3 Crystallinity of PS and CPPS with different degrees of substitution
样品 结晶度(%) PS 30.15c CPPS1 29.66bc CPPS2 29.16b CPPS3 28.96a 注:表中不同小写字母表示同列数据差异显著(P<0.05)。 表 4 紫薯淀粉和不同取代度交联紫薯淀粉的平均粒径
Table 4 Mean particle size of PS and CPPS with different degrees of substitution
样品 平均粒径(μm) PS 16.89 CPPS1 17.05 CPPS2 17.26 CPPS3 17.68 -
[1] 楚良慧, 宋帅, 张红, 等. 紫薯的营养价值及其脱毒快繁技术研究进展[J]. 安徽农学通报,2018,24(24):34−35, 42. [CHU L H, SONG S, ZHANG H, et al. Advances in the nutritional value of purple potato and its detoxification and rapid propagation techniques[J]. Anhui Agricultural Science Bulletin,2018,24(24):34−35, 42. doi: 10.3969/j.issn.1007-7731.2018.24.017 [2] YONG H, WANG X, SUN J, et al. Comparison of the structural characterization and physicochemical properties of starches from seven purple sweet potato varieties cultivated in China[J]. International Journal of Biological Macromolecules,2018,120:1632−1638. doi: 10.1016/j.ijbiomac.2018.09.182
[3] 张梦潇, 周文化, 杨代明, 等. 不同品种紫薯淀粉结构与其面团品质的关系[J]. 中国食品学报,2021,21(8):182−192. [ZHANG M X, ZHOU W H, YANG D M, et al. Relationship between starch structure and dough quality characteristics of different varieties of purple sweet potato[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(8):182−192. doi: 10.16429/j.1009-7848.2021.08.018 [4] 季佳佳. 三偏磷酸钠交联玉米淀粉的理化性质研究[D]. 天津: 天津科技大学, 2010. JI J J. A study on physiochemical properties of cross-linked maize starch with sodium trimetaphosphat[D]. Tianjin: Tianjin University of Science and Technology, 2010.
[5] WEI M, LIU Y, LIU B, et al. Preparation and application of starch phosphate with a low degree of substitution[J]. Phosphorus, Sulfur, and Silicon and the Related Elements,2011,186(4):974−982. doi: 10.1080/10426507.2010.537714
[6] ZHANG K X, ZHENG Z, ZHANG X F, et al. Study on the characterization of cross-linked cassava starch prepared by microwave radiation[J]. Advanced Materials Research,2013,2735(821-822):1051−1054.
[7] BISMARK S, ZHIFENG Z, BENJAMIN T. Effects of differential degree of chemical modification on the properties of modified starches: Sizing[J]. The Journal of Adhesion,2018,94(2):97−123. doi: 10.1080/00218464.2016.1250629
[8] BENDORAITIENE J, LEKNIUTE-KYZIKE E, RUTKAITE R. Biodegradation of cross-linked and cationic starches[J]. International Journal of Biological Macromolecules,2018,119:345−351. doi: 10.1016/j.ijbiomac.2018.07.155
[9] 葛亚芳. 基于不同取代度OSA改性淀粉包埋虾青素的营养载体研究[D]. 南京: 南京师范大学, 2021. GE Y F. Study on nutrient carrier embedding astaxanthin in OSA modified starch based on different degree of substitution[D]. Nanjing: Nanjing Normal University Normal University, 2021.
[10] MATHEW S, ABRAHAM T E. Physico-chemical characterization of starch ferulates of different degrees of substitution[J]. Food Chemistry,2007,105(2):579−589. doi: 10.1016/j.foodchem.2007.04.032
[11] SECHI N S M, MARQUES P T. Preparation and physicochemical, structural and morphological characterization of phosphorylated starch[J]. Materials Research,2017,20:174−180. doi: 10.1590/1980-5373-mr-2016-1008
[12] PASSAUER L, BENDER H, FISCHER S. Synthesis and characterisation of starch phosphates[J]. Carbohydrate Polymers,2010,82(3):809−814. doi: 10.1016/j.carbpol.2010.05.050
[13] 杨秋歌, 王颖, 崔雯雯, 等. 小利马豆淀粉理化性质的研究[J]. 中国粮油学报,2012,27(12):28−32, 53. [YANG Q G, WANG Y, CUI W W, et al. Study on extracting technics of walnut oil assisted by ultrasonic wave[J]. Journal of the Chinese Cereals and Oils Association,2012,27(12):28−32, 53. doi: 10.3969/j.issn.1003-0174.2012.12.006 [14] 唐洪波, 孙敏, 李艳平, 等. 酸解、氧化马铃薯淀粉与酸解、氧化木薯淀粉性能比较[J]. 粮油加工,2010(7):71−74. [TANG H B, SUN M, LI Y P, et al. Comparison of acidolysis and oxidized potato starch with acidolysis and oxidized cassava starch[J]. Cereals and Oils Processing,2010(7):71−74. [15] SUKHIJA S, SINGH S, RIAR C S. Effect of oxidation, cross-linking and dual modification on physicochemical, crystallinity, morphological, pasting and thermal characteristics of elephant foot yam (Amorphophallus paeoniifolius) starch[J]. Food Hydrocolloids,2016,55:56−64. doi: 10.1016/j.foodhyd.2015.11.003
[16] HU N, LI L, TANG E, et al. Structural, physicochemical, textural, and thermal properties of phosphorylated chestnut starches with different degrees of substitution[J]. Journal of Food Processing and Preservation,2020,44(6):201−211.
[17] LIU J, WANG B, LONG L, et al. Functional, physicochemical properties and structure of cross-linked oxidized maize starch[J]. Food Hydrocolloids,2014,36:45−52. doi: 10.1016/j.foodhyd.2013.08.013
[18] 刘燕. 山药粉及其交联淀粉的制备与表征[D]. 保定: 河北农业大学, 2019. LIU Y. Preparation and characterization of yam powder and cross-linked starch[D]. Baoding: Hebei Agricultural University, 2019.
[19] 白礼涛. 莲藕支链淀粉—乳清分离蛋白复合乳化剂的制备及其特性研究[D]. 合肥: 合肥工业大学, 2019. BAI L T. Study on preparation and properties of emulsifier for lotus root amylopectin-whey protein isolate complex[D]. Hefei: Hefei University of Technology, 2019.
[20] DONG D, QI Z, CUI B, et al. Complex formation between soy proteins and potato starch: Effect of pH, biopolymer ratio, and biopolymer concentration[J]. Starch,2019,72(1−2):1900020.
[21] HU X, GU N, LI T T, et al. Synthesis and evaluation of microstructure of phosphorylated chestnut starch[J]. Journal of Food Process Engineering,2014,16:225−232.
[22] 韦冬梅. 乳酸磷酸双改性糯米淀粉制备及其结构和物化性质的研究[D]. 安徽: 安徽农业大学, 2021. WEI D M. Preparation, structure and physicochemical properties of dual-modified glutinous rice starch with lactates and phosphorylation[D]. Anhui: Anhui Agricultural University, 2021.
[23] 李岩. 三偏磷酸钠对葛根淀粉微结构及其应用性能影响的研究[D]. 天津: 天津大学, 2015. LI Y. Study on the effect of sodium trimetaphosphate on the micro-structure and application properties of kudzu starch[D]. Tianjin: Tianjin University, 2015.
[24] 毛海锋, 吴卫国, 胡元斌, 等. 大米淀粉及其磷酸酯的理化性质研究[J]. 中国粮油学报,2012,27(1):33−37, 52. [MAO H F, WU W G, HU Y B, et al. Study on preparation and physicochemical properties of rice starch and its phosphate ester[J]. Journal of the Chinese Cereals and Oils Association,2012,27(1):33−37, 52. doi: 10.3969/j.issn.1003-0174.2012.01.008 [25] TÉLLEZ-MORALES J A, HERNÁNDEZ-SANTO B, RODRÍGUEZ-MIRANDA J. Effect of ultrasound on the techno-functional properties of food components/ingredients: A review[J]. Ultrasonics Sonochemistry,2020,61:104787. doi: 10.1016/j.ultsonch.2019.104787
[26] 康欣月, 王立梅, 孙姜, 等. 竹豆淀粉理化性质的研究[J]. 食品研究与开发,2017,38(22):20−24. [KANG X Y, WANG L M, SUN J, et al. Study on the physical and chemical properties of bamboo beans starch[J]. Food Research and Development,2017,38(22):20−24. doi: 10.3969/j.issn.1005-6521.2017.22.004 [27] VEMA D K, SRIVASTAV P P. Isolation, modification, and characterization of rice starch with emphasis on functional properties and industrial application: A review[J]. Critical Reviews in Food Science and Nutrition,2021:1−28.
[28] SOFI B A, WANI I A, MASOODI F A, et al. Effect of gamma irradiation on physicochemical properties of broad bean (Vicia faba L.) starch[J]. LWT-Food Science and Technology,2013,54(1):63−72. doi: 10.1016/j.lwt.2013.05.021
[29] SINGH J, MCCARTHY O J, SINGH H. Physico-chemical and morphological characteristics of New Zealand Taewa (Maori potato) starches[J]. Carbohydrate Polymers,2006,64(4):569−581. doi: 10.1016/j.carbpol.2005.11.013
[30] CHEN T, GU C, OUYANG Y, et al. Synthesis of high hydrothermal stability beta zeolite with cross linked starch and catalytic performance in catalytic cracking reaction[J]. Fuel,2022,318:123696. doi: 10.1016/j.fuel.2022.123696
[31] DHITAL S, SHRESTHA A K, HASJIM J, et al. Physicochemical and structural properties of maize and potato starches as a function of granule size[J]. Journal of Agricultural & Food Chemistry,2011,59(18):10151−10161.
[32] 张翔, 陈彦君, 刘家宏, 等. 压热-酶法制备高抗性复合淀粉的结构分析及加工特性研究[J]. 食品科技,2021,46(4):216−221. [ZHANG X, CHEN Y J, LIU J H, et al. Study on structural analysis and processing characteristics of high resistance composite starch prepared by pressure heat enzymatic method[J]. Food Science and Technology,2021,46(4):216−221. doi: 10.13684/j.cnki.spkj.2021.04.033 [33] MIYAZAKI M, MAEDA T, MORITA N. Bread quality of frozen dough substituted with modified tapioca starches[J]. European Food Research and Technology,2008,227(2):503−509. doi: 10.1007/s00217-007-0747-0
[34] REN Z, XING X, XI W, et al. FTIR, Raman, and XPS analysis during phosphate, nitrate and Cr(VI) removal by amine cross-linking biosorbent[J]. Journal of Colloid and Interface Science,2016,468:313−323. doi: 10.1016/j.jcis.2016.01.079
[35] CHEN F P, OU S Y, TANG C H. Core-shell soy protein-soy polysaccharide complex (nano) particles as carriers for improved stability and sustained release of curcumin[J]. Journal of Agricultural and Food Chemistry,2016,64(24):5053−5059. doi: 10.1021/acs.jafc.6b01176
[36] PARK S-H, WILSON J D, SEABOURN B W. Starch granule size distribution of hard red winter and hard red spring wheat: Its effects on mixing and bread making quality[J]. Journal of Cereal Science,2009,49(1):98−105. doi: 10.1016/j.jcs.2008.07.011
[37] 陈洁. 紫薯淀粉品质特性的研究与应用[D]. 福州: 福建农林大学, 2014. CHEN J. Study on qualitative characteristics of purple sweet potato and its application[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014.
[38] 张金玲. 辛烯基琥珀酸山药淀粉酯的制备、性能及应用研究[D]. 天津: 天津科技大学, 2018. ZHANG J L. Preparation, properties and application of octenyl succinic anhydride modified yam starch[D]. Tianjin: Tianjin University of Science and Technology, 2018.
[39] 米红波, 苏情, 李政翰, 等. 脂肪酸不饱和度对高直链玉米淀粉-脂肪酸复合物结构和热性能的影响[J]. 食品工业科技,2020,41(3):27−32. [MI H B, SU Q, LI Z H, et al. Effect of unsaturation of fatty acid on structure and stability of high amylose corn starch-fatty acid complex[J]. Science and Technology of Food Industry,2020,41(3):27−32. doi: 10.13386/j.issn1002-0306.2020.03.006 [40] 张佳艳, 熊建文, 崔娜, 等. 交联淀粉对甘薯浊汁饮料稳定性的影响[J]. 食品与机械,2020,36(2):187−192. [ZHANG J Y, XIONG J W, CUI N, et al. Effect of cross-linked starch on the stability of sweet potato turbid juice beverage[J]. Food & Machinery,2020,36(2):187−192. doi: 10.13652/j.issn.1003-5788.2020.02.035










 下载:
下载:




 下载:
下载:
