Screening and Application of Dominant Lactic Acid Bacteria and Yeasts in Rice Sour Soup from Miao
-
摘要: 目的:为了得到适合白酸汤发酵的发酵剂,实现传统白酸汤的规范性生产。方法:采用溶钙圈法结合总酸产量和耐酸耐胆盐实验筛选乳酸菌优良菌株;采用糖苷酶活性实验筛选酵母菌优良菌株;通过生理生化实验、16S rDNA序列和ITS序列进行菌株鉴定。将两株优良发酵菌株复配应用于白酸汤中,对其pH、总酸、总糖、还原糖和感官品质进行分析。结果:从128株乳酸菌中筛选出1株产酸能力较强的菌株G1-3,该菌株在pH3.0与0.3%牛胆盐环境中均生长良好,从20株酵母菌中筛选出1株糖苷酶活性较强的菌株G2-2。经鉴定菌株G1-3为副干酪乳酸杆菌(Lactobacillus paracasei),G2-2为印迪卡有孢圆酵母(Torulaspora indica)。两株菌复配发酵后的籼米白酸汤的总酸含量较自然发酵提高了5倍,总糖与还原糖含量分别降低了61.53%与81.02%;糯米白酸汤中的总酸含量较自然发酵提高了18倍,总糖与还原糖含量分别降低了68.86%与86.99%。两株菌复配发酵后的白酸汤的感官品质也优于自然发酵。结论:G1-3与G2-2的复合发酵剂发酵得到的白酸汤具有较好的品质,有望应用于白酸汤的发酵生产。Abstract: Objective: To obtain the starter culture suitable for rice sour soup fermentation, and realize the standard produc-tion of traditional rice sour soup. Methods: The excellent strains of lactic acid bacteria were screened by calcium-dissolving circle method combined with total acid yield and the tolerance experiments of acid and bile salt; The experiment of glycosidase activity was used to screen the excellent strains of yeast. The strains were identified by physiological and biochemical experiments, 16S rDNA and ITS sequence; The compounded two excellent fermentation strains were applied to rice sour soup, and their pH, total acid, total sugar, reducing sugar and sensory quality were analyzed. Results: The strain G1-3 with strong acid-producing ability was selected from 128 strains of lactic acid bacteria, which grew well in the environment of pH3.0 and 0.3% bovine bile salt. The strain G2-2 with strong glycosidase activity was screened from 20 yeasts. The strains G1-3 and G2-2 were identified as Lactobacillus paracasei and Torulaspora indica, respectively. Compared with natural fermentation, the total acid content of indica white sour soup fermented by two strains of bacteria increased by 5 times, while the total sugar and reducing sugar content decreased by 61.53% and 81.02%, respectively; The total acid content in glutinous rice sour soup increased by 18 times, while the content of total sugar and reducing sugar decreased by 68.86% and 86.99%, respectively. Also, the sensory quality of white sour soup fermented by two strains of bacteria was better than that of natural fermentation. Conclusion: The white sour soup fermented by compound starter of G1-3 and G2-2 has excellent quality, which is expected to be applied to the fermentation production of white sour soup.
-
Keywords:
- lactic acid bacteria /
- yeast /
- screening /
- identification /
- rice sour soup
-
苗族白酸汤,流行于中国贵州省,是利用糯米或籼米作为发酵基质,以自然发酵的形式制作而成的一类液态发酵食品[1],可配制成饮品,也可当调料制作佳肴。谷物基质发酵后富含有机酸、氨基酸、矿物质元素及维生素等,具有丰富的营养价值[2],再加上其独特的风味和口感,深受广大消费者的喜爱,极具产业开发价值。
贵州特色发酵白酸汤中蕴含丰富的益生菌资源,国内部分研究学者对传统发酵白酸汤制品进行了筛选工作,袁玮[3]通过传统可培养方法表明,白酸汤中发酵的主要菌群为植物乳杆菌、醋酸杆菌和酿酒酵母菌;王琪琪等[4]采用高通量测序(Illumina MiSeq)技术对贵州凯里酸汤微生物多样性及群落结构进行了解析,结果表明,在属水平上,白酸汤的优势菌属为乳杆菌属、明串珠菌属、产阮假丝酵母与毕赤酵母;万宁威等[5]发现白酸汤在发酵过程中维氏乳杆菌、法式醋酸杆菌是优势细菌,毛榛毕赤酵母是优势真菌。在淀粉食物原料的发酵过程中,优势菌主要为乳酸菌和酵母菌,二者可进行协同发酵来改善产品的风味和营养成分[6]。
虽然国内学者在白酸汤中菌株的筛选等方面已有研究,但目前可以投入商业化应用的菌株仍然较少。因此,本研究旨在从苗族传统白酸汤中分离鉴定有良好发酵性能的乳酸菌和酵母菌,并用作白酸汤的复合发酵剂,期望从中筛选到性能优良的菌株,为白酸汤的标准化、规范化生产提供理论依据。
1. 材料与方法
1.1 材料与仪器
白酸汤 贵州省黔东南苗族侗族自治州农家生产正宗苗家白酸汤;糯米、籼米 重庆永辉超市;牛胆盐 上海博微生物科技有限公司;七叶灵(纯度≥98%) 酷尔化学科技(北京)有限公司;α-淀粉酶(10000 U/g) 尤特尔生化有限公司;麦芽汁培养基 广东环凯微生物科技有限公司;细菌DNA提取试剂盒 天根生化科技(北京)有限公司;真菌DNA提取试剂盒 索莱宝(北京)科技有限公司;MRS培养基:蛋白胨10 g、酵母提取物5 g、牛肉膏10 g、葡萄糖20 g、磷酸氢二钾2 g、柠檬酸三铵2 g、乙酸钠5 g、吐温80 1 mL、七水硫酸镁0.58 g、四水硫酸锰0.25 g、去离子水1000 mL、pH6.2~6.4;121 ℃灭菌20 min。固体培养基加入15 g琼脂;其他试剂 国产分析纯。
SPX-250B-Z生化培养箱 上海博讯实业有限公司医疗设备厂;SJ-CJ-2FD超净工作台 苏州苏洁净化设备有限公司;HYQX-II厌氧培养箱 上海跃进医疗器械有限公司;GZX-9140MBE电热恒温鼓风干燥箱 上海博讯实业有限公司;ATY224电子天平 Shimadzu Corporation;DW-HL100超低温冷冻冰箱 中科美菱低温科技股份有限公司;LDZH-100L立式高压蒸汽灭菌锅 上海申安医疗器械厂;SP-1920紫外分光光度计 上海光谱仪器有限公司;13395H2X普通光学显微镜 德国徕卡公司;XP基因扩增仪 杭州博日科技有限公司;EPS-301电泳仪 美国安玛西亚;PHS-3C pH计 上海佑科仪器仪表有限公司。
1.2 实验方法
1.2.1 菌株的分离筛选
1.2.1.1 菌株分离
现场采集白酸汤样品,密封在无菌取样瓶中,冰盒保存运回实验室。在无菌超净工作台中,吸取10 mL白酸汤样品,置入含90 mL无菌去离子水三角瓶中进行梯度稀释,吸取100 μL合适稀释度的样品稀释液,分别涂布于MRS或麦芽汁固体培养基上,MRS培养基于35 ℃(麦芽汁培养基于28 ℃)培养48 h。分别挑取具有不同菌落特征的疑似乳酸菌菌落和具有不同菌落特征的疑似酵母菌菌落进行划线纯化[7]。
1.2.1.2 菌株筛选
对疑似乳酸菌进行菌株形态、革兰氏染色和过氧化氢酶实验,选择革兰氏染色阳性、过氧化氢酶阴性的菌株进行斜面保藏和甘油管冷冻保藏(菌液和50%甘油按1:1的体积比接入甘油管内并置于实验室−80 ℃冰箱中)。对疑似酵母菌进行水浸片镜检,选择具有典型酵母菌特征和良好产气性能的菌株进行斜面保藏和甘油管冷冻保藏(与乳酸菌菌种保藏方法一致)。
1.2.2 高产乳酸乳酸菌的筛选
将上述纯化后的乳酸菌单菌落接种于添加了1%的碳酸钙与0.01%的溴甲酚紫的改良MRS固体培养基中,35 ℃培养24 h,测量溶钙圈直径[8]。将乳酸菌按3%接种量接种于MRS液体培养基中,35 ℃摇瓶培养16 h后测定pH。采用酸碱滴定法以乳酸的含量计算其产酸量[9]:取10 g发酵液置于100 mL烧杯中,加入50 mL的纯水,混合均匀,超声30 min后取出,冷却至室温,转移至100 mL容量瓶中,用纯水定容至刻度线,快速滤纸过滤后使用移液枪吸取25 mL滤液置于250 mL三角瓶中,加入2~4滴酚酞指示剂,用0.1 mol/L的NaOH标准液滴定至微红色。由消耗的NaOH溶液的量来计算乳酸菌产酸量。产酸量计算公式为:
产酸量(g/kg)=(V−V0)×C×k×Fm×1000 (1) 式中:V:发酵液样品滴定消耗的NaOH标液体积,mL;V0:对照组(空白培养基)滴定消耗的NaOH标液体积,mL;C:滴定液NaOH的浓度0.1 mol/L;k:乳酸换算系数0.090;F:稀释倍数;m:样品的质量,g;1000:换算系数。
1.2.3 胁迫下菌株耐受性检测
1.2.3.1 耐酸能力
为了测定乳酸菌在低酸条件下的耐受能力,将乳酸菌在MRS液体培养基中活化12 h后分别按2%的接种量接种于含有不同pH浓度(2.0、3.0)的MRS液体培养基中,以pH6.5作为对照组,置于35 ℃条件下培养3 h后,分别计算各菌株在不同pH浓度下的活菌数,并按照下列公式计算细菌的存活率[10]。
细菌存活率(%)=处理组的活菌数对照组的活菌数×100 (2) 1.2.3.2 耐胆盐能力
为了测定菌株的耐胆盐能力,将活化菌株分别按2%的接种量接种于含有不同质量分数的牛胆盐(0.3%、0.6%)的MRS液体培养基中,以不含牛胆盐的培养基为对照,置于35 ℃条件下,恒温培养3 h后, 分别计算活菌数,并按照公式(2)计算细菌的存活率[11]。
1.2.4 具有高β-葡萄糖苷酶活性的酵母菌的筛选
将酵母菌分离纯化后,参考薛菊兰等[12]的方法,将活化好的酵母菌接种于七叶灵甘油琼脂培养基中,25 ℃培养8 d,观察菌落周围颜色的变化,菌落周围出现深褐色则说明具有糖苷酶活性,测量黑褐色圈的直径,以黑褐色圈的直径大小表示其产酶强弱[13]。
1.2.5 优势菌株鉴定
1.2.5.1 优势乳酸菌鉴定
菌株的形态学和生理生化特征参照《常见细菌系统鉴定手册》。使用试剂盒提取菌体总DNA,以菌体DNA为模版,乳酸菌采用通用引物27F(5'-AGAGTTTGATCATGGCTCAG-3')和1492R(5'-TAGGGTTACCTTGTTACGACTT-3')进行PCR扩增[14],细菌PCR反应体系为:Mix混合物12.5 μL;双蒸水9.5 μL;DNA模版2 μL;正反引物各0.5 μL,扩增程序为:95 ℃预变性5 min;95 ℃变性1 min;55 ℃退火1 min;72 ℃延伸90 s;共35个循环,得到PCR产物。将扩增后的PCR产物送往上海生工生物公司测序,将测得的基因序列使用Blast与NCBI数据库上的序列进行比对,选择同源性较高的相关序列使用MEGAX软件来构建菌株的系统进化树。
1.2.5.2 优势酵母菌鉴定
菌株的形态学特征参照《酵母菌的特征与鉴定手册》。采用酵母基因组DNA提取试剂盒(离心柱型)对酵母菌总DNA进行提取。采用引物ITS1(5'-TCCGTAGGTGAACCTGCGC-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增[15],酵母菌PCR反应体系为:Mix混合物12.5 μL;双蒸水9.5 μL;DNA模版2 μL;正反引物各0.5 μL,扩增程序为:95 ℃预变性5 min;95 ℃变性1 min;55 ℃退火2 min;72 ℃延伸40 s;共35个循环,得到PCR产物。将扩增后的PCR产物送往上海生工生物公司测序,将测得的基因序列使用Blast与NCBI数据库上的序列进行比对,选择同源性较高的相关序列使用MEGAX软件来构建菌株的系统进化树。
1.2.6 菌悬液的制备
将本研究筛选出的乳酸菌活化后,用无菌枪头取菌体接种于MRS液体培养基中,35 ℃摇瓶培养18 h,直至菌液浓度达到1×108 CFU/mL,备用。将本研究筛选出的酵母菌活化后,取菌体接种于麦芽汁液体培养基中,30 ℃摇瓶培养18 h,直至菌液浓度达到1×108 CFU/mL,备用。
1.2.7 白酸汤制备
将糯米与籼米分别用高速粉碎机破碎,80目筛网过筛,得到糯米粉与籼米粉,分别以1%的添加量加入至300 mL纯净水中,在电炉中煮沸20 min后,补加蒸发水分,将米汤晾至36 ℃左右,备用。将上述米汤分别移入60 ℃水浴锅中进行糊化30 min,期间用玻璃棒不断搅拌,结束后加入1%的α-淀粉酶,液化30 min后在95 ℃水浴锅中放置20 min,随后冷却至36 ℃左右,备用。将上述备用米汤置于500 mL灭菌三角瓶中(n=12),3瓶为一组。其中,一组糯米汤与一组籼米汤中分别都接入1%的酵母菌与8%的乳酸菌,另外2组糯米汤与籼米汤中均不接入菌种,作为自然发酵样品,摇匀后置于30 ℃环境下发酵。每天定期取样,一直取样至第7 d。
1.2.8 pH和总酸含量测定
用pH计测定pH。通过酸碱滴定法测定菌株的产酸量[9],具体操作方法见1.2.2处。
1.2.9 总糖和还原糖测定
将0~7 d的白酸汤样品8000 r/min,离心15 min。吸取上清液备用,总糖含量的测定[16]:用移液枪吸取上清液5 mL,置于25 mL容量瓶中,加入5 mL的6 mol/L的HCl溶液,封口,置于电炉上加热30 min,流水冷却至室温,加1滴酚酞指示剂,用6 mol/L的NaOH溶液滴定至溶液呈淡红色,加去离子水定容至25 mL,摇匀备用,用移液枪吸取5 mL置于50 mL容量瓶中,定容至50 mL,用移液枪吸取上述溶液1 mL于25 mL容量瓶中,加入2.5 mL的DNS试剂,混匀后沸水浴加热5 min,流水冷却,去离子水定容至25 mL,以去离子水为空白,使用分光光度计在540 nm处测定吸光度值,根据标准曲线(y=0.2757x+0.0251,R2=0.9976),计算发酵液中的总糖含量;还原糖含量的测定[17]:用移液枪吸取样品1 mL,置于25 mL容量瓶中,用去离子水定容至25 mL,随后吸取2.5 mL于25 mL容量瓶中,加入2.5 mL的DNS试剂,混匀后沸水浴加热5 min,流水冷却,去离子水定容至25 mL,以去离子水为空白,使用分光光度计在540 nm处测定吸光度值,根据标准曲线(y=0.2757x+0.0251,R2=0.9976)计算发酵液中还原糖的含量。
1.2.10 感官评价
根据国标GB/T 16291.1-2012中的要求进行感官评价培训,评价环境参照GB/T 13868-2009中要求的环境进行设置。选择10名品评员(5男5女)参照感官评分标准[18](表1)进行评价,在评价前,禁止喝酒、抽烟、吃辛辣食物,将样品随机编码放入白色样品杯中,观察样品,看有无光泽和沉淀,闻其气味,品评其滋味,品评完一个样品之后进行漱口[19]。使用表1对发酵结束后的白酸汤样品进行了消费者可接受性测试。
表 1 感官评分标准Table 1. Standards of sensory evaluation感官项目 好
(9~10分)较好
(7~8分)普通
(5~6分)较弱
(3~4分)非常弱
(0~2分)色泽 米白色,清亮,有光泽 米白色或淡黄色,略有光泽 白色或淡黄色 色泽偏暗 灰色,无光泽 酸味 浓郁的乳酸味 乳酸味明显 有乳酸味 乳酸味较淡 无乳酸味 甜味 无甜味 甜味较淡 有甜味 甜味明显 有强烈的甜味 复合香味 浓郁的醇酯香味 有醇酯味 略有醇酯味 醇酯味不明显 无醇酯味,有异味 苦涩味 酸爽适宜,回味浓,无苦涩味 酸爽适宜,有回味,无苦涩味 有酸爽感,稍带苦涩味 酸度、甜度偏高或偏低,
苦涩味明显酸甜比例失调,有强烈的
苦涩味形态 流动呈液态,质地均一 流动呈液态,略有悬浮物,
质地均一流动呈液态,略有
悬浮物流动性较差,有沉淀物和
悬浮物流动性差,粘度大 1.3 数据处理
每个样本均进行3次平行,应用Origin 8.6和DPS数据软件进行数据处理与分析。
2. 结果与分析
2.1 优势乳酸菌的分离鉴定
2.1.1 乳酸菌的分离
从白酸汤发酵中共分离得到128株乳酸菌,菌株的来源及编号见表2。
表 2 白酸汤发酵液中乳酸菌的分离结果Table 2. Isolation results of lactic acid bacteria from rice sour soup fermentation liquid采集地区 菌株编号 菌株数(株) 凯里 G1-1~G1-9 9 麻江 H1-1~H1-18 18 丹寨 I1-1~I1-24 24 黄平 J1-1~J1-37 37 雷山 K1-1~K1-6 6 镇远 L1-1~L1-14 14 从江 M1-1~M1-20 20 2.1.2 乳酸菌产酸能力分析
将128株乳酸菌转接于改良的碳酸钙-溴甲酚紫MRS平板培养基上进行培养,若菌株周围生成透明的圆圈,即溶钙圈,则意味着该菌株可以产生酸来降解环境中的碳酸钙,溶钙圈的大小被认为是乳酸菌产酸能力的重要指标[20-21]。根据菌落周围出现的较明显的溶钙圈分离纯化出了11株乳酸菌菌株。11株乳酸菌的溶钙圈直径与乳酸产量结果见表3。11株乳酸菌的溶钙圈变化范围为0.19~2.20 cm (表3),其中,G1-2菌株的溶钙圈最大,达到2.20 cm。乳酸产量变化范围为2.98~17.19 g/kg,其中,菌株G1-3的乳酸产量达到17.19 g/kg,但其溶钙圈却不及G1-2,可见菌株分泌乳酸的能力并不完全与溶钙圈大小相同,这可能是因为菌株在MRS固体培养基上分泌乳酸后,由于乳酸的不断积累,菌株生长会受到乳酸的反馈抑制[22],其溶钙圈就不会继续扩大。因此筛选出的高产酸乳酸菌株为菌株G1-3。
表 3 不同乳酸菌产酸能力分析Table 3. Analysis of the acid-producing capacity of different lactic acid bacteria菌株 溶钙圈(cm) pH 乳酸产量(g/kg) G1-1 1.33±0.19c 4.53±0.03f 9.66±0.22c G1-2 2.20±0.23a 4.19±0.03g 12.00±0.13b G1-3 1.85±0.03b 4.04±0.03h 17.19±0.04a G1-4 1.24±0.13c 4.86±0.02de 6.17±0.14d H1-4 0.79±0.03de 4.89±0.05cd 5.97±0.26de H1-6 0.19±0.02g 5.59±0.05a 2.98±0.20g J1-1 0.85±0.04de 4.80±0.03e 5.96±0.20de J1-2 0.51±0.05f 5.35±0.04b 4.63±0.11f M1-4 0.36±0.03fg 5.33±0.06b 4.69±0.11f M1-5 0.73±0.03e 4.93±0.02c 5.77±0.04e M1-17 0.96±0.03d 4.84±0.04de 6.10±0.10d 注:同列不同小写字母表示差异显著(P<0.05);表4同。 2.1.3 乳酸菌耐酸和耐胆盐性能分析
益生菌能否在人体内发挥作用,取决于其在胃液酸性和肠道胆盐环境中的存活能力,这是衡量其益生作用的一个重要指标[23-24],基于乳酸菌的产酸特性,对乳酸菌进行了耐酸和耐胆盐性能测定,结果见表4。正常人胃液pH在1.5~4.5之间,受饮食结构的不同而上下波动[22],将筛选出的乳酸菌接种于不同pH的MRS培养基中,测定存活率,观察其耐酸情况,在pH为3.0时,11株乳酸菌的存活率为17.54%~71.14%,当pH从3.0降低至2.0时,其存活率为1.67%~27.27%,说明环境pH降低后,乳酸菌的生长均受到了一定程度的阻碍,甚至死亡,细菌数开始急剧下降。其中,菌株G1-3在pH为3.0时表现出了较强的耐受能力,存活率高达71.14%,说明菌株G1-3的耐低酸性能较好,而G1-4的低酸耐受性最差,在pH为3.0时,其存活率仅为17.54%。
表 4 乳酸菌菌株对低酸和胆盐的耐受性能(%)Table 4. Tolerance to low acid and bile salt of different strains of lactic acid bacteria (%)菌株 pH3.0 pH2.0 0.3%牛胆盐 0.6%牛胆盐 G1-1 44.59±1.98c 27.27±1.30a 46.75±1.30ab 16.45±2.70b G1-2 52.27±1.14b 18.56±2.37cd 41.29±3.47b 14.44±1.97bc G1-3 71.14±3.07a 23.98±1.86ab 52.03±2.54a 24.39±1.21a G1-4 17.54±2.00g 8.33±1.31e 30.70±2.74c 2.63±1.31f H1-4 43.90±0.43c 4.87±0.12ef 28.46±3.92cd 0.85±0.32f H1-6 36.40±0.49de 9.21±0.47e 24.12±0.53de 8.77±0.33d J1-1 45.88±0.73bc 14.51±1.79d 20.00±2.35ef 7.63±0.70de J1-2 41.77±1.86cd 5.22±0.27ef 13.25±2.40g 7.05±1.17de M1-4 29.49±0.34ef 1.67±0.77f 20.09±0.53ef 5.62±0.70de M1-5 34.83±2.24de 14.23±1.71d 26.97±2.24cd 11.97±1.96c M1-17 27.27±0.52f 19.48±0.47bc 15.58±1.30fg 5.24±1.71e 人体小肠中胆盐质量浓度在0.03%~0.3%之间波动,11株乳酸菌对胆盐的耐受性能测试中数据表明,当牛胆盐浓度为0.3%时,其存活率为13.25%~52.03%,均表现出了较好的耐受性,其中,菌株G1-3的胆盐耐受性能最好,存活率达到52.03%;牛胆盐浓度为0.6%时,菌株的胆盐耐受性能均减弱,其存活率降低至0.85%~24.39%。
总的来说,所筛选出的乳酸菌都有一定的耐酸耐胆盐能力,特别是G1-3。
2.1.4 优势乳酸菌的形态、生理生化反应和种类鉴定
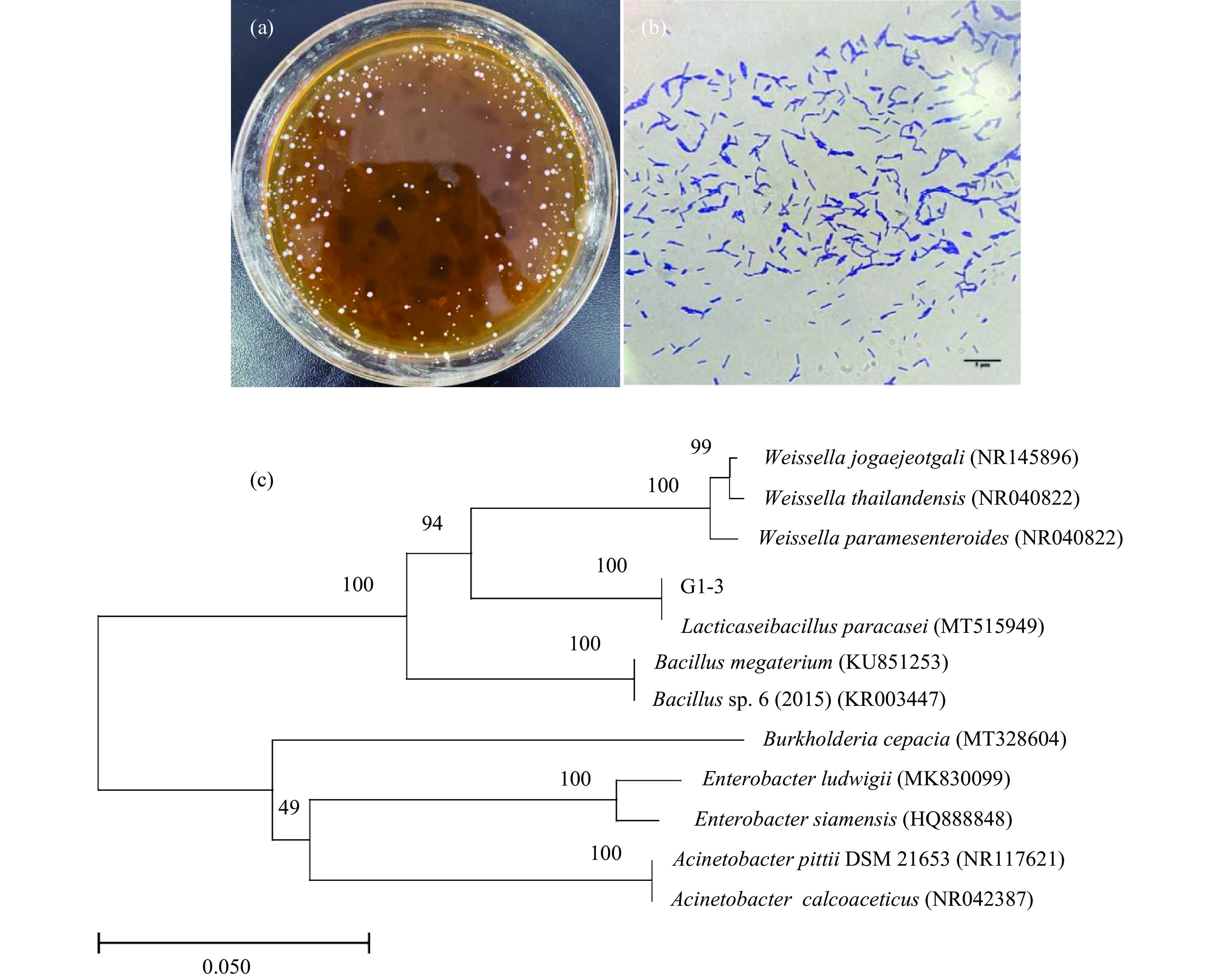
根据对乳酸菌菌株的产乳酸能力、低酸和胆盐耐受性筛选,本研究最终筛选出优势菌株G1-3进一步进行鉴定。菌株G1-3的菌落表面光滑有光泽,易挑起(图1-a),革兰氏染色为阳性,显微镜观测菌体G1-3呈长短不一的杆状,短链或长链排列(图1-b),符合乳杆菌的形态学特征,由表5生理生化特性可以看出,该菌不利用纤维二糖、棉子糖和木糖,明胶不液化,可以利用葡萄糖、甘露醇、麦芽糖和乳糖,水解淀粉,以上特征与文献[25]中描述的副干酪乳杆菌的特征极为相似。测序结果显示菌株G1-3的16S rDNA基因序列长度为1476 bp;在BLAST数据库进行相似性比对,并使用MEGAX构建系统发育树(图1-c)。结果显示,菌株G1-3与菌株副干酪乳杆菌(Lactobaci-llus paracasei)(Genbank登录号:MT515949)的相似性达100%。根据菌株的形态特征、生理生化以及其16S rDNA序列分析,初步鉴定该菌株G1-3为副干酪乳杆菌。
表 5 菌株G1-3的生理生化特征Table 5. Physiological and biochemical charactersitics of strain G1-3实验项目 结果 实验项目 结果 葡萄糖 + 接触酶实验 − 纤维二糖 − 明胶液化 − 甘露醇发酵 + 麦芽糖水解 + 乳糖 + 棉子糖 − 木糖 − 淀粉水解 + 注:“+”表示菌株阳性;“−”表示菌株阴性。 2.2 优势酵母菌的分离鉴定
2.2.1 优势酵母菌的分离
酵母菌可以产生释放香气成分的关键酶:β-葡萄糖苷酶,水解糖苷键,帮助释放原料中潜在的挥发性苷元[12],丰富白酸汤中的香气和风味物质。因此,为了提高白酸汤的风味品质,对白酸汤中具有β-葡萄糖苷酶活性的优势酵母菌进行了筛选,根据初筛获得的20株酵母菌周围不同黑褐色圈直径的大小,将酵母菌产β-葡萄糖苷酶特性分为不产(小于或等于菌落直径)、弱(15~22 mm)、中等(22~29 mm)、强(大于29 mm)4个等级,具体结果见表6。20株酵母菌中仅有G2-2菌株产β-葡萄糖苷酶活性的能力中等,另外9株较弱,10株不产。上述测试结果表明,G2-2菌株具有潜在的开发价值,因此选择其进行鉴定与后续的白酸汤发酵实验。
表 6 不同酵母菌产β-葡萄糖苷酶能力分析Table 6. Analysis of β-glucosidase production capacity of different yeasts菌株 糖苷酶
活性等级菌株 糖苷酶
活性等级菌株 糖苷酶
活性等级菌株 糖苷酶
活性等级G2-1 不产 H2-1 弱 I2-2 弱 K2-1 不产 G2-2 中等 H2-2 不产 I2-3 弱 K2-2 不产 G2-3 不产 H2-3 弱 J2-1 不产 K2-3 弱 G2-4 弱 H2-4 不产 J2-2 弱 L2-1 不产 G2-5 弱 I2-1 不产 J2-3 不产 M2-1 弱 2.2.2 优势酵母菌的形态和种类鉴定
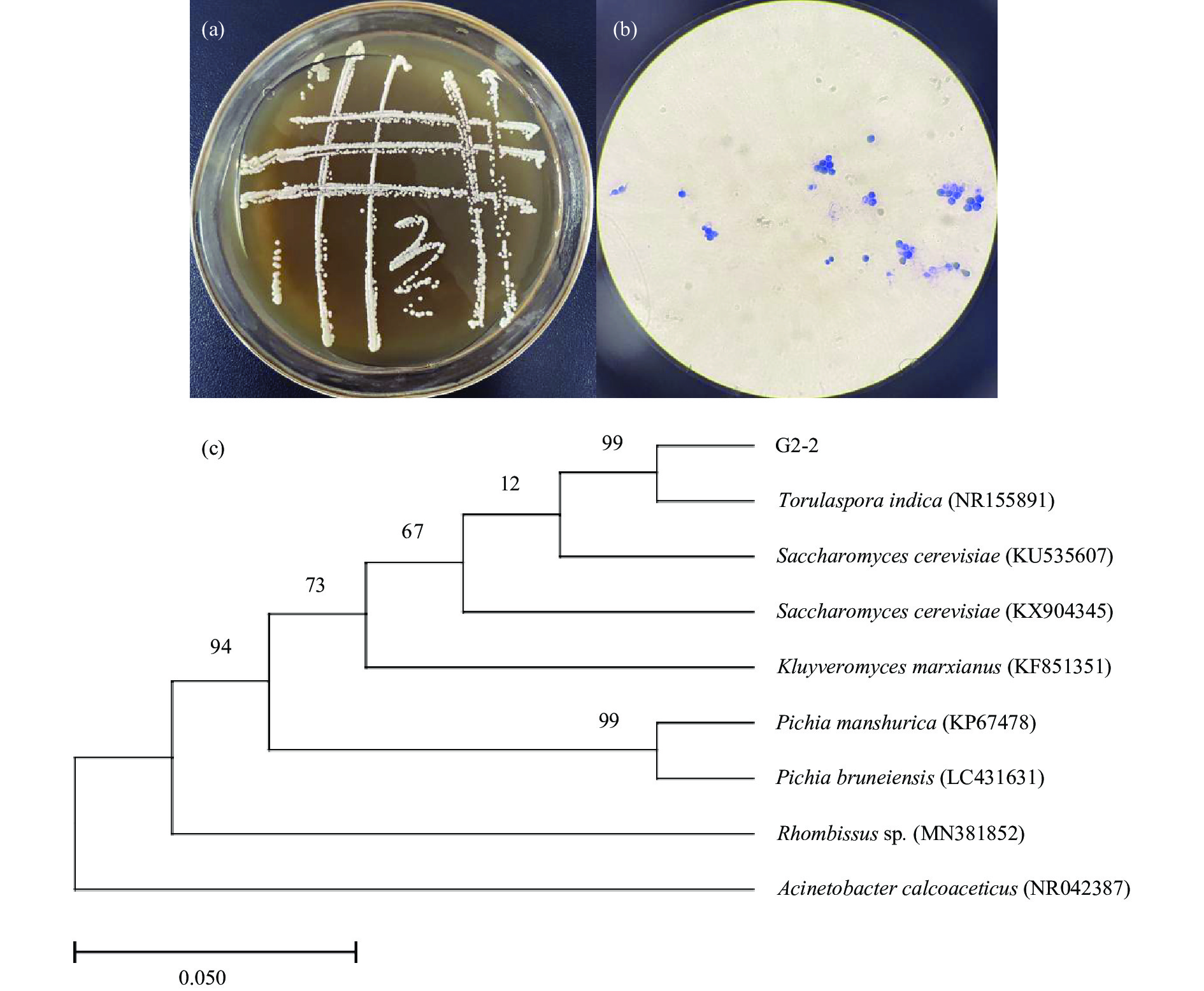
菌株G2-2的菌落在麦芽汁培养基上呈乳白色,光滑,边缘整齐有光泽,显微镜观测菌体G2-2呈卵形或球形,单个或成对排列(图2-b),说明其符合酵母菌的形态特征。结合ITS区基因序列分析,结果显示,菌株G2-2与菌株印迪卡有孢圆酵母菌(Torulaspora indica)(Genbank登录号:NR155891)的相似性达99%。根据菌株的形态特征以及ITS区基因序列分析,初步鉴定该菌株G2-2为印迪卡有孢圆酵母菌。Torulaspora indica为有孢圆酵母属,属于非酿酒酵母,这类酵母具有高产β-葡萄糖苷酶的能力,可以促进萜烯类和C13-降异戊二烯类糖苷的水解,从而增加发酵产品的花香、果香和坚果香[26]。
2.3 菌种组合发酵白酸汤品质变化
2.3.1 pH和总酸含量变化
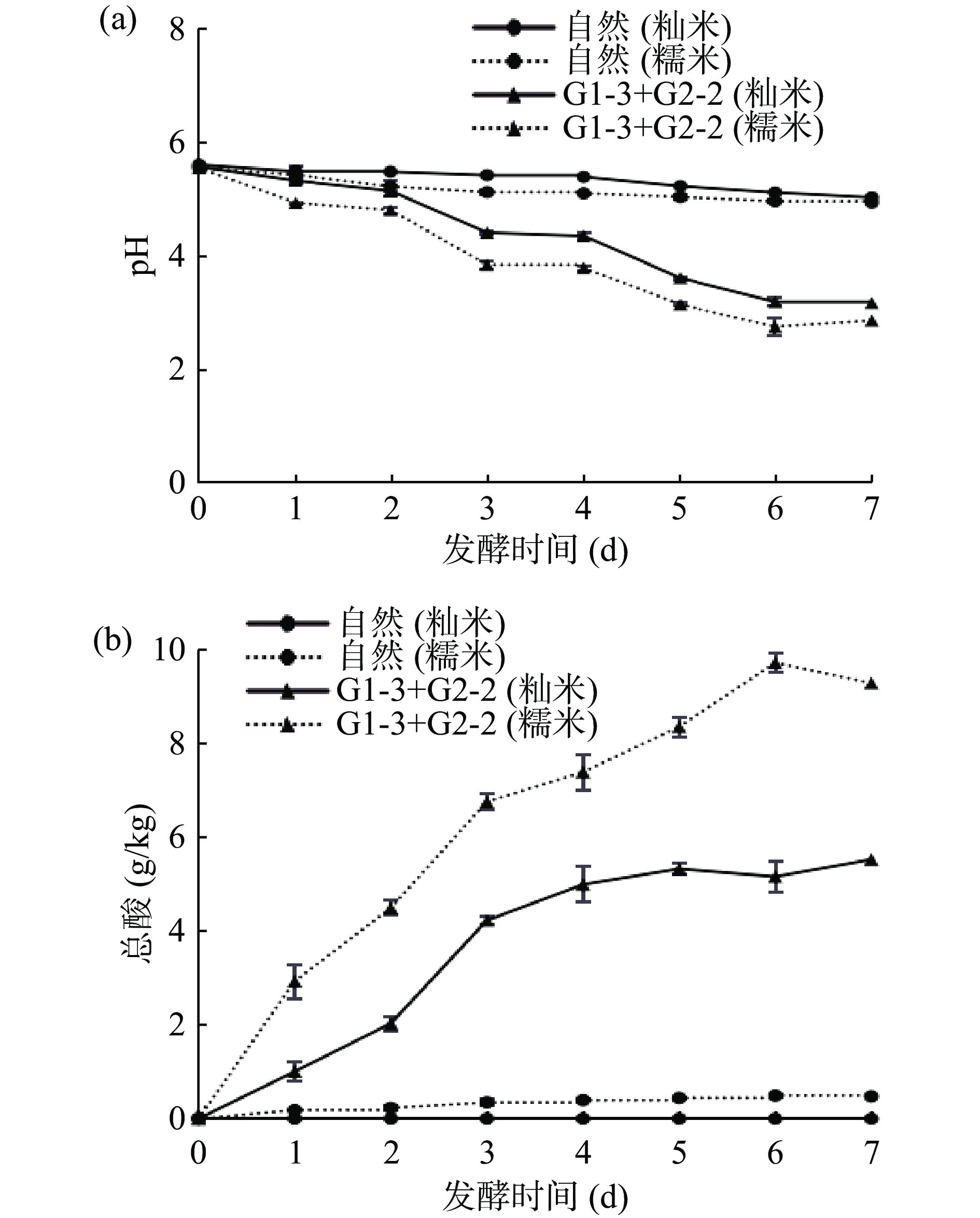
乳酸菌是白酸汤发酵过程中的优势功能微生物,其代谢产物乳酸是白酸汤中的主要呈味物质之一[27],以pH及总酸作为考核指标,可对白酸汤发酵程度的变化趋势进行综合分析。随着发酵时间的不断变化,白酸汤中的pH与总酸含量呈现出相反的变化趋势。白酸汤发酵过程中pH变化见图3-a。结果显示,在发酵过程中,传统自然发酵和外加复合菌种发酵的两种原料白酸汤中的pH均呈现下降的趋势,但直投式复合菌种发酵白酸汤的pH下降速度较快,而传统自然发酵白酸汤的pH下降速度相对较缓慢,添加优势菌种发酵在第6 d时基本结束,两种原料的自然发酵都处于发酵初期,说明外加复合菌种可以缩短白酸汤的发酵时间。
由图3-b可知,在白酸汤的发酵过程中,白酸汤中的总酸含量随着发酵的进行呈上升趋势。乳酸菌在白酸汤发酵过程中可以代谢产生乳酸、乙酸、苹果酸与丁二酸等有机酸[28],多菌系人工接种的白酸汤中总酸含量在前4 d 急剧增加,说明接种的2株菌株在发酵前期快速增长,从而导致发酵系统中积累大量的酸类物质,使得环境中的总酸含量升高。其中,接种发酵后(7 d)的糯米原料中总酸为9.73 g/kg,籼米原料中总酸含量为5.53 g/kg。发酵后期,白酸汤中的总酸含量有缓慢下降的趋势,这可能是因为在发酵过程中产生的如乙醇等其他代谢物质会与有机酸在酯化作用下形成酯香类物质[29-30],因此总酸量会相应减少。
2.3.2 白酸汤发酵过程中总糖和还原糖含量变化
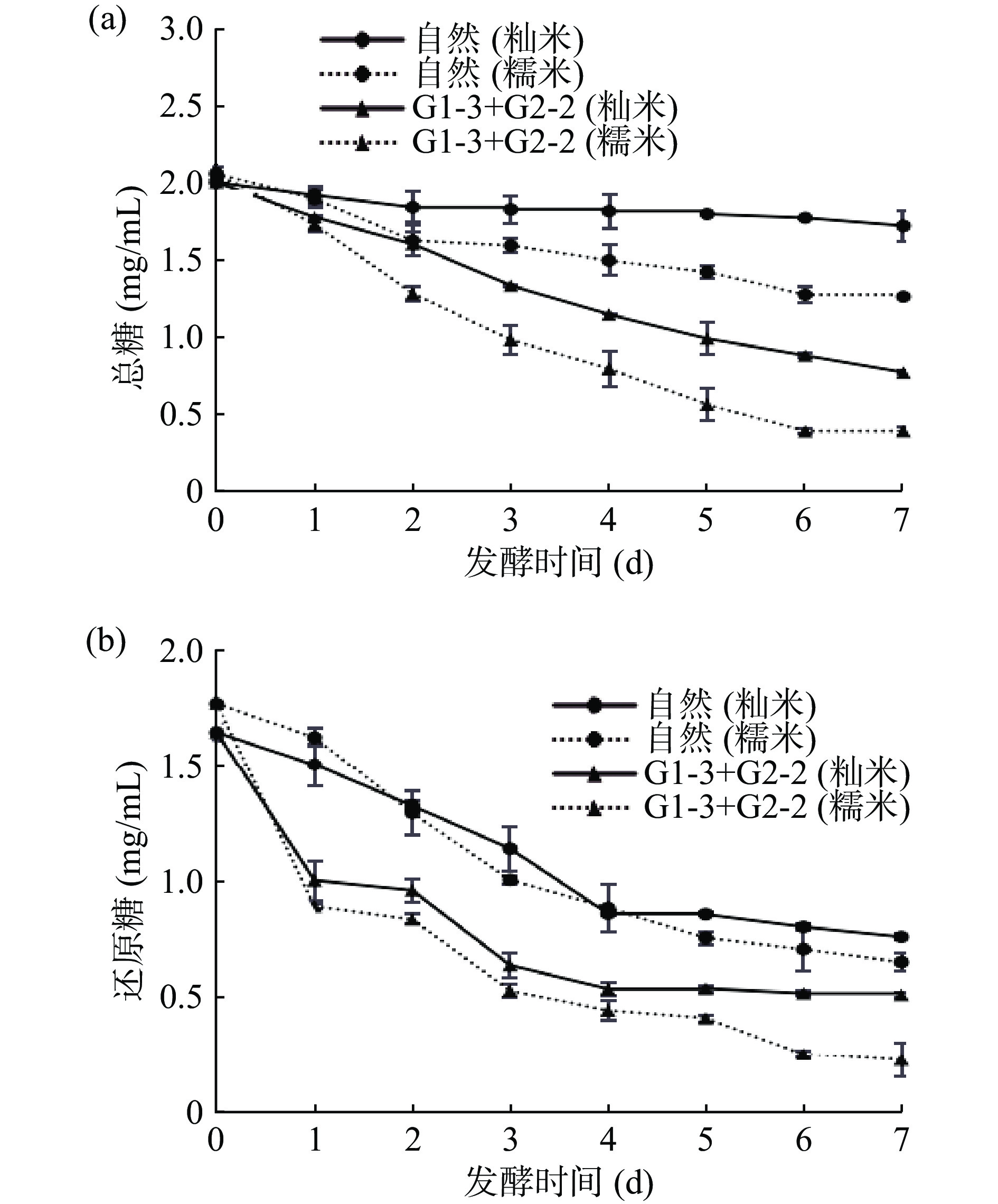
白酸汤发酵过程中总糖与还原糖含量变化见图4。结果显示,不管何种原料发酵的白酸汤中总糖与还原糖的含量均随着发酵时间的延长呈现递减趋势,说明糯米与籼米中的糖类物质都易被G1-3与G2-2菌株吸收利用。两株菌株复配后两种原料的降糖速度非常快,当发酵第6 d时,原料中的糖类物质基本就被其消耗完全了,说明此时其发酵体系已经成熟,而自然发酵的糖类物质还在不断降低。G1-3为副干酪乳杆菌,其主要发酵的糖类物质为葡萄糖,最终产L-乳酸[21],G2-2为印迪卡有孢圆酵母,其能够合成和释放β-葡萄糖苷酶,从而利用多种糖类物质,生成醇类与多种挥发性香气物质[31],两者协同发酵可以快速有效地降低白酸汤中的糖的含量。
2.3.3 感官品质评价
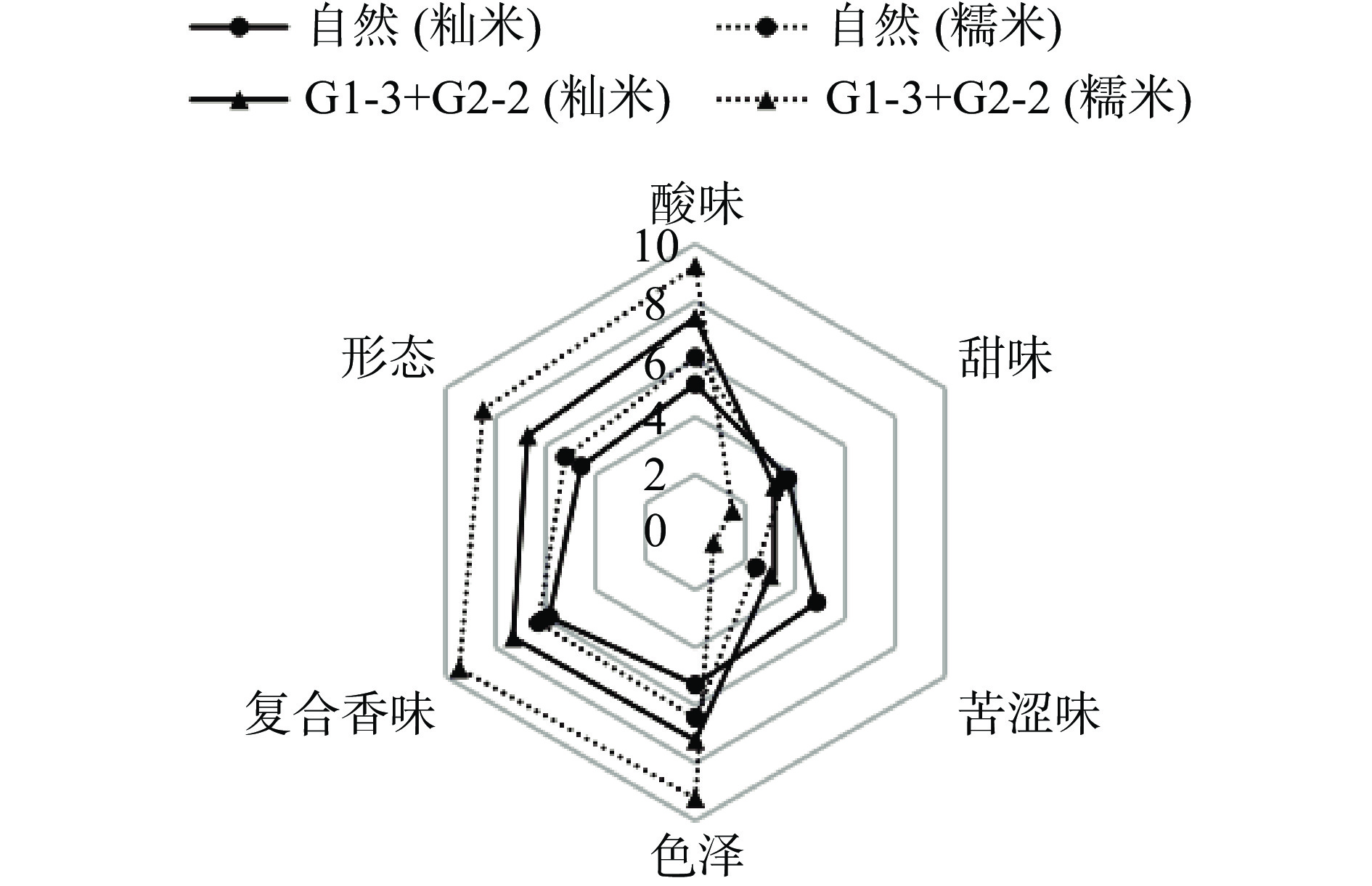
对发酵体系成熟后的样品(G1-3与G2-2联合发酵为第6 d的白酸汤样品,自然发酵为第15 d的样品)进行感官分析,评价其感官品质。图5表明,4组样品均基本无甜味,表明其发酵体系成熟,已经没有多余的淀粉转化为葡萄糖,其中最重要的味道是酸味。其中,G1-3与G2-2联合发酵后的糯米酸汤与籼米酸汤感官评分都较自然发酵高,总体表现在其复合香味、色泽与形态方面。G1-3与G2-2复配发酵后的酸汤整体香味馥郁,在保有较强乳酸味的同时,还具有淡淡的果香与米酒香味。乳酸菌以三羧酸循环中的苹果酸-乳酸发酵为主,主要作用是产乳酸,酵母菌则代谢产生乙醇和羧基化合物,醇与酸反应又会进一步转化为具有果香与甜香的酯类化合物[32],从而改变白酸汤的口感,提高其愉悦感,丰富产品的整体风味。
3. 结论
本文从贵州地区苗族的传统发酵白酸汤中筛选得到2株能够复配用于白酸汤发酵的菌株,经测序分析确定分别为副干酪乳杆菌和印迪卡有孢圆酵母。研究发现2株菌株复配后可以发酵糯米与籼米原料,而且可以降低酸汤发酵时间,提高酸汤的风味品质。双菌复合发酵剂与自然发酵的白酸汤相比,其总糖与还原糖含量降低得更多,其中籼米白酸汤分别降低了61.53%与81.02%;糯米白酸汤分别降低了68.86%与86.99%。此外,籼米与糯米白酸汤中的总酸含量分别提高了5倍与18倍。而且双菌复合发酵后的酸汤具有更优的感官品质。基于以上研究,副干酪乳杆菌和印迪卡有孢圆酵母作为复合发酵剂可用于白酸汤的生产。
由于本文研究主要以乳酸菌群与酵母菌群为主要研究对象,通过对比分析自然发酵来确定其发酵性能,所以对于乳酸菌和酵母菌群中哪种菌对发酵起主要作用还不是很清楚,因此接下来的工作就是探讨乳酸菌和酵母菌群中何种菌对白酸汤发酵起实质性的作用。
-
表 1 感官评分标准
Table 1 Standards of sensory evaluation
感官项目 好
(9~10分)较好
(7~8分)普通
(5~6分)较弱
(3~4分)非常弱
(0~2分)色泽 米白色,清亮,有光泽 米白色或淡黄色,略有光泽 白色或淡黄色 色泽偏暗 灰色,无光泽 酸味 浓郁的乳酸味 乳酸味明显 有乳酸味 乳酸味较淡 无乳酸味 甜味 无甜味 甜味较淡 有甜味 甜味明显 有强烈的甜味 复合香味 浓郁的醇酯香味 有醇酯味 略有醇酯味 醇酯味不明显 无醇酯味,有异味 苦涩味 酸爽适宜,回味浓,无苦涩味 酸爽适宜,有回味,无苦涩味 有酸爽感,稍带苦涩味 酸度、甜度偏高或偏低,
苦涩味明显酸甜比例失调,有强烈的
苦涩味形态 流动呈液态,质地均一 流动呈液态,略有悬浮物,
质地均一流动呈液态,略有
悬浮物流动性较差,有沉淀物和
悬浮物流动性差,粘度大 表 2 白酸汤发酵液中乳酸菌的分离结果
Table 2 Isolation results of lactic acid bacteria from rice sour soup fermentation liquid
采集地区 菌株编号 菌株数(株) 凯里 G1-1~G1-9 9 麻江 H1-1~H1-18 18 丹寨 I1-1~I1-24 24 黄平 J1-1~J1-37 37 雷山 K1-1~K1-6 6 镇远 L1-1~L1-14 14 从江 M1-1~M1-20 20 表 3 不同乳酸菌产酸能力分析
Table 3 Analysis of the acid-producing capacity of different lactic acid bacteria
菌株 溶钙圈(cm) pH 乳酸产量(g/kg) G1-1 1.33±0.19c 4.53±0.03f 9.66±0.22c G1-2 2.20±0.23a 4.19±0.03g 12.00±0.13b G1-3 1.85±0.03b 4.04±0.03h 17.19±0.04a G1-4 1.24±0.13c 4.86±0.02de 6.17±0.14d H1-4 0.79±0.03de 4.89±0.05cd 5.97±0.26de H1-6 0.19±0.02g 5.59±0.05a 2.98±0.20g J1-1 0.85±0.04de 4.80±0.03e 5.96±0.20de J1-2 0.51±0.05f 5.35±0.04b 4.63±0.11f M1-4 0.36±0.03fg 5.33±0.06b 4.69±0.11f M1-5 0.73±0.03e 4.93±0.02c 5.77±0.04e M1-17 0.96±0.03d 4.84±0.04de 6.10±0.10d 注:同列不同小写字母表示差异显著(P<0.05);表4同。 表 4 乳酸菌菌株对低酸和胆盐的耐受性能(%)
Table 4 Tolerance to low acid and bile salt of different strains of lactic acid bacteria (%)
菌株 pH3.0 pH2.0 0.3%牛胆盐 0.6%牛胆盐 G1-1 44.59±1.98c 27.27±1.30a 46.75±1.30ab 16.45±2.70b G1-2 52.27±1.14b 18.56±2.37cd 41.29±3.47b 14.44±1.97bc G1-3 71.14±3.07a 23.98±1.86ab 52.03±2.54a 24.39±1.21a G1-4 17.54±2.00g 8.33±1.31e 30.70±2.74c 2.63±1.31f H1-4 43.90±0.43c 4.87±0.12ef 28.46±3.92cd 0.85±0.32f H1-6 36.40±0.49de 9.21±0.47e 24.12±0.53de 8.77±0.33d J1-1 45.88±0.73bc 14.51±1.79d 20.00±2.35ef 7.63±0.70de J1-2 41.77±1.86cd 5.22±0.27ef 13.25±2.40g 7.05±1.17de M1-4 29.49±0.34ef 1.67±0.77f 20.09±0.53ef 5.62±0.70de M1-5 34.83±2.24de 14.23±1.71d 26.97±2.24cd 11.97±1.96c M1-17 27.27±0.52f 19.48±0.47bc 15.58±1.30fg 5.24±1.71e 表 5 菌株G1-3的生理生化特征
Table 5 Physiological and biochemical charactersitics of strain G1-3
实验项目 结果 实验项目 结果 葡萄糖 + 接触酶实验 − 纤维二糖 − 明胶液化 − 甘露醇发酵 + 麦芽糖水解 + 乳糖 + 棉子糖 − 木糖 − 淀粉水解 + 注:“+”表示菌株阳性;“−”表示菌株阴性。 表 6 不同酵母菌产β-葡萄糖苷酶能力分析
Table 6 Analysis of β-glucosidase production capacity of different yeasts
菌株 糖苷酶
活性等级菌株 糖苷酶
活性等级菌株 糖苷酶
活性等级菌株 糖苷酶
活性等级G2-1 不产 H2-1 弱 I2-2 弱 K2-1 不产 G2-2 中等 H2-2 不产 I2-3 弱 K2-2 不产 G2-3 不产 H2-3 弱 J2-1 不产 K2-3 弱 G2-4 弱 H2-4 不产 J2-2 弱 L2-1 不产 G2-5 弱 I2-1 不产 J2-3 不产 M2-1 弱 -
[1] LIU N, PAN J, MIAO S, et al. Microbial community in Chinese traditional fermented acid rice soup (rice-acid) and its correlations with key organic acids and volatile compounds[J]. Food Research International,2020,137(5):109672.
[2] 张东亚. 红酸汤发酵工艺优化及品质控制研究[D]. 贵阳: 贵州大学, 2018. ZHANG D Y. Research on the optimization of fermentation process and quality control of the red sour soup[D]. Guiyang: Guizhou University, 2018.
[3] 袁玮. 贵州省苗族腌酸汤中产乳酸菌素菌的筛选与初步研究[D]. 武汉: 华中农业大学, 2010. YUAN W. The acid soup of Miao nationality in Guizhou Province bacteriocin of lab produced strain screening and preliminary study[D]. Wuhan: Huazhong Agricultural University, 2010.
[4] 王琪琪, 田界先, 潘宗东, 等. 基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J]. 食品与发酵工业,2020,46(14):40−47. [WANG Q Q, TIAN J X, PAN Z D, et al. Analysis of dominant microflora associated with the wnique flavor of Guizhou Kaili sour soup using Illumina MiSeq sequencing[J]. Food and Fermentation Industries,2020,46(14):40−47. [5] 万宁威, 雷帮星, 李彪, 等. 白酸汤发酵过程中微生物多样性及有机酸动态变化研究[J]. 食品与发酵工业,2022,48(9):65−70. [WAN N W, LEI B X, LI B, et al. Microbial diversity and dynamic changes of organic acids during the fermentation of white sour soup[J]. Food and Fermentation Industries,2022,48(9):65−70. doi: 10.13995/j.cnki.11-1802/ts.028592 [6] SHEN Y, SUN H, ZENG H, et al. Increases in phenolic, fatty acid, and phytosterol contents and anticancer activities of sweet potato after fermentation by Lactobacillus acidophilus[J]. Journal of Agricultural & Food Chemistry,2018,66(11):2735−2741.
[7] 谷海瀛. 形态学检查方法的标准化及其在细菌鉴定中的作用[J]. 中华检验医学杂志,2006(10):951−953. [GU H Y. Standardization of morphological examination methods and their role in bacterial identification[J]. Chinese Journal of Laboratory Medicine,2006(10):951−953. doi: 10.3760/j:issn:1009-9158.2006.10.031 [8] AYODEJI B D, PICCIRILLO C, FERRARO V, et al. Screening and molecular identification of lactic acid bacteria from gari and fufu and gari effluents[J]. Annals of Microbiology,2017,67(1):1−11. doi: 10.1007/s13213-016-1231-5
[9] 白友菊. 传统发酵型泡菜中乳酸菌的分离筛选及直投式发酵剂的制备[D]. 武汉: 华中农业大学, 2016. BAI Y J. Seperation and wcrccbing of lactic acid bacteria from traditional fermented paocai and preparation of directed vat set[D]. Wuhan: Huazhong Agricultural University, 2016.
[10] LIONG M T, SHAH N P. Acid and bile tolerance and cholesterol removal ability of lactobacilli strains[J]. Journal of Dairy Science,2005,88(1):55−66. doi: 10.3168/jds.S0022-0302(05)72662-X
[11] RAMOS C L, THORSEN L, SCHWAN R F, et al. Strain-specific probiotics properties of Lactobacillus fermentum, Lactobacillus plantarum and Lactobacillus brevis isolates from Brazilian food products[J]. Food Microbiology,2013,36(1):22−29. doi: 10.1016/j.fm.2013.03.010
[12] 薛菊兰, 程玉来, 张佰清, 等. 慕萨莱思酿酒酵母产果胶酶及β-葡萄糖苷酶定性分析[J]. 食品科学,2013,34(19):166−169. [XUE J L, CHENG Y L, ZHANG B Q, et al. Qualitative analysis of pectinase and β-glucosidase secreted by Saccharomyces cerevisiae strains isolated from musalais[J]. Food Science,2013,34(19):166−169. doi: 10.7506/spkx1002-6630-201319035 [13] 赵林果, 孟鹏, 李丽娟, 等. 利用七叶灵显色技术检验和判断β-葡萄糖苷酶的研究[J]. 食品与发酵工业,2008,34(12):163−166. [ZHAO L G, MENG P, LI L J, et al. Study on the detection and judgment of β-glucosidase by using esculin chromogenic technology[J]. Food and Fermentation Industries,2008,34(12):163−166. [14] DOMINGOS-LOPES M F P, STANTON C, ROSS P R, et al. Genetic diversity, safety and technological characterization of lactic acid bacteria isolated from artisanal pico cheese[J]. Food Microbiology,2017,63:178−190. doi: 10.1016/j.fm.2016.11.014
[15] OSBURN K, AMARAL J, METCALF S R, et al. Primary souring: A novel bacteria-free method for sour beer production[J]. Food Microbiology,2018,70:76−84. doi: 10.1016/j.fm.2017.09.007
[16] JIANG Y, QI X, GAO K, et al. Relationship between molecular weight, monosaccharide composition and immunobiologic activity of Astragalus polysaccharides[J]. Glycoconjugate Journal,2016,33(5):1−7.
[17] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[18] 肖欣欣. 海带乳酸发酵制品的研制及贮藏期间菌相变化的研究[D]. 福州: 福建农林大学, 2012. XIAO X X. Develop product of kelp by lactic acid fermentation and study on changes of microbial flora during storage[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012.
[19] 陈树俊, 吴梦月. 基于模糊数学感官评价法对红枣核桃粹配方的优化[J]. 食品研究与开发,2019,40(21):144−151. [CHEN S J, WU M Y. Optimization of jujube walnut crisp formula based on fuzzy mathematical sensory evaluation method[J]. Food Research and Development,2019,40(21):144−151. [20] 高盛, 乔宇, 张宇微, 等. 人母乳源乳酸菌的筛选, 鉴定及益生活性的初步研究[J]. 食品工业科技,2017,38(10):205−210. [GAO S, QIAO Y, ZHANG Y W, et al. Isolation, identification and probiotic characterization of lactic acid bacteria in human breast milk[J]. Science and Technology of Food Industry,2017,38(10):205−210. [21] LIU N, MIAO S, QIN L. Screening and application of lactic acid bacteria and yeasts with l-lactic acid-producing and antioxidant capacity in traditional fermented rice acid[J]. Food Science & Nutrition,2020,8(11):6095−6111.
[22] HWANHLEM N, BURADALENG S, WATTANACHANT S, et al. Isolation and screening of lactic acid bacteria from Thai traditional fermented fish (Plasom) and production of Plasom from selected strains[J]. Food Control,2011,22(3-4):401−407. doi: 10.1016/j.foodcont.2010.09.010
[23] GUO Z, WANG J, YAN L, et al. In vitro comparison of probiotic properties of Lactobacillus casei Zhang, a potential new probiotic, with selected probiotic strains[J]. LWT-Food Sci Technol,2009,42(10):1640−1646. doi: 10.1016/j.lwt.2009.05.025
[24] POURRAJAB B, FATAHI S, DEHNAD A, et al. The impact of probiotic yogurt consumption on lipid profiles in subjects with mild to moderate hypercholesterolemia: A systematic review and meta-analysis of randomized controlled trials[J]. Nutr Metab Cardiovas,2020,30(1):11−22. doi: 10.1016/j.numecd.2019.10.001
[25] 巨晓英, 寇晓虹. 副干酪乳杆菌的功能及其在食品工业中的应用研究进展[J]. 中国乳品工业,2009(8):48−50. [JU X Y, KOU X H. Research progress on the function of Lactobacillus paracasei and its application in food industry[J]. China Dairy Industry,2009(8):48−50. doi: 10.3969/j.issn.1001-2230.2009.08.012 [26] FERNANDES T, FLÁVIA SILVA-SOUSA, FÁBIO P, et al. Biotechnological importance of Torulaspora delbrueckii: From the obscurity to the spotlight[J]. Journal of Fungi,2021,7(9):712. doi: 10.3390/jof7090712
[27] WEI J P, ZHANG Y Z, QIU Y, et al. Chemical composition, sensorial properties, and aroma-active compounds of ciders fermented with Hanseniaspora osmophila and Torulaspora quercuum in co-and sequential fermentations[J]. Food Chemistry,2020,306:125623. doi: 10.1016/j.foodchem.2019.125623
[28] 熊瑛, 寻思颖, 孙棣, 等. 高效液相色谱法测定酸汤中的有机酸[J]. 中国调味品,2012,37(7):71−73. [XIONG Y, XUN S Y, SUN D, et al. Determination of organic acids in sour soup by high performance liquid chromatography[J]. Chinese Condiments,2012,37(7):71−73. doi: 10.3969/j.issn.1000-9973.2012.07.020 [29] LEE J W, TRINH C T. Microbial biosynthesis of lactate esters[J]. Biotechnol Biofuels,2019,12:226. doi: 10.1186/s13068-019-1563-z
[30] LAYTON D S, TRINH C T. Expanding the modular ester fermentative pathways for combinatorial biosynthesis of esters from volatile organic acids[J]. Biotechnology & Bioengineering,2016,113(8):1764−1776.
[31] SALUJA P, YELCHURI R K, SOHAL S K, et al. Torulaspora indica a novel yeast species isolated from coal mine soils[J]. Antonie van Leeuwenhoek,2012,101(4):685−700. doi: 10.1007/s10482-012-9698-y
[32] ROMANENS E, FREIMÜLLER L S, VOLLAND A, et al. Screening of lactic acid bacteria and yeast strains to select adapted anti-fungal co-cultures for cocoa bean fermentation[J]. International Journal of Food Microbiology,2018,290:262−272.







 下载:
下载:
 下载:
下载:
