Effects of Antioxidant Yeast ALDH Extract on Lipid Oxidation during Simulated Digestion of Fish
-
摘要: 鱼肉脂质在消化过程中可能发生明显氧化,产生有害醛类。本文以脂肪过氧化值(peroxidation value,POV)、硫代巴比妥酸反应物值(thiobarbituric acid reactant value,TBARS)、醛类化合物和多不饱和脂肪酸含量作为评价指标研究了一株抗氧化酵母醛脱氢酶(aldehyde dehydrogenase,ALDH)提取物对鱼肉模拟消化过程中脂肪氧化的影响。结果表明,在模拟胃肠道消化过程中,空白鱼肉(CK)在模拟消化5 h后POV从(0.12±0.06)meq/kg增加到(1.14±0.12)meq/kg,加入ALDH提取物的鱼肉(FE)模拟消化5 h后POV为(0.69±0.08)meq/kg,而加入包埋ALDH的鱼肉(EB)POV为(0.13±0.06)meq/kg;CK组TBARS值从(0.77±0.11)mg/kg增加到(2.31±0.13)mg/kg,而FE、EB组的TBARS值分别为(0.79±0.09)mg/kg和(0.19±0.09)mg/kg;模拟消化物中含量较多的醛包括壬醛、己醛、2-庚醛、壬二烯醛、2-己烯醛等;CK组的醛含量在消化过程中迅速增加,FE、EB组醛含量逐渐减少,消化结束时己醛、壬醛、2-庚醛含量已低于检测限。CK组鱼肉中EPA、DHA在消化过程中氧化损失分别为59%和58%,FE组的损失值分别为35%和32%,EB组的损失值分别为20%和26%。本研究证明了抗氧化酵母ALDH提取物可以很好地抑制鱼肉在模拟消化过程中的脂肪氧化并有效消减因脂肪氧化产生的有害物质。酵母酶提取物可能是控制脂质氧化致餐后氧化应激的新型有效活性制剂。
-
关键词:
- 鱼肉脂质氧化 /
- 酵母醛脱氢酶提取物 /
- 活泼羰基化合物(RCCs) /
- 气相色谱-质谱法(GC-MS) /
- 鱼肉模拟消化
Abstract: The lipid of fish may undergo obvious oxidation and produce harmful aldehydes during digestion. In this paper, the effects of aldehyde dehydrogenase (ALDH) extract of an antioxidant yeast on fat oxidation during simulated digestion of fish were studied by taking fat peroxidation value (POV), thiobarbituric acid reactant value (TBARS), aldehyde compounds and polyunsaturated fatty acids as evaluation indexes. The results showed that in the process of simulating gastrointestinal digestion, the POV of control fish (CK) increased from (0.12±0.06) meq/kg to (1.14±0.12) meq/kg during simulated digestion. The POV of fish (free enzyme, FE) added with ALDH extract was (0.69±0.08) meq/kg after simulated digestion for 5 hours, while the POV of fish meat (embedded enzyme, EB) embedded with ALDH was (0.13±0.06) meq/kg. The TBARS value of CK group increased from (0.77±0.11) mg/kg to (2.31±0.13) mg/kg, while the TBARS values of FE and EB groups were (0.79±0.09) mg/kg and (0.19±0.09) mg/kg, respectively. Aldehydes with high content in digestive products include nonanal, hexanal, 2-heptanal, nonadienal, 2-hexenal, etc. The aldehyde content of CK group increased rapidly and significantly during digestion, while that of FE and EB group decreased gradually. At the end of digestion, the contents of hexanal, nonanal and 2-heptanal were lower than the detection limit. The oxidative losses of EPA and DHA in fish meat in CK group were 59% and 58%, 35% and 32% in FE Group and 20% and 26% in EB group. This study proves that antioxidant yeast enzyme extract can well inhibit the fat oxidation of fish during simulated digestion and effectively reduce the harmful substances produced by fat oxidation. Yeast enzyme extract may be a new active agent to control postprandial oxidative stress caused by lipid oxidation. -
在消化过程中,脂类物质可能会因为人体胃液、肠液中促进脂质氧化因子(例如抗坏血酸、铁离子等)的存在而持续地发生氧化反应,导致机体餐后“氧化应激”。食物在消化阶段发生脂质氧化及其控制已成为一个热门研究课题[1-3]。脂质氧化水解和酸败产生的有害物质主要包括过氧化物、活泼羰基化合物(Reactive carbonyl compounds, RCCs)等。RCCs主要指α,β-不饱和醛、酮醛、二元醛,如丙烯醛(Acrolein, ACR)、2-己烯醛、2,4-己二烯醛、4-羟基-己烯醛(4-hydroxy Hexenal, HHE)、4-羟基-壬烯醛(Hydroxynonenal, HNE)、4-氧代-2-壬烯醛(4-oxo-2-nonenal, ONE)和丙二醛(Malondialdehyde, MDA)等[4]。过氧化物及RCCs会直接破坏生物体的细胞及大分子如蛋白质、DNA,参与心血管疾病、糖尿病、肿瘤、阿尔兹海默症等多种常见疾病的发生、发展及导致机体衰老[5-6]。消减食品中RCCs的方法主要有化学清除剂法[7]、化学生物肽法[8]与生物酶法[9]。但化学清除剂的安全性不足,生物肽效率较低。
醛脱氢酶(aldehyde dehydrogenase, ALDH),是一种胞内酶,可以催化醛类有机化合物的脱氢反应,从而消减因脂质氧化产生的一些有害物质。醛脱氢酶催化氧化脱氢是消减醛类化合物新方法,具有效率高,生物安全性高的优点[10]。如Yoval-Sánchez等[11]发现ALDH不但可以消减乙醛,还可以消减4-羟基壬烯醛(HNE)、丙二醛(MDA)、3,4-二羟基苯乙醛(DOPAL)和丙烯醛等;Konkit等[12]发现高ALDH活性乳酸菌(L. Chungangensis CAU28T)发酵生产的奶酪,具有较高的ALDH活性,并可消减模型小鼠血清中的乙醛,从而减轻酒精伤害。本研究组前期研究发现抗氧化酵母可有效消减冷藏鱼肉中的RCCs[13-14]。但目前利用ALDH消减胃肠道中其它醛类物质,特别是RCCs的研究还未见报道。
草鱼是我国食用量最大的鱼类,富有丰富的不饱和脂肪酸,且在消化过程中易发生脂质氧化。因此选取草鱼作为体外消化对象。一般而言,酶类在胃肠道的低pH环境中容易失活,因此需要做酶固定化处理[15]来提高酶的稳定性。本实验室前期工作[16]中筛选出了一株具有较高的抗脂质氧化活性的异常威克汉姆J9菌株。J9菌株ALDH活性较高,对醛类物质清除能力强。为避免ALDH在胃液低pH的环境下失活,提高酶的稳定性,对J9酵母ALDH进行了包埋处理,然后研究其对鱼肉模拟消化过程中脂肪氧化及醛类物质累积的影响。为开发新型健康制剂控制餐后脂质氧化应激提供依据与参考。
1. 材料与方法
1.1 材料与仪器
草鱼肉 超市购买鲜活草鱼,快速宰杀清洗,取无刺白肉,立即于−20 ℃保存,使用前4 ℃解冻12 h;J9酵母菌株:异常威克汉姆酵母(Wickerhamomyces anomalus) 保存于中南林业科技大学食品科学与工程实验室[16];三氯甲烷 AR,成都市科龙化工试剂厂;胃蛋白酶(≥1200 U/g)、磷酸二氢钾、胰蛋白酶(500 U/mg)、碘化钾、抗坏血酸、无水硫酸钠、氯化钙 AR,上海国药集团化学试剂有限公司;冰乙酸 AR,湖南汇鸿试剂有限公司;硫代硫酸钠、淀粉 AR,上海如吉生物科技有限公司;海藻酸钠 AR,青岛晶岩生物科技开发有限公司;对氟苯甲醛、甲醇、五氟苯肼、十七碳酸、正己烷 GR,Sigma。
BKQ-B50II全自动立式压力蒸汽灭菌锅 山东博科有限公司;SW-CT超净工作台 济南鑫贝西生物技术有限公司;722S可见分光光度计 上海仪电分析仪器有限公司;JY92-HN超声波细胞破碎仪 宁波新芝有限公司;DNM-9602酶标仪 北京普朗新技术有限公司;GCMS-QP2010 Plus GC-MS 岛津(中国)有限公司。
1.2 实验方法
1.2.1 ALDH粗酶液制备
参考衣海龙[17]的超声波破碎提取方法,对酵母菌进行ALDH粗酶提取。取培养好的酵母悬浊菌液100 mL,4 ℃下以10000×g的转速冷冻离心15 min,倒去上清液,并用30 mL 0.05 mol/L pH8.0的磷酸钾缓冲溶液洗涤酵母菌细胞泥 1 次,然后在 4 ℃ 下 10000×g 离心 10 min 收集得到酵母泥。将湿酵母按质量比1:30重悬浮于0.05 mol/L PBS(pH8.0)缓冲液中,于冰水浴中超声波破碎:称取 1 g 湿酵母,加入 pH8.0、0.05 mol/L 磷酸盐缓冲液 30 mL,放入合适的塑料管中;超声功率 300 W,超声时间 7 s、间歇 5 s,全程时间 15 min;再于 10000×g 冷冻 4 ℃ 离心 15 min,取上清液为ALDH粗酶液。
1.2.2 ALDH粗酶提取物包埋处理
参照李超敏等[18]的方法。将10 mL 3.0%浓度的海藻酸钠溶液充分加热溶解,待冷却后与5 mL的粗酶液混合均匀,用一次性的注射器将海藻酸钠与酶液混合液以均匀的速度滴入3.0%的氯化钙溶液中,通过海藻酸钠与钙离子形成大小均一的光滑颗粒,固化1 h后过滤取出,用蒸馏水洗涤表面的离子,在0~4 ℃条件下静置硬化2 h直至形成比较坚固的凝胶颗粒。
1.2.3 样品处理
取草鱼背部无刺白肉,磨碎,以98 ℃纯水煮12 min后进行体外模拟消化实验。取10 mL制备保存的ALDH粗酶液与10 g鱼肉混合记为游离酶组;经过海藻酸钠和氯化钙复合包埋的ALDH微胶囊(含10 mL粗酶液)与鱼肉样品10 g混合记为包埋酶组,鱼肉样品与蒸馏水混合记为空白对照组,分别进行体外模拟消化实验。
1.2.4 ALDH活性测定
参考Okibe等[19]的方法,配制3 mL酶活反应体系,取酶活性测定体系和待测酶液分别于25 ℃恒温水浴箱中水浴5 min后将待测酶液迅速加入酶活测定体系中混匀。立即放入波长为 340 nm 分光光度计中,在连续 5 min 每隔 l min读取吸光度值。酶活力单位定义为:每分钟转化1 μmol的底物所需酶量为一个酶活力单位(U)。
式中:D:稀释倍数;ΔA1:样品吸光度值变化量;ΔA2:空白对照吸光度值变化量;vt:反应总体积,mL;e:摩尔吸光度值(6.22×10−3mol/(L·cm−2));vs:酶液体积,mL;d:比色皿光径,1 cm;c:蛋白质浓度,mg/mL。
粗蛋白含量检测:参考万茵等[20]准备空白对照(缓冲液)和待测蛋白溶液,调节仪器波长为280 nm。用空白对照调节吸光度A280为零。通常用1 cm光径的标准石英比色皿,读取待测蛋白溶液的A280,调节仪器波长为260 nm,用空白对照调节吸光度A260为零,读取待测蛋白溶液的A260。
1.2.5 体外模拟消化实验
根据《中国药典》配制模拟胃液、模拟肠液。
取250 mL三角瓶分别加入游离酶组、包埋组与空白组样品20 g,30 mL模拟胃液置于37 ℃、150 r/min的恒温摇床模拟胃消化3 h,每隔1 h取样。取经胃消化3 h的各样品分别加入30 mL模拟肠液,置于37 ℃、150 r/min的恒温摇床模拟肠消化2 h,每隔1 h取样。
1.2.6 过氧化值(POV)测定
按照食品安全国家标准 食品中过氧化值的测定 GB/T 5009.227-2016第一法滴定法。
1.2.7 硫代巴比妥酸反应物(TBARS)测定
参考Fu等[21]的方法并稍作修改:称取样品3 g,添加27 mL三氯乙酸(15%,w/w)-硫代巴比妥酸(0.1%,w/w),60 ℃加热反应1 h,5000 r/min离心5 min,取上清液在532 nm测吸光值。以丙二醛(MDA)为标准品绘制标准曲线,结果表示为mg/kg鱼肉。
1.2.8 挥发性醛类化合物测定
采用原位衍生化结合SPME-GC-MS法测定挥发性醛类物质。
样品预处理[22]:准确吸取2 mL体外模拟消化液置于顶空瓶中,加入2 µL内标对氟苯甲醛溶液(浓度为1.0724 mg/L)和50 µL的衍生化试剂五氟苯肼溶液,2 g NaCl、0.2 mL VC溶液2 %(现用现配),旋紧瓶盖,待分析。
原位衍生化-顶空固相微萃取条件[22]:萃取衍生化温度为65 ℃,时间为30 min。
气相色谱(GC)条件:不分流进样;色谱柱使用的是RTX-5ms(30 m×0.25 mm×0.25 μm)毛细管柱;升温程序为:50 ℃保持2 min,以6 ℃/min升至100 ℃,保持0.1 min,以2 ℃/min升至160 ℃,保持0.1 min,以5 ℃/min升至230 ℃,保持15 min。
质谱(MS)条件:离子源温度230 ℃,SCAN模式扫描范围为35~380 amu。
1.2.9 脂肪酸含量测定
脂肪酸的提取与甲酯化:取体外模拟消化液1 mL与内标十七碳酸10 µL(用正己烷配制成0.1 mg/mL)和2 mL正己烷,充分混匀,离心,取上清液1 mL,加1 mL KOH-MeOH(0.5 mol/L),振荡,40 ℃水浴30 min,加水至10 mL,振荡离心。取少量上层清液加少量无水Na2SO4(已烘干),密封,4 ℃静置2 h脱水,进行GC-MS分析[23]。
GC条件:色谱柱使用的是RTX-5ms(30 m×0.25 mm×0.25 μm)毛细管柱;进样口温度250 ℃,载气为高纯氦,柱流速0.81 mL/min,柱前压73.0 kPa;升温程序为:柱起始温度150 ℃,保持3.5 min;以20 ℃/min升至200 ℃,再以5 ℃/min升至280 ℃,保持25 min。分流进样1 μL,分流比50:1。
MS条件:离子源温度200 ℃,接口温度250 ℃,溶剂延迟3.5 min。
1.3 数据处理
SPME-GC-MS检测到的挥发性RCCs按照匹配度>70%筛选,采用内标法进行定量分析;运用WPS、Origin 2018软件对实验数据进行处理作图,运用SPSS软件进行显著差异分析(Duncan),显著差异水平取P<0.05,每组实验重复3次,结果以平均值±标准误差表示。
2. 结果与分析
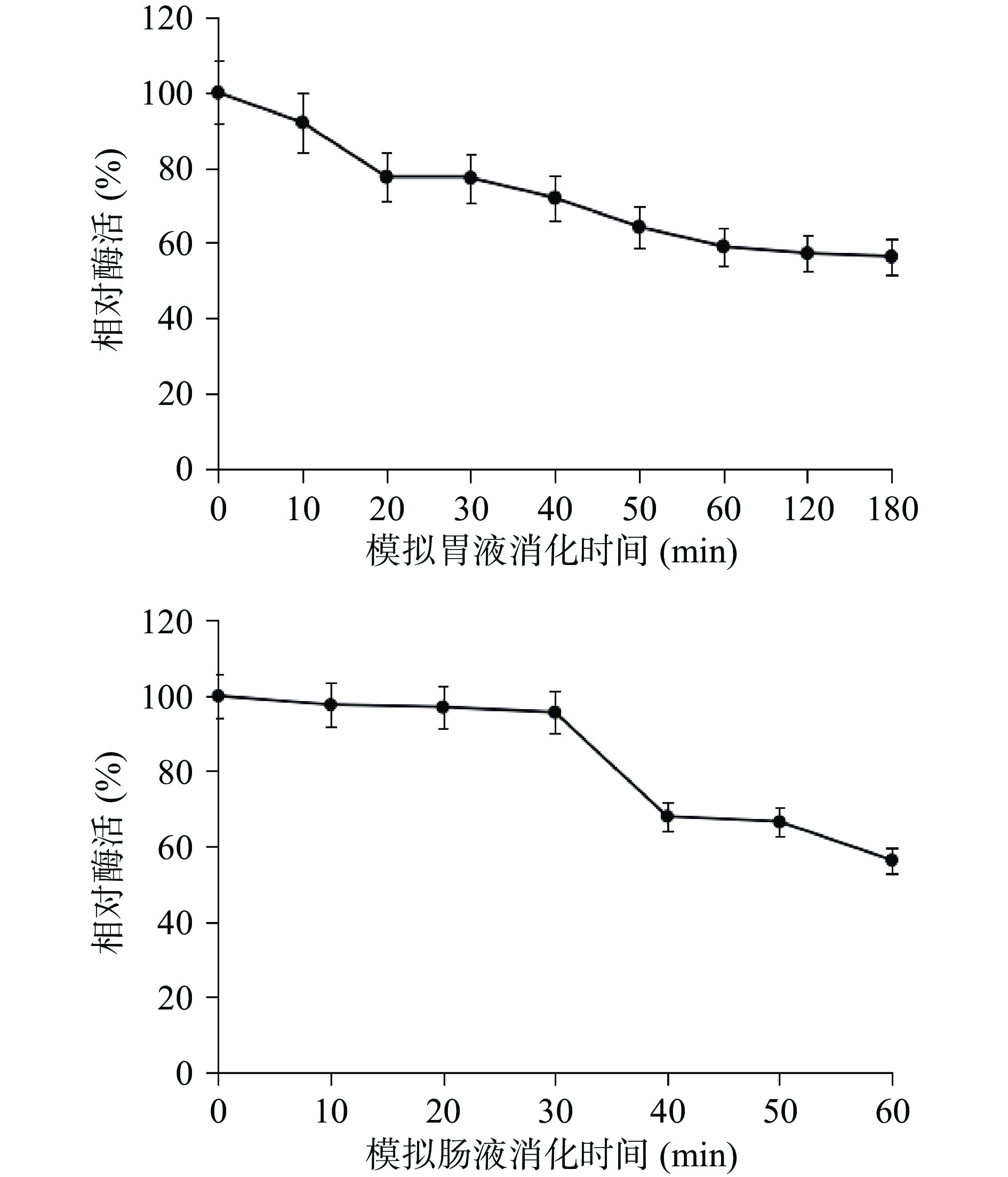
2.1 包埋对ALDH在模拟消化液中稳定性的影响
未进行包埋的游离酶,在胃液消化10 min就已经几乎检测不出酶活(比活力<50 U/mg),说明该酶在胃液环境中极不稳定。而利用海藻酸钠与氯化钙进行包埋后的酶在模拟胃液消化环境下表现出较好的稳定性(图1),在胃液消化3 h后,酶活仍然保留有56.39%。在模拟肠液消化环境下,包埋酶在前30 min表现出良好的稳定性,相对酶活保持在90%以上。然后,酶活下降速度加快,在消化60 min后降至60%以下。而在40 min后酶活变化速度缓慢,故本文仅研究了60 min包埋酶在肠消化中的酶活变化。这与万茵等[20]的研究结果相似,可能是因为微胶囊的结构受到了破坏导致内部包埋的酶渗出,但是酶活仍然保留有56.35%,说明海藻酸钠与氯化钙的包埋起到了较好的保护效果,有效增加了醛脱氢酶在胃肠道环境下的稳定性。
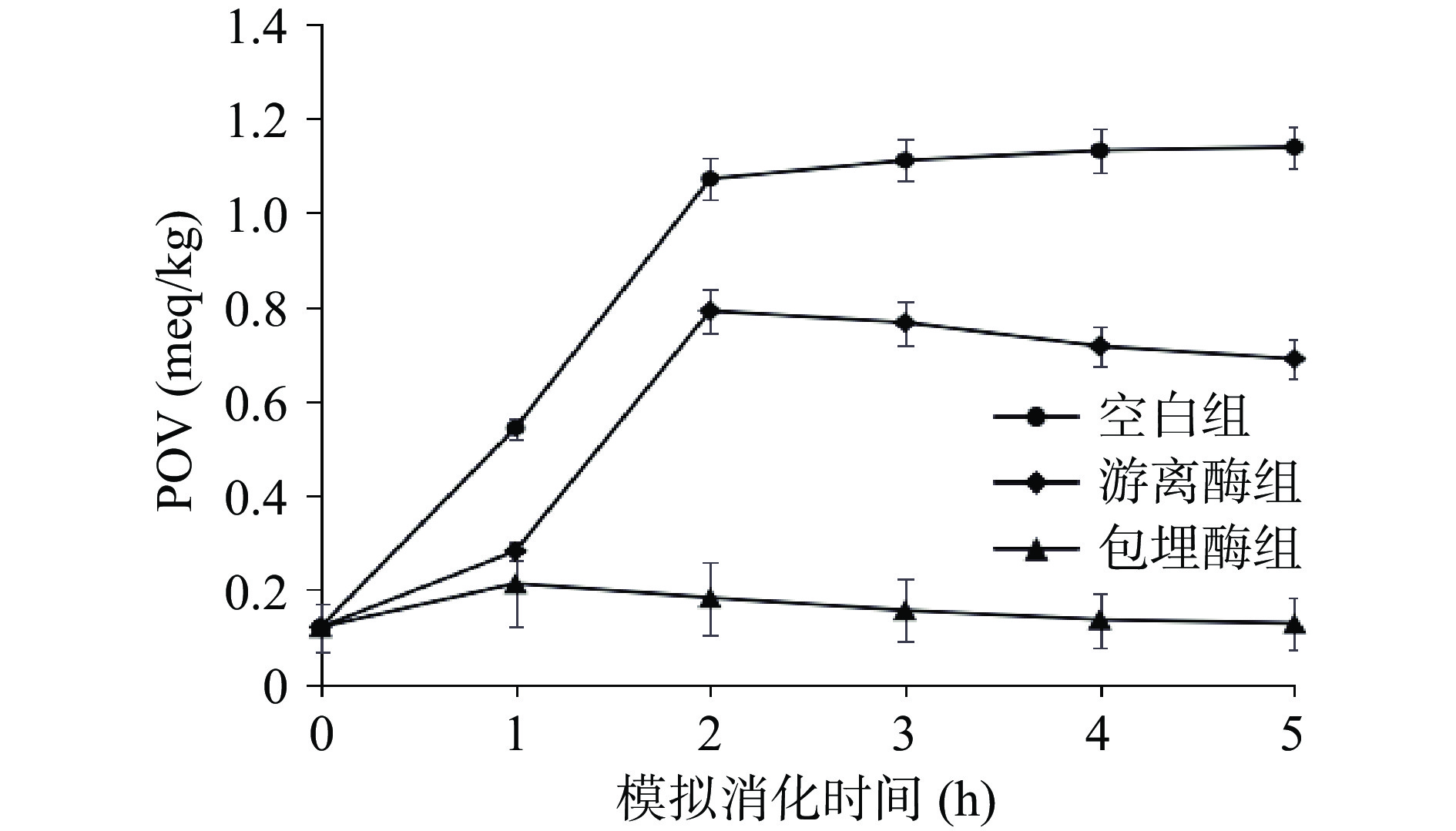
2.2 体外模拟消化过程中POV值的变化
POV值反映过氧化物的含量。如图2所示,空白对照的鱼肉样品POV值在消化过程中,从0.12 meq/kg增加到1.14 meq/kg,随着在模拟胃肠过程中的不断消化,过氧化值也呈不断增大的趋势,尤其是在模拟胃消化的前2 h变化迅速。在进入模拟肠道消化后,POV值增加缓慢。游离酶组的POV值依然呈现先上升后下降的趋势,相对于对照组POV值明显降低,在胃中消化2 h增加到0.79 meq/kg,后面缓慢下降至0.69 meq/kg。包埋酶组POV值从0.12 meq/kg到0.13 meq/kg变化波动不大。游离酶和包埋酶在整个消化过程中均明显抑制脂肪氧化反应。包埋处理极大提升了抗氧化酵母ALDH粗酶提取物在胃肠道中的稳定性。刘朝霞等[24]研究发现资木瓜乙醇提取物可以使猪油的POV值降低且比VC(0.8 mg/mL)的效果更好,通过体外模拟消化检测出在24 h的模拟消化后猪油的空白组POV值为2.5 meq/kg,而实验组POV值可以降到1.00 meq/kg。而本研究在5 h的模拟消化后鱼肉的空白组POV值为1.14 meq/kg,包埋酶组POV值可以降到0.13 meq/kg。可能因为酵母提取物中还原性物质[25]或过氧化物酶在起作用,从而抑制POV值的升高。
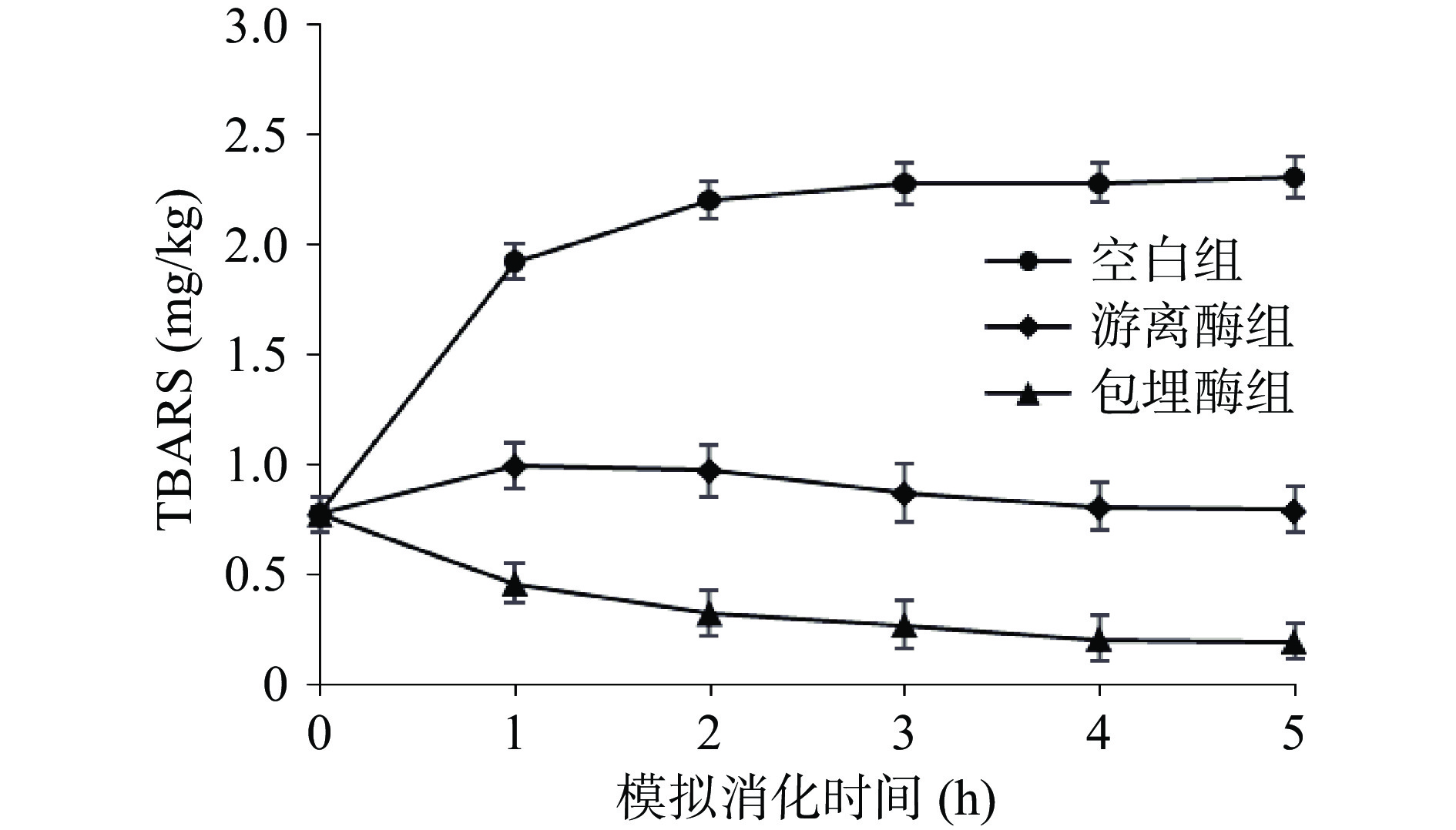
2.3 体外模拟消化过程中TBARS值的变化
氢过氧化物裂解是脂肪氧化的第三阶段,一般用TBARS值反映裂解产物醛、酮、烯醛等物质的含量。如图3所示,空白对照的鱼肉样品TBARS值在消化过程中呈不断增大的趋势,从0 h的0.77 mg/kg增加到消化5 h后的2.31 mg/kg。加入游离酶和包埋酶的实验组消化5 h后TBARS值分别为0.79 mg/kg和0.19 mg/kg。本项目组前期研究发现,酵母可消减冷藏鱼肉的TBARS值。本研究首次报道酵母ALDH酶提取物可消减模拟消化鱼肉中的TBARS值,特别是包埋酶可消减模拟消化鱼肉中75%的TBARS值。酵母ALDH提取物产生了大量的抗氧化物质,抑制了鱼肉的脂肪氧化;包埋酶组TBARS逐步降低,表明ALDH逐渐消减了一部分的醛、烯醛类等脂质氧化产物。Zhang等[26]研究发现通过从黑莓渣、红甘蓝和麦麸中分离的富含结合多酚的不溶性膳食纤维对乙二醛、甲基乙二醛、丙烯醛和丙二醛等活泼羰基化合物均有较高的清除作用,其中对丙二醛的清除率为16.7%~45.7%。比较而言,本文酵母ALDH酶提取物的清除率更高。
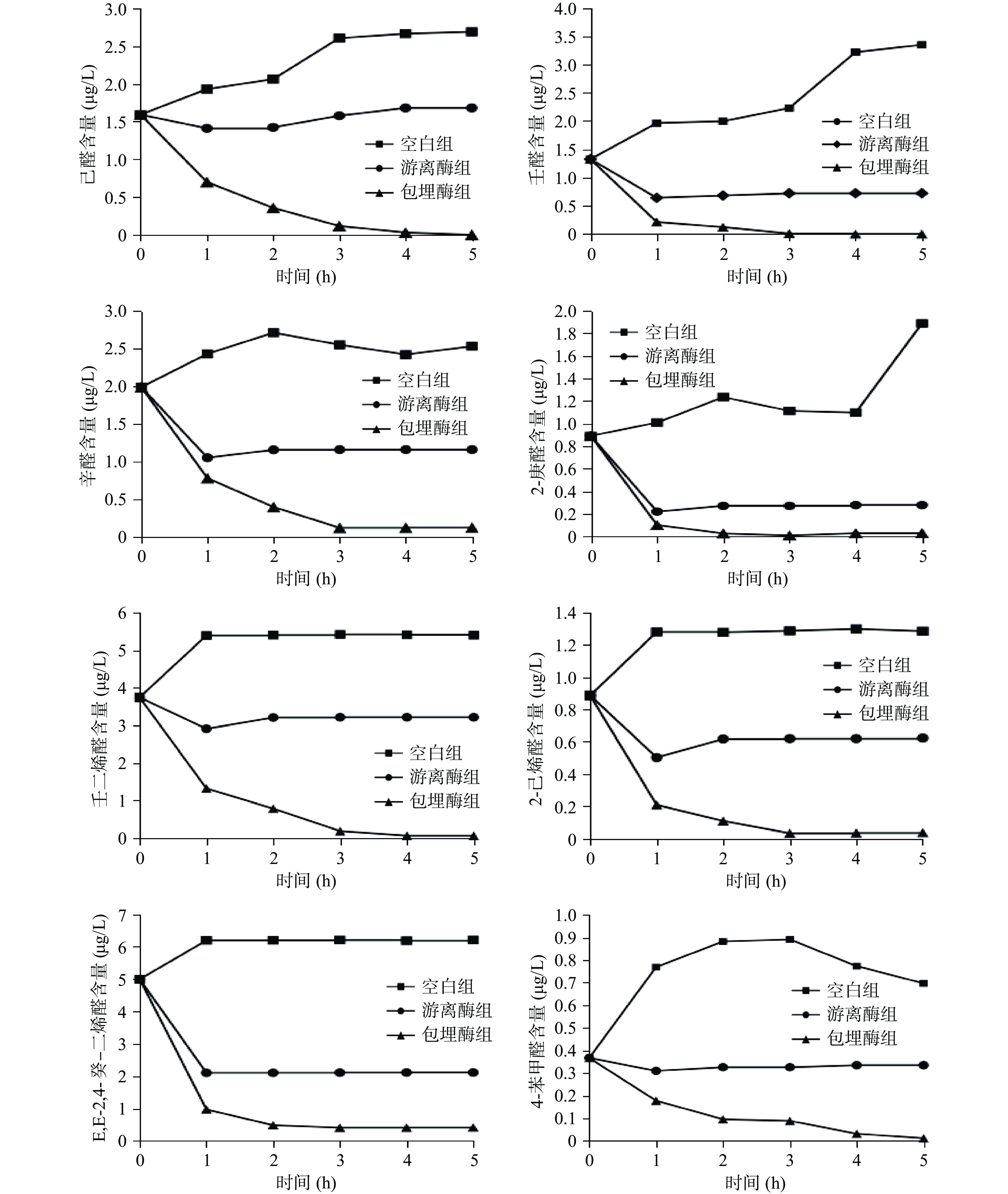
2.4 体外模拟消化过程中醛类物质变化
取体外模拟后的消化液,采用原位衍生化SPME-GC-MS进行RCCs测定,鉴定出48种化合物,主要为醛、酸、醇、酯类化合物。含量较多的己醛、壬醛、辛醛、E,E-2,4-癸-二烯醛、2-庚醛、2-己烯醛、壬二烯醛和4-苯甲醛含量变化如图4所示。从图4可以看出空白鱼肉组的醛类物质含量随着消化时间的增长迅速增加。加入抗氧化酵母ALDH提取物的游离酶组和包埋酶组在模拟消化过程中,醛含量逐渐减少,而游离酶组的醛含量可能会在胃阶段消化一段时间后出现增高,是由于游离酶易在胃液的低pH环境下失活。包埋酶组的醛含量逐渐降低说明海藻酸钠和氯化钙的固定化对酶起到了较好的保护作用,增加了其在体内环境中的稳定性,使得酵母ALDH逐渐发挥作用,与游离酶组相比,清除醛类效果更好,消化结束时有的醛类(如己醛、壬醛、2-庚醛)已经几乎检测不到,与TBARS的结果一致(图3)。
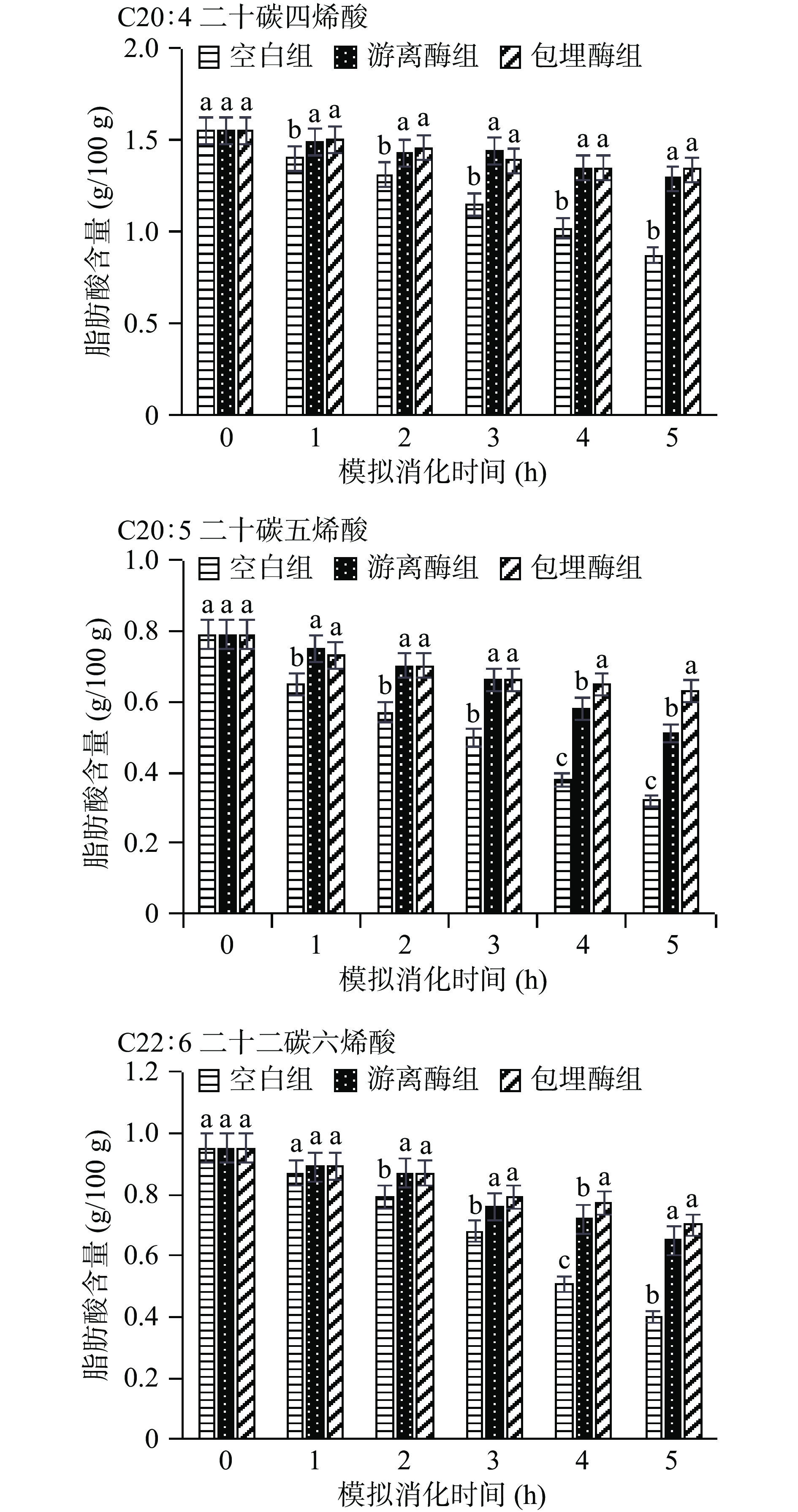
2.5 体外模拟消化过程中PUFA变化结果分析
草鱼肉含有丰富的PUFA,是其营养价值的重要指标,但PUFA极易氧化[27]。通过分别提取以上实验中空白鱼肉组、加入抗氧化酵母ALDH提取物的游离酶组和包埋酶组的消化液中的脂肪,甲酯化后进行GC-MS分析,共测定到17种脂肪酸;其中饱和脂肪酸(SFA)7种,单不饱和脂肪酸(MUFA)3种,多不饱和脂肪酸(PUFA)7种。从图5中可以看出,鱼肉经过模拟消化过程,PUFA含量均有所降低。消化过程中,空白组、游离酶组、包埋酶组的二十碳四烯酸(C20:4)分别从1.55 g/100 g减少到0.87、1.29、1.34 g/100 g;二十碳五烯酸(C20:5)从0.79 g/100 g减少到0.32、0.51、0.63 g/100 g;二十二碳六烯酸(C22:6)从0.95 g/100 g减少到0.40、0.65、0.70 g/100 g。鱼肉空白组的二十碳四烯酸、EPA和DHA含量均比初始新鲜样品中相对应的含量低,消化过程中呈逐渐降低的趋势。经过胃肠道消化后EPA和DHA的氧化损失分别为59%和58%,加入了酵母ALDH后缓解了脂肪酸的氧化损失,游离酶组的损失值分别为35%和32%,包埋酶组的为20%和26%。本研究中三组样品总PUFA在模拟消化过程中的含量变化结果表明:空白组的PUFA从新鲜鱼肉的24.86 g/100 g消化5 h后变为19.81 g/100 g,始终呈逐渐下降趋势,表明PUFA在消化过程中不断氧化损失,而加入了酵母ALDH的实验组很好地保护了PUFA的损失且使鱼肉始终具有较高的PUFA含量。其中包埋酶实验组的含量相比更高一点,消化5 h后达到29.71 g/100 g。可见抗氧化酵母ALDH提取物显著减少了PUFA的氧化降解。
3. 结论
J9酵母ALDH酶提取物在鱼肉模拟体外消化的过程中,能够明显抑制脂质氧化反应和脂肪氧化产物累积,降低POV和TBARS值,并可消减部分醛类物质,且可以通过包埋提高酵母ALDH酶提取物的稳定性;鱼肉不饱和脂肪酸在消化过程中非常容易氧化从而造成脂肪酸损失,而酵母ALDH酶提取物能够缓解PUFA的氧化降解,保留鱼肉中的PUFA。酵母ALDH酶提取物可能是控制脂质氧化致餐后氧化应激的新型有效活性制剂。
-
-
[1] 刘秀妨, 刘胜男, 马云芳, 等. 胃肠道消化过程中脂质氧化的影响因素、健康危害及控制研究进展[J]. 食品工业科技,2017,38(21):330−335. [ZHANG X F, LIU S N, MA Y F, et al. Research progress on the influencing factors, health hazards, and control of lipid oxidation during gastrointestinal digestion[J]. Science and Technology of Food Industry,2017,38(21):330−335. doi: 10.13386/j.issn1002-0306.2017.21.064 [2] NIEVA-ECHEVARRÍA B, GOICOECHEA E, GUILLÉN M D. Food lipid oxidation under gastrointestinal digestion conditions: A review[J]. Critical Reviews in Food Science and Nutrition,2020,60(3):461−478. doi: 10.1080/10408398.2018.1538931
[3] DOMÍNGUEZ R, PATEIRO M, GAGAOUA M, et al. A comprehensive review on lipid oxidation in meat and meat products[J]. Antioxidants,2019,8(10):429. doi: 10.3390/antiox8100429
[4] POLI D, GOLDONI M, CORRADI M, et al. Determination of aldehydes in exhaled breath of patients with lung cancer by means of on-fiber-derivatisation SPME-GC/MS[J]. J Chromatogr B,2010,878(27):2643−2651. doi: 10.1016/j.jchromb.2010.01.022
[5] 吴宝森, 孙玥晖, 刘姝韵. 肉和肉制品中脂质氧化的研究进展[J]. 食品安全质量检测学报,2017(3):94−98. [WU B S, SUN Y H, LIU S Y. Research progress on lipid oxidation in meat and meat products[J]. Journal of Food Safety & Quality,2017(3):94−98. doi: 10.19812/j.cnki.jfsq11-5956/ts.2017.03.016 [6] CHEN L, FU Y J, FANG W L, et al. Screening of a highly effective fluorescent derivatization reagent for carbonyl compounds and its application in HPLC with fluorescence detection[J]. Talanta,2018,186:221−228. doi: 10.1016/j.talanta.2018.04.017
[7] GORELIK S, LIGUMSKY M, KOHEN R, et al. A novel function of red wine polyphenols in humans: Prevention of absorption of cytotoxic lipid peroxidation products[J]. FASEB Journal,2008,22(1):41−46. doi: 10.1096/fj.07-9041com
[8] ZHAO J, CHEN J, ZHU H, et al. Mass spectrometric evidence of malonaldehyde and 4-hydroxynonenal adductions to radical-scavenging soy peptides[J]. J Agric Food Chem,2012,60(38):9727−9736. doi: 10.1021/jf3026277
[9] LU J, LYU Y, LI M, et al. Alleviating acute alcoholic liver injury in mice with Bacillus subtilis co-expressing alcohol dehydrogenase and acetaldehyde dehydrogenase[J]. Journal of Functional Foods,2018,49:342−350.
[10] AHMED LASKAR A, YOUNUS H. Aldehyde toxicity and metabolism: The role of aldehyde dehydrogenases in detoxification, drug resistance and carcinogenesis[J]. Drug Metabolism Reviews,2019,51(1):42−64. doi: 10.1080/03602532.2018.1555587
[11] YOVAL-SÁNCHEZ B, RODRÍGUEZ-ZAVALA J S. Differences in susceptibility to inactivation of human aldehyde dehydrogenases by lipid peroxidation byproducts[J]. Chemical Research in Toxicology,2012,25(3):722−729. doi: 10.1021/tx2005184
[12] KONKIT M, CHOI W J, KIM W. Aldehyde dehydrogenase activity in Lactococcus chungangensis: Application in cream cheese to reduce aldehyde in alcohol metabolism[J]. Journal of Dairy Science,2016,99(3):1755−1761. doi: 10.3168/jds.2015-10549
[13] XU L, GUO W, LIU W, et al. Metabolites analysis for cold-resistant yeast (Wickerhamomyces anomalus) strains own antioxidant activity on cold stored fish mince[J]. Food Chemistry,2020,303:125368. doi: 10.1016/j.foodchem.2019.125368
[14] XU L, LUO Y, FU X, et al. Effect of Saccharomyces uvarum on lipid oxidation and carbonyl compounds in silver carp mince during cold storage[J]. Food Science & Nutrition,2019,7(7):2404−2411.
[15] 柯彩霞, 范艳利, 苏枫, 等. 酶的固定化技术最新研究进展[J]. 生物工程学报,2018,34(2):188−203. [KE C X, FAN Y L, SU F, et al. Recent advances in enzyme immobilization[J]. Chinese Journal of Biotechnology,2018,34(2):188−203. doi: 10.13345/j.cjb.170164 [16] 郭薇丹, 刘薇丛, 胡作民, 等. 抗鱼肉脂肪氧化的耐冷冻酵母筛选及鉴定[J]. 食品科学,2019,40(10):166−170. [GUO W D, LIU W C, HU Z M, et al. Screening for and identification of freeze-tolerant yeasts with antioxidant activity in fish[J]. Food Science,2019,40(10):166−170. doi: 10.7506/spkx1002-6630-20180610-145 [17] 衣海龙. 利用超声波法破碎啤酒酵母细胞壁的工艺研究[J]. 酿酒,2015,42(4):83−85. [YI H L. Study on the technology of breaking the cell wall of beer yeast by ultrasonic wave[J]. Liquor Making,2015,42(4):83−85. doi: 10.3969/j.issn.1002-8110.2015.04.023 [18] 李超敏, 韩梅, 张良, 等. 细胞固定化技术—海藻酸钠包埋法的研究进展[J]. 安徽农业科学,2006(7):1281−1282, 1284. [LI C M, HAN M, ZHANG L, et al. Development of the sodium-aliginate immobilized cell technology[J]. Anhui Agricultural Sciences,2006(7):1281−1282, 1284. doi: 10.3969/j.issn.0517-6611.2006.07.003 [19] OKIBE N, AMADA K, HIRANO S, et al. Gene cloning and characterization of aldehyde dehydrogenase from a petroleum-degrading bacterium, strain HD-1[J]. Journal of Bioscience and Bioengineering,1999,88(1):7−11. doi: 10.1016/S1389-1723(99)80167-4
[20] 万茵, 罗成, 张鸿婷, 等. 海藻酸钠微胶囊对乳酸菌产乙醛脱氢酶在体外胃肠消化环境中保护作用[J]. 食品与发酵工业,2018,44(9):61−65. [WAN Y, LUO C, ZHANG H T, et al. Protection of Lactobacillus ALDH activity by sodium alginate microcapsule during gastrointestinal digestion in vitro[J]. Food and Fermentation Industries,2018,44(9):61−65. doi: 10.13995/j.cnki.11-1802/ts.015646 [21] FU X, LIN Q, XU S, et al. Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J]. LWT - Food Science and Technology,2015,61(1):251−257. doi: 10.1016/j.lwt.2014.10.035
[22] 曹长江, 范文来, 聂尧, 等. HS-SPME同时萃取衍生化定量白酒中反-2-烯醛和二烯醛类化合物[J]. 食品工业科技,2014,35(21):286−290. [CAO C J, FAN W L, NIE Y, et al. Quantification of trans-2-alkenals and alkadienals in Chinese liquors by simultaneous extraction/derivatization by HS-SPME coupled with GC-MS-SIM[J]. Science and Technology of Food Industry,2014,35(21):286−290. doi: 10.13386/j.issn1002-0306.2014.21.053 [23] 陈希苗, 李美英, 许秋莉, 等. 体外模拟胃肠消化中山楂多酚及抗氧化活性的变化[J]. 食品科学,2019,40(5):31−37. [CHEN X M, LI M Y, XU Q L, et al. Changes in polyphenol contents and antioxidant activity in hawthorn (Crataegus pinnatifida Bunge) during simulated gastrointestinal digestion[J]. Food Science,2019,40(5):31−37. doi: 10.7506/spkx1002-6630-20170930-447 [24] 刘朝霞, 胡士德, 邹坤, 等. 资木瓜乙醇提取物的体外抗氧化活性研究[J]. 三峡大学学报(自然科学版),2008(4):72−75. [LIU C X, HU S D, ZOU K, et al. Studies of antioxidation in vitro of ethanol extract from Chaenomeles speciosa (Sweet) Nakai[J]. Journal of China Three Gorges University (Natural Sciences),2008(4):72−75. [25] ALARCÓN M, PÉREZ-COELLO M S, DÍAZ-MAROTO M C, et al. Inactive dry yeast to improve the oxidative stability of Spanish dry-fermented sausage “salchichón”[J]. LWT,2021,146:111385. doi: 10.1016/j.lwt.2021.111385
[26] ZHANG H, TROISE A D, QI Y, et al. Insoluble dietary fibre scavenges reactive carbonyl species under simulated physiological conditions: The key role of fibre-bound polyphenols[J]. Food Chemistry,2021,349:129018. doi: 10.1016/j.foodchem.2021.129018
[27] 张帆, 孙家娟, 简舒婷, 等. 气相色谱/质谱法检测草鱼肌肉脂肪酸组成[J]. 河南化工,2017,34(3):3. [ZHANG F, SUN J J, JIAN S T, et al. Determination of muscle fatty acid composition of grass carp by gas chromatography/mass spectrometry[J]. Henan Chemical,2017,34(3):3. doi: 10.14173/j.cnki.hnhg.2017.03.015








 下载:
下载:
 下载:
下载:
