Construction of Heterotrophic Axenic System of Chlorella sorokiniana Based on Antibiotic Sensitivity
-
摘要: 为构建索罗金小球藻(Chlorella sorokiniana FZU60)的异养无菌体系,对其共生菌进行分离和鉴定,并考察了8种常见抗生素(头孢噻肟、卡那霉素、新霉素、氨苄青霉素、链霉素、四环素、氯霉素和红霉素)对共生菌和藻株FZU60生长的影响。结果表明:异养体系中主要的共生菌为芽孢杆菌(Bacillus)(78.76%)和甲基杆菌(Methylobacterium)(3.14%),且10 mg/L头孢噻肟、10 mg/L四环素、100 mg/L卡那霉素和100 mg/L红霉素对这两株共生菌均具有较好抑制效果,但对藻株FZU60的生长无明显影响。在此基础上,进一步考察了不同抗生素组合对藻株FZU60异养共生菌的抑制效果,发现采用10 mg/L头孢噻肟、10 mg/L四环素和100 mg/L卡那霉素的抗生素组合可成功构建异养无菌体系,且经3次传代培养后藻株FZU60仍可维持稳定的生长及无菌状态。本实验结果可为索罗金小球藻高密度异养中无菌藻种的制备提供一定的理论参考和实验依据。Abstract: To construct a heterotrophic axenic system of Chlorella sorokiniana FZU60, the symbiotic bacteria were isolated and identified, and the effects of eight common antibiotics (cefotaxime, kanamycin, neomycin, ampicillin, streptomycin, tetracycline, chloramphenicol, and erythromycin) on the cell growth of symbiotic bacteria and C. sorokiniana FZU60 were investigated. Results showed that the main symbiotic bacteria were Bacillus (78.76%) and Methylobacterium (3.14%). Besides, 10 mg/L cefotaxime, 10 mg/L tetracycline, 100 mg/L kanamycin, and 100 mg/L erythromycin showed excellent inhibitory effect on these two symbiotic bacteria but no obvious effect on the cell growth of C. sorokiniana FZU60. Based on the above-mentioned results, the inhibition effect of different antibiotic combinations on symbiotic bacteria of C. sorokiniana FZU60 was further investigated. It was found that the heterotrophic axenic system could be successfully constructed by using the combination of 10 mg/L cefotaxime, 10 mg/L tetracycline, and 100 mg/L kanamycin. Moreover, C. sorokiniana FZU60 could maintain stable and axenic growth after three generations. The experimental results would provide theoretical reference and experimental basis for the preparation of axenic microalgal seed for high-cell-density heterotrophic cultivation of C. sorokiniana.
-
Keywords:
- Chlorella sorokiniana /
- heterotrophic cultivation /
- antibiotic /
- axenic cultivation
-
索罗金小球藻(Chlorella sorokiniana)是一种单细胞绿藻,具有生长速度快、能适应宽广的环境和培养条件等特点[1-3]。Xu等[2]以氯化铵为氮源,并用氨水控制pH,通过建立合适的补料策略最终实现C. sorokiniana CMBB276的超高细胞密度培养,其最高生物量浓度和蛋白质产量可分别达232和86.55 g/L。Jin等[3]以C. sorokiniana GT-1为生产藻株,通过优化其异养培养条件,在7.5 L小试发酵罐和1000 L中试发酵罐分别获得了271和247 g/L的超高生物量浓度。由于索罗金小球藻可实现超高密度异养培养,因此在诸如油脂、蛋白质、碳水化合物等生产方面展现出了巨大的商业应用潜力,近年来引起了广泛的科学和商业兴趣[1-3]。
然而,在微藻异养培养过程中,特别是工业放大的异养培养过程中,其很容易被细菌污染,生产当中保持藻种的稳定比较困难,容易形成藻-菌共生的微环境[1,4]。目前小球藻异养培养染菌后通常的做法是停止发酵、彻底杀菌,或通过使用抑菌剂来减少由于倒料造成的经济损失[5]。因此,如何实现藻种的纯种培养和保存是其应用的基础和关键性环节,也是研究其生理、生化、营养价值等必不可少的步骤。
抗生素可抑制水生细菌的生长和繁殖,在除菌、抑菌方面表现出强大的作用。因此,目前常用抗生素来纯化藻种,其原理是选择合适的抗生素类型及用量来杀灭细菌,同时又对微藻的生长无明显影响[6]。研究表明,采用多种抗生素组合的除菌效果要优于单种抗生素的效果,因此选择性地使用多种抗生素进行无菌处理则较容易获得无菌藻系[7]。Cottrell等[7]通过联合使用庆大霉素、青霉素和卡那霉素,成功获得了无菌藻株Micromonas pusilla。Bruckner等[8]采用物理分离和抗生素处理的不同组合方式,以去除淡水硅藻中的伴生细菌。然而,抗生素的使用也会在一定程度上对微藻的生长及其代谢过程产生影响。Scholz[9]使用不同的抗生素结合物理分离方法对海洋底栖硅藻进行纯化,纯化藻株经长期培养后发现,无菌藻株的生长速度下降并且细胞体积缩小。因此,如何选用合适的抗生素来实现藻种的纯种培养和保存十分关键。
先前研究表明,C. sorokiniana FZU60是一株高产叶黄素的优良藻株[10-12]。然而,共生菌等使得该藻株在异养过程中易感染杂菌,从而严重影响其后续的开发利用。鉴于此,本研究首先从藻株FZU60的异养培养液中分离并鉴定主要的共生菌,以及考察所分离细菌和藻株FZU60对不同抗生素的敏感性,并在此基础上确定合适的抗生素组合来实现藻株FZU60的纯种培养,为高密度异养过程无菌藻种的制备提供一定的参考依据。
1. 材料与方法
1.1 材料与仪器
C. sorokiniana FZU60藻株 分离自中国福建省沿海地区,并保存于福建省海洋产品废弃物综合利用工程技术研究中心[10];叶黄素标准品 美国Sigma-Aldrich公司;丙酮、无水乙醚、乙酸铵、三乙胺、甲醇、乙醇、甲基叔丁基醚、丁基羟基甲苯均为色谱纯、培养基试剂均为分析纯 国药集团化学试剂有限公司;通用基因组DNA提取试剂盒、SYBR Green I染料、革兰氏染色试剂盒 北京索莱宝科技有限公司。
ZQPZ-228恒温振荡器 天津莱玻特瑞仪器设备有限公司;SP-756P紫外可见分光光度计 上海光谱仪器有限公司;TDL-40B低速台式大容量离心机 上海安亭科学仪器厂;Minibeadbeater-16破碎仪 美国Biospec公司;FD-1000型冷冻干燥机 上海爱郎仪器有限公司;LC-20A气相色谱仪 日本岛津公司;E100荧光显微镜 日本尼康公司。
1.2 实验方法
1.2.1 改良的Mann and Myer's培养基
改良的Mann and Myer's培养基(g/L)[10]:葡萄糖 10,NaNO3 1.75,MgSO4·7H2O 0.4,KCl 0.6,CaCl2·2H2O 0.15,K2HPO4·3H2O 0.1,Tris 0.5,微量元素25 mL;微量元素组成(g/L):EDTA·2Na 3.000,H3BO3 0.600,FeSO4·7H2O 0.200,MnCl2·4H2O 0.140,ZnSO4·7H2O 0.033,Co(NO3)2·6H2O 0.0007,CuSO4·5H2O 0.0002;并用1 mol/L HCl将pH调为7.5±0.1。
1.2.2 细菌的分离鉴定
取40 mL异养藻液(培养条件见1.2.4对照组)在4 ℃、8000 r/min条件下离心5 min,去除上清液,之后用无菌的0.3 mol/L乙二胺四乙酸(EDTA)洗涤并转移至1.5 mL离心管中再次离心,然后将沉淀物保存于液氮中,委托北京诺禾致源科技股份有限公司进行物种多样性分析,以获得异养体系的细菌群落组成。取100 μL异养藻液涂布于LB固体培养基上,在30±1 ℃培养箱中培养3 d,然后挑取不同形态的单菌落进行划线纯化。之后采用通用基因组DNA提取试剂盒提取所纯化菌株的DNA,并通过细菌通用引物(27f:5'-AGAGTTTGATCCTGGCTCAG-3',1492r:5'-GGTTACCTTGTTACGACTT-3')进行16S rDNA PCR扩增。反应体系(50 μL):0.25 μL 5 U/μL Ex Taq,5 μL 20 mmol/L 10×Ex Taq Buffer(Mg2+ plus),4 μL 25 mmol/L dNTP Mix,5 μL DNA模板,2 μL 10 μmol/L 27f上游引物,2 μL 10 μmol/L 1492r下游引物,补充ddH2O至50 μL。PCR反应条件:94 ℃、5 min预变性;94 ℃、45 s变性,55 ℃、1 min退火,72 ℃、2 min 15 s延伸,30 个循环;72 ℃、10 min。将PCR产物送铂尚生物技术(上海)有限公司进行测序分析,获得的序列通过NCBI进行Blast比对,并采用Neighbor-Joining法构建系统发育树。
1.2.3 细菌的抗生素敏感性研究
采用打孔药敏试剂法[13]评价头孢噻肟(CTX)、卡那霉素(KM)、新霉素(N)、氨苄青霉素(AMP)、链霉素(S)、四环素(TE)、氯霉素(C)和红霉素(E)在不同浓度下的抑菌效果。采用LB液体培养基摇瓶培养1.2.2所分离的细菌24 h,之后取1.25 mL菌液注入已冷却至50 ℃左右的100 mL LB固体培养基中,混合均匀后倾注于平板中,水平静置凝固后备用。使用平板打孔器在试验平板上打孔,之后往孔中注入80 μL不同浓度的抗生素,并置于30 ℃培养箱中培养24 h,之后测定抑菌圈大小。选择抑菌圈直径≥20 mm、11~19 mm和≤10 mm的抗生素分别为高敏(++)、中敏(+)和低敏(−)抗生素。
1.2.4 藻株FZU60的抗生素敏感性研究
在本研究中,考察浓度为10~100 mg/L的各抗生素对藻株FZU60的影响,该浓度是获取或储存无菌藻类培养物的常用浓度[14]。将藻株FZU60接种于装有100 mL改良Mann and Myer's培养基的250 mL锥形瓶中,并控制初始细胞浓度为0.15 g/L,之后加入头孢噻肟、卡那霉素、链霉素、四环素、氯霉素、红霉素等抗生素使其终浓度分别为10、25、50、100 mg/L,每组设置3个平行,以未添加抗生素的培养组作为对照组,在转速为150 r/min、温度为30±1 ℃的摇床中避光培养3 d,期间每12 h取样测定小球藻的生物量浓度,培养结束后离心收集藻细胞并冻干。
1.2.5 利用联合抗生素构建异养无菌体系
根据1.2.3和1.2.4的实验结果,选取既不影响藻细胞生长又能对细菌生长有显著抑制效果的抗生素类型及浓度,组成不同的联合抗生素组合:CTX+TE(10 mg/L+10 mg/L)、CTX+TE+KM(10 mg/L+10 mg/L+100 mg/L)、CTX+TE+E(10 mg/L+10 mg/L+100 mg/L)和CTX+TE+KM+E(10 mg/L+10 mg/L+100 mg/L+100 mg/L),考察其异养无菌体系的构建效果,具体培养步骤与1.2.4一致,培养结束后采用荧光显微镜观察藻液的共生菌情况。
1.2.6 异养无菌体系的稳定性研究
取100 μL经1.2.5无菌化处理后的藻液涂布于LB平板上,之后将平板置于30 ℃培养箱中培养24 h,初步判定无菌后再将藻液涂布于改良的Mann and Myer's固体培养基上,在温度为30±1 ℃的培养箱中避光培养5 d,然后挑取单藻落于新的固体培养基上,经3次传代培养,以消除残留抗生素的影响,同时通过摇瓶培养测定每代藻株的生长情况和色素含量。
1.2.7 藻细胞浓度测定
参考谢友坪等[15]报道的方法测定藻细胞浓度,由于藻体生物量与其在特定波长下的吸光度存在线性关系,可得藻株FZU60的生物量标准曲线为
1.2.8 色素含量测定
参考谢友坪等[15]报道的方法测定藻体叶绿素和叶黄素含量。
1.2.9 荧光显微镜观察分析
参考Han等[16]报道的方法分析藻液的共生菌情况。简言之,取1 mL异养藻液于5 mL离心管中,并加入SYBR Green I染料使其浓度达0.1%,避光染色10 min,之后于荧光显微镜下进行观察。由于染色后细菌和微藻的细胞核是绿色的,而藻细胞内的叶绿素因自发荧光则呈红色,可据此来区别藻细胞和共生菌细胞。
1.3 数据处理
采用Origin2019软件对数据进行处理和作图,实验结果由平均值±SD表示,并通过IBM SPSS Statistics软件分析对照组与试验组数据之间的差异显著性。
2. 结果与分析
2.1 C. sorokiniana FZU60异养培养液中细菌的分离鉴定
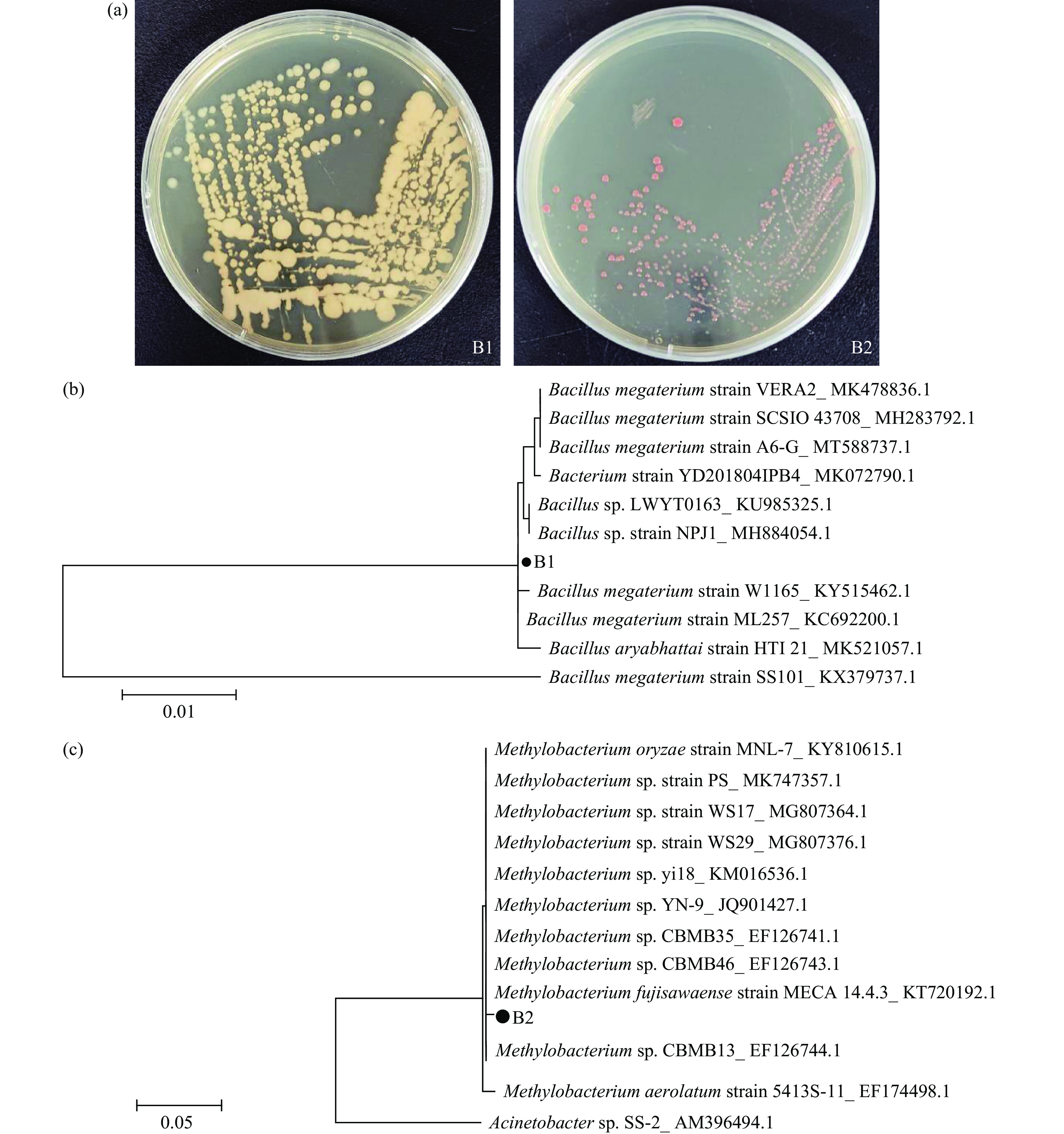
由于异养所使用的索罗金小球藻(C. sorokiniana FZU60)并不是纯化的藻种,通过离心藻液发现藻泥表层有一层米白色和粉色杂菌(图1a)。同时,使用荧光显微镜观察藻液,发现多个视野中均能观察到绿色杆状细胞(图1b)。如表1所示,对异养藻液中的细菌进行物种多样性分析,发现藻液中芽孢杆菌(Bacillus)所占细菌比例最高,达78.76%;其次是甲基杆菌(Methylobacterium),占3.14%。类似地,李静[17]在铜绿微囊藻XW01的藻液中分离出的4种优势菌株均为杆菌。钱文倩[18]发现原始小球藻(Chlorella protothecoides)所带细菌和通气异养培养中污染的细菌均属于芽孢杆菌,这说明芽孢杆菌是小球藻异养培养过程中极易污染的细菌。有报道表明,芽孢杆菌属具有溶藻作用,Kuramshina等[19]将芽孢杆菌引入普通小球藻(Chlorella vulgaris)的培养液中,发现由于芽孢杆菌合成和分泌耐热生物活性物质,会使得藻细胞数量明显减少。Pei等[20]从固定化生物系统中分离出溶藻芽孢杆菌P05,发现其对小球藻(Chlorella)、栅藻(Scenedesmus)和微囊藻(Microcystis)具有溶解作用。因此,需对藻株FZU60进行纯化,以消除细菌对微藻异养生长的负面影响。
表 1 异养培养液的细菌群落组成Table 1. Bacterial community composition of heterotrophic culture broth细菌群落组成 相对丰度(%) Bacillus 78.76 Chloroplast 9.42 Methylobacterium-Methylorubrum 3.14 Mitochondria 1.75 Lactobacillus 1.62 Muribaculaceae 1.13 Porphyrobacter 0.57 Mycoplasma 0.47 Parabacteroides 0.27 Bacteroides 0.25 Others 2.63 为更方便比较不同细菌对抗生素的敏感性,从藻株FZU60异养培养液中分离出两种优势菌株,分别命名为B1、B2,各菌株的形态特征见图2(a)和表2。进一步对两株菌株的16S rDNA进行测序分析,并构建系统发育树(图2(b)、图2(c))。通过比对,发现B1与Bacillus megaterium strain ML257、B2与Methylobacterium sp. CBMB13的遗传距离最近,在遗传学特征中有较高的一致性。综上结果表明,从藻株FZU60中分离出的细菌分别为芽孢杆菌(Bacillus)和甲基杆菌(Methylobacterium)。
表 2 所分离优势菌株的形态特征Table 2. Morphological characteristics of isolated strains菌株 形态特征 B1 革兰氏阳性菌,菌落呈米白色,圆形,表面光滑,
有光泽,细胞圆形杆状B2 革兰氏阴性菌,菌落呈粉红色,圆形,表面光滑,有光泽,细胞杆状 2.2 不同抗生素对细菌生长的影响
如表3、表4所示,氨苄青霉素和新霉素对菌株B1和B2的抑制效果不佳,而其余6种抗生素在一定质量浓度范围内均有较好的抑制作用,并随着抗生素的浓度升高而增强。类似地,武振晋等[21]发现新霉素对埃氏小球藻(Erichsen chlorella)中细菌的抑制效果不佳。周琨等[22]在蛋白核小球藻(Chlorella pyrenoidosa)无菌体系的构建过程中发现,当氨苄青霉素的浓度高达400 mg/L时,藻液中仍有细菌存在。因此,氨苄青霉素和新霉素不适合用于藻株除菌。此外,在菌株B1的抑菌圈实验中,当头孢噻肟和四环素的浓度达10 mg/L时均表现为高敏,氯霉素浓度达50 mg/L时表现为高敏,而卡那霉素、链霉素和红霉素的浓度达100 mg/L时才表现为高敏。而在菌株B2的抑菌圈实验中,只有当头孢噻肟和四环素的浓度达50 mg/L时才表现为高敏,以及卡那霉素和红霉素的浓度达100 mg/L时才表现为高敏。以上结果说明,两株菌对各抗生素的敏感度并不相同,其中B1(芽孢杆菌)对抗生素更为敏感。因此,一般需采用多种抗生素组合才能有效去除藻液中的细菌[23]。
表 3 菌株B1的抗生素敏感性结果Table 3. Antibiotic sensitivity of strain B1抑菌剂 抑菌圈大小(mm) 10 mg/L 50 mg/L 100 mg/L 头孢噻肟 ++ ++ ++ 卡那霉素 + + ++ 新霉素 − + + 氨苄青霉素 − − − 链霉素 − + ++ 四环素 ++ ++ ++ 氯霉素 − ++ ++ 红霉素 − + ++ 注:抑菌圈直径(mm)≥20(++);11-19(+);≤10(−);表4同。 表 4 菌株B2的抗生素敏感性结果Table 4. Antibiotic sensitivity of strain B2抑菌剂 抑菌圈大小(mm) 10 mg/L 50 mg/L 100 mg/L 头孢噻肟 + ++ ++ 卡那霉素 − + ++ 新霉素 − + + 氨苄青霉素 − − − 链霉素 − − + 四环素 + ++ ++ 氯霉素 − + + 红霉素 + + ++ 2.3 不同抗生素对C. sorokiniana FZU60细胞生长及色素合成的影响
利用微藻比细菌具有更强的抗生素耐受性的特点,可选择性地使用不同抗生素对藻株进行无菌化处理,从而获得无菌藻系[24]。然而,当抗生素的浓度超过微藻所能耐受的阈值时,也会对藻细胞的生长代谢过程产生影响。因此,有必要考察不同抗生素对藻株FZU60细胞生长及色素合成的影响。
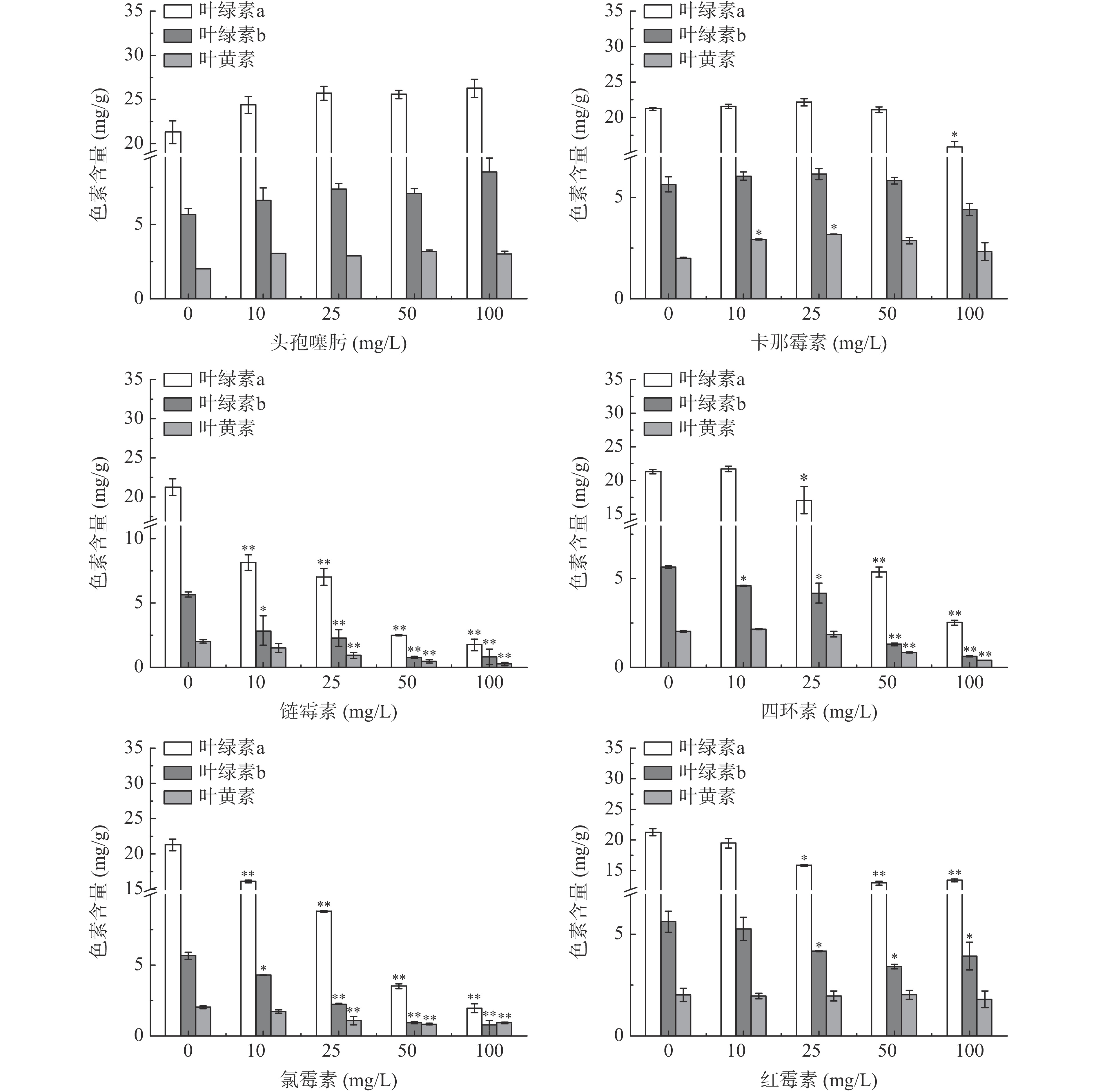
如图3所示,添加了头孢噻肟、卡那霉素和红霉素的实验组与对照组相比,藻株FZU60的生长曲线从第0 d到第3 d几乎一致。Fu等[25]研究发现头孢噻肟等细胞壁合成抑制类抗生素对微藻细胞的毒性相对较低。周文礼等[26]发现普通小球藻(C. vulgaris)在低于100 mg/L青霉素条件下的叶绿素a含量高于对照组。如图4所示,由于头孢噻肟与青霉素同属于β-内酰胺类抗生素,因此可发现头孢噻肟也可促进藻株FZU60叶绿素的积累。然而,高浓度的抗生素也会破坏光合作用系统,从而影响色素的生物合成[27],当卡那霉素浓度达100 mg/L、红霉素浓度大于25 mg/L时会对藻株FZU60的叶绿素合成具有抑制作用(P<0.05),但以上3种抗生素均未对微藻的叶黄素合成产生负面影响。
由图3和图4还可知,当培养液中链霉素、四环素和氯霉素的浓度达到10 mg/L时,虽然对藻株FZU60的细胞生长没有明显抑制作用,但藻细胞内的总色素含量开始明显下降,同时对藻细胞生长的抑制作用随着抗生素浓度的提高而明显增强;当这3种抗生素的浓度为50 mg/L时,藻株FZU60的生物量浓度分别为对照组的58.39%、58.24%和50.63%。相关研究表明,作为蛋白质合成抑制类的链霉素和氯霉素对索罗金小球藻细胞的毒性较强[28]。此外,也有研究发现富油新绿藻、雨生红球藻和埃氏小球藻对链霉素极其敏感[29-31]。因此,同时结合2.2的结果可知,10 mg/L头孢噻肟、10 mg/L四环素、100 mg/L卡那霉素和100 mg/L红霉素可在影响藻株FZU60生长及色素合成较小的前提下,又能对菌株B1、B2产生一定的抑制效果,因此选择以上抗生素类型及浓度作为联合抑菌剂对藻株FZU60进行纯化。
2.4 利用联合抗生素构建异养无菌体系
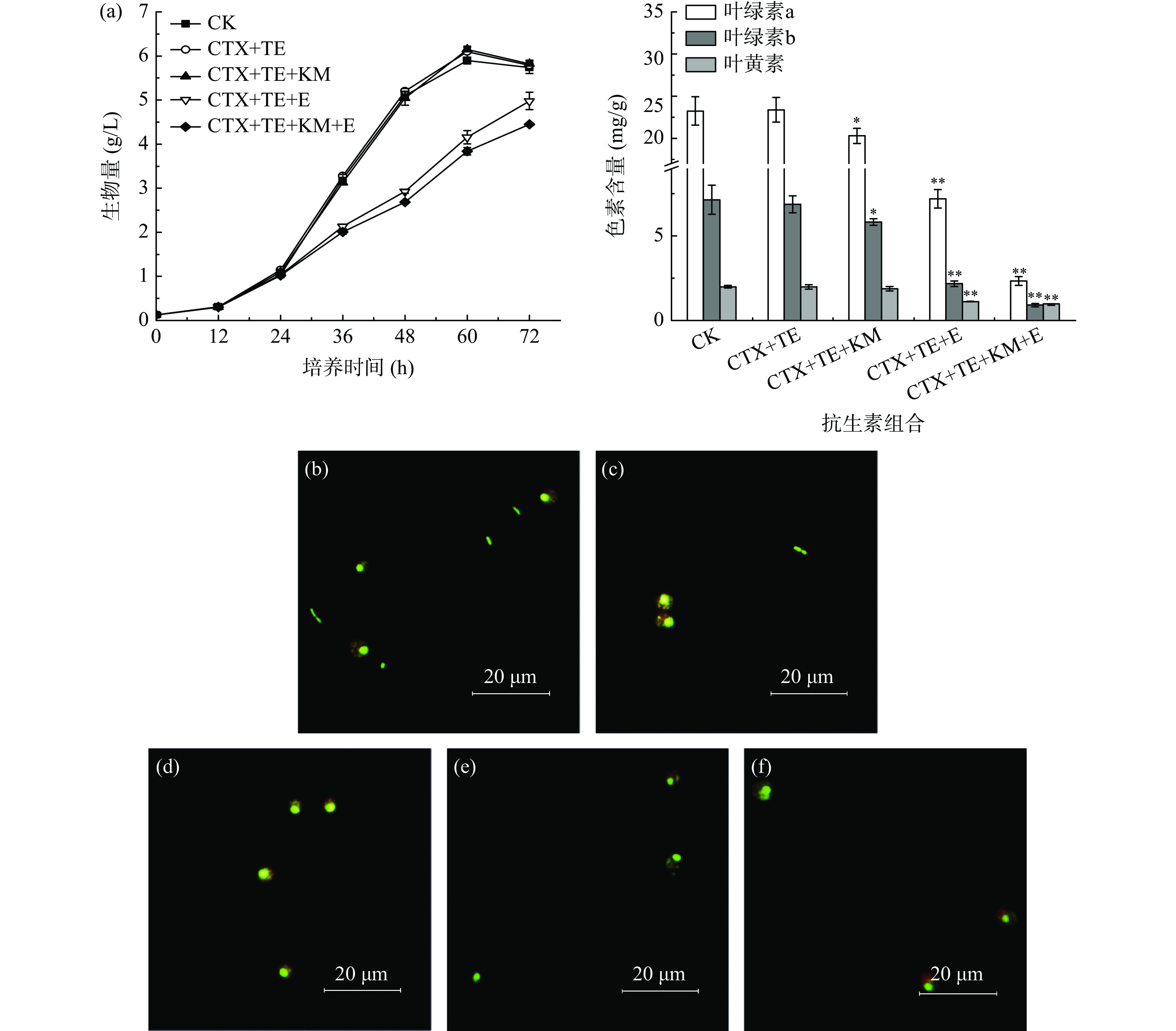
由于10 mg/L头孢噻肟(CTX)和10 mg/L四环素(TE)均对藻株FZU60的色素合成或细胞生长有一定的促进作用,基于此本实验设计并考察了4种不同抗生素组合(CTX+TE、CTX+TE+KM、CTX+TE+E和CTX+TE+KM+E)的影响。如图5(a)可知,CTX+TE、CTX+TE+KM组与对照组的生长曲线几乎一致,且CTX+TE和CTX+TE+KM对藻株FZU60的总色素含量影响较小(P>0.05);而CTX+TE+E和CTX+TE+KM+E的加入会在培养24 h后明显减缓藻株FZU60的生长速率,至培养结束时,藻株FZU60的生物量浓度仅为对照组的86.75%和77.49%,且色素含量极显著低于对照组(P<0.01)。另外,由图5可知,在CTX+TE组的培养液中还存在部分细菌,且略少于对照组;而其余实验组在多个视野中均未发现细菌的存在,这说明CTX+TE+KM、CTX+TE+E和CTX+TE+KM+E的抗生素组合对细菌具有较好的抑制效果。
综上,由于CTX+TE+KM组的抗生素组合可在对藻株FZU60生长及色素合成不产生明显影响的前提下,又能起到良好的抑菌效果,因此最终选择10 mg/L头孢噻肟+10 mg/L四环素+100 mg/L卡那霉素作为联合抑菌剂进行藻株FZU60异养无菌体系的构建。
2.5 异养无菌体系的稳定性
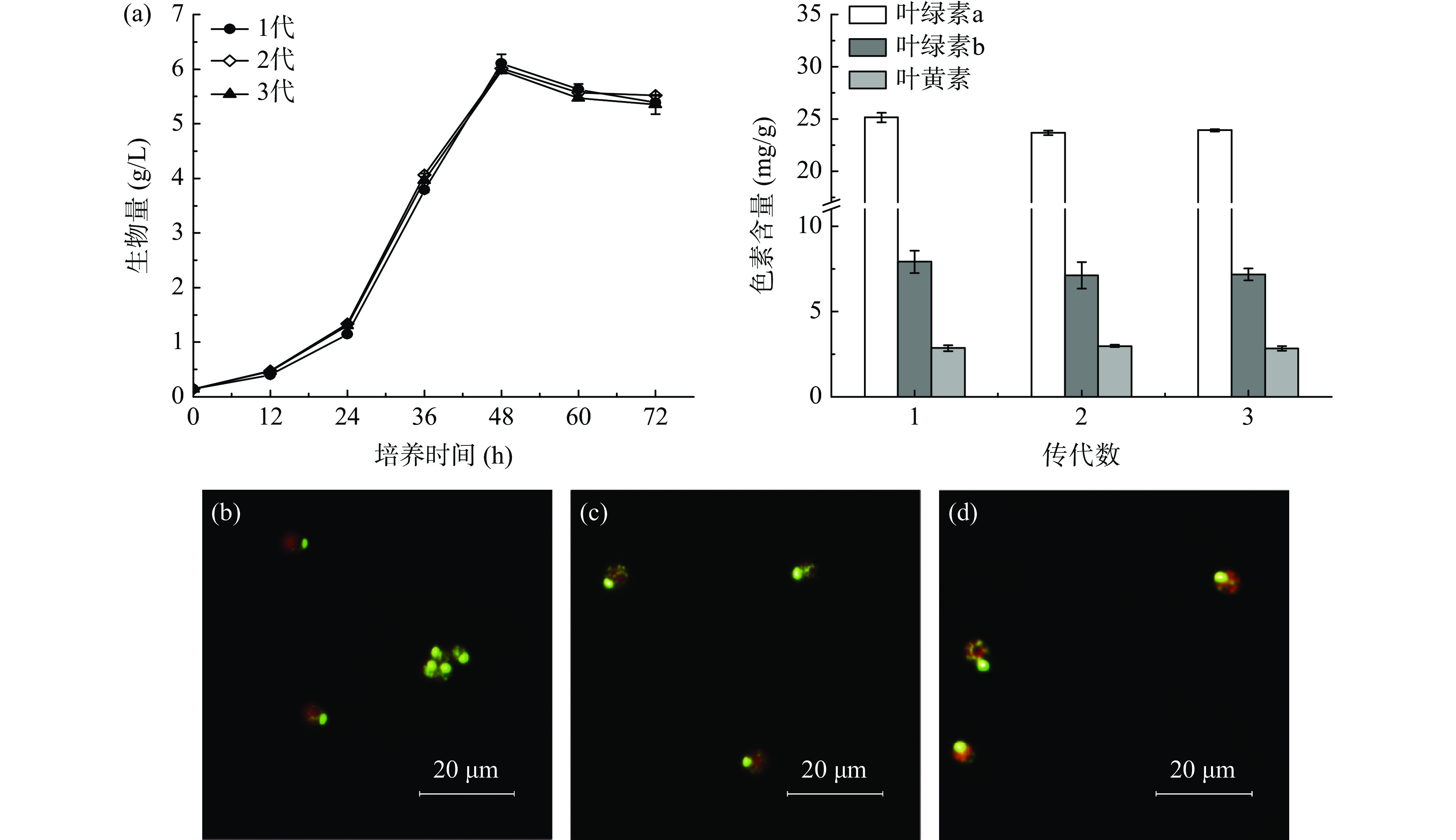
如图6所示,将联合抗生素处理后的藻株FZU60进行3次传代培养,可发现藻株FZU60均可维持较稳定的生物量浓度及色素含量,以上结果表明联合抗生素处理对该藻株的生长和色素合成无明显影响。此外,在传代培养过程中取对数生长期的藻液使用SYBR Green I溶液进行染色,并置于荧光显微镜下观察,发现多个视野内只有发红绿光的藻细胞,且均未发现杂菌细胞。综上可知,通过联合抗生素构建的异养无菌体系较为稳定。
3. 结论
通过对优势菌株的分离、形态观察和16S rDNA相似序列比对,发现索罗金小球藻FZU60异养体系内主要的共生菌为芽孢杆菌(Bacillus)和甲基杆菌(Methylobacterium)。此外,抗生素敏感性结果表明10 mg/L头孢噻肟、10 mg/L四环素、100 mg/L卡那霉素和100 mg/L红霉素对两株共生菌均有较好抑制效果,但对藻株FZU60的生长无明显影响。在此基础上,发现采用10 mg/L头孢噻肟、10 mg/L四环素和100 mg/L卡那霉素的抗生素组合可成功构建藻株FZU60的异养无菌体系,且经3次传代培养后藻株FZU60仍可维持稳定的生长及无菌状态。本实验结果可为索罗金小球藻的高密度异养开发提供一定的技术支持。
-
表 1 异养培养液的细菌群落组成
Table 1 Bacterial community composition of heterotrophic culture broth
细菌群落组成 相对丰度(%) Bacillus 78.76 Chloroplast 9.42 Methylobacterium-Methylorubrum 3.14 Mitochondria 1.75 Lactobacillus 1.62 Muribaculaceae 1.13 Porphyrobacter 0.57 Mycoplasma 0.47 Parabacteroides 0.27 Bacteroides 0.25 Others 2.63 表 2 所分离优势菌株的形态特征
Table 2 Morphological characteristics of isolated strains
菌株 形态特征 B1 革兰氏阳性菌,菌落呈米白色,圆形,表面光滑,
有光泽,细胞圆形杆状B2 革兰氏阴性菌,菌落呈粉红色,圆形,表面光滑,有光泽,细胞杆状 表 3 菌株B1的抗生素敏感性结果
Table 3 Antibiotic sensitivity of strain B1
抑菌剂 抑菌圈大小(mm) 10 mg/L 50 mg/L 100 mg/L 头孢噻肟 ++ ++ ++ 卡那霉素 + + ++ 新霉素 − + + 氨苄青霉素 − − − 链霉素 − + ++ 四环素 ++ ++ ++ 氯霉素 − ++ ++ 红霉素 − + ++ 注:抑菌圈直径(mm)≥20(++);11-19(+);≤10(−);表4同。 表 4 菌株B2的抗生素敏感性结果
Table 4 Antibiotic sensitivity of strain B2
抑菌剂 抑菌圈大小(mm) 10 mg/L 50 mg/L 100 mg/L 头孢噻肟 + ++ ++ 卡那霉素 − + ++ 新霉素 − + + 氨苄青霉素 − − − 链霉素 − − + 四环素 + ++ ++ 氯霉素 − + + 红霉素 + + ++ -
[1] 张虎, 赵亮, 陈义, 等. 微藻异养高密度培养研究进展与发展趋势[J]. 中国生物工程杂志,2022,42(3):110−123. [ZHANG H, ZHAO L, CHEN Y, et al. Research progress and future direction on high-cell-density heterotrophic cultivation of microalgae[J]. China Biotechnology,2022,42(3):110−123. ZHANG H, ZHAO L, CHEN Y, et al. Research progress and future direction on high-cell-density heterotrophic cultivation of microalgae[J]. China Biotechnology, 2022, 42(3): 110-123.
[2] XU Q, HOU G, CHEN J, et al. Heterotrophically ultrahigh-cell-density cultivation of a high protein-yielding unicellular alga Chlorella with a novel nitrogen-supply strategy[J]. Frontiers in Bioengineering and Biotechnology,2021,9:774854. doi: 10.3389/fbioe.2021.774854
[3] JIN H, CHUAI W, LI K, et al. Ultrahigh-cell-density heterotrophic cultivation of the unicellular green alga Chlorella sorokiniana for biomass production[J]. Biotechnology and Bioengineering,2021,118(10):4138−4151. doi: 10.1002/bit.27890
[4] RAMANAN R, KIM B H, CHO D H, et al. Algae-bacteria interactions: Evolution, ecology and emerging applications[J]. Biotechnology Advances,2016,34(1):14−29. doi: 10.1016/j.biotechadv.2015.12.003
[5] 毕生雷, 张成明, 金洪波, 等. 抑菌剂在异养小球藻发酵过程中的应用[J]. 食品与发酵工业,2015,41(3):70−74. [BI S L, ZHANG C M, JIN H B, et al. The application of antibacterial agent in the cultivation of heterotrophic Chlorella[J]. Science and Technology of Food Industry,2015,41(3):70−74. BI S L, ZHANG C M, JIN H B, et al. The application of antibacterial agent in the cultivation of heterotrophic Chlorella[J]. Science and Technology of Food Industry, 2015, 41(3): 70-74.
[6] BEDNARSKA K, WACHOWICZ B, BUCZYNSKI A. UV-B-induced generation of free radicals in blood platelets[J]. Journal of Photochemistry and Photobiology B:Biology,2000,55(2−3):109−112. doi: 10.1016/S1011-1344(00)00023-3
[7] COTTRELL M T, SUTTLE C A. Production of axenic cultures of micromonas pusilla (Prasinophyceae) using antibiotic[J]. Journal of Phycology,1993,29(3):385−387. doi: 10.1111/j.0022-3646.1993.00385.x
[8] BRUCKNER C G, KROTH P G. Protocols for the removal of bacteria from freshwater benthic diatom cultures[J]. Journal of Phycology,2009,45(4):981−986. doi: 10.1111/j.1529-8817.2009.00708.x
[9] SCHOLZ B. Purification and culture characteristics of 36 benthic marine diatoms isolated from the Solthorn tidal flat (Southern North Sea)[J]. Journal of Phycology,2014,50(4):685−697. doi: 10.1111/jpy.12193
[10] XIE Y, LI J, MA R, et al. Bioprocess operation strategies with mixotrophy/photoinduction to enhance lutein production of microalga Chlorella sorokiniana FZU60[J]. Bioresource Technology,2019,290:121798. doi: 10.1016/j.biortech.2019.121798
[11] XIE Y, LI J, HO SH, et al. Pilot-scale cultivation of Chlorella sorokiniana FZU60 with a mixotrophy/photoautotrophy two-stage strategy for efficient lutein production[J]. Bioresource Technology,2020,314:123767. doi: 10.1016/j.biortech.2020.123767
[12] MA R, ZHANG Z, TANG Z, et al. Enhancement of co-production of lutein and protein in Chlorella sorokiniana FZU60 using different bioprocess operation strategies[J]. Bioresources and Bioprocessing,2021,8:82. doi: 10.1186/s40643-021-00436-9
[13] 谭才邓, 朱美娟, 杜淑霞, 等. 抑菌试验中抑菌圈法的比较研究[J]. 食品工业,2016,37(11):122−125. [TAN C D, ZHU M J, DU S X, et al. Study on the inhibition zone method in antimicrobial test[J]. The Food Industry,2016,37(11):122−125. TAN C D, ZHU M J, DU S X, et al. Study on the inhibition zone method in antimicrobial test[J]. The Food Industry, 2016, 37(11): 122-125.
[14] BHATTARAI H D, PAUDEL B, HONG Y K, et al. A simple method to preserve algal spores of Ulva spp. in cold storage with ampicillin[J]. Hydrobiologia,2007,592(1):399−404. doi: 10.1007/s10750-007-0777-4
[15] 谢友坪, 赵旭蕊, 阳需求, 等. 脉冲式添加氮源对耐温微藻Desmodesmus sp. F51细胞生长和细胞组成的影响[J]. 食品科学,2017,38(14):64−70. [XIE Y P, ZHAO X R, YANG X Q, et al. Effect of nitrate pulse-feeding cultivation on cell growth and cell composition of thermo-tolerant Desmodesmus sp. F51[J]. Food Science,2017,38(14):64−70. XIE Y P, ZHAO X R, YANG X Q, et al. Effect of nitrate pulse-feeding cultivation on cell growth and cell composition of thermo-tolerant Desmodesmus sp. F51[J]. Food Science, 2017, 38(14): 64-70.
[16] HAN J, WANG S, ZHANG L, et al. A method of batch-purifying microalgae with multiple antibiotics at extremely high concentrations[J]. Chinese Journal of Oceanology and Limnology,2015,34(1):79−85.
[17] 李静. 群体微囊藻XW01无菌化培养及全基因组测序[D]. 南京: 南京师范大学, 2014 LI J. Sterile culturing and whole genome sequencing of Microcystis aeruginosa XW01[D]. Nanjing: Nanjing Normal University, 2014.
[18] 钱文倩. 微生物对异养小球藻生长及代谢产物影响的研究[D]. 上海: 上海交通大学, 2008 QIAN W Q. Effect of bacteria on the growth and biochemical component of heterotrophic Chlorella protothecoides[D]. Shanghai: Shanghai Jiao Tong University, 2008.
[19] KURAMSHINA Z M, KHAIRULLIN R M. Influence of endophytic strains of the bacterium Bacillus subtilis on cell number in monocultures of green algae[J]. Russian Journal of Plant Physiology,2013,60(4):571−575. doi: 10.1134/S1021443713040080
[20] PEI H Y, HU W R, MU R M, et al. Alga-lysing bioreactor and dominant bacteria strain[J]. Journal of Environmental Sciences,2007,19(5):546−552. doi: 10.1016/S1001-0742(07)60091-6
[21] 武振晋, 周广航, 赵奎, 等. 小球藻无菌培养体系的建立及培养条件的优化[J]. 山西农业大学学报:自然科学版,2017,37(4):287−294. [WU Z J, ZHOU G H, ZHAO K, et al. The establishment of sterile culture system and optimization of culture conditions from Erichsen chlorella[J]. Journal of Shanxi Agricultural University (Natural Science Edition),2017,37(4):287−294. WU Z J, ZHOU G H, ZHAO K, et al. The establishment of sterile culture system and optimization of culture conditions from Erichsen chlorella[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2017, 37(4): 287-294.
[22] 周琨, 卢其能, 岳明. 蛋白核小球藻无菌培养体系的建立[J]. 安徽农业科学,2015,43(19):14−17. [ZHOU K, LU Q N, YUE M. Establishment of sterile culture system of Chlorella pyrenoidosa[J]. Journal of Anhui Agricultural Sciences,2015,43(19):14−17. ZHOU K, LU Q N, YUE M. Establishment of sterile culture system of Chlorella pyrenoidosa[J]. Journal of Anhui Agricultural Sciences, 2015, 43(19): 14-17.
[23] 麻晓霞, 马丽萍, 石勋祥, 等. 微藻对常用抗生素敏感性的研究进展[J]. 微生物学免疫学进展,2012,40(1):83−86. [MA X X, MA L P, SHI X X, et al. The research progress of sensitivity of microalgaes to common antibiotics[J]. Progress in Microbiology and Immunology,2012,40(1):83−86. MA X X, MA L P, SHI X X, et al. The research progress of sensitivity of microalgaes to common antibiotics[J]. Progress in Microbiology and Immunology, 2012, 40(1): 83-86.
[24] 周文俊, 郑立, 郑明刚, 等. 海洋微藻的无菌化处理及对其生长特性和生化组成的影响[J]. 海洋学报(中文版),2012,34(6):177−186. [ZHOU W J, ZHENG L, ZHENG M G, et al. Axenation of marine microalgae and effects of axenic cultivation on growth characteristics and biochemical compositions of marine microalgae[J]. Acta Oceanologica Sinica,2012,34(6):177−186. ZHOU W J, ZHENG L, ZHENG M G, et al. Axenation of marine microalgae and effects of axenic cultivation on growth characteristics and biochemical compositions of marine microalgae[J]. Acta Oceanologica Sinica, 2012, 34(6): 177-186.
[25] FU L, HUANG T, WANG S, et al. Toxicity of 13 different antibiotics towards freshwater green algae Pseudokirchneriella subcapitata and their modes of action[J]. Chemosphere,2017,168:217−222. doi: 10.1016/j.chemosphere.2016.10.043
[26] 周文礼, 乔秀亭, 肖慧, 等. 三种抗生素对几种海洋微藻叶绿素a含量影响的初步研究[J]. 海洋环境科学,2009,28(3):268−271. [ZHOU W L, QIAO X T, XIAO H, et al. Effects of antibiotics on chlorophyll-a level in marine microalga[J]. Marine Environmental Science,2009,28(3):268−271. ZHOU W L, QIAO X T, XIAO H, et al. Effects of antibiotics on chlorophyll-a level in marine microalga[J]. Marine Environmental Science, 2009, 28(3): 268-271.
[27] XIONG J Q, GOVINDWAR S, KURADE M B, et al. Toxicity of sulfamethazine and sulfamethoxazole and their removal by a green microalga, Scenedesmus obliquus[J]. Chemosphere,2019,218:551−558. doi: 10.1016/j.chemosphere.2018.11.146
[28] 李亚军, 朱为菊, 费小雯, 等. 不同抗生素和防腐剂对小球藻Chlorella sorokiniana细胞生长的影响[J]. 南方农业学报,2017,48(11):2078−2085. [LI Y J, ZHU W J, FEI X W, et al. Effects of different antibiotics and preservatives on Chlorella sorokiniana cell growth[J]. Journal of Southern Agriculture,2017,48(11):2078−2085. LI Y J, ZHU W J, FEI X W, et al. Effects of different antibiotics and preservatives on Chlorella sorokiniana cell growth[J]. Journal of Southern Agriculture, 2017, 48(11): 2078-2085.
[29] 张茜, 李雁群, 卢少霞, 等. 富油新绿藻对四种抗生素敏感性的研究[J]. 食品工业科技,2016,37(14):154−157,174. [ZHANG X, LI Y Q, LU S X, et al. Research on the sensitivity of Neochloris oleoabundans to four antibiotics[J]. Science and Technology of Food Industry,2016,37(14):154−157,174. ZHANG X, LI Y Q, LU S X, et al. Research on the sensitivity of Neochloris oleoabundans to four antibiotics[J]. Science and Technology of Food Industry, 2016, 37(14): 154-157, 174.
[30] 郑凌凌, 张琪, 李天丽, 等. 雨生红球藻无菌化处理及其对生长和生理的影响[J]. 福建师范大学学报,2017,33(1):44−50. [ZHENG L L, ZHANG Q, LI T L, et al. Axenation of Haematococcus pluvialis and the effects of axenic cultivation on the growth and physiology of the strain[J]. Journal of Fujian Normal University (Natural Science Edition),2017,33(1):44−50. ZHENG L L, ZHANG Q, LI T L, et al. Axenation of Haematococcus pluvialis and the effects of axenic cultivation on the growth and physiology of the strain[J]. Journal of Fujian Normal University (Natural Science Edition), 2017, 33(1): 44-50.
[31] 王亚君, 周广航, 季春丽, 等. 埃氏小球藻对11种抗生素的敏感性[J]. 山西农业科学,2017,45(3):379−385. [WANG Y J, ZHOU G H, JI C L, et al. Study on the sensitivity of Chlorella emersonii to eleven kinds of antibiotics[J]. Journal of Shanxi Agricultural Sciences,2017,45(3):379−385. doi: 10.3969/j.issn.1002-2481.2017.03.15 WANG Y J, ZHOU G H, JI C L, et al. Study on the sensitivity of Chlorella emersonii to eleven kinds of antibiotics[J]. Journal of Shanxi Agricultural Sciences, 2017, 45(3): 379-385. doi: 10.3969/j.issn.1002-2481.2017.03.15







 下载:
下载:

 下载:
下载:
