Improving Effects of Epigallocatechin-3-gallate (EGCG) on Dextran Sulfate Sodium (DSS)-Induced Colitis
-
摘要: 本研究旨在探讨表没食子儿茶素没食子酸酯(Epigallocatechin-3-gallate,EGCG)对葡聚糖硫酸钠(Dextran sulfate sodium,DSS)诱导的小鼠结肠炎和肠道菌群的影响。将C57BL/6雄性小鼠分为正常对照组、肠炎模型组和EGCG处理组(50 mg/kg),每组10只,连续灌胃给药9 d。通过称取小鼠体质量,观察并记录小鼠大便黏稠度、大便出血情况,测量小鼠结肠长度和检测血清中炎症因子来评估EGCG对DSS诱导的小鼠结肠炎症的改善作用;通过分析结肠病理形态、紧密连接蛋白的表达量、肠道菌群多样性和肠道菌群结构来评估EGCG对DSS诱导的结肠炎小鼠肠道菌群的影响。结果表明,EGCG能够有效改善DSS诱导的结肠炎小鼠体质量的下降、腹泻、便血、结肠缩短等不良反应;缓解DSS诱导的小鼠结肠炎导致的全身性慢性炎症和肠道屏障损伤;改善DSS诱导的结肠炎小鼠肠道菌群紊乱,恢复肠道菌群多样性,降低厚壁菌门的相对丰度,提高拟杆菌门的相对丰度,促进有益菌Akkermansia、Alistipes和Bacteroides的增殖并抑制有害菌Desulfovibrio、Escherichia-Shigella和Helicobacter的生长。因此,EGCG通过保护肠道屏障和调节肠道菌群紊乱,从而有效改善DSS诱导的小鼠结肠炎症。
-
关键词:
- 表没食子儿茶素没食子酸酯 /
- 葡聚糖硫酸钠 /
- 结肠炎 /
- 肠道菌群
Abstract: This study aimed to investigate the effect of epigallocatechin-3-gallate (EGCG) on dextran sulfate sodium (DSS)-induced colitis and gut microbiota in mice. The C57BL/6 male mice were divided into normal control group, enteritis model group and EGCG treatment group (50 mg/kg), 10 mice in each group, and were administered orally for 9 consecutive days. The improvement effect of EGCG on DSS-induced colitis in mice was evaluated by weighing the weight of the mice, observing and recording the fecal viscosity and fecal bleeding of the mice, measuring the length of the colon in the mice and detecting inflammatory factors in the serum. The effect of EGCG on the gut microbiota of DSS-induced colitis mice was evaluated by analyzing colon pathological morphology, expression of tight junction proteins, the diversity and structure of gut microbiota. The results showed that EGCG effectively improved the adverse reactions in DSS-induced colitis mice such as weight loss, diarrhea, blood in the stool, and colon, and alleviated systemic chronic inflammation and intestinal barrier damage in DSS-induced colitis mice. Furthermore, EGCG also ameliorated the gut microbiota disturbance, restored gut microbiota diversity, decreased the relative abundance of Firmicutes, increased the relative abundance of Bacteroidetes, promoted the proliferation of beneficial bacteria such as Akkermansia, Alistipes and Bacteroides, and inhibited the growth of harmful bacteria including Desulfovibrio, Escherichia-Shigella and Helicobacter. Therefore, EGCG effectively ameliorated DSS-induced colitis in mice by protecting the intestinal barrier and regulating gut microbiota disturbance.-
Keywords:
- epigallocatechin-3-gallate /
- dextran sulfate sodium /
- colitis /
- gut microbiota
-
炎症性肠炎(Inflammatory bowel disease,IBD)是一种慢性胃肠道炎症性疾病,其病理生理特征表现为腹泻、血便、体重减轻、慢性炎症和结肠溃疡性损伤等,在临床上通常分为溃疡性结肠炎(Ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD)两种[1-2]。近些年来,全球IBD患者的数量已经超过600万,中国IBD患者的数量也在不断增加,为公共卫生带来了巨大的挑战[3]。目前治疗IBD的药物主要有氨基水杨酸、糖皮质激素、免疫调节剂、抗生素和生物制剂等,其主要作用在于控制肠道炎症,但这些药物仍然存在价格高昂、效果不佳、副作用多等缺点[4-5]。因此,需要寻找一种安全有效的治疗IBD的方法。
尽管对于IBD的发病机制尚不清楚,但大多数研究人员认为IBD与遗传因素、环境因素和肠道微生态失衡等有关[6-7]。近几年来,研究人员发现肠道炎症性疾病与肠道菌群紊乱相关[8-9]。有研究显示,IBD患者的肠道内菌群多样性降低,菌群处于紊乱状态[10]。此外,在葡聚糖硫酸钠(DSS)诱导的肠炎小鼠体内也观察到肠道菌群多样性的降低和肠道菌群紊乱,如益生菌Akkermansia相对丰度的降低,有害菌Escherichia-Shigella相对丰度增加等[11]。因此,调节肠道菌群已经被提出是预防和治疗肠道炎症性疾病的新靶点。
表没食子儿茶素没食子酸酯(EGCG)是绿茶中最主要的多酚类物质,占干茶的6%~8%,具有抗炎和抗氧化作用[12-13]。流行病学研究表明饮用绿茶能有效降低患IBD的风险[14-15]。另外一项随机对照试验中发现,IBD患者每天服用400 mg的EGCG后症状有所好转,并且副作用较小[16]。目前的研究已经报道EGCG能够有效缓解DSS诱导的小鼠结肠炎症,但多数集中在EGCG对炎症通路的调节作用上,对肠道屏障和肠道菌群的影响研究较少[17]。因此,本研究采用DSS诱导小鼠建立结肠炎模型,从小鼠的体质量、疾病活动指数、结肠长度、结肠病理形态、血清中炎症因子、肠道屏障和肠道菌群等多角度,探究EGCG对DSS诱导的小鼠结肠炎和肠道菌群的影响,以期为肠道疾病的防治提供新的思路,促进茶作为功能膳食补充保护肠道功能提供科学依据。
1. 材料与方法
1.1 材料与仪器
表没食子儿茶素没食子酸酯(纯度>98%) 由湖南三福生物科技有限公司馈赠;葡聚糖硫酸钠(DSS) 购买于美国MP Biologicals公司;普通维持饲料、30只SPF级4周龄雄性C57BL/6小鼠 均购买于湖南斯莱克景达实验动物有限公司,试验动物生产许可证号为SCXK(湘)2019-0004;酶联免疫试剂盒白介素-1β(Interleukin-1β,IL-1β)、白介素-6(Interleukin-6,IL-6)、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α) 购买于湖南艾方生物科技有限公司;抗体胞质紧密粘连蛋白1(Zonula occludens-1,ZO-1) 购买于湖南艾方生物科技有限公司;ECL化学发光底物 购买于美国伯乐Bio-Rad公司;RIPA裂解液(强)、BCA蛋白定量试剂盒 购买于上海碧云天生物技术有限公司。
MIKRO 22R冷冻离心机 德国Hettich公司;Varioskan Flash多功能酶标仪 美国Thermo公司;Nikon Eclipse Ci正置荧光显微镜 日本尼康公司;RM2235病理切片机 上海徕卡公司;DYCZ-24EN双垂直电泳仪 北京六一公司;TS-100水平脱色摇床 海门其林贝尔公司。
1.2 实验方法
1.2.1 动物试验设计
本动物试验经湖南农业大学生物医学研究伦理委员会批准,批准号为第2138号。C57BL/6小鼠均喂养在湖南农业大学SPF级标准动物房,环境温度为24~25 ℃,开灯时间/关灯时间为12/12 h循环,整个实验过程中小鼠均自由进食饮水。
C57BL/6小鼠在适应性饲养1周后,随机分为3组:正常对照组、肠炎模型组和EGCG处理组,每组小鼠10只。整个试验周期为9 d,正常对照组小鼠每日饮用蒸馏水,肠炎模型组和EGCG处理组小鼠前7 d的饮用加入3% DSS的蒸馏水,以此来建立小鼠结肠炎模型,剩下2 d饮用蒸馏水[18]。参考Wu等[19]的方法,在整个试验阶段EGCG处理组小鼠每日灌胃50 mg/kg的EGCG,属于安全剂量范围内,其余两组灌胃相同体积的生理盐水。此外,每天记录小鼠的结肠炎相关指标,包括体质量、粪便特征以及出血状况。试验结束后,采用1%的戊巴比妥麻醉小鼠,采取眼球取血,收集结肠以及盲肠内容物,放入−80 ℃保存,备用。
1.2.2 检测方法
1.2.2.1 疾病活动指数评价
参考Li等[20]的方法,每日检查并记录每只小鼠的身体状况,包括大便黏稠度、大便出血情况和体质量下降百分率来进行综合评价,最终的疾病活动指数=(大便黏稠度评分+大便出血评分+体质量下降评分)/3。具体评分标准如表1所示。
表 1 疾病活动指数评价标准Table 1. Scoring criteria of disease activity index大便黏稠度 大便出血 体质量下降百分率(%) 得分 正常 正常 不变 0 轻度软便 潜血弱阳性 1~5 1 严重软便 潜血阳性 6~10 2 轻度腹泻 潜血强阳性 11~15 3 严重腹泻 显性出血 >15 4 1.2.2.2 血清中炎症因子检测
眼球采血后,将离心管中收集的全血静置30 min后,在4 ℃条件下4000 r/min离心10 min,取上层血清。根据试剂盒说明书方法检测血清中的炎症因子IL-1β、IL-6和TNF-α的含量。
1.2.2.3 小鼠结肠组织切片病理学观察
将结肠组织置于4%多聚甲醇缓冲液中固定24 h,脱水后采用石蜡包埋。用石蜡切片机将石蜡包埋的结肠组织切成厚度为5 μm的切片后,用苏木精和曙红(H&E)和高碘酸-席夫(PAS)进行染色处理。使用配备相机的光学显微镜采集图片并分析。
1.2.2.4 Western Blot检测结肠组织中ZO-1表达量
参考Zhou等[21]的实验方法,使用裂解缓冲液从结肠组织中提取总蛋白后并用BCA试剂盒定量,在98 ℃中加热10 min,再用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法分离蛋白质,然后转移到聚偏二氟乙烯膜上。其次,膜在5%脱脂牛奶在缓冲液中室温封闭1 h后,加入ZO-1抗体在4 ℃孵育过夜后,再在二抗中孵育1 h。然后,在膜的蛋白面侧滴加新鲜配制的ECL混合溶液,进行发光检测;然后调整曝光条件,进行显影和定影;最后将胶片进行扫描存档,用AlphaEaseFC软件处理系统分析目标带的光密度值。
1.2.2.5 盲肠内容物菌群检测分析
将收集好的小鼠盲肠内容物进行预处理后,对盲肠内容物的基因组DNA进行提取。参考Zhou等[21]的实验方法,利用琼脂糖凝胶电泳检测DNA的纯度和浓度后,对16S rRNA测序主要扩增区域V3-V4片段,上游引物为338F:ACTCCTACGGGAGGCAGCAG,下游引物为806R:GGACTACHVGGGTWTCTAAT。反应条件如下:98 ℃变性60 s;98 ℃ 10 s、50 ℃ 30 s、72 ℃ 30 s,共30个循环;72 ℃ 5 min;扩增体系为20 μL,扩增后对产物进行鉴定、纯化和定量。使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序,再用QIIME2软件包进行序列分析。
1.3 数据处理
所有结果均以平均值±标准差表示。数据采用GraphPad Prism 8.0.1软件进行统计学分析和作图,统计学分析采用单因素方差分析(ANOVA)和LSD法检验,P<0.05表示差异具有统计学意义。
2. 结果与分析
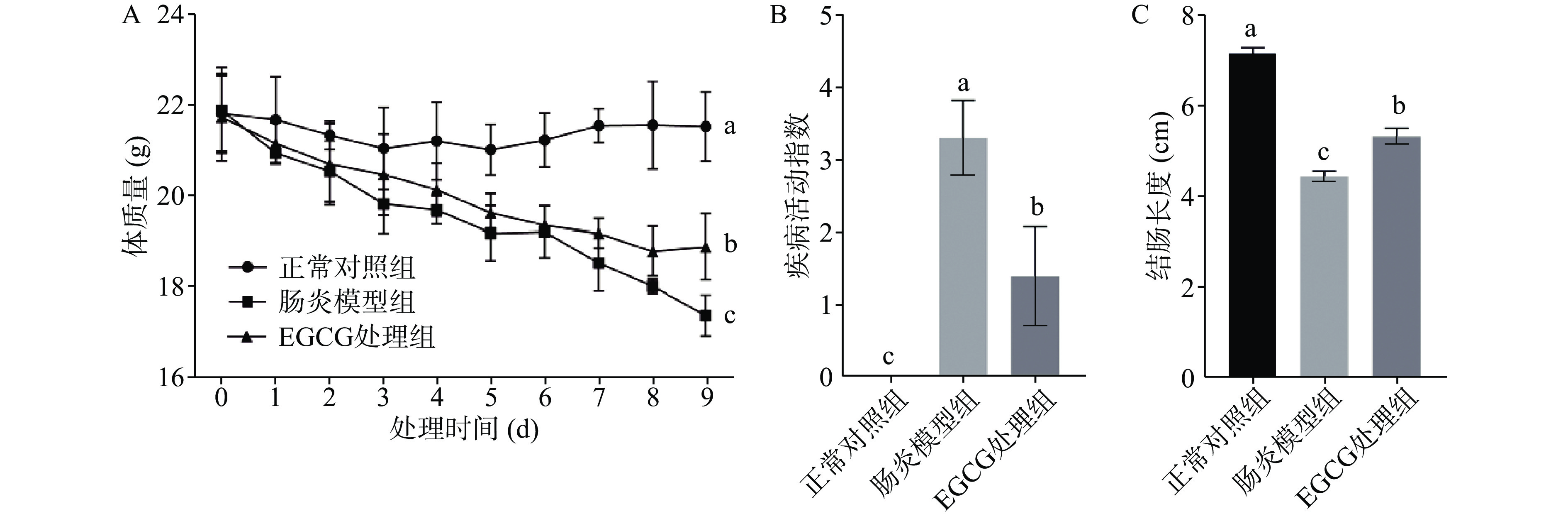
2.1 EGCG对DSS诱导的结肠炎小鼠体质量、活动疾病指数以及结肠长度的影响
在整个试验期间,正常对照组和EGCG处理组小鼠毛发乌黑油亮,饮食和精神状况良好,粪便成形;DSS处理组的结肠炎小鼠表现出掉毛严重、精神萎靡、腹泻、大便带血、肛门有血迹,说明造模成功[22]。小鼠的体质量变化如图1A所示,肠炎模型组小鼠的体质量呈下降趋势,并且显著低于正常对照组小鼠(P<0.05);经过连续9 d的EGCG处理后,其体质量的下降趋势得到缓解,EGCG处理组小鼠的体质量显著高于肠炎模型组(P<0.05)。如图1B所示,肠炎模型组的疾病活动指数显著高于正常对照组(P<0.05),表明DSS导致了小鼠肠炎,从而引发了严重的腹泻、便血以及体重下降;经过EGCG处理后,肠炎小鼠的腹泻、便血情况得到了有效缓解。小鼠的结肠长度如图1C所示,经过测量发现正常对照组小鼠的结肠长度显著高于肠炎模型组小鼠的结肠长度(P<0.05),EGCG处理组小鼠的结肠长度则介于正常对照组和肠炎模型组的小鼠结肠长度之间。以上结果表明,EGCG能够有效改善DSS诱导结肠炎小鼠的不良反应。
2.2 EGCG对DSS诱导的结肠炎小鼠血清中炎症因子的影响
如图2所示,肠炎模型组小鼠血清中的炎症因子IL-1β、IL-6和TNF-α的含量显著高于正常对照组(P<0.05),说明DSS能够诱发小鼠全身性炎症。与肠炎模型组相比,EGCG处理组的IL-1β、IL-6和TNF-α的含量显著降低(P<0.05),其中IL-1β和IL-6的含量恢复到了近似正常对照组水平。以上结果表明,EGCG能够有效的缓解DSS诱导的结肠炎小鼠全身性炎症。
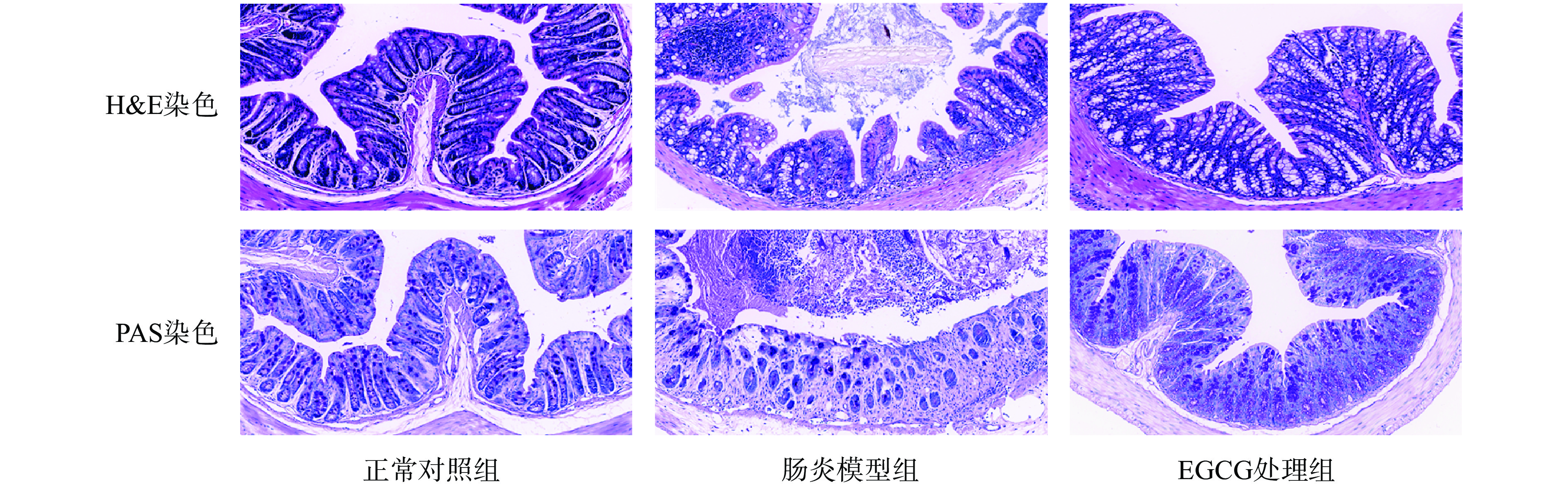
2.3 EGCG对DSS诱导的结肠炎小鼠结肠形态结构的影响
小鼠结肠H&E染色由图3显示,正常对照组小鼠结肠病理形态正常,绒毛排列整齐,未见明显炎症细胞浸润和损伤;肠炎模型组小鼠结肠表现为严重的急性结肠炎,肠道细胞排列紊乱,肌层变薄,绒毛断裂并且存在大量的炎性浸润,肠粘膜层有水肿,杯状细胞核浅表上皮消失;EGCG处理组病理形态较为完整,绒毛完整度高,炎症细胞浸润少。小鼠结肠PAS染色结果表明,与正常对照组相比,肠炎模型组小鼠结肠杯状细胞和黏蛋白明显减少且分布不均匀;经过EGCG处理后,结肠杯状细胞数量和黏蛋白分泌得到了恢复。因此,EGCG具有保护DSS诱导的肠炎小鼠的肠道结构和功能的完整性的作用。
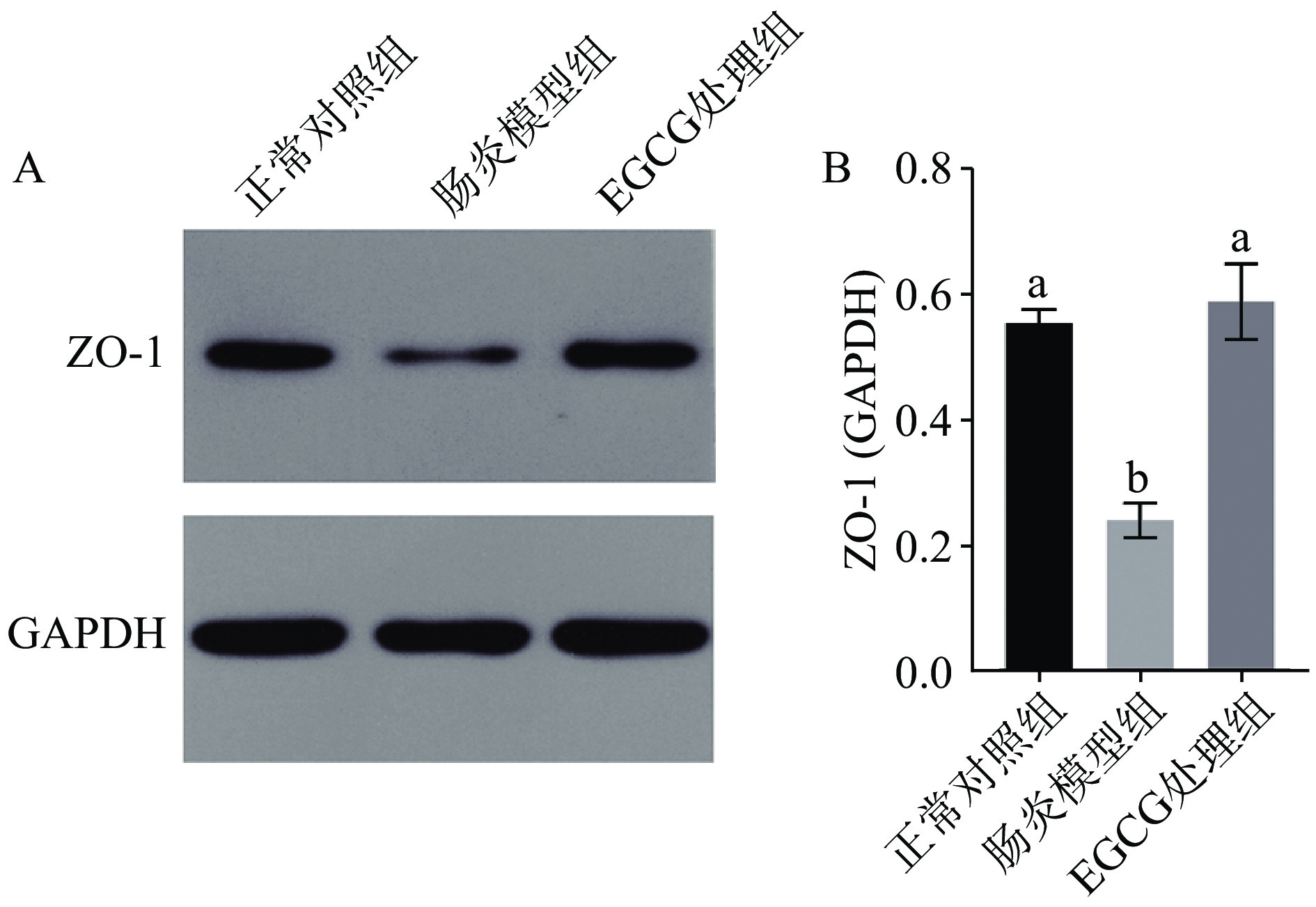
2.4 EGCG对DSS诱导的结肠炎小鼠肠道屏障的影响
如图4所示,肠炎模型组小鼠结肠中的ZO-1蛋白表达量显著低于正常对照组(P<0.05),这与小鼠结肠病理学分析结果一致。经过EGCG处理后,ZO-1的蛋白表达量显著提高(P<0.05),且与正常对照组为同一水平。以上结果说明,EGCG能有效缓解DSS诱导的肠炎小鼠肠道屏障损伤。
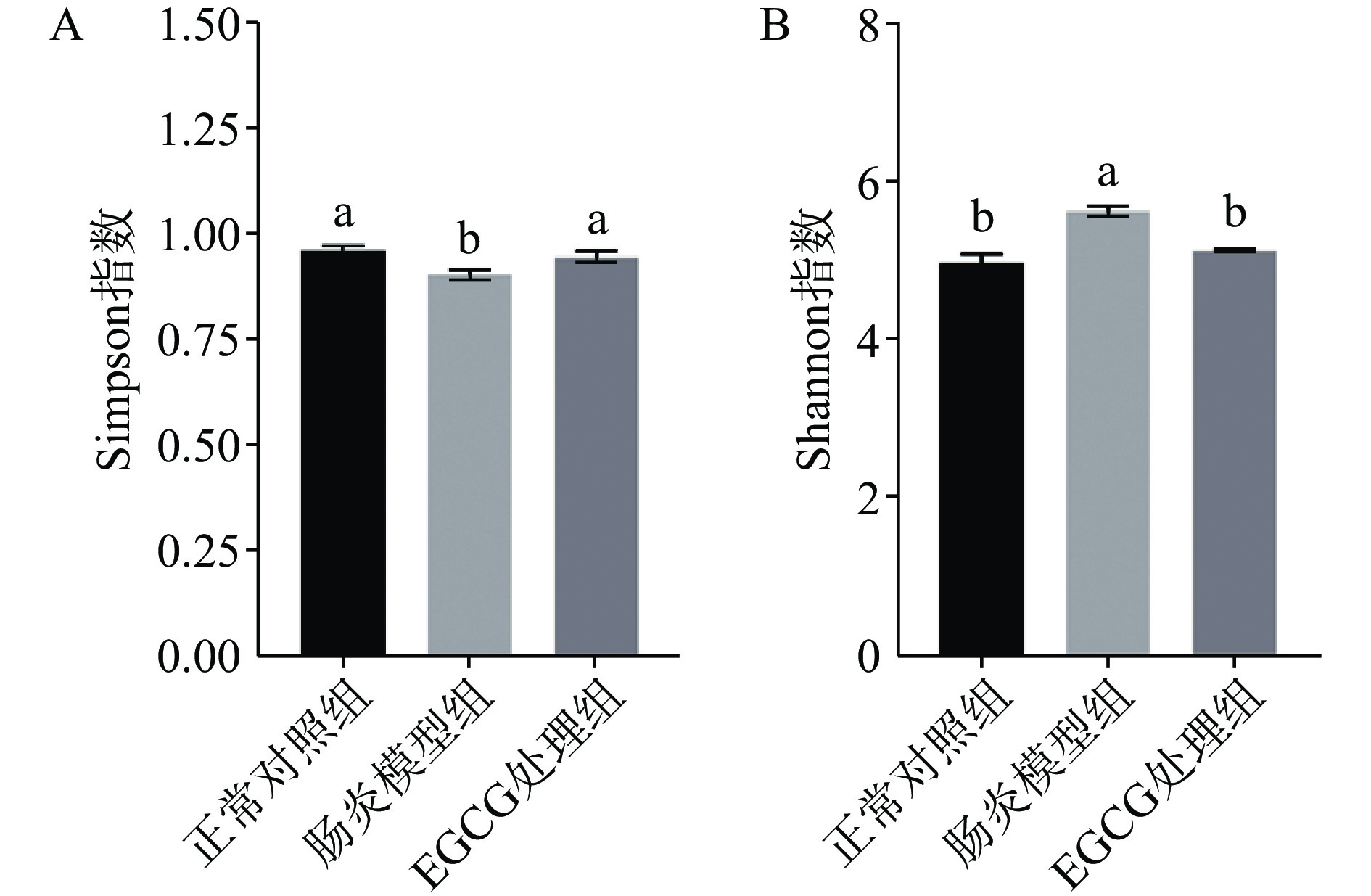
2.5 EGCG对DSS诱导的结肠炎小鼠肠道菌群多样性的影响
对不同组的小鼠粪便进行16S rRNA进行PCR扩增测序。结果如图5所示,与正常对照组相比,肠炎模型组的Simpson指数显著降低(P<0.05),Shannon指数显著升高(P<0.05);经过EGCG处理后,EGCG处理组的Simpson指数显著升高(P<0.05),Shannon指数显著降低(P<0.05)。以上结果表明,EGCG能够恢复DSS诱导肠炎小鼠肠道菌群多样性的降低。
2.6 EGCG对DSS诱导的结肠炎小鼠肠道菌群门水平的影响
如图6A所示,小鼠肠道菌群门水平的优势菌为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobiota)、弯曲杆菌(Campylobacterota)和变形菌门(Proteobacteria)。与正常对照组相比,肠炎模型组的厚壁菌门相对丰度显著升高(P<0.05),拟杆菌门的相对丰度显著降低(P<0.05);经过EGCG处理后,厚壁菌门相对丰度显著降低(P<0.05),拟杆菌门的相对丰度显著升高(P<0.05)。以上结果表明,EGCG能够恢复DSS诱导的肠炎小鼠菌群结构的破坏。
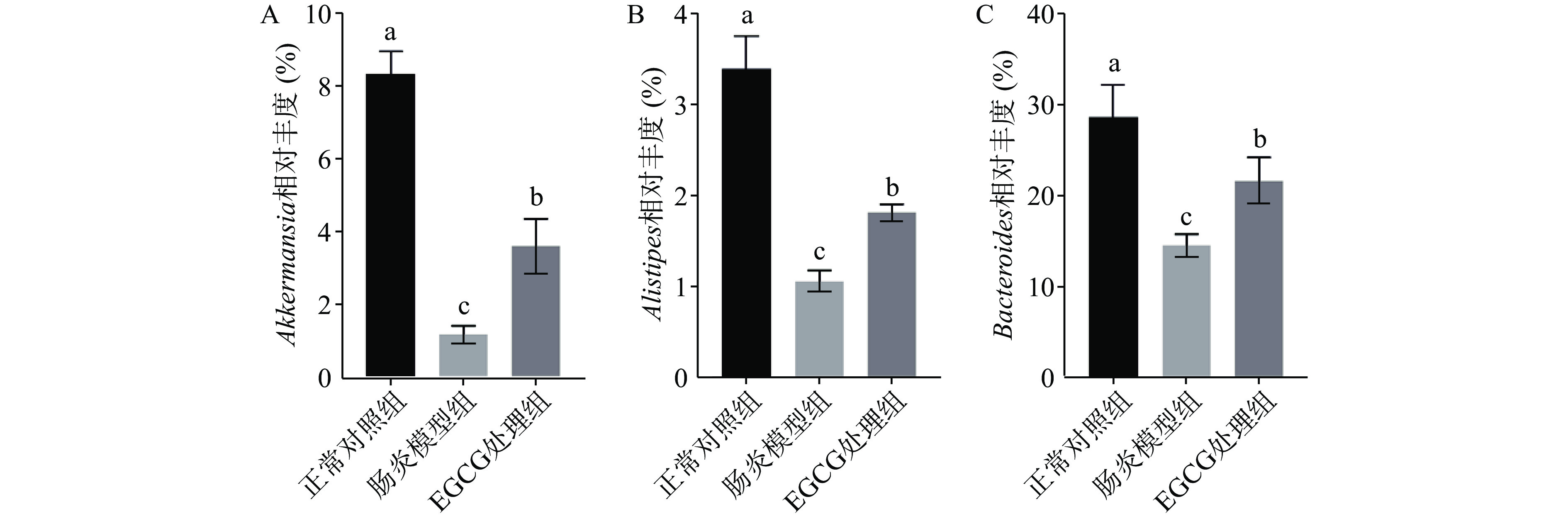
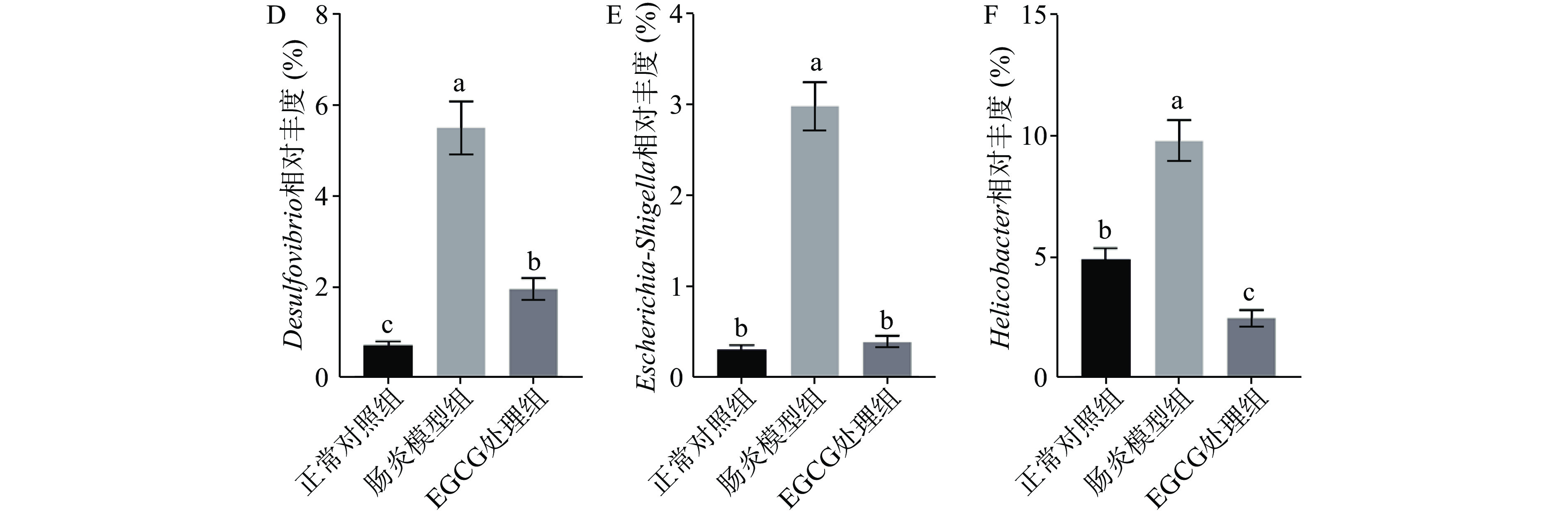
2.7 EGCG对DSS诱导的结肠炎小鼠肠道菌群属水平的影响
如图7所示,在属水平上,有6种与肠炎相关且具有代表性的肠道微生物分别为Akkermansia、Alistipes、Bacteroides、Desulfovibrio、Escherichia-Shigella和Helicobacter。DSS诱导小鼠肠炎后,肠道有益菌Akkermansia、Alistipes和Bacteroides的相对丰度显著降低(P<0.05),有害菌Desulfovibrio、Escherichia-Shigella和Helicobacter的相对丰度显著升高(P<0.05);经过EGCG处理后,Akkermansia、Alistipes和Bacteroides的相对丰度得到显著提高(P<0.05),Desulfovibrio、Escherichia-Shigella和Helicobacter显著降低(P<0.05)。以上结果说明,EGCG促进DSS诱导的肠炎小鼠肠道中有益菌Akkermansia、Alistipes和Bacteroides生长,抑制有害菌Desulfovibrio、Escherichia-Shigella和Helicobacter的增殖。
3. 讨论
IBD是一种发病机制复杂的肠道炎症性疾病,每年影响着全球数百万人。研究表明,DSS诱导老鼠结肠炎症的组织学特征、临床表现和发病部位与人类溃疡性结肠炎非常相似[23]。因此,DSS通常被研究人员广泛用于构建肠炎模型,其主要原理是利用DSS损伤肠道黏膜屏障,提高肠道通透性,导致外来抗原进入固有层,从而引发一系列的免疫和炎症反应,最终形成炎症性肠炎[24-25]。在本研究中,经过3%的DSS造模7 d后,肠炎模型组的小鼠出现了精神萎靡不振、严重的腹泻、便血和体质量下降,这与Park等[22]研究结果相似。通过EGCG处理后,肠炎模型小鼠的腹泻、便血、体质量下降等不良反应得到显著改善。此外,对小鼠结肠长度的测量结果表明EGCG缓解DSS诱导的结肠炎小鼠结肠缩短。
在DSS诱导结肠炎的过程中,肠道上皮细胞受损、肠道通透性增加导致炎性细胞因子失衡和免疫反应异常,从而引发全身性炎症。研究发现炎性细胞因子如IL-1β、IL-6和TNF-α在调节肠道天然免疫反应中起重要作用[24]。因此,调节血清中的炎细胞因子水平是治疗肠炎的一个重要靶点[26]。研究报道,相比于健康个体,结肠炎患者血清中的促炎因子过度表达,主要表现为IL-1β、IL-6和TNF-α水平异常升高[27]。本研究中的肠炎模型组小鼠IL-1β、IL-6和TNF-α的含量显著高于正常对照组,说明DSS诱导结肠炎的过程中,会引发了小鼠全身性炎症。在EGCG处理后,肠炎模型小鼠的IL-1β、IL-6和TNF-α的含量得到了降低,这表明EGCG能够降低促炎因子的表达和分泌,在结肠炎中发挥抗炎作用。赵悦伶等[17]也发现了EGCG能够抑制炎症因子分泌,减少肠道炎症引起的全身性炎症反应。
肠道屏障破损作为IBD的症状之一,在导致肠道炎症的同时,其更进一步导致了细菌移位和其他抗原进入,从而导致整个肠道微生态失衡[28]。肠上皮细胞如杯状细胞和潘氏细胞共同组成保护性粘液层,是肠道屏障功能的关键。研究发现肠道杯状细胞数量的减少和粘液产生缺陷与IBD的发生有关[28]。因此,维持肠道屏障的完整性和紧密性能够有效防止慢性肠道炎症的发生。ZO-1是肠道紧密中的一种主要的蛋白质,与肠道上皮完整性密切相关,可作为肠道屏障完整性的标志[29]。通过免疫印迹方法检测紧密连接蛋白ZO-1在结肠组织中的表达量发现,EGCG恢复DSS导致的小鼠结肠肠道屏障损伤。同时,从小鼠结肠组织病理学切片结果来看,结肠炎小鼠组的结肠病理损伤严重、肌层变薄、绒毛断裂、炎性浸润严重、粘膜层水肿、杯状细胞大量消失、黏蛋白分泌减少;EGCG处理后,杯状细胞和黏蛋白数量明显增多。以上结果进一步证明了,EGCG对DSS诱导的小鼠结肠炎改善作用也体现在对肠道完整性的保护上。
肠道菌群与宿主体内许多生理功能如免疫、营养和代谢和健康状况密切相关。当肠道菌群生态受到破坏时,会直接或者间接导致疾病的发生与发展。肠道菌群紊乱一直被认为是IBD发病的关键因素[30]。研究表明,在DSS诱导的结肠炎小鼠中,其肠道菌群的多样性和稳定性降低[24]。在本研究中,EGCG能够恢复DSS导致的小鼠肠道菌群多样性的降低。同时,EGCG还能够恢复DSS导致的结肠炎小鼠厚壁菌门的相对丰度的提高和拟杆菌门的相对丰度的降低。Peng等[24]在DSS诱导的结肠炎小鼠中也观察到这一现象。在属水平上,EGCG还提高了结肠炎小鼠体内有益菌Akkermansia、Alistipes和Bacteroides的相对丰度。Akkermansia是以肠道黏蛋白为唯一碳源和氮源生长的严格厌氧菌,定植于肠道的粘膜层,对维持肠道屏障功能具有重要作用[31]。在一项临床试验中,对46例IBD患者进行Akkermansia的丰度检测,结果表明IBD患者的Akkermansia丰度显著低于健康个体[32]。更有研究结果进一步发现,对结肠炎小鼠灌胃Akkermansia后小鼠结肠炎得到有效缓解[33]。此外,Akkermansia还是一种短链脂肪酸产生菌,其代谢产物(主要以乙酸和丙酸为主)能够降低肠道通透性来进行免疫调节[34]。Alistipes参与血清素前体色氨酸代谢和维持肠道免疫稳态,其代谢产物丁酸也被报道可促进肠道黏膜修复、维持肠道屏障完整性,抑制炎症因子的分泌[35-36]。此外,丁酸还可通过调控T细胞分化来改善小鼠结肠炎[37]。同时,口服Bacteroides也被报道能够改善肠道炎症[38]。本研究还发现结肠炎模型小鼠中富集肠道有害菌Desulfovibrio、Escherichia-Shigella和Helicobacter,这些菌能够产生脂多糖等内毒素来破坏肠道上皮细胞和损伤肠道屏障,从而促进了炎症的发生[39-40]。经过EGCG处理后,有害菌Desulfovibrio、Escherichia-Shigella和Helicobacter的生长得到有效抑制。
4. 结论
综上所述,EGCG能有效缓解全身慢性炎症、保护肠道屏障、调节肠道菌群紊乱、提高肠道菌群的多样性、降低厚壁菌门的相对丰度、提高拟杆菌门的相对丰度、促进有益菌Akkermansia、Alistipes和Bacteroides的增殖和抑制有害菌Desulfovibrio、Escherichia-Shigella和Helicobacter的生长,从而改善DSS诱导的小鼠结肠炎症状。这些发现为EGCG作为营养膳食补充剂治疗IBD和改善肠道功能提供参考与理论依据。此外,EGCG在多种病理生理过程中的抗炎作用,都提示其潜在的临床药物开发价值。
-
表 1 疾病活动指数评价标准
Table 1 Scoring criteria of disease activity index
大便黏稠度 大便出血 体质量下降百分率(%) 得分 正常 正常 不变 0 轻度软便 潜血弱阳性 1~5 1 严重软便 潜血阳性 6~10 2 轻度腹泻 潜血强阳性 11~15 3 严重腹泻 显性出血 >15 4 -
[1] XAVIER R J, PODOLSKY D K. Unravelling the pathogenesis of inflammatory bowel disease[J]. Nature,2007,448(7152):427−434. doi: 10.1038/nature06005
[2] GIUFFRIDA P, CORAZZA G R, DI SABATINO A. Old and new lymphocyte players in inflammatory bowel disease[J]. Digestive Diseases and Sciences,2018,63(2):277−288. doi: 10.1007/s10620-017-4892-4
[3] KAPLAN G G. The global burden of IBD: From 2015 to 2025[J]. Nature Reviews Gastroenterology & Hepatology,2015,12(12):720−727.
[4] DANESE S, FIOCCHI C, PANES J. Drug development in IBD: From novel target identification to early clinical trials[J]. Gut,2016,65(8):1233−1239. doi: 10.1136/gutjnl-2016-311717
[5] SINGH D, SRIVASTAVA S, PRADHAN M, et al. Inflammatory bowel disease: Pathogenesis, causative factors, issues, drug yreatment strategies, and delivery approaches[J]. Critical Reviews in Therapeutic Drug Carrier Systems,2015,32(3):181−214. doi: 10.1615/CritRevTherDrugCarrierSyst.2015011095
[6] KHALILI H, DE SILVA P S, ANANTHAKRISHNAN A N, et al. Dietary iron and heme iron consumption, genetic susceptibility, and risk of crohn's disease and ulcerative colitis[J]. Inflammatory Bowel Diseases,2017,23(7):1088−1095. doi: 10.1097/MIB.0000000000001161
[7] LIM J S, LIM M Y, CHOI Y, et al. Modeling environmental risk factors of autism in mice induces IBD-related gut microbial dysbiosis and hyperserotonemia[J]. Molecular Brain,2017,10:14. doi: 10.1186/s13041-017-0292-0
[8] LEE M, CHANG E B. Inflammatory bowel diseases (IBD) and the microbiome-searching the crime scene for clues[J]. Gastroenterology,2021,160(2):524−537. doi: 10.1053/j.gastro.2020.09.056
[9] BEHESHTI-MAAL A, SHAHROKH S, ANSARI S, et al. Gut mycobiome: The probable determinative role of fungi in IBD patients[J]. Mycoses,2021,64(5):468−476. doi: 10.1111/myc.13238
[10] D'ODORICO I, BELLA S D, MONTICELLI J, et al. Role of fecal microbiota transplantation in inflammatory bowel disease[J]. Journal of Digestive Diseases,2018,19(6):322−334. doi: 10.1111/1751-2980.12603
[11] LI M, WU Y, HU Y, et al. Initial gut microbiota structure affects sensitivity to DSS-induced colitis in a mouse model[J]. Science China-Life Sciences,2018,61(7):762−769. doi: 10.1007/s11427-017-9097-0
[12] SHI M, SHI Y L, LI X M, et al. Food-grade encapsulation systems for (-)-epigallocatechin gallate[J]. Molecules,2018,23(2):445. doi: 10.3390/molecules23020445
[13] GAN R Y, LI H B, SUI Z Q, et al. Absorption, metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate (EGCG): An updated review[J]. Critical Reviews in Food Science and Nutrition,2018,58(6):924−941. doi: 10.1080/10408398.2016.1231168
[14] NIE J Y, ZHAO Q. Beverage consumption and risk of ulcerative colitis systematic review and meta-analysis of epidemiological studies[J]. Medicine,2017,96(49):e9070. doi: 10.1097/MD.0000000000009070
[15] PIOVANI D, DANESE S, PEYRIN-BIROULET L, et al. Environmental risk factors for inflammatory bowel diseases: An umbrella review of meta-analyses[J]. Gastroenterology,2019,157(3):647−660. doi: 10.1053/j.gastro.2019.04.016
[16] DRYDEN G W, LAM A, BEATTY K, et al. A pilot study to evaluate the safety and efficacy of an oral dose of (-)-epigallocatechin-3-gallate-rich polyphenon e in patients with mild to moderate ulcerative colitis[J]. Inflammatory Bowel Diseases,2013,19(9):1904−1912.
[17] 赵悦伶, 丁健, 何佳, 等. 表没食子儿茶素没食子酸酯对葡聚糖硫酸钠诱导小鼠炎症性肠病的保护作用[J]. 浙江大学学报(农业与生命科学版),2019,45(5):626−634. [ZHAO Y, DING J, HE J, et al. Protective effect of epigallocatechin gallate on inflammatory bowel disease induced by sodium dextran sulfate in mice[J]. Journal of Zhejiang University (Agriculture and Life Sciences Edition),2019,45(5):626−634. doi: 10.3785/j.issn.1008-9209.2018.09.261 ZHAO Y, DING J, HE J, et al. Protective effect of epigallocatechin gallate on inflammatory bowel disease induced by sodium dextran sulfate in mice[J]. Journal of Zhejiang University (Agriculture and Life Sciences Edition), 2019, 45(5): 626-634. doi: 10.3785/j.issn.1008-9209.2018.09.261
[18] 曾鸿哲, 方雯雯, 周方, 等. 陈年武夷岩茶对DSS诱导小鼠结肠炎的缓解作用及肠道菌群的影响[J/OL]. 食品科学: 1−14. [2023-04-20]. http://kns.cnki.net/kcms/detail/11.2206.ts.20220613.1106.087.html ZENG H Z, FANG W W, ZHOU F, et al. Effect of aged wuyi rock tea on relieving DSS-induced colitis and gut microbiota in mice [J/OL].Food Science: 1−14. http://kns.cnki.net/kcms/detail/11.2206.ts.20220613.106.087.html
[19] WU Z, HUANG S, LI T, et al. Gut microbiota from green tea polyphenol-dosed mice improves intestinal epithelial homeostasis and ameliorates experimental colitis[J]. Microbiome, 2021, 9(1): 184.
[20] LI Q, CUI Y, XU B, et al. Main active components of jiawei gegen qinlian decoction protects against ulcerative colitis under different dietary environments in a gut microbiota-dependent manner[J]. Pharmacological Research,2021,170:105694. doi: 10.1016/j.phrs.2021.105694
[21] ZHOU F, ZHU M Z, TANG J Y, et al. Six types of tea extracts attenuated high-fat diet-induced metabolic syndrome via modulating gut microbiota in rats[J]. Food Research International,2022,161:111788. doi: 10.1016/j.foodres.2022.111788
[22] PARK Y H, KIM N, SHIM Y K, et al. Adequate dextran sodium sulfate-induced colitis model in mice and effective outcome measurement method[J]. Journal of Cancer Prevention,2015,20(4):260−267. doi: 10.15430/JCP.2015.20.4.260
[23] CHASSAING B, AITKEN J D, MALLESHAPPA M, et al. Dextran sulfate sodium (DSS)-induced colitis in mice[J]. Current Protocols in Immunology,2014,104:15.25.11−15.25.14.
[24] PENG Y, YAN Y, WAN P, et al. Gut microbiota modulation and anti-inflammatory properties of anthocyanins from the fruits of Lycium ruthenicum Murray in dextran sodium sulfate-induced colitis in mice[J]. Free Radical Biology and Medicine,2019,136:96−108. doi: 10.1016/j.freeradbiomed.2019.04.005
[25] WU H, RAO Q, MA G C, et al. Effect of triptolide on dextran sodium sulfate-induced ulcerative colitis and gut microbiota in mice[J]. Frontiers in Pharmacology,2020,10:1652. doi: 10.3389/fphar.2019.01652
[26] BIASI F, ASTEGIANO M, MAINA M, et al. Polyphenol supplementation as a complementary medicinal approach to treating inflammatory bowel disease[J]. Current Medicinal Chemistry,2011,18(31):4851−4865. doi: 10.2174/092986711797535263
[27] SZCZEKLIK K, OWCZAREK D, PYTKO-POLONCZYK J, et al. Proinflammatory cytokines in the saliva of patients with active and nonactive Crohn's disease[J]. Polskie Archiwum Medycyny Wewnetrznej-Polish Archives of Internal Medicine,2012,122(5):200−207. doi: 10.20452/pamw.1256
[28] BHAT A A, UPPADA S, ACHKAR I W, et al. Tight junction proteins and signaling pathways in cancer and inflammation: A functional crosstalk[J]. Frontiers in Physiology,2019,9:1942. doi: 10.3389/fphys.2018.01942
[29] GERSEMANN M, BECKER S, KUEBLER I, et al. Differences in goblet cell differentiation between Crohn's disease and ulcerative colitis[J]. Differentiation,2009,77(1):84−94. doi: 10.1016/j.diff.2008.09.008
[30] ZHOU F, LI Y L, ZHANG X, et al. Polyphenols from fu brick tea reduce obesity via modulation of gut microbiota and gut microbiota-related intestinal oxidative stress and barrier function[J]. Journal of Agricultural and Food Chemistry,2021,69(48):14530−14543. doi: 10.1021/acs.jafc.1c04553
[31] JIN S, ZHAO D, CAI C, et al. Low-dose penicillin exposure in early life decreases Th17 and the susceptibility to DSS colitis in mice through gut microbiota modification[J]. Scientific Reports,2017,7(1):43662. doi: 10.1038/srep43662
[32] NAITO Y, UCHIYAMA K, TAKAGI T. A next-generation beneficial microbe: Akkermansia muciniphila[J]. Journal of Clinical Biochemistry and Nutrition,2018,63(1):33−35. doi: 10.3164/jcbn.18-57
[33] LIU S, ZHAO W, LAN P, et al. The microbiome in inflammatory bowel diseases: From pathogenesis to therapy[J]. Protein & Cell,2021,12(5):331−345.
[34] QIAN K, CHEN S, WANG J, et al. A beta-N-acetylhexosaminidase Amuc_2109 from Akkermansia muciniphila protects against dextran sulfate sodium-induced colitis in mice by enhancing intestinal barrier and modulating gut microbiota[J]. Food & Function,2022,13(4):2216−2227.
[35] PARKER B J, WEARSCH P A, VELOO A C M, et al. The genus alistipes: Gut bacteria with emerging implications to inflammation, cancer, and mental health[J]. Frontiers in Immunology,2020,11:906. doi: 10.3389/fimmu.2020.00906
[36] PITUCH A, WALKOWIAK J, BANASZKIEWICZ A. Butyric acid in functional constipation[J]. Przeglad Gastroenterologiczny,2013,8(5):295−298.
[37] CZAJKOWSKA A, SZPONAR B. Short chain fatty acids (SCFA), the products of gut bacteria metabolism and their role in the host[J]. Postepy Higieny I Medycyny Doswiadczalnej,2018,72:131−142. doi: 10.5604/01.3001.0011.6468
[38] ZENG S L, LI S Z, XIAO P T, et al. Citrus polymethoxyflavones attenuate metabolic syndrome by regulating gut microbiome and amino acid metabolism[J]. Science Advances,2020,6(1):6208. doi: 10.1126/sciadv.aax6208
[39] SIMPSON C A, DIAZ-ARTECHE C, ELIBY D, et al. The gut microbiota in anxiety and depression-A systematic review[J]. Clinical Psychology Review,2021,83:101943−101943. doi: 10.1016/j.cpr.2020.101943
[40] WANG F, MENG W, WANG B, et al. Helicobacter pylori-induced gastric inflammation and gastric cancer[J]. Cancer Letters,2014,345(2):196−202. doi: 10.1016/j.canlet.2013.08.016





 下载:
下载:


 下载:
下载:
