Quality Analysis of Key Nodes of Natural Drying Chilis in Xinjiang Region
-
摘要: 目的:新疆是全国主要的干制辣椒生产与出口基地之一,其干制过程主要采用自然干制方法,然而由于过度依赖经验且缺乏科学的理论指导,干制成品易出现破碎、发霉等问题,因此亟需对辣椒自然干制过程品质变化进行系统分析,规范干制辣椒生产技术流程。方法:针对新疆地区量大面广的红龙系列羊角椒(红龙18、红龙23),选取了其自然干制过程中三个关键节点:平铺(干制起点)、拢小堆、拢大堆(干制终点),跟踪了四个不同干制批次,监测辣椒的品质变化,包括水分含量、水分活度、籽肉比、糖含量、总酚含量、抗氧化能力、色价、质构、发霉率、微生物组成等指标。结果:辣椒干制终点水分含量低于13%,干制过程中辣椒的糖含量、总酚含量、抗氧化能力会显著性降低(P<0.05),辣椒色价显著性升高(P<0.05),干制终点辣椒的色价为29左右。辣椒品种、采收时间、干制时长均会影响干制辣椒成品的品质。发霉辣椒中真菌以曲霉属和根霉属为主。结论:干制起点的辣椒水分含量是影响辣椒干制过程品质变化的最关键因素,建议采用“挂果晾晒”、延迟干制起点的时间来降低初始水分含量,提高干制效率、提升品质、降低发霉率。本研究将为“新疆辣椒自然干制技术规程”的制定提供理论依据。Abstract: Objective: Xinjiang is one of the main producers and exporters of dried chilies in China. Dried chilies in Xinjiang are mainly dried by natural drying methods, however, relying too much on experience and lacking scientific theoretical guidance, the dried products are prone to problems such as breakage and mold. Therefore, it is urgent to monitor the quality changes in the drying process of chilies and to standardize the technical process of dried chili production. Methods: The Honglong series of rambutan peppers (Honglong 18 and Honglong 23), grown on a large scale in Xinjiang, were selected. Three key points in the natural drying process have been selected: Flattening (starting point of drying), gathering of small piles and gathering of large piles (end point of drying). The study followed four batches and monitored changes in the quality of chilies, including moisture content, water activity, seed to flesh ratio, sugar content, total phenolic content, antioxidant capacity, color value, texture, moldiness and microbiological composition. Results: The moisture content of the chilies at the end of drying was below 13%. The drying process significantly reduced the sugar content, total phenolic content and antioxidant capacity of the chilies (P<0.05) and significantly increased the color value of the chilies (P<0.05), eventually reaching around 29. The variety of chilies, the time of harvest and the length of drying would all affect the quality of the finished product. The dominant fungi in moldy chilies were Aspergillus and Rhizoctonia spp. Conclusion: The moisture content of chilies at the beginning of drying was the key factor affecting the quality of chilies during drying. It was recommended to use "hanging and drying" to reduce the initial moisture content, improve the drying efficiency, enhance the quality and reduce the mold rate. This study would provide a theoretical basis for the development of the "Natural Drying Technology for Chilies in Xinjiang".
-
Keywords:
- Xinjiang chili /
- natural drying /
- key point /
- quality /
- microorganisms /
- fungus
-
辣椒(Capsicum annuum L.)也称秦椒或海椒,是茄科辣椒属的一种一年或有限多年生草本植物[1],具有独特的辣味[2]和较高的营养价值[3],富含多酚、维生素C、类胡萝卜素、辣椒碱等活性成分[4]。辣椒原产于墨西哥[5],在明朝末代时,经由丝绸之路与海上两条渠道传入我国;在清朝道光年间,我国已实现辣椒大面积的种植与食用[6]。据联合国粮食及农业组织(FAO)的统计数据显示,目前我国辣椒种植面积达81.4万公顷,占世界辣椒总种植面积的40.7%;产量为1960万吨,占据世界辣椒总产量的49.9%,是全世界辣椒种植面积和产量最高的国家,且均呈现逐年增长态势[7]。目前我国辣椒加工制品种类繁多,主要可以划分出非发酵加工产品、发酵加工产品和辣椒提取物及制品三大类,包括辣椒干、辣椒粉、辣椒油、辣椒酱等。辣椒在国内的农业市场中占据了重要地位[8],辣椒产业在我国蔬菜产业中位居第一[9]。新疆是全国重要的辣椒生产与出口基地之一,在新疆地区辣椒产业仅次于番茄的第二大红色产业。
目前我国采用的辣椒干制方法主要分为自然干制和人工干制两种,自然干制是利用太阳的照射,在露天的场地中直接晾晒鲜辣椒原料进行干制的过程[10],包括晾晒干制与自然风干,方法简便,使用广泛,但是会受天气因素的限制[11]且食品安全保障低;人工干制则是由人工控制条件使果蔬干燥,不受天气限制,干燥时间较快[12],但需要一定的干制设备,制作技术复杂,成本费用较高。新兴非热干制技术也利于更好地保持辣椒的品质[13]。新疆地域广阔,由于目前辣椒贮藏保鲜技术相对落后且运输成本高,部分地区鲜辣椒难以及时被运输到加工地再进行干制,故人工干制方法在新疆尚未得到广泛应用。但新疆具有日照充足、气候干燥的自然环境优势,目前新疆仍主要采取传统的自然干制方法进行辣椒自然干制。
传统自然干制过程受天气因素影响较大,工人们仅靠经验判断干制终点,存在以下问题:干制时间短,干制不充分,辣椒水分含量过高,易发生霉变;延长干制时间,增加了时间与人工成本,导致辣椒水分含量过低,在打包与运输过程中易破碎。整个干制过程缺乏统一标准与理论指导,亟需对干制过程中辣椒的品质变化进行监测。本研究选取南疆地区主栽红龙系列羊角椒品种(红龙18和红龙23),对实际干制过程中关键节点辣椒的水分含量、水分活度、籽肉比、糖含量、总酚含量、抗氧化能力、色价、质构等品质指标进行测定,筛选不同的发霉辣椒样本,对其微生物组进行分析及鉴定,从而为新疆辣椒的自然干制提供理论依据,为进一步提升新疆干制辣椒的品质奠定基础。
1. 材料与方法
1.1 材料与仪器
干制辣椒原料 由新疆隆平高科红安种业有限责任公司与青岛柏兰集团有限公司提供,品种为红龙系列羊角椒(红龙18和红龙23)。
DHG-9053A电热恒温鼓风干制箱 上海精宏实验设备有限公司;FBS-3A水分活度测试仪 深圳弗布斯仪器有限公司;HH.S1-Ni电热恒温水浴锅 北京长安科学仪器厂;2000D 型超纯水器 北京长风仪器仪表公司;BSA 224S-CW分析天平 德国Sartorius公司;CF-RX低温高速离心机 日本日立公司;UV-1800紫外分光光度计 日本岛津公司;Waters e2695高效液相色谱仪 美国Waters公司;Innoval NH2糖柱 美国安捷伦科技有限公司;FTC TMS-PRO质构仪 美国FTC公司。
1.2 实验方法
1.2.1 样品采集
本研究共选取红龙系列羊角椒两个品种,其中红龙23为红龙18的优化升级品种。相对红龙18而言,红龙23丰产性好,耐病毒病、耐疫病、抗逆性强抗病能力均更高,种植面积更广。采样年份为2021年,采样地点为新疆巴音郭楞蒙古自治州的戈壁滩地区,所采集辣椒均在新疆本地完成种植、采收及干制。依据当地工人经验,新疆地区辣椒自然干制全过程主要分为六个步骤,采收、平铺晾晒、拢小堆、拢大堆、软化和打包,其中采收分为机械采收与人工采收。平铺晾晒是自然干制的起点,要求辣椒分散均匀、厚度一致并在一定时间间隔内进行翻动,平铺厚度在0.2 m左右,这一过程实现了辣椒的大面积晾晒,快速降低辣椒水分,经平铺晾晒后的辣椒手感较脆。随后拢小堆,将辣椒拢成小堆,堆高0.4 m左右,这一过程会加快风干速度,并将平铺过程位于底部的辣椒翻到上部,实现辣椒的均匀干制,这一节点辣椒已基本达到干制要求。随后拢大堆,这一步为自然干制的终点,拢堆堆高1 m左右。若买家需要对辣椒进行长途运输,则需增加软化步骤,最后将干制完成的辣椒打包并运输。结合调研及实际干制过程,本研究设定平铺晾晒、拢小堆、拢大堆三个阶段的起始点为自然干制过程的关键节点,分别命名为节点A、节点B和节点C。表1为自然干制监测的不同批次辣椒及其关键节点情况。其中批次一为成熟后立即采收干制的辣椒,由于场地限制,后三批次均经过了不同时长的挂果晾晒过程。
1.2.2 原料处理
分离辣椒籽和肉,分别粉碎,所得样品存于−20 ℃冰箱中,用于后续试验分析使用。
1.2.3 水分含量
参照GB 5009.3-2016[14]:称取一定量样品,于105 ℃烘箱干燥,至样品恒重时(前后两次误差小于0.002 g),根据公式计算水分含量。
x(%)=m2−m0m1−m0×100 式中:x表示样品中水分含量,g/100 g;m0表示容器质量,g;m1表示烘干前质量,g;m2表示烘干后质量,g。
1.2.4 水分活度
在辣椒堆随机采样,单次采样数量大于30根,使用水分活度仪分别测定辣椒肉和辣椒籽的水分活度。
1.2.5 籽肉比
随机选取辣椒样本10根,进行籽、肉分离,分别称重。根据公式计算籽肉比为籽总重/肉总重。
x(%)=M1M2 式中:x表示样品籽肉比,g/g;M1表示辣椒籽总重,g;M2表示辣椒肉总重,g。
1.2.6 糖含量的测定与计算
辣椒中的糖含量测定方法参照GB 5009.8-2016的第一法[15]。其中辣椒籽中脂肪含量高于10%[16],需预先使用石油醚进行除脂。辣椒肉和除脂辣椒籽经提取、0.45 μm膜过滤后使用高效液相色谱仪进行测定。选择糖柱色谱柱、RI示差检测器,使用80%的乙腈溶液作为流动相等度洗脱,流速为0.5 mL/min,柱温与流通池温度设定为40 ℃。测定样品前首先使用流动相对示差检测器的流通池与色谱柱进行清除操作。标准曲线:分别使用果糖、葡萄糖、蔗糖标准品,配制浓度为0.25、0.5、1.0、2.0、4.0 mg/mL的标准溶液,经0.45 μm膜过滤后,使用高效液相色谱仪测定,绘制标准曲线,得果糖、葡萄糖、蔗糖线性方程分别为Y=−34256.21X+226765.17,R2=0.999;Y=−43228.54X+339218.28,R2=0.999;Y=−61300.83X+249236.02,R2=0.999。
1.2.7 总酚含量测定
采用Folin-ciocalteu法,并略作修改[17]。取5 g辣椒肉或辣椒籽样品,加入15 mL甲醇溶液,混匀后放入超声清洗机室温超声30 min,在4 ℃下10000 r/min离心10 min,取上清液。向沉淀中再次加入15 mL甲醇,重复上述操作。两次提取获得的上清液混合即为总酚提取液。按照1:9的体积比(v/v)将Folin-ciocalteu试剂与超纯水混匀,取1 mL总酚粗提液,用甲醇溶液稀释4倍后,取0.4 mL稀释液与2 mL的福林酚稀释液混合,再加入1.8 mL的Na2CO3(7.5%)溶液,室温下反应30 min,使用紫外分光光度计测定765 nm处吸光值。结果用每克辣椒肉/籽所含没食子酸的当量来表示,单位为mg GAE/g。准确称取没食子酸50 mg,用超纯水溶解为10、20、40、60、80、100 μg/mL的没食子酸标准溶液。取不同浓度没食子酸标准溶液各0.4 mL,按上述相同操作与福林酚稀释液反应,并测定吸光值。绘制的没食子酸标准曲线,得线性方程为Y=0.03438X+0.00818,R2=0.999。
1.2.8 抗氧化能力的测定
1.2.8.1 DPPH测定
取5 g辣椒肉或辣椒籽,加入15 mL甲醇溶液,混匀后放入超声清洗机室温超声30 min,在4 ℃下10000 r/min离心10 min,取上清液,并于沉淀中再次加入15 mL甲醇,重复上述操作。两次提取获得的上清液混合即为待测样品溶液。
参照Brand-Williams等的方法[18],并略作修改。准确称取0.1000 g DPPH粉末,用甲醇溶解后,定容至100 mL棕色容量瓶中,得到DPPH浓缩液。吸取14 mL浓缩液于棕色容量瓶中,继续用甲醇定容至250 mL,制得0.14 mmol/L的DPPH工作液。将200 μL样品溶液与4 mL DPPH工作液混匀,避光静置30 min,以甲醇在同等条件下进行反应作为对照,测定517 nm处吸光度,结果用每克辣椒肉/籽所含Trolox的当量表示,单位为mg Trolox/g。配制0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 mmol/L的Trolox标准溶液,按上述相同操作各取200 μL Trolox标准液与DPPH工作液反应,测定溶液在517 nm处的吸光值。绘制Trolox标准曲线,得线性方程为Y=1.58234X−1.51094,R2=0.999。
1.2.8.2 铁离子抗氧化能力(Ferric ion reducing antioxidant power,FRAP)测定
按照10:1:1的体积比,将醋酸缓冲液(pH3.6)、10 mmol/L的TPTZ溶液、20 mmol/L的FeCl3溶液混合,得到TPTZ工作液。在4 mL TPTZ工作液中加入100 μL样品溶液,于37 ℃水浴中反应10 min,测定593 nm处吸光度。配制0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 mmol/L的Trolox标准溶液,按上述相同操作各取100 μL Trolox标准液与TPTZ工作液反应,测定溶液在593 nm处的吸光值。绘制Trolox标准曲线,得线性方程为Y=0.18891X+1.33198,R2=0.999。
1.2.9 色价测定
参考GB 1886.34-2015中的分光光度计法并略做修改[19]。取0.4 g辣椒样品在锥形瓶中,加入60 mL丙酮后超声提取20 min,再加入40 mL丙酮后摇匀,待辣椒粉沉淀后吸取5 mL定容至50 mL,使用紫外分光光度计于460 nm处测定溶液吸光值。色价表示单位质量原料的提取液在1%浓度,以1 cm比色皿在其最大吸收峰处的吸光度。
E1%1 cm460 nm=A×fm×100 式中:A表示溶液吸光值;f表示稀释倍数;m表示样品质量,g。
1.2.10 质构测定
质构仪设置为剪切模式,剪切探头。参数设定为测试前速度60 mm/min,测试速度10 mm/min,起始力0.1 N,回升高度40~45 min,压缩变形60%。
1.2.11 辣椒发霉率与破损率
为研究机采和手采对辣椒发霉破损的影响,在第三批次与第四批次辣椒的晾晒场地,采用五点取样法确定采样位置,随机采集数量不等的五批辣椒,计算破损率与发霉率。
P(%)=N1N2×100 式中:P表示破损率;N1表示破损辣椒的个数;N2表示所取辣椒的总数。
F(%)=N1N2×100 式中:F表示发霉率;N1表示发霉辣椒的个数;N2表示所取辣椒的总数。
1.2.12 Misqe测序
采集样品后送至美吉公司测定。
1.2.12.1 DNA的提取和扩增
基因组DNA抽提,而后利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。按指定测序区域,合成带有barcode的特异引物。每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱。
1.2.12.2 荧光定量
参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
1.2.12.3 Miseq文库构建
通过PCR将Illumina官方接头序列添加至目标区域外端;使用凝胶回收试剂盒切胶回收PCR产物;Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测;氢氧化钠变性,产生单链DNA片段。
1.2.12.4 Miseq测序
DNA片段的一端与引物碱基互补,固定在芯片上;以DNA片段为模板,芯片上固定的碱基序列为引物进行PCR合成,在芯片上合成目标待测DNA片段;变性、退火后,芯片上DNA片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥(bridge)”;PCR扩增,产生DNA簇;DNA扩增子线性化成为单链。加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3'端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.2.13 真菌培养与检测
配制沙氏琼脂培养基(SDA),用于霉菌的平板划线分离。称取65.0 g培养基粉末,溶于1 L超纯水中,121 ℃高压灭菌15 min,倒入90 mm无菌培养皿,待凝固。用一次性无菌涂布棒挑取发霉辣椒的菌丝,在SDA培养基上进行三次划线,平板倒扣后放入37 ℃培养基培养72 h。配制铃薯液体培养基(含氯霉素),用于霉菌的培养和富集。称取26 g培养基粉末,溶于1 L超纯水中,121 ℃高压灭菌15 min,分装至15 mL无菌离心管,备用。用一次性无菌涂布棒挑取菌体菌丝接种于铃薯液体培养基(含氯霉素),37 ℃摇床72 h,待菌体生长富集。使用植物基因组DNA提取试剂盒进行霉菌基因组DNA的提取。真菌测序与分析:对提取的DNA进行TIS扩增和测序,该步骤交由北京睿博兴科生物技术有限公司进行。将测序结果上传至NCBI进行Blast比对。
1.3 数据处理
使用WPS Office Excel记录和处理数据;使用Origin 2021软件进行数据统计分析与作图;使用IBM SPSS Statistics 25进行差异性分析,显著性水平α=0.05。全部实验过程进行三重复三平行操作,测定结果均以干基含量表示。
2. 结果与分析
2.1 关键节点辣椒水分含量与水分活度变化
表2为不同批次辣椒在关键节点的水分含量与水分活度测定结果。如表2所示,辣椒肉和籽中的水含量和水分活度在干制过程中呈下降趋势。在四个批次中,批次一辣椒的A节点含水量(65.09%)和水分活度(0.90)最高,其干制所需时间也最长。结合表1可知,不同批次干制耗时的差距主要体现在节点A到节点B之间,节点B是干制过程的重要节点。分析发现批次一在B节点辣椒的水分含量最低为9.06%,推测与批次一辣椒的平铺阶段时间最长相关,从而导致干制效率的降低。而批次二辣椒在B节点水分含量异常升高,结合环境监测情况发现监测当日发生降雨,环境湿度达到90%,温度达到干制过程中最低点,辣椒受潮导致水分含量升高。综合来看,在B节点辣椒的平均水分含量约为20%,而在C节点辣椒的平均水分含量低于13%,这一结论与团队前期研究结论“拢小堆时辣椒水分含量低于30%,拢大堆时水分含量低于16%”相吻合[20]。
表 2 不同干制批次辣椒在关键节点的水分含量和水分活度变化Table 2. Changes in moisture content and water activity of different dried batches of chilis at critical points干制批次 干制节点 籽肉比(g/g) 辣椒肉 辣椒籽 水分含量(%) 水分活度Aw 水分含量(%) 水分活度Aw 一 A 0.18±0.08 65.09±6.69 0.90±0.02 43.40±2.29 0.84±0.01 B 0.31±0.03 9.06±1.88 0.44±0.09 8.59±3.42 0.43±0.06 C 0.32±0.03 6.83±0.70 0.32±0.01 6.28±0.20 0.33±0.01 二 A 0.33±0.04 28.71±2.77 0.72±0.02 21.06±2.77 0.70±0.08 B 0.38±0.04 37.76±14.24 0.78±0.06 26.95±4.43 0.79±0.04 C 0.44±0.06 13.40±3.15 0.51±0.06 10.45±2.06 0.63±0.09 三 A 0.23±0.03 45.98±14.85 0.88±0.07 27.26±6.46 0.87±0.03 B 0.32±0.02 20.33±8.62 0.63±0.17 14.60±3.19 0.73±0.09 C 0.34±0.01 13.61±2.57 0.55±0.07 10.80±0.98 0.55±0.03 四 A 0.28±0.03 37.22±7.05 0.71±0.03 18.67±4.53 0.72±0.02 B 0.28±0.02 18.04±4.20 0.42±0.04 11.40±0.36 0.56±0.06 C 0.30±0.04 9.48±0.54 0.39±0.02 8.08±0.26 0.39±0.03 2.2 不同干制批次关键节点辣椒品质变化
2.2.1 糖含量
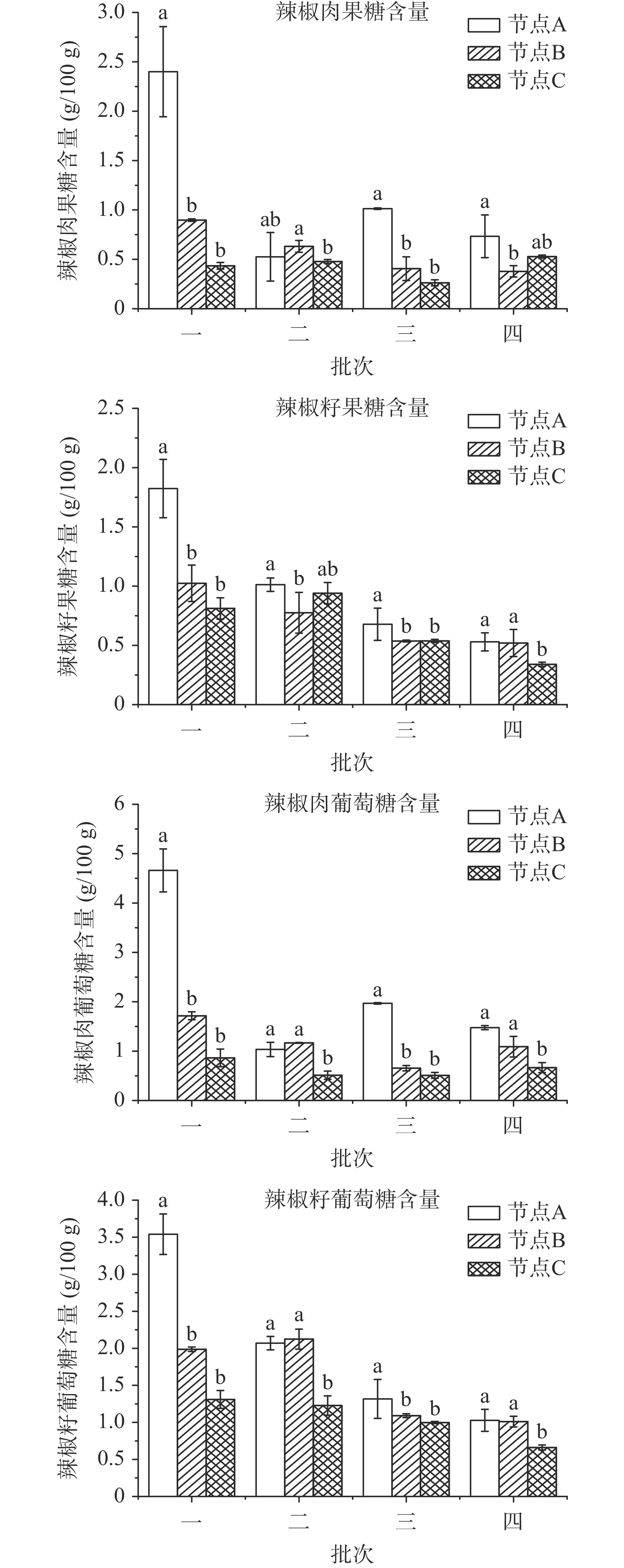
图1为不同干制批次辣椒肉与辣椒籽的还原糖含量变化。如图可见,辣椒的干制起点与终点之间,即节点A与节点C之间,大部分批次的还原糖含量显著性降低(P<0.05),这主要与干制过程中辣椒发生呼吸作用[21-22]有关,这两种作用都会消耗辣椒中的还原糖。其中,批次一辣椒在节点A的还原糖含量最高,辣椒肉和籽的果糖含量分别为2.40和1.82 g/100 g,葡萄糖含量分别为4.66和3.54 g/100 g,与其在节点C的还原糖含量差异最大,这主要是由于批次一采收时间最早且干制时间最长。相比批次一,其他批次辣椒采收时间晚,在干制起点还原糖含量也低,主要是由于辣椒成熟后未及时采摘,随着挂果时间延长,辣椒中的糖分被消耗。可见干制时间和采收时间都会影响辣椒干制过程中还原糖变化。整体而言,辣椒中葡萄糖含量高于果糖含量。在干制起点辣椒处于较新鲜状态时,还原糖含量为7 g/100 g左右,与刘宇鹏等[23]监测的11个贵州地方辣椒品种还原糖含量平均为8.14 g/100 g较接近。干制终点的辣椒果糖及葡萄糖含量均低于2 g/100 g,这一结果远低于王兴波等[24]测得的9个品种干辣椒的还原糖含量结果,可能是由于所选辣椒品种不同,新疆红龙系列辣椒是羊角椒,而王兴波等人选取的是朝天椒、线椒和角椒。
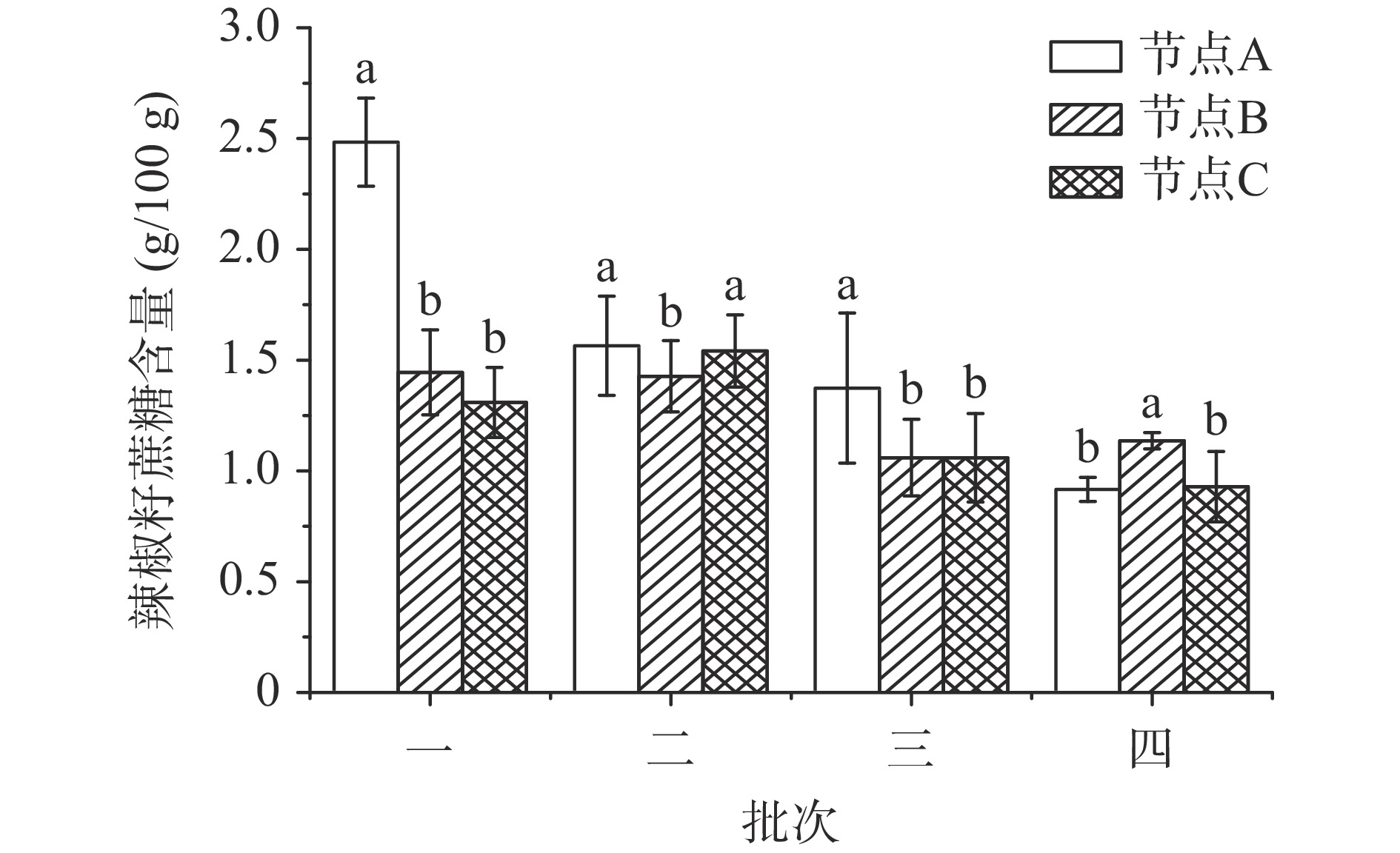
图2为不同干制批次辣椒籽中的蔗糖含量变化,辣椒肉中蔗糖含量未达到检出限(<0.2 g/100 g),推测是由于辣椒肉中存在大量蔗糖转化酶,使得蔗糖被分解为还原糖[25]。如图2可见,不同批次辣椒籽的蔗糖含量存在显著性差异(P<0.05),其中批次一在节点A的辣椒籽蔗糖含量最高为2.48 g/100 g,批次四在节点A的辣椒籽蔗糖含量最低为0.92 g/100 g,可见辣椒籽的蔗糖含量随着采收时间的延后而逐渐降低。辣椒籽在不同关键节点间的蔗糖含量变化无特定规律,主要由于初始水分含量不同,批次一的节点A和C之间存在显著性差异(P<0.05),而批次四的节点A和C之间无显著性差异(P>0.05),初始蔗糖含量较低时,干制对其含量变化影响不大。总体而言,辣椒籽的总糖含量范围在1.93~7.85 g/100 g之间,这与薛琰文等[26]测得的11种干制辣椒籽总糖含量范围在3.34~5.73 g/100 g间结果相近。
2.2.2 总酚含量
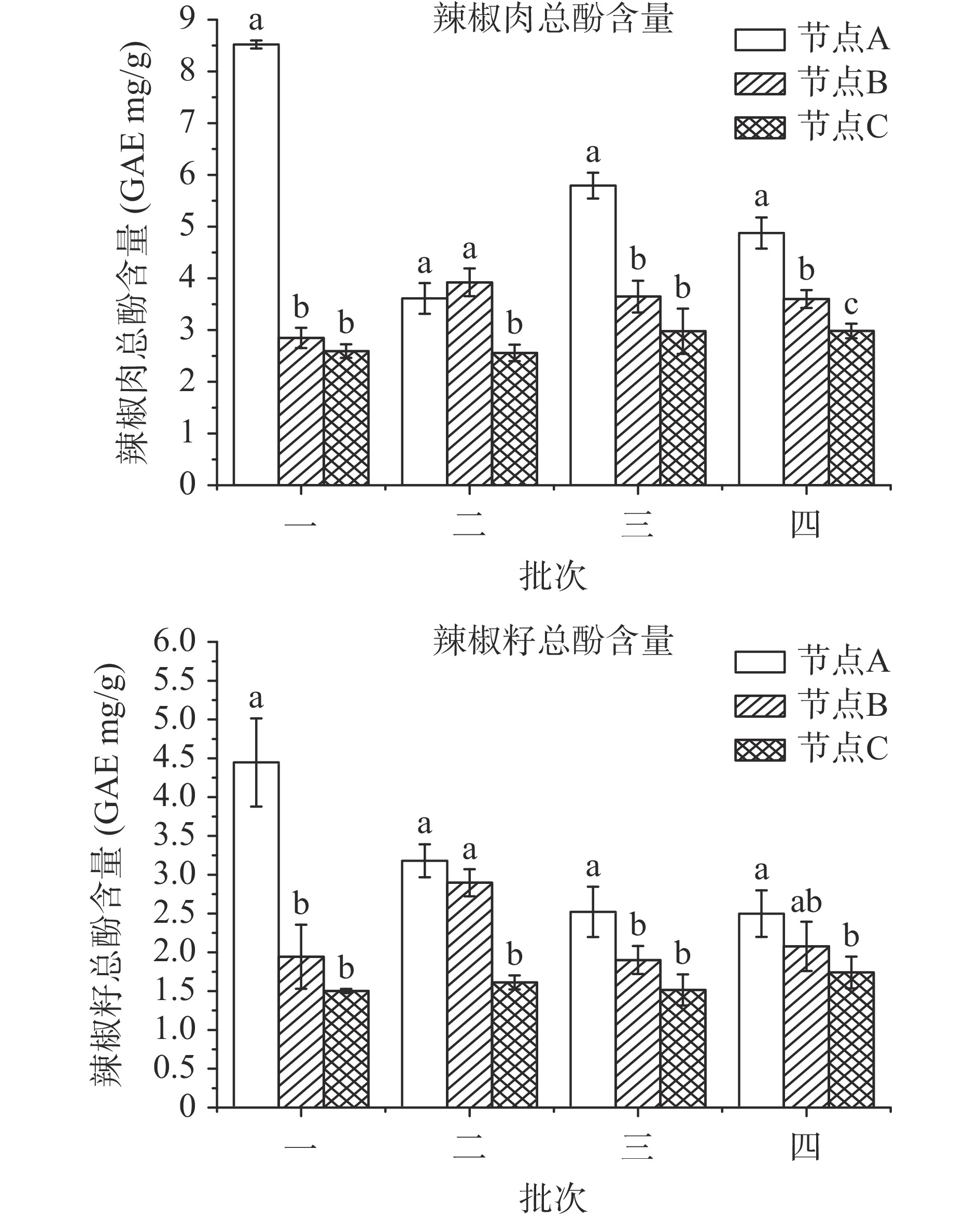
图3为不同干制批次辣椒中的总酚含量变化。干制过程中,四个批次辣椒的总酚含量均随干制时间延长而显著降低,说明干制过程会不断氧化、消耗辣椒籽中的酚类物质。其中批次一辣椒在节点A总酚含量最高,辣椒肉与辣椒籽的含量分别为8.52与4.45 GAE mg/g,与曹珍珍等[27]测得新鲜辣椒中的多酚含量7.01 GAE mg/g结果相近。高于Gurnani等[28]测定风干辣椒的7.95~26.15 GAE mg/g范围。辣椒中的总酚含量受温度影响较大,经热风自然干制生产的红辣椒中的总酚含量和抗氧化活性均会随着干燥温度的升高而成比例地降低[13],在批次二的节点B因降雨导致温度下降,使得总多酚含量被更好地保留住了。
2.2.3 抗氧化能力
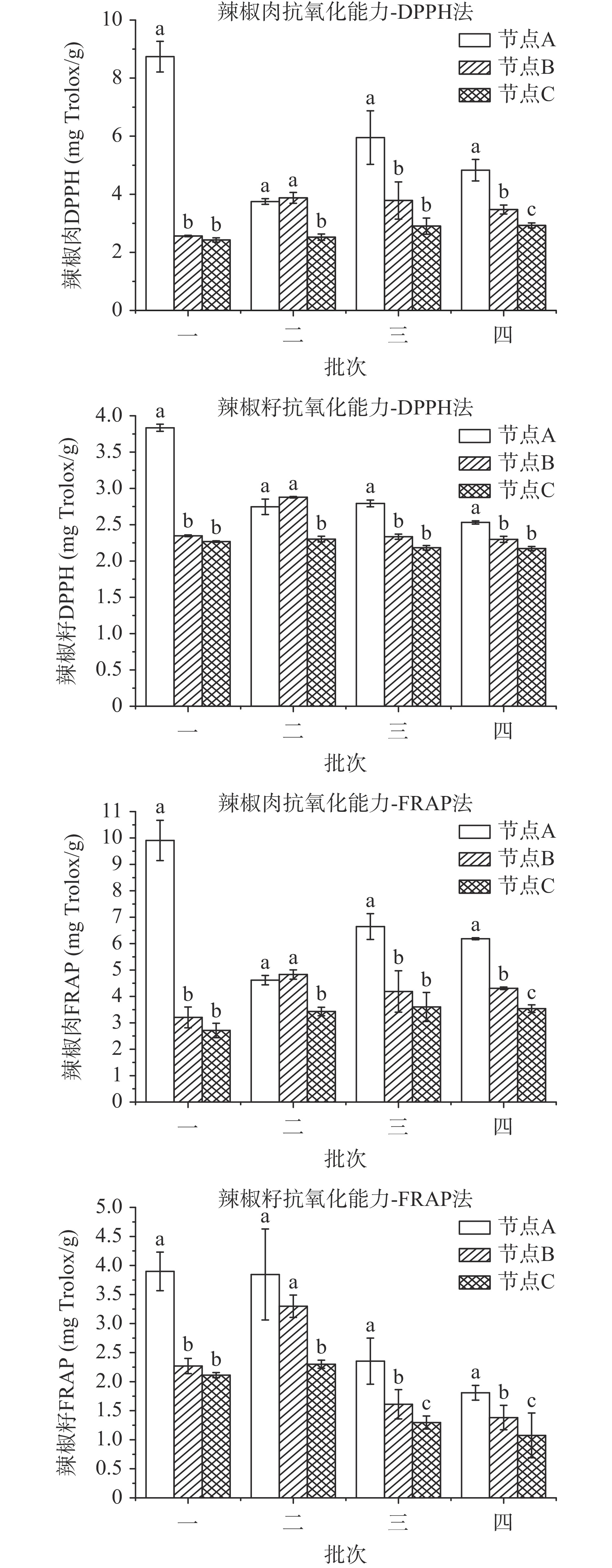
通过DPPH法和FRAP法测得的不同干制批次辣椒中的抗氧化能力变化如图4所示。所有干制批次的辣椒在节点A与节点C之间均存在显著性差异(P<0.05),且两种方法均测得辣椒抗氧化能力随干制过程逐渐降低。这一趋势与辣椒中总酚含量变化相符,可见辣椒中总酚含量与抗氧化能力呈正相关性,这一结果与Azieana等[29]研究香菇中总酚含量与抗氧化关系所得结论相同。经拟合发现二者不呈线性正相关,可能是由于辣椒中影响抗氧化能力的物质除酚类物质外,还有维生素C、花色苷等生物活性物质[30-31]。James等[32]研究发现辣椒经光照干燥会显著降低其维生素C的含量。批次一的辣椒在节点A抗氧化能力最强,其辣椒肉和辣椒籽抗氧化能力分别约为9.33和3.87 mg Trolox/g。批次一的辣椒肉在节点C抗氧化能力最弱,综合两种测试方法结果约为2.57 mg Trolox/g。曹珍珍[33]应用DPPH法测得新鲜辣椒的抗氧化能力为15.96 mg Trolox/g,晒干的辣椒抗氧化能力约为4.63 mg Trolox/g,均高于本实验的测定结果,可能与其使用的辣椒为小米辣而非羊角椒所致。
综上所述,采收时间与干制时长是影响辣椒品质的关键因素,采收时间越早的辣椒其糖含量、总酚含量、抗氧化能力均越高;干制时间越长的辣椒其糖含量、总酚含量、抗氧化能力降低越多。
2.2.4 色价
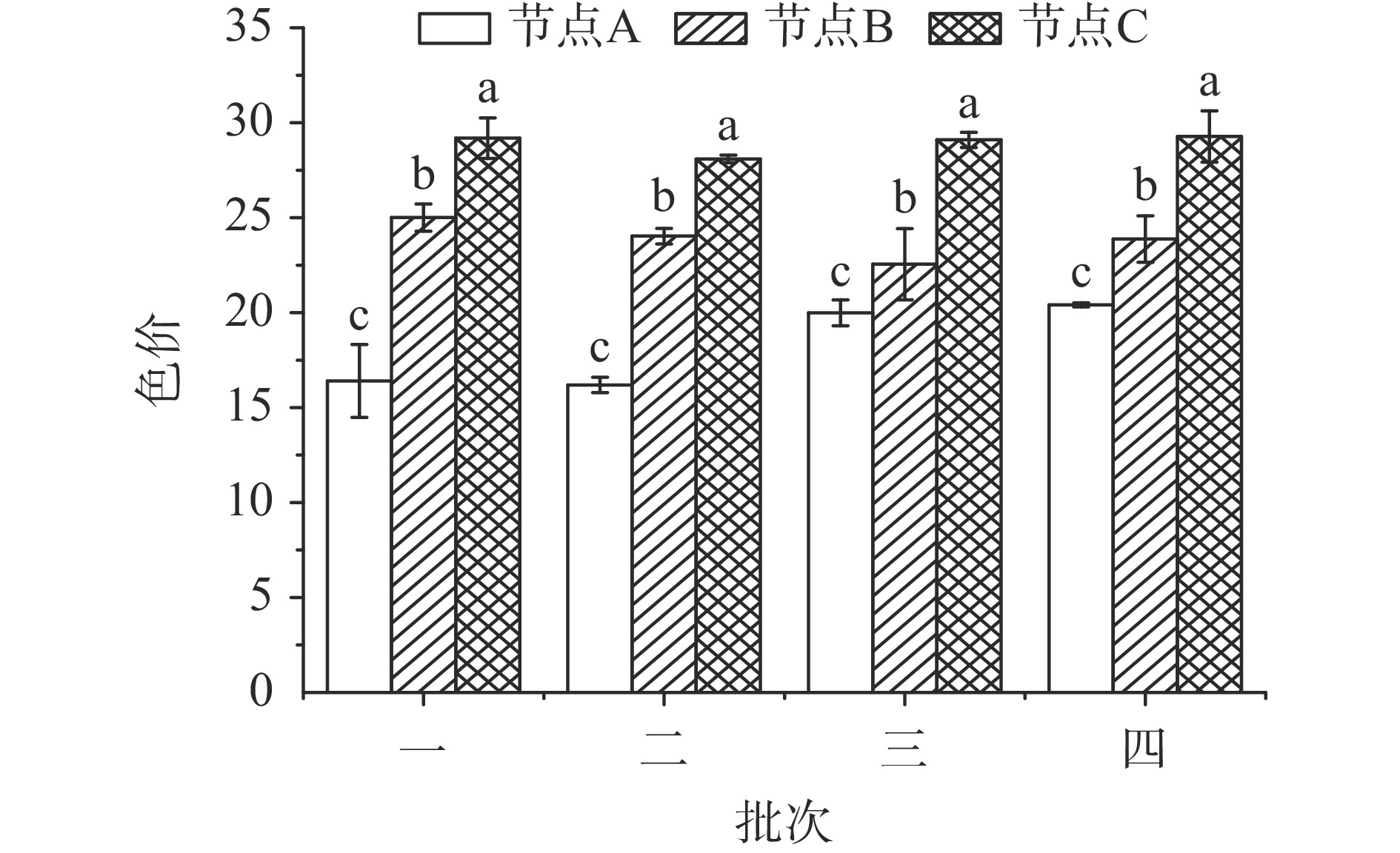
图5是不同干制批次辣椒在关键节点的色价变化。如图5可知,辣椒的色价随干制时间延长而升高,同一批次辣椒在不同节点间的色价具有显著差异(P<0.05),表现为辣椒颜色逐渐加深,主要原因是水分含量降低致色素的浓缩,另外也受到氧化褐变、酶促褐变等过程的影响[34]。这一结果与Andrade等[35]的实验结果相符,辣椒的色价随着干燥过程延长而增加,在干燥过程中辣椒的饱和度不断增强。位于干制过程终点(即节点C)的辣椒显示出了类似的色价,约为29。位于干制过程起点(即节点A)的辣椒色价则差异较大,其中批次一和二起始相对较低,批次三和四则起始相对较高,这主要是由于批次三和四较前两批次采收时间晚一个月,意味着挂果晾晒时长延长,这一过程使得辣椒的初始水分含量降低,从而加深了辣椒的颜色。
2.2.5 辣椒微生物分析
2.2.5.1 辣椒破损与发霉情况
表3为干制批次三和四辣椒在关键节点的破损率与发霉率统计结果。采摘方式是影响辣椒发霉及破损的一大关键原因,为探究其影响,研究选择品种相同而仅采摘方式有异的第三批次和第四批次辣椒,分别为人工采摘(手采)与机械采摘(机采)。结果表明,相对机采平均破损率达到74.17%,手采辣椒的破损程度更低,为24.89%。结合批次四辣椒的干制时长明显低于批次三,推测辣椒的破损会加快干制进程。另外,两批次辣椒的发霉率与破损率呈负相关,与常见的破损率高更易导致发霉情况相悖,结合两个批次的初始水分含量考虑,可能是由于批次四干制初始的水分含量较低,故破损率高也不易发霉。
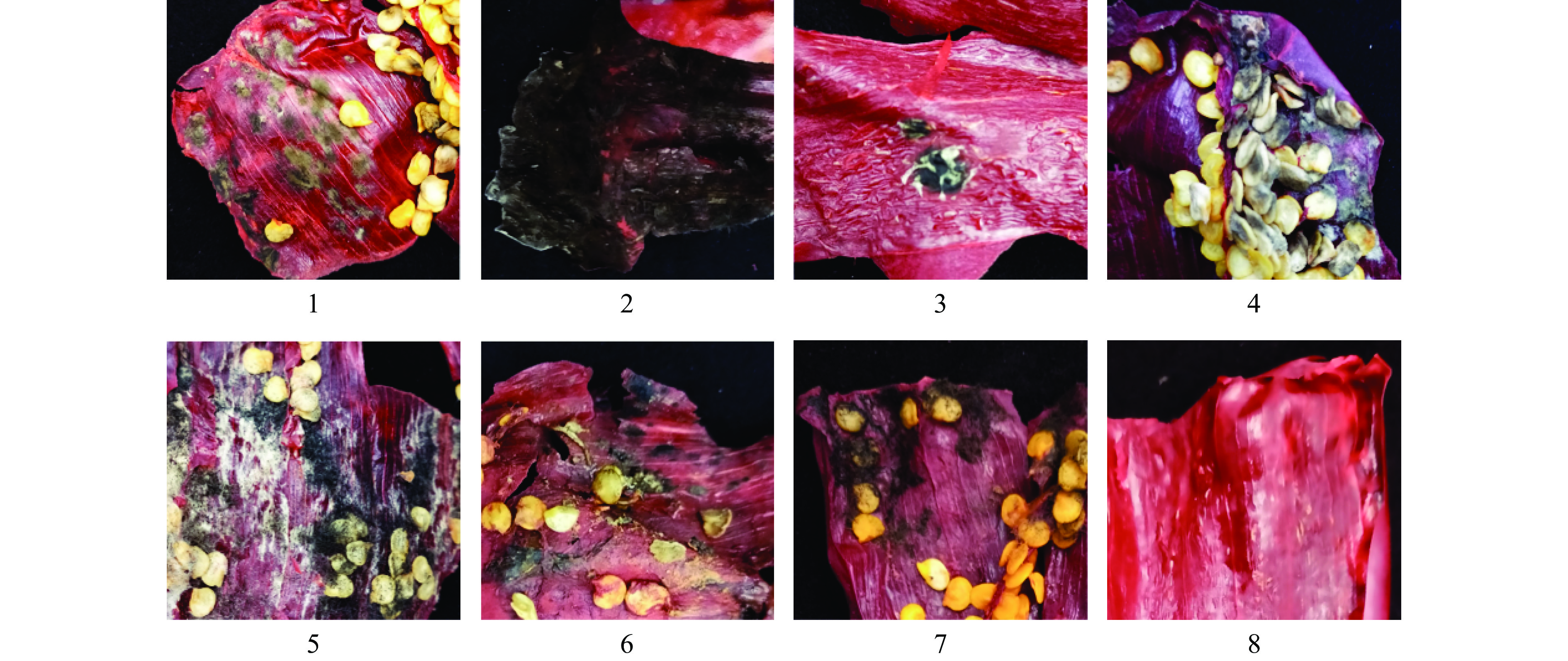
表 3 辣椒破损率与发霉率统计Table 3. Chili breakage rate and mold rate statistics干制批次 采样点 未破损数量 破损数量 破损率(%) 平均破损率(%) 未发霉数量 发霉数量 发霉率(%) 平均发霉率(%) 三 1 99 35 26.12 24.89 119 15 11.19 7.36 2 110 41 27.15 145 6 3.97 3 93 33 26.61 112 12 9.68 4 105 27 20.45 124 8 6.06 5 129 41 24.12 160 10 5.88 四 1 117 186 61.39 74.17 156 12 7.14 5.32 2 84 366 81.33 160 4 2.44 3 78 271 77.65 145 10 6.45 4 102 384 79.01 148 14 8.64 5 150 376 71.48 153 3 1.92 辣椒的发霉会有白色、棕色、黑色等不同的表现,这与辣椒品种、采收方式、采收时间、干制时长等因素都密切相关。为进一步探究致辣椒发霉的具体菌种,本研究对发霉样本进行了取样检测。批次一与批次三仅采收时间不同,批次二为非优势品种,因此主要选取批次三和批次四作为典型代表采样。表4为不同发霉辣椒样本的外观情况描述,图6为不同发霉辣椒样本的外观图片。
表 4 不同发霉辣椒样本的外观情况描述Table 4. Description of the appearance of different moldy chili samples编号 批次来源 辣椒品种 采收方式 发霉情况 1 三 红龙23 手采 棕色霉斑 2 三 红龙23 手采 大面积黑色菌丝,伴有轻微白色霉斑 3 三 红龙23 手采 黑色霉,伴有白色霉菌 4 三 红龙23 手采 黑色菌丝 5 四 红龙23 机采 表皮颜色变浅,伴有棕色、黑色、
白色菌丝6 四 红龙23 机采 表皮暗黄色,有黑色霉斑 7 二 红龙18 手采 黑色菌丝 8 四 红龙23 机采 对照,外观完好样品 2.2.5.2 辣椒细菌群落分析
为进一步研究发霉辣椒的微生物群落组成,试验检测了不同发霉样本在不同分类水平上的细菌结构构成。图7所示为辣椒在门水平的细菌群落结构。可见大部分辣椒样本中细菌以变形菌门(Proteobacteria)为主,参杂了少量的厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。在未发霉正常辣椒样本中,也几乎只存在变形菌门。这一结果与Liu等[36]对传统发酵蔬菜中的细菌群落组成的研究结果一致。事实上由于变形菌门是细菌中最大的一门,在绝大多数的辣椒样本中变形菌门的丰度都会超过50%。样本7与其他样本则不同,其厚壁菌门丰度最大,可能是辣椒品种导致了样本的群落构成差异。
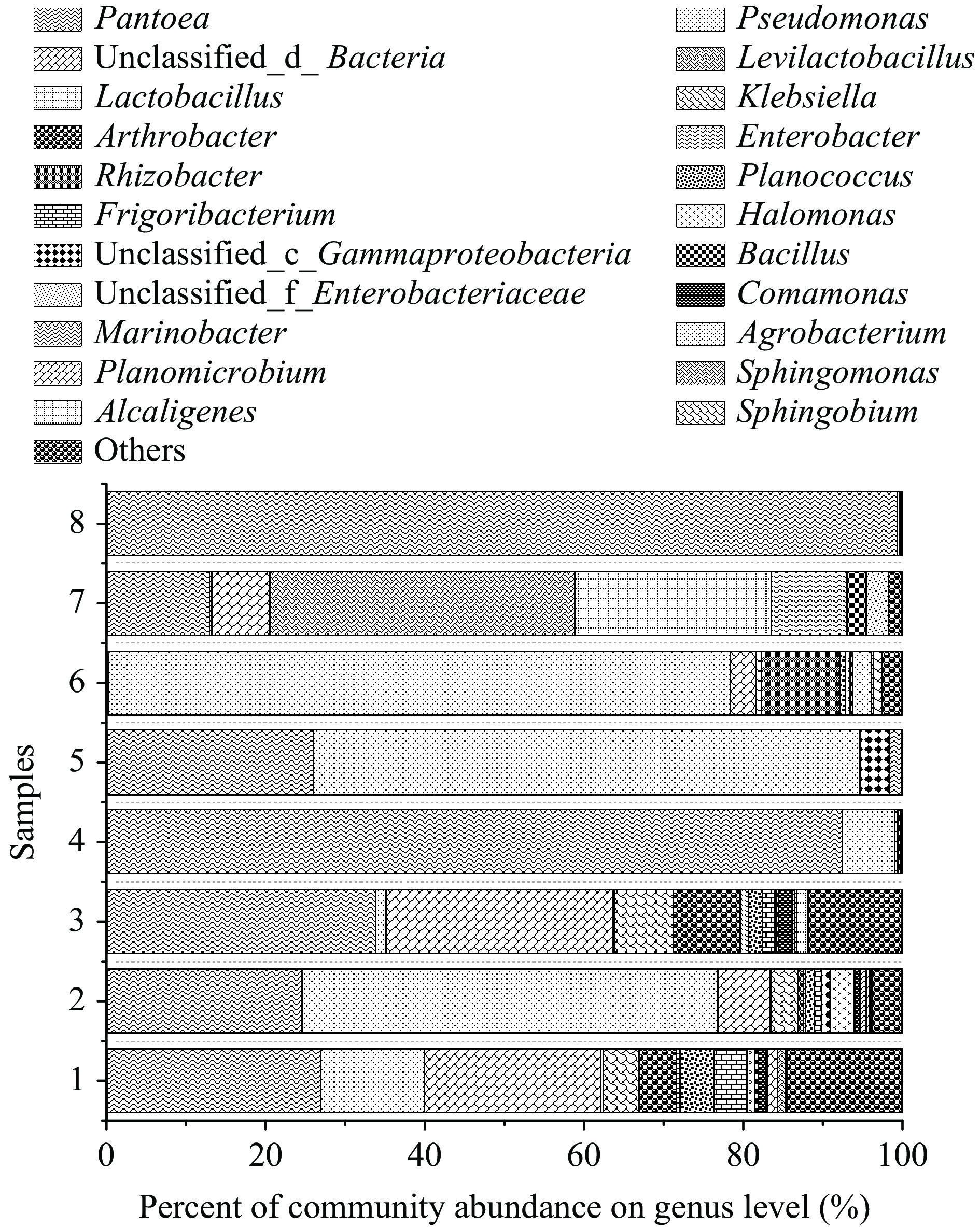
图8为不同发霉辣椒样本的属水平细菌群落组成。对比完全未发霉的样本8与其他样本发现,发霉辣椒的细菌群落组成更复杂,且样本间差异大。红龙23的发霉样本中细菌属水平均以泛菌属(Pantoea)和假单胞菌属(Pseudomonas)为主,其中泛菌属丰度最高。泛菌属具有发酵功能,可以促进辣椒的自然发酵过程,广泛存在于植物、发酵大酱和白酒中[37]。红龙18的样本中乳杆菌属(Levilactobacillus)和乳酸菌属(Lactobacillus)丰度较高。除上述提及菌属外,克雷伯氏菌(Klebsiella)、节杆菌属(Arthrobacter)、肠杆菌属(Enterobacter)、根瘤杆菌属(Rhizobacter)、动性球菌属(Planococcus)、鞘氨醇单胞菌属(Sphingomonas)、盐单胞菌属(Halomonas)、芽孢杆菌(Bacillus)、农杆菌(Agrobacterium)等均有检出。其中假单胞菌、鞘氨醇单胞菌、芽孢杆菌等微生物对辣椒疫霉菌会产生生物防治效果,可以提高辣椒植株的耐疫病性[38]。
2.2.5.3 辣椒真菌群落组成分析
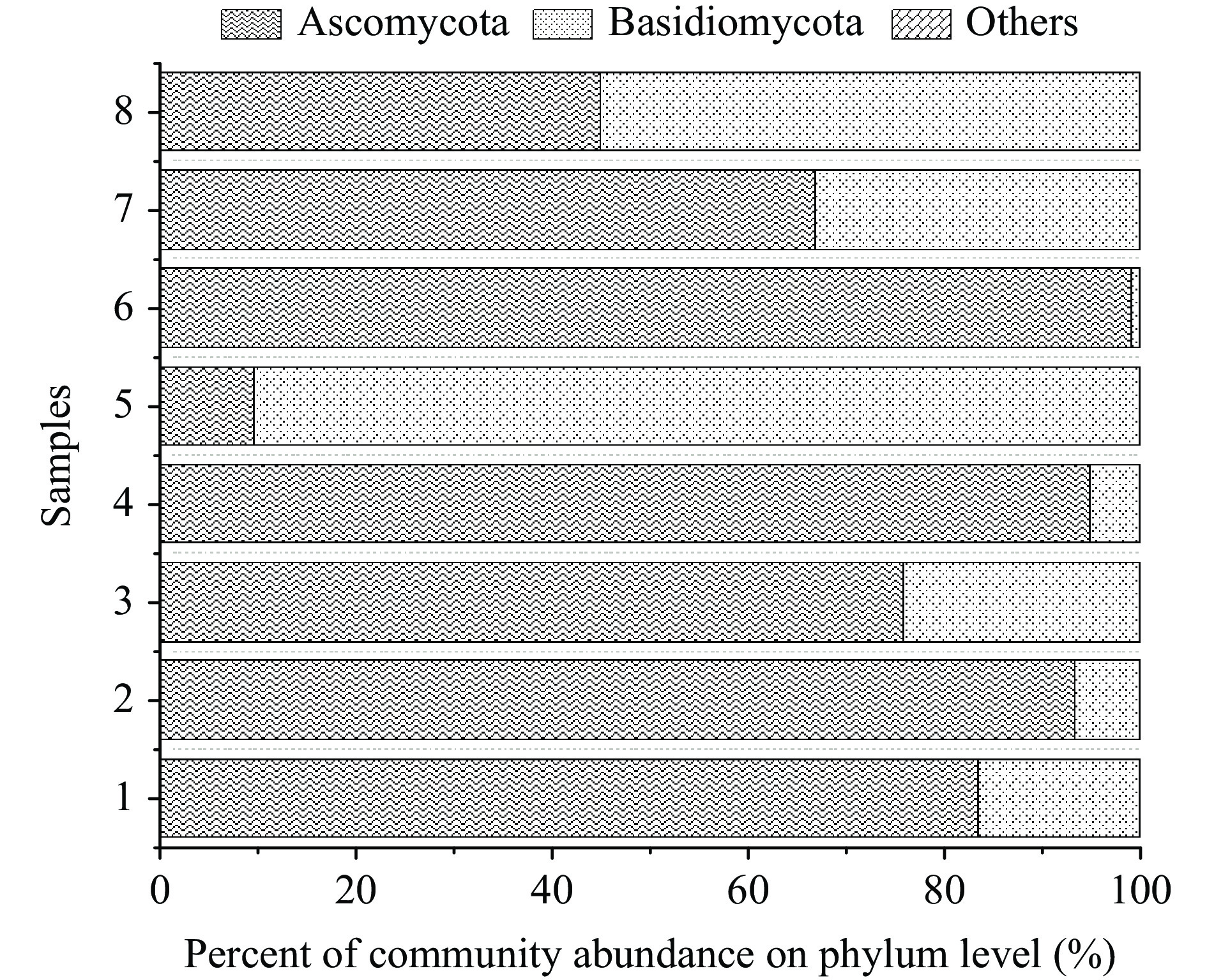
图9为不同辣椒样本的门水平真菌群落组成。辣椒样本中的真菌只有子囊菌门(Ascomycota)和担子菌门(Basidiomycota)两类。不同于未发霉辣椒两菌门丰度相似,发霉辣椒中明显子囊菌门丰度更高。子囊菌门属于腐生型的真菌,可以导致植物或食品发生霉烂。担子菌门则是真菌中最高等的一门,广泛分布于自然界中,有些种类可以与植物共生形成菌根,有利于作物的栽培,也有些种类担子菌会引起植物的病害,其在辣椒样本中的影响还需进一步解析真菌的属水平。
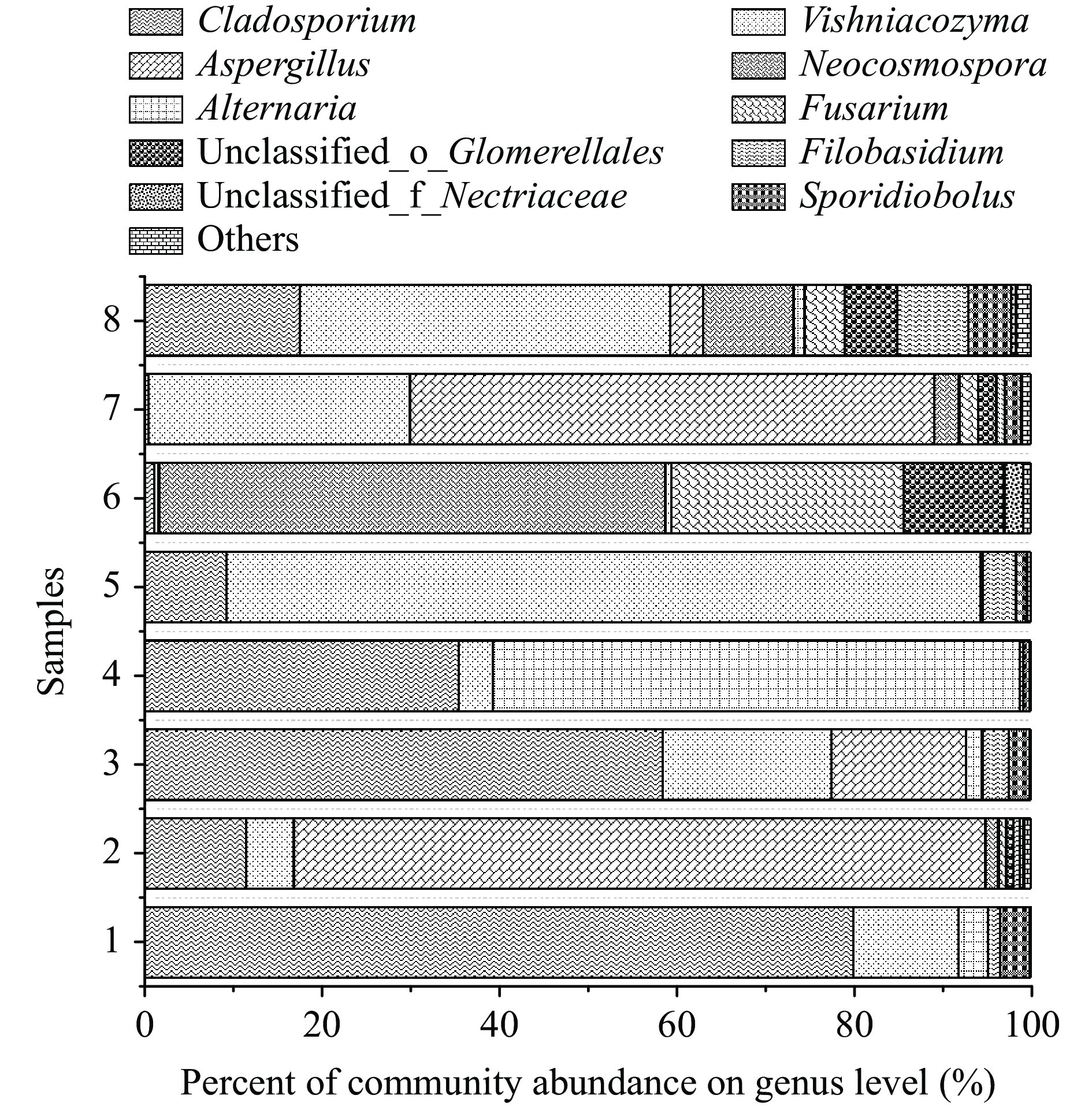
图10为不同辣椒样本的属水平真菌群落组成。如图10可见,不同样本间的真菌组成差异较大。在样本1和3中占据主要种类的真菌是枝胞霉属(Cladosporium),在样本2和7中是曲霉属(Aspergillus),在样本4中则是交链孢霉属(Alternaria),在样本5和8中酵母菌属(Vishniacozyma)较多,在样本6中是新赤壳属(Neocosmospora)。对比批次三和批次四的样本可见,破损后的辣椒发霉菌种丰度明显增多,且枝胞霉属占比降低。这些真菌的组成不同对应了相应不同的菌丝表型。除此之外镰刀菌属(Fusarium)、线黑粉酵母属(Filobasidium)、掷孢酵母属(Sporidiobolus)等真菌也有所检出。这一现象与Darsana等[39]在贮藏红辣椒中分离和鉴定的污染物菌群结果较一致。发霉辣椒中最常见真菌属是曲霉属和青霉属[40],在本研究中真菌群落中曲霉属也占了很大比重,而青霉属则检测较少。枝胞霉属也在所有红龙23的样本中均有检出,这是一种与辣椒挥发性风味物质密切相关的真菌[41]。交链孢菌属于辣椒内生菌,对辣椒有利有弊,优点在于可以促进辣椒素生产[42],但某些交链孢属的真菌也会产生真菌毒素并导致辣椒果实腐烂。则镰刀菌属是一种土传病害菌,已被证明会导致辣椒霉变[43]。
2.2.5.4 真菌培养及测序比对结果
为进一步探究导致辣椒霉变的具体菌株,试验选取了4个代表性样本对其中的菌丝进行了分离培养,并采用16S rDNA测序法,得到了比二代测序一致性和准确性均更高的结果。鉴定得到的菌株比对结果如表5所示。经鉴定,1号样品的菌株为曲霉属塔宾曲霉(Aspergillus tubingensis),2号样品的菌株为曲霉属黑曲霉(Aspergillus niger),3号样品的菌株则是1号和2号样品的混合体。4号样品中菌株为根霉属米根霉(Rhizopus oryzae)和根霉属少根根霉(Rhizopus arrhizus)。可见干辣椒主要受曲霉属和根霉属污染,在张晓玲[44]的研究中也得到了类似的结论。曲霉广泛分布于土壤与植物中,是常见的导致果蔬腐烂霉变的病原菌,与霉菌毒素密切相关,其中黄曲霉毒素(Aflatoxin,AFs)是干制红辣椒中最常检测到的霉菌毒素,有时也伴随赭曲霉毒素A(Ochratoxin A,OTA)共同存在。Aspergillus flavus是曲霉属中黄曲霉毒素的主要生产者,在此次样品中未检测到,但此次检测A. niger和A. tubingensis菌株都有产生OTA的概率,其中A. niger被证实经常污染辣椒[40]。根霉菌属为条件致病菌,可能会导致食品变质,但经美国食品药品管理局认证具有较高的安全性,现被广泛用于传统发酵[45]。目前市面对于轻微发霉辣椒处理不严格,仍存在使用现象,经本研究测序比对发现霉变干制辣椒的毒性轻微,但仍不建议使用发霉辣椒。
表 5 菌株对比结果Table 5. Comparison results of strains编号 样本来源 菌株 相似性
(%)最大得分 1 1号辣椒 Aspergillus tubingensis strain FJBJ11 99.50 1099 2 2号辣椒 Aspergillus niger isolate KNS3 100 1072 3-1 3号辣椒 Aspergillus tubingensis strain DL-03 99.83 1075 3-2 3号辣椒 Aspergillus niger isolate MEBP0047 99.34 1090 4-1 4号辣椒 Rhizopus oryzae UICC 8 99.68 1115 4-2 4号辣椒 Rhizopus arrhizus isolate 8-3M 100 1125 3. 结论
研究发现,新疆辣椒自然干制关键节点拢小堆和拢大堆的主要判断指标为水分含量,分别要求低于20%和13%。干制辣椒从平铺到拢大堆阶段,其糖含量、总酚含量、抗氧化能力随干制时间延长而显著降低。初始水分含量是关键影响因素,初始水分含量低的辣椒其品质指标随干制时间的延长变化小,且发霉率更低。发霉辣椒样本中存在枝胞霉属、曲霉属、交链孢霉属和酵母菌属等多种真菌,群落结构复杂。从发霉样品中分离真菌菌株发现曲霉和根霉是致辣椒发霉的主要病原菌。综上,建议合理选取采收时间节点,辣椒在辣椒成熟后不立刻采摘,而是进行“挂果晾晒”,先挂在植株上进行初步晾晒以降低辣椒中的含水量,既可以缩短自然干制时长,降低时间与人工成本,也能有效降低霉变率,提高辣椒加工产品的质量及安全性,更大程度降低机采破损辣椒的损失。本研究结果为新疆自然干制技术规程的标准化和规范化提供了理论基础,有利于指导未来干制辣椒的实际生产,从而避免干制时间不合理导致的辣椒霉变。
-
表 1 不同批次辣椒及关键节点情况
Table 1 Different batches of chili and key nodes situation
表 2 不同干制批次辣椒在关键节点的水分含量和水分活度变化
Table 2 Changes in moisture content and water activity of different dried batches of chilis at critical points
干制批次 干制节点 籽肉比(g/g) 辣椒肉 辣椒籽 水分含量(%) 水分活度Aw 水分含量(%) 水分活度Aw 一 A 0.18±0.08 65.09±6.69 0.90±0.02 43.40±2.29 0.84±0.01 B 0.31±0.03 9.06±1.88 0.44±0.09 8.59±3.42 0.43±0.06 C 0.32±0.03 6.83±0.70 0.32±0.01 6.28±0.20 0.33±0.01 二 A 0.33±0.04 28.71±2.77 0.72±0.02 21.06±2.77 0.70±0.08 B 0.38±0.04 37.76±14.24 0.78±0.06 26.95±4.43 0.79±0.04 C 0.44±0.06 13.40±3.15 0.51±0.06 10.45±2.06 0.63±0.09 三 A 0.23±0.03 45.98±14.85 0.88±0.07 27.26±6.46 0.87±0.03 B 0.32±0.02 20.33±8.62 0.63±0.17 14.60±3.19 0.73±0.09 C 0.34±0.01 13.61±2.57 0.55±0.07 10.80±0.98 0.55±0.03 四 A 0.28±0.03 37.22±7.05 0.71±0.03 18.67±4.53 0.72±0.02 B 0.28±0.02 18.04±4.20 0.42±0.04 11.40±0.36 0.56±0.06 C 0.30±0.04 9.48±0.54 0.39±0.02 8.08±0.26 0.39±0.03 表 3 辣椒破损率与发霉率统计
Table 3 Chili breakage rate and mold rate statistics
干制批次 采样点 未破损数量 破损数量 破损率(%) 平均破损率(%) 未发霉数量 发霉数量 发霉率(%) 平均发霉率(%) 三 1 99 35 26.12 24.89 119 15 11.19 7.36 2 110 41 27.15 145 6 3.97 3 93 33 26.61 112 12 9.68 4 105 27 20.45 124 8 6.06 5 129 41 24.12 160 10 5.88 四 1 117 186 61.39 74.17 156 12 7.14 5.32 2 84 366 81.33 160 4 2.44 3 78 271 77.65 145 10 6.45 4 102 384 79.01 148 14 8.64 5 150 376 71.48 153 3 1.92 表 4 不同发霉辣椒样本的外观情况描述
Table 4 Description of the appearance of different moldy chili samples
编号 批次来源 辣椒品种 采收方式 发霉情况 1 三 红龙23 手采 棕色霉斑 2 三 红龙23 手采 大面积黑色菌丝,伴有轻微白色霉斑 3 三 红龙23 手采 黑色霉,伴有白色霉菌 4 三 红龙23 手采 黑色菌丝 5 四 红龙23 机采 表皮颜色变浅,伴有棕色、黑色、
白色菌丝6 四 红龙23 机采 表皮暗黄色,有黑色霉斑 7 二 红龙18 手采 黑色菌丝 8 四 红龙23 机采 对照,外观完好样品 表 5 菌株对比结果
Table 5 Comparison results of strains
编号 样本来源 菌株 相似性
(%)最大得分 1 1号辣椒 Aspergillus tubingensis strain FJBJ11 99.50 1099 2 2号辣椒 Aspergillus niger isolate KNS3 100 1072 3-1 3号辣椒 Aspergillus tubingensis strain DL-03 99.83 1075 3-2 3号辣椒 Aspergillus niger isolate MEBP0047 99.34 1090 4-1 4号辣椒 Rhizopus oryzae UICC 8 99.68 1115 4-2 4号辣椒 Rhizopus arrhizus isolate 8-3M 100 1125 -
[1] 尹乐斌, 雷志明, 杨莹, 等. 辣椒加工副产物的综合利用现状[J]. 农产品加工,2016(21):59−61. [YIN L B, LEI Z M, YANY Y, et al. Current status of comprehensive utilization of pepper processing by-products[J]. Agricultural Product Processing,2016(21):59−61. YIN L B, LEI Z M, YANY Y, et al. Current status of comprehensive utilization of pepper processing by-products[J]. Agricultural Product Processing, 2016(21): 59-61.
[2] 中国科学院中国植物志编辑委员会. 中国植物志第67卷第1册茄科[M]. 北京: 科学出版社, 1990 Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China, Vol. 67, No. 1, Solanaceae[M]. Beijing: Science Press, 1990.
[3] 董彩军, 李锋, 卢国峰, 等. 辣椒及辣椒制品辣度分析研究进展[J]. 中国调味品,2016,41(12):142−146. [DONG C J, LI F, LU G F, et al. Research progress on spiciness analysis of chili peppers and chili pepper products[J]. China Spice,2016,41(12):142−146. DONG C J, LI F, LU G F, et al. Research progress on spiciness analysis of chili peppers and chili pepper products[J]. China Spice, 2016, 41(12): 142-146.
[4] 李军明. 辣椒的营养保健价值[J]. 中国食物与营养,2010(2):68−71. [LI J M. Nutritional health value of chili peppers[J]. China Food and Nutrition,2010(2):68−71. LI J M. Nutritional health value of chili peppers[J]. China Food and Nutrition, 2010(2): 68-71.
[5] POYRAZOGLU E S, YEMIS O, KADAKAL C, et al. Determination of capsaicinoid profile of different chilli peppers grown in Turkey[J]. Journal of the Science of Food and Agriculture,2005,85(9):1435−1438. doi: 10.1002/jsfa.2087
[6] 胡乂尹. 明清民国时期辣椒在中国的引种传播研究[D]. 南京: 南京农业大学, 2014 HU M Y. Study on the spread of pepper introduction in China during the Ming and Qing Dynasties[D]. Nanjing: Nanjing Agricultural University, 2014.
[7] Food and Agriculture Organization. World Food and Agriculture-Statistical Yearbook 2021[M]. 2021.
[8] 曹悦, 马燕, 赵靓, 等. 辣椒籽及其高值化利用研究进展[J]. 食品工业科技,2018,39(21):320−327. [CAO Y, MA Y, ZHAO L, et al. Research progress on chili seeds and their high value utilization[J]. Science and Technology of Food Industry,2018,39(21):320−327. CAO Y, MA Y, ZHAO L, et al. Research progress on chili seeds and their high value utilization[J]. Science and Technology of Food Industry, 2018, 39(21): 320-327.
[9] 刘莉. 辣椒干制及干燥过程模型的建立[D]. 新疆: 新疆农业大学, 2018 LIU L. Development of model for drying and drying process of chili pepper[D]. Xinjiang: Xinjiang Agricultural University, 2018.
[10] 周洁, 孔晓玲. 自然干燥与热风干燥对甘薯粉丝质量的影响[J]. 包装与食品机械,2011,29(6):14−16. [ZHOU J, KONG X L. Effect of natural drying and hot air drying on the quality of sweet potato vermicelli[J]. Packaging and Food Machinery,2011,29(6):14−16. ZHOU J, KONG X L. Effect of natural drying and hot air drying on the quality of sweet potato vermicelli[J]. Packaging and Food Machinery, 2011, 29(6): 14-16.
[11] 张慧, 徐健, 王丽丽, 等. 红辣椒干制技术研究[J]. 辣椒杂志,2013,11(2):29−33. [ZHANG H, XU J, WANG L L, et al. Research on drying technology of red pepper[J]. Chili Journal,2013,11(2):29−33. ZHANG H, XU J, WANG L L, et al. Research on drying technology of red pepper[J]. Chili Journal, 2013, 11(2): 29-33.
[12] 李琳, 王桢. 果蔬干燥技术研究进展[J]. 中国果菜,2020,40(3):9−17. [LI L, WANG Z. Research progress on drying technology of fruits and vegetables[J]. China Fruit and Vegetables,2020,40(3):9−17. LI L, WANG Z. Research progress on drying technology of fruits and vegetables[J]. China Fruit and Vegetables, 2020, 40(3): 9-17.
[13] KRZYKOWSKI A, DZIKI D, RUDY S, et al. Effect of pre-treatment conditions and freeze-drying temperature on the process kinetics and physicochemical properties of pepper[J]. LWT-Food Science and Technology,2018,98:25−30. doi: 10.1016/j.lwt.2018.08.022
[14] 中华人民共和国国家卫生和计划生育委员会. GB 5009.3-2016 食品安全国家标准 食品中水分的测定[S]. 北京: 中国标准出版社, 2016 National Health and Family Planning Commission of the People's Republic of China. GB 5009.3-2016 National standard for food safety Determination of moisture in food[S]. Beijing: China Standard Press, 2016.
[15] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.8-2016 食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定[S]. 北京: 中国标准出版社, 2016 National Health and Family Planning Commission of the People's Republic of China, State Food and Drug Administration. GB 5009.8-2016 National standard for food safety Determination of fructose, glucose, sucrose, maltose and lactose in food[S]. Beijing: China Standards Press, 2016.
[16] 沈文娇, 何新益, 冯长禄, 等. 粉碎度对辣椒籽成分溶出效果的影响[J]. 食品研究与开发,2018,39(1):78−82. [SHEN W J, HE X Y, FENG C L, et al. Effect of pulverization degree on the dissolution of pepper seeds[J]. Food Research and Development,2018,39(1):78−82. SHEN W J, HE X Y, FENG C L, et al. Effect of pulverization degree on the dissolution of pepper seeds[J]. Food Research and Development, 2018, 39(1): 78-82.
[17] CAO X M, ZHANG Y, ZHANG F S, et al. Effects of high hydrostatic pressure on enzymes, phenolic compounds, anthocyanins, polymeric color and color of strawberry pulps[J]. Journal of the Science of Food and Agriculture,2011,91(5):877−885. doi: 10.1002/jsfa.4260
[18] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free-radical method to evaluate antioxidant activity[J]. Food Science and Technology-Lebensmittel-Wissenschaft & Technologie,1995,28(1):25−30.
[19] 中华人民共和国国家卫生和计划生育委员会. GB 1886.34-2015 食品安全国家标准 食品添加剂 辣椒红[S]. 北京: 中国标准出版社, 2015 National Health and Family Planning Commission of the People's Republic of China. GB 1886.34-2015 National standard for food safety Food additive Capsicum red[S]. Beijing: China Standard Publishing House, 2015.
[20] 朱琳. 新疆地区主要干制辣椒品种原料评价与自然干制特性研究[D]. 北京: 中国农业大学, 2020 ZHU L. Evaluation of raw materials and natural drying characteristics of major dried pepper varieties in Xinjiang region[D]. Beijing: China Agricultural University, 2020.
[21] 刘珣. 辣椒采后生理及贮藏保鲜技术研究[D]. 石河子: 石河子大学, 2008 LIU X. Post-harvest physiology and storage and preservation technology of pepper[D]. Shihezi: Shihezi University, 2008.
[22] 王姝玚. 不同干燥方式对树莓品质的影响[D]. 沈阳: 沈阳农业大学, 2018 WANG S S. Effect of different drying methods on the quality of raspberries[D]. Shenyang: Shenyang Agricultural University, 2018.
[23] 刘宇鹏, 张皓, 陈芳, 等. 贵州地方辣椒品种品质差异分析[J]. 中国瓜菜,2022,35(1):42−46. [LIU Y P, ZHANG H, CHEN F, et al. Analysis of quality differences of local pepper varieties in Guizhou[J]. Chinese Melon and Vegetable,2022,35(1):42−46. LIU Y P, ZHANG H, CHEN F, et al. Analysis of quality differences of local pepper varieties in Guizhou[J]. Chinese Melon and Vegetable, 2022, 35(1): 42-46.
[24] 王兴波, 饶雷, 王永涛, 等. 9个品种干辣椒的品质分析及评价[J]. 食品工业科技,2022,43(18):300−310. [WANG X B, RAO L, WANG Y T, et al. Quality analysis and evaluation of nine varieties of dried chili peppers[J]. Science and Technology of Food Industry,2022,43(18):300−310. WANG X B, RAO L, WANG Y T, et al. Quality analysis and evaluation of nine varieties of dried chili peppers[J]. Science and Technology of Food Industry, 2022, 43(18): 300-310.
[25] 魏华伟, 柴松琳, 胡克玲, 等. 辣椒酸性蔗糖转化酶基因家族鉴定及表达[J]. 分子植物育种,2019,17(15):4900−4907. [WEI H W, CHAI S L, HU K L, et al. Identification and expression of acid sucrose invertase gene family in pepper[J]. Molecular Plant Breeding,2019,17(15):4900−4907. WEI H W, CHAI S L, HU K L, et al. Identification and expression of acid sucrose invertase gene family in pepper[J]. Molecular Plant Breeding, 2019, 17(15): 4900-4907.
[26] 薛琰文, 胡景娜, 敬璞, 等. 我国11种常见品种辣椒籽成分分析和比较[J]. 粮食与油脂,2021,34(7):143−149. [XUE Y W, HU J N, JING P, et al. Analysis and comparison of 11 common varieties of pepper seeds in my country[J]. Food and Oil,2021,34(7):143−149. XUE Y W, HU J N, JING P, et al. Analysis and comparison of 11 common varieties of pepper seeds in my country[J]. Food and Oil, 2021, 34(7): 143-149.
[27] 曹珍珍, 周林燕, 毕金峰, 等. 干燥方式对辣椒中活性物质含量和抗氧化能力的影响[J]. 中国食品学报,2017,17(2):173−181. [CAO Z Z, ZHOU L Y, BI J F, et al. Effects of drying methods on the content of active substances and antioxidant capacity in peppers[J]. Chinese Journal of Food Science,2017,17(2):173−181. CAO Z Z, ZHOU L Y, BI J F, et al. Effects of drying methods on the content of active substances and antioxidant capacity in peppers[J]. Chinese Journal of Food Science, 2017, 17(2): 173-181.
[28] GURNANI N, GUPTA M, MEHTA D, et al. Chemical composition, total phenolic and flavonoid contents, and in vitro antimicrobial and antioxidant activities of crude extracts from red chilli seeds (Capsicum frutescens L.)[J]. Journal of Taibah University for Science,2016,10(4):462−470. doi: 10.1016/j.jtusci.2015.06.011
[29] AZIEANA J, ZAINON M N, NORIHAM A, et al. Total phenolic and flavonoid content and antioxidant activities of ten malaysian wild mushrooms[J]. OALib,2017,4(11):1−9.
[30] 祝思宇, 肖怡, 陈冠林, 等. 山竹的花色苷、黄酮、总酚含量及其抗氧化活性[J]. 食品工业,2020,41(2):338−343. [ZHU S Y, XIAO Y, CHEN G L, et al. Contents of anthocyanins, flavonoids, total phenolics and their antioxidant activities in mangosteen[J]. Food Industry,2020,41(2):338−343. ZHU S Y, XIAO Y, CHEN G L, et al. Contents of anthocyanins, flavonoids, total phenolics and their antioxidant activities in mangosteen[J]. Food Industry, 2020, 41(2): 338-343.
[31] 陈金娥, 李冬梅, 赵戌利, 等. 10种生、熟蔬菜中VC含量及抗氧化性对比研究[J]. 食品科技,2012,37(4):57−59. [CHEN J E, LI D M, ZHAO X L, et al. Comparative study on VC content and antioxidant activity in 10 kinds of raw and cooked vegetables[J]. Food Science and Technology,2012,37(4):57−59. CHEN J E, LI D M, ZHAO X L, et al. Comparative study on VC content and antioxidant activity in 10 kinds of raw and cooked vegetables[J]. Food Science and Technology, 2012, 37(4): 57-59.
[32] JAMES O K, FRANCIS K K K, FORTUNE A. Effects of blanching and natural convection solar drying on quality characteristics of red pepper (Capsicum annuum L.)[J]. International Journal of Food Science, 2017: 4656814.
[33] 曹珍珍. 辣椒干燥动力学及生物活性评价研究[D]. 北京: 中国农业科学院, 2015 CAO Z Z. Study on drying kinetics and bioactivity evaluation of pepper[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015.
[34] MARIA M T. Thermo-physical property and Thin-layer drying kinetics for long red pepper[J]. Energy Procedia,2014,57:1160−1168. doi: 10.1016/j.egypro.2014.10.103
[35] ANDRADE E T D, FIGUEIRA V G, TEIXEIRA L P, et al. Effect of drying kinetics on color of "Dedo De Moça" chili peppers (Capsicum baccatum)[J]. Engenharia Agrícola, 2019, 39(5).
[36] LIU D Q, TONG C. Bacterial community diversity of traditional fermented vegetables in China[J]. LWT-Food Science and Technology,2017,86:40−48. doi: 10.1016/j.lwt.2017.07.040
[37] XIE M X, WU J R, AN F Y, et al. An integrated metagenomic/metaproteomic investigation of microbiota in dajiang-meju, a traditional fermented soybean product in Northeast China[J]. Food Research International,2019,115:414−424. doi: 10.1016/j.foodres.2018.10.076
[38] 王光飞, 马艳, 郭德杰, 等. 生物质炭介导生防微生物抑制辣椒疫霉的作用[J]. 中国生态农业学报(中英文),2019,27(7):1015−1023. [WANG G F, MA Y, GUO D J, et al. Biochar-mediated biocontrol microbial inhibition of Phytophthora capsicum[J]. Chinese Journal of Ecological Agriculture (English and Chinese),2019,27(7):1015−1023. WANG G F, MA Y, GUO D J, et al. Biochar-mediated biocontrol microbial inhibition of Phytophthora capsicum[J]. Chinese Journal of Ecological Agriculture (English and Chinese), 2019, 27(7): 1015-1023.
[39] DARSANA R, CHANDRASEHAR G. Isolation and characterization of contaminant mycoflora from stored red peppers[J]. Journal of Pure and Applied Microbiology,2021,15(3):1187−1197. doi: 10.22207/JPAM.15.3.08
[40] KIM S, BAEK S G, HUNG N B, et al. Effects of temperature and humidity on fungal occurrence in dried red pepper during storage[J]. Research in Plant Disease,2021,27(4):155−163. doi: 10.5423/RPD.2021.27.4.155
[41] YE Z, SHANG Z X, ZHANG S Y, et al. Dynamic analysis of flavor properties and microbial communities in Chinese pickled chili pepper (Capsicum frutescens L.): A typical industrial-scale natural fermentation process[J]. Food Research International,2022,153:110952. doi: 10.1016/j.foodres.2022.110952
[42] STROBEL G, DAISY B, CASTILLO U, et al. Natural products from endophytic microorganisms[J]. Journal of Natural Products,2004,67(2):257−268. doi: 10.1021/np030397v
[43] 高秀丽, 窦玉焕. 辣椒疫霉根腐病的发生与防治[J]. 新农业,2021(17):49−50. [GAO X L, DOU Y H. Occurrence and control of root rot of Phytophthora capsicum[J]. New Agriculture,2021(17):49−50. GAO X L, DOU Y H. Occurrence and control of root rot of Phytophthora capsicum[J]. New Agriculture, 2021(17): 49-50.
[44] 张晓玲. 干辣椒微生物区系及保藏方法的研究[D]. 重庆: 西南大学, 2008 ZHANG X L. Research on microbiota and preservation methods of dried chili peppers[D]. Chongqing: Southwest University, 2008.
[45] 刘晓玲, 鞠笑, 贾碧丝, 等. 少根根霉产孢能力、变种与发酵产物的相关性[J]. 微生物学报,2022,62(3):1131−1149. [LIU X L, JU X, JIA B S, et al. Correlation between sporulation ability, variants and fermentation products of Rhizopus oligoides[J]. Acta Microbiologica Sinica,2022,62(3):1131−1149. LIU X L, JU X, JIA B S, et al. Correlation between sporulation ability, variants and fermentation products of Rhizopus oligoides[J]. Acta Microbiologica Sinica, 2022, 62(3): 1131-1149.





 下载:
下载:





 下载:
下载:
