Antioxidant, Anti-inflammatory, Analgesic and Antimicrobial Activities of Crude Polysaccharides from Polygonum perfoliatum L.
-
摘要: 目的:研究扛板归粗多糖体内外抗氧化、抗炎、镇痛和抑菌活性。方法:水提醇沉法制备扛板归粗多糖。以清除1,1 -二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基和超氧阴离子自由基的能力为体外抗氧化评价方法,以测定总超氧化物歧化酶(Total superoxide dismutase,T-SOD)活力、过氧化氢酶(Catalase,CAT)活力和丙二醛(Malondialdehyde,MDA)含量为体内抗氧化指标,综合考察粗多糖抗氧化活性;采用二甲苯诱导小鼠耳廓肿胀法,评价粗多糖抗炎效果;测定小鼠热板痛阈值评价粗多糖镇痛作用;采用牛津杯法评价粗多糖体外抑菌效果。结果:扛板归粗多糖对DPPH自由基、羟自由基和超氧阴离子自由基具有较好的清除能力,呈剂量依懒性,半抑制浓度值(IC50)分别为 420.93、171.53和 575.40 μg/mL;与对照组相比,粗多糖在体内能提高组织T-SOD活力和CAT活力,降低MDA水平。粗多糖能抑制二甲苯诱导的肿胀作用,抑制率高达40.95%。但是,该粗多糖镇痛作用不明显,对大肠埃希氏菌和金黄色葡萄球菌均无抑制作用。结论:扛板归粗多糖具有抗氧化和抗炎活性,有望开发成天然抗氧化剂。Abstract: Objectives: This study aimed to investigate the in vivo and in vitro antioxidant, anti-inflammatory, analgesic, and antimicrobial activities of crude polysaccharides from Polygonum erfoliatum L.. Methods: The crude polysaccharides were prepared using the water extraction and alcohol precipitation method. The in vitro antioxidant activity was assessed based on the capability to scavenge 1,1-diphenyl-2-picrylhydrazyl (DPPH) radicals, hydroxyl radicals, and superoxide anion radicals. The in vivo antioxidant indicators were the determination of total superoxide dismutase (T-SOD) activity, catalase (CAT) activity, and malondialdehyde (MDA) content, providing a comprehensive evaluation of the antioxidant activity of the crude polysaccharides. The anti-inflammatory effect of the crude polysaccharides was assessed using the xylene-induced mice ear edema method. The analgesic effect was evaluated by determining the pain threshold in mice using the hot plate test. The in vitro antimicrobial activity was evaluated by the Oxford cup method. Results: The crude polysaccharides displayed effective scavenging abilities against DPPH radicals, hydroxyl radicals, and superoxide anion radicals, with the activity significantly dependent on the concentration of the polysaccharides. The half-maximal inhibitory concentration (IC50) values were 420.93, 171.53, and 575.40 μg/mL, respectively. Compared to the control group, the polysaccharides enhanced the activity of T-SOD and CAT, reduced MDA levels in vivo. The crude polysaccharides inhibited xylene-induced swelling with an inhibition rate reaching 40.95%. However, the analgesic effect of the crude polysaccharides was not significant, and they showed no inhibitory effects against Escherichia coli and Staphylococcus aureus. Conclusions: The crude polysaccharides from Polygonum perfoliatum L. possess antioxidant and anti-inflammatory activities and have the potential to be developed as natural antioxidants.
-
Keywords:
- Polygonum perfoliatum L. /
- crude polysaccharides /
- antioxidant /
- anti-inflammatory /
- analgesic /
- antibacterial
-
扛板归又名蛇不过、杠板归、犁头刺,系蓼科蓼属扛板归(Polygonum perfoliatum L.)的干燥地上部分,是一年生攀援性草本植物,多在夏季采收。扛板归在我国资源分布广泛,常见于山东、湖南、贵州、江浙及两广等省区,多生于阴湿荒地、路边和灌木丛中。近年来国内外对扛板归的研究报道主要集中在化学成分提取分离[1−3]、生物活性研究[4−7]和质量标准建立[8−9]。
多糖(Polysaccharides)是由十个以上单糖通过糖苷键结合而成的糖链聚合物。多糖具有抗氧化[10]、抑菌[11]、抗炎[12]、抗肿瘤[13]、护肝[14]、降血压[15]和免疫调节[16]等多方面的生物活性。Lai等[17]证实扛板归多糖对A549肿瘤细胞具有显著抑制作用,其作用机制可能与上调caspase-3、caspase-9、Bax表达和下调Bcl-2表达有关。然而对扛板归多糖的研究,文献报道相对较少且多集中在多糖提取工艺方面[18−19]。王庆等[20]应用纤维素酶法制备扛板归多糖,该多糖在体外实验中表现出一定抗氧化活性,对羟自由基最大清除率为78.56%,IC50为0.480 mg/mL;对超氧阴离子自由基最大清除率为89.81%,IC50为0.297 mg/mL。梁珊珊等[21]借助超声辅助提取法制备扛板归多糖,该多糖对DPPH自由基和ABTS+自由基均表现出较强的清除能力。
本实验以扛板归为原料,水提醇沉法制备扛板归粗多糖,探讨扛板归粗多糖体内外抗氧化活性、抗炎活性、镇痛活性和抑菌活性。旨在为明确扛板归活性物质基础提供理论依据,为开发扛板归多糖在食品、医药行业的应用打下实验基础。
1. 材料与方法
1.1 材料与仪器
扛板归 采自广西柳州市郊区,经广西科技大学医学部韦运东副教授鉴定为蓼科蓼属扛板归(Polygonum perfoliatum L.)的地上部分;金黄色葡萄球菌、大肠埃希氏菌 均由广东微生物菌种保藏中心提供;昆明小白鼠 6~8周龄,体重20±2 g 购于广西医科大学实验动物中心,实验动物使用许可证号:SYXK桂2014-0001,实验动物生产许可证号:SCXK桂2014-0002。本实验所涉及的生物安全问题的研究内容通过广西科技大学生物安全审查委员会审查批准,在实施过程中严格执行生物安全制度及相关规章;硫酸亚铁、二甲苯 AR,成都市科龙化工试剂厂;抗坏血酸(Vitamin C,VC) AR,天津市福晨化学试剂厂;MH琼脂培养基 BR,广东环凯微生物科技有限公司;1,10-菲啰啉 AR,天津市天新精细化工开发中心;100万单位注射用硫酸链霉素 山东鲁抗医药股份有限公司;复方醋酸地塞米松乳膏 广东泰恩康医药股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2- picrylhydrazyl,DPPH) 默克生命科学技术有限公司;阿斯匹林 AR,郑州派尼化学试剂厂;蛋白定量测试盒、抗超氧阴离子自由基及产生超氧阴离子自由基测试盒、总超氧化物歧化酶(Total superoxide dismutase,T-SOD)测试盒、过氧化氢酶(Catalase,CAT)测试盒、丙二醛(Malondialdehyde,MDA)测试盒 南京建成生物工程研究所;WwCO 3500 D透析袋 美国MYM公司;其他试剂均为市售分析纯。
DHG-9241A电热恒温干燥箱、SPX-60BSH-Ⅱ生化培养箱 上海圣科仪器设备有限公司;FD-IA50真空冷冻干燥机 北京博医康实验仪器有限公司;SW-CJ-2F超净工作台 广州睿智净化设备有限公司;YLS-Q4耳肿打孔器(直径8 mm)、YLS-6B智能热板仪 济南益延科技发展有限公司;FM200高剪切分散乳化机 上海市鲁克科技发展有限公司;8mm×6mm×100 mm牛津杯 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 粗多糖的制备
取经粉碎(40 目)后的扛板归药材,按30 mL每克的扛板归粉末比例用石油醚回流提取2次,每次2 h。抽滤,弃去提取液;收集药渣,60 ℃烘箱中除去石油醚,即得预处理后的扛板归粉末,待用。精密称取预处理过的扛板归粉末500 g,30倍量(30 mL/g)纯化水煎煮提取两次,每次1.5 h。离心(4000 r/min,10 min),收集上清液。上清液经浓缩至一定体积。在快速搅拌的情况下,缓慢向浓缩液中加入四倍浓缩液体积量的无水乙醇,4 ℃冰箱静置过夜,离心(4000 r/min,10 min),收集沉淀。沉淀用无水乙醇洗涤数次,洗至洗涤液为无色为止,真空冷冻干燥,收集固体即为扛板归粗多糖。使用Sevag法对扛板归粗多糖脱蛋白[22],使用AB-8大孔吸附树脂对扛板归粗多糖脱色[23],纯化水透析24 h,浓缩,乙醇沉淀,真空冷冻干燥后得扛板归粗多糖样品,称重。根据本实验室建立的方法,使用苯酚-硫酸法测定扛板归粗多糖中多糖含量[24]。根据公式(1)计算扛板归粗多糖得率。
得率(%)=mM×100 (1) 式中:m为扛板归粗多糖(g);M为预处理后的扛板归药材重量(g)。
1.2.2 粗多糖体外抗氧化活性
1.2.2.1 DPPH自由基清除实验
参考文献方法[25]。精密称定扛板归粗多糖样品40 mg,溶解于蒸馏水中,定容至10 mL,即得4.0 mg/mL的粗多糖样品作为母液。在序列试管中分别加入0.025、0.05、0.1、0.2、0.4、0.6、0.8、1.0 mL的母液,分别补蒸馏水至1.0 mL(在反应液中粗多糖终浓度分别为25、50、100、200、400、600、800、1000 μg/mL),而后,每管加入3.0 mL的0.1 mmol/L溶于80%(V/V)乙醇的DPPH溶液(现配现用);样品对照组中用80%乙醇代替DPPH溶液;空白组中用蒸馏水代替样品溶液。以上各实验组溶液混匀后,置黑暗处,室温放置30 min后,用1 mL 蒸馏水和3 mL 80%乙醇调零,于517 nm处,1 cm光径,测各管吸光度。VC为阳性对照。每个测试管做三个平行,结果取平均值。根据公式(2)计算粗多糖对DPPH自由基清除率:
DPPH自由基清除率(%)=A空白−(A样品−A对照)A空白×100 (2) 式中:A样品为加样品和DPPH溶液的吸光度;A对照为只加样品溶液的吸光度;A空白为只加DPPH溶液的吸光度。
1.2.2.2 羟自由基清除实验
参考文献方法[26]。精密称定扛板归粗多糖样品45 mg,溶解于蒸馏水中,定容至10 mL,即得4.5 mg/mL的粗多糖样品作为母液。在序列试管中分别加入0.025、0.05、0.1、0.2、0.4、0.6、0.8、1.0 mL 4.5 mg/mL的母液,分别补蒸馏水至1.0 mL(在反应液中粗多糖终浓度分别为25、50、100、200、400、600、800、1000 μg/mL),即得序列浓度的样品组。样品组中每管依次加入0.5 mL pH7.4 缓冲液、1 mL 7.5 mmol/L 1,10-菲啰啉、1.5 mL 0.75 mmol/L FeSO4和0.5 mL 3% H2O2后,置于37 ℃水浴中保温1 h。蒸馏水调零,于536 nm处,1 cm光径,测各管吸光度。对照组用1.0 mL蒸馏水代替样品;空白组用1.5 mL蒸馏水代替1.0 mL样品和0.5 mL 3% H2O2。VC为阳性对照。每个测试管做三个平行,结果取平均值。根据公式(3)计算粗多糖对羟自由基清除率:
羟自由基清除率(%)=A样品−A对照A空白−A对照×100 (3) 式中:A样品为样品反应后吸光度;A对照为用蒸馏水代替样品的吸光度;A空白为用蒸馏水代替样品和H2O2的吸光度。
1.2.2.3 超氧阴离子自由基清除实验
按抗超氧阴离子自由基及产生超氧阴离子自由基测试盒说明书上操作。模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统,精密吸取序列质量浓度的粗多糖溶液各50 μL(在反应液中粗多糖终浓度分别为25、50、100、200、400、600、800、1000 μg/mL),置于不同的试管中,分别依次加入1.0 mL的试剂一,加入试剂二、试剂三、试剂四各0.1 mL。用旋涡混匀器充分混匀,置37 ℃恒温水浴反应40 min,加入2.0 mL显色剂显色,混匀,10 min后倒入1 cm光径比色杯中,蒸馏水调零,550 nm处测定各管吸光度。对照管中用等体积的蒸馏水代替粗多糖溶液。VC为阳性对照。每个浓度做三个平行,结果取平均值。根据公式(4)计算粗多糖对超氧阴离子自由基的清除率。
超氧阴离子自由基清除率(%)=A空白−A样品A空白×100 (4) 式中:A样品为样品反应后吸光度;A空白为用蒸馏水代替样品的吸光度。
1.2.3 粗多糖体内抗氧化活性
参考文献方法[27]。32只小鼠,雌雄各半,随机分成 4组,每组8只:对照组(灌胃等体积生理盐水)、扛板归粗多糖低剂量组(L:50 mg/(kg·d))、扛板归粗多糖中剂量组(M:100 mg/(kg·d))和扛板归粗多糖高剂量组(H:200 mg/(kg·d)),连续灌胃15 d。末次灌胃后,所有小鼠禁食不禁水12 h,颈椎脱臼处死,快速分离肝脏和肾脏,在冰冷的生理盐水中漂洗,除去血液,滤纸吸干表面水分,分别准确称取肝脏0.2 g和肾脏0.1 g,各加生理盐水10.0 mL,冰浴条件下机械匀浆,5000 r/min 离心10 min,分别收集上清液,于−80 ℃保存,待测。严格按照试剂盒说明书方法操作,分别测定T-SOD、CAT活力,蛋白质和MDA含量。
1.2.4 小鼠耳廓肿胀实验
参考文献方法[28]。40只小鼠,雌雄各半,分成5组,每组8只小鼠:模型组(灌胃等体积生理盐水)、阳性对照组(阿司匹林,5 mg/(kg·d))、扛板归粗多糖低剂量组(L:50 mg/(kg·d))、扛板归粗多糖中剂量组(M:100 mg/(kg·d))和扛板归粗多糖高剂量组(H:200 mg/(kg·d)),连续灌胃15 d。末次给药后1 h,均匀涂抹100 μL二甲苯于实验小鼠的右耳两面,左耳不涂二甲苯作为对照,半小时后,运用脱颈椎法处理实验小鼠,用实验打孔器分别在实验小鼠左、右耳同一部位分别制作耳片,精密称重,以实验小鼠两耳片质量之差来表示各组实验小鼠的炎性肿胀程度。比较各组小鼠耳廓肿胀度(右耳耳片重-左耳耳片重),并根据公式(5)计算肿胀抑制率。
耳廓肿胀抑制率(%)=模型组肿胀度(mg)−给药组肿胀度(mg)模型组肿胀度(mg)×100 (5) 1.2.5 粗多糖镇痛实验(热板法)
参考文献方法[29]。用热板舔足反应观察扛板归粗多糖对热刺激导致小鼠疼痛的镇痛作用。待热板仪温度稳定在 55 ℃时,将小鼠放入槽内,以小鼠舔右后足为疼痛反应指标预先测定痛阈值(以痛阈值平均值在5~30 s为合格小鼠)。挑选合格雌小鼠40只,分成5组,每组8只小鼠:对照组(灌胃等体积生理盐水)、阳性对照组(阿司匹林,5 mg/(kg·d))、扛板归多糖低剂量组(L:50 mg/(kg·d))、扛板归多糖中剂量组(M:100 mg/(kg·d))和扛板归多糖高剂量组(H:200 mg/(kg·d)),连续灌胃15 d。末次给药后60 min,观察小鼠舔足的反应潜伏期(即痛阈),根据公式(6)计算痛阈提高的百分率。
痛阈提高率(%)=给药组痛阈(s)−对照组痛阈(s)对照组痛阈(s)×100 (6) 1.2.6 粗多糖抑菌实验
参考文献方法[30]。在37 ℃条件下,用MH琼脂平板培养基分别将大肠埃希氏菌和金黄色葡萄球菌活化培养24 h。活化菌种分别与灭菌的生理盐水混匀,调整浓度约为(1~2)×108 CFU/mL的菌悬液(约0.5麦氏标准液),备用。用蒸馏水配制质量浓度分别为50 mg/mL和100 mg/mL的扛板归粗多糖溶液。0.22 μm微孔滤膜过滤除菌,备用。同法,制备2 mg/mL硫酸链霉素作为阳性对照,蒸馏水作为阴性对照。用无菌棉拭子蘸分别取浓度为(1~2)×108 CFU/mL大肠埃希氏菌和金黄色葡萄球菌试验菌悬液,在直径为90 mm MH琼脂平板培养基表面均匀涂抹三次。在涂菌培养基表面均匀垂直放置6个灭菌牛津杯;在杯中加入不同药液0.1 mL,每种药液做 3 个重复平皿;盖好平板,37 ℃条件下培养24 h,观察结果。用十字交叉法测量并记录抑菌圈的大小。
1.3 数据处理
采用Origin 7.5 数据处理软件进行数据处理并作图。统计学分析采用SPSS 19.0统计软件进行分析,结果以“平均数±标准差”表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2. 结果与分析
2.1 粗多糖的制备
扛板归经石油醚脱色脱脂、水提取、乙醇沉淀、脱蛋白、脱色素、透析、冷冻干燥后,收集得扛板归粗多糖16.77 g,粗多糖中多糖含量为82.44%,多糖得率为3.35%。
2.2 粗多糖对DPPH自由基的清除作用
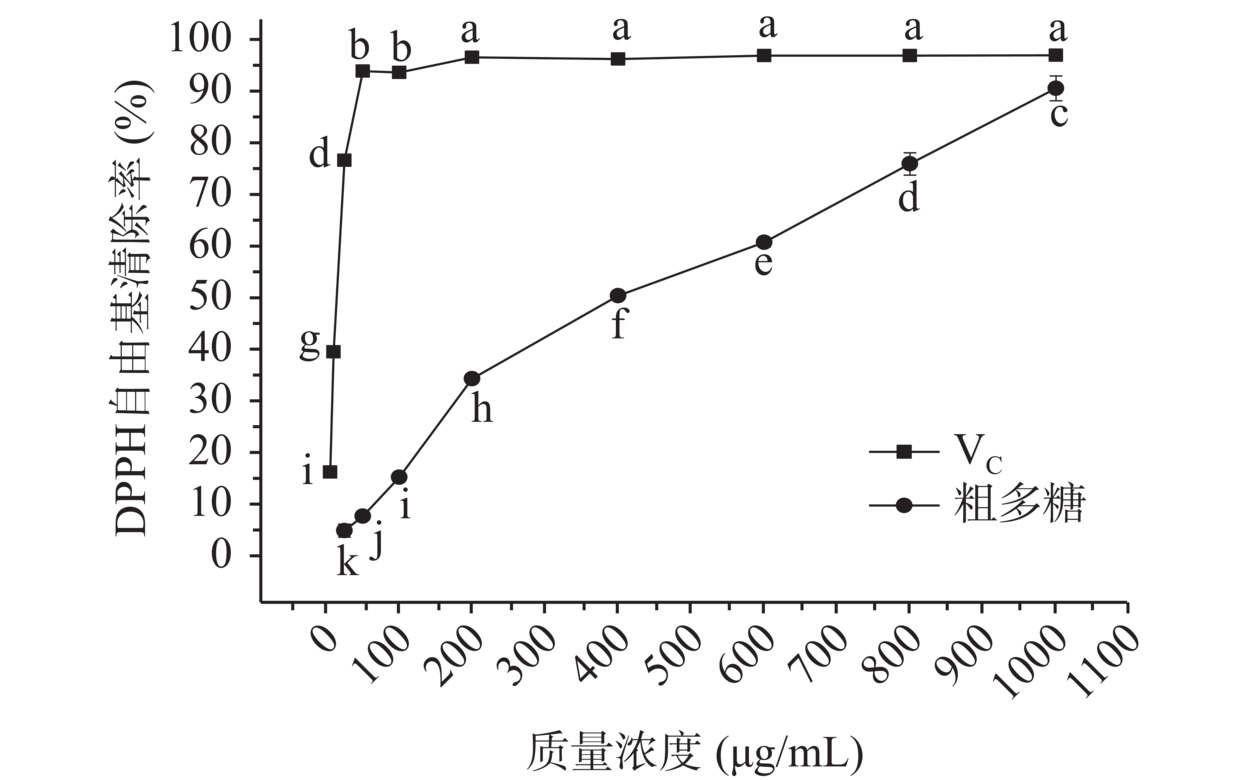
图1为粗多糖对DPPH自由基的清除作用结果,由图1可知,扛板归粗多糖对DPPH自由基的清除作用明显,呈现量效相关性,当粗多糖质量浓度由25 μg/mL增加到1000 μg/mL时,对DPPH自由基清除率显著提高(P<0.05),从4.98% 持续提升至90.52%,接近VC对DPPH自由基清除的水平,但是在相同浓度下不及VC的清除效果。经计算扛板归粗多糖和VC半抑制浓度值(IC50)分别为420.93和14.26 μg/mL,IC50值越小,对自由基的清除活性就越大,VC对DPPH自由基的清除能力强于扛板归粗多糖。实验结果表明,扛板归粗多糖对DPPH自由基的清除作用明显。
2.3 粗多糖对羟自由基的清除作用
粗多糖对羟自由基的清除作用结果见图2,由图2可知,扛板归粗多糖在低浓度(25~200 μg/mL)时,随着粗多糖浓度的加大,对羟自由基的清除作用迅速增加,浓度依懒性明显,清除率从3.21%增加到57.96%。而后增加缓慢,当粗多糖浓度为800 μg/mL时,清除率达到最大值85.70%,经计算,粗多糖对羟自由基清除的IC50值为171.53 μg/mL。VC也呈现出明显的量效相关性,VC的IC50值为135.32 μg/mL。VC在浓度为200和400 μg/mL时对羟自由基清除率分别为60.26%和69.50%,与同浓度下的粗多糖清除率无显著性差异(P>0.05)。实验结果表明,扛板归粗多糖对羟自由基具有很强的清除作用。
2.4 粗多糖对超氧阴离子自由基的清除作用
超氧阴离子自由基是生物有机体在线粒体内对氧气代谢过程中产生的对机体损伤较小的一种自由基,由多种生物反应和光化学产生。因此对超氧阴离子自由基的清除作用也是抗氧化活性物质的目标之一[31]。由图3可知,扛板归粗多糖对该自由基有一定的清除作用,在实验浓度范围内,清除能力增加的较为缓慢。当浓度为600 μg/mL时,清除率为54.51%;当浓度增加到1000 μg/mL时,清除率为60.59%,浓度虽然增加400 μg/mL,但对超氧阴离子自由基的清除率仅增加6.08%。阳性对照VC在6.25 μg/mL至100 μg/mL浓度范围内,对超氧阴离子自由基清除率能力从4.95%剧增至91.92%,而后趋于平缓。经计算,粗多糖与VC的IC50值分别为575.40 μg/mL和42.72 μg/mL。
2.5 抗氧化指标的测试
蛋白质是有机大分子物质,具有多种生理功能。蛋白质的缺乏将会影响机体正常代谢功能,易受疾病侵害,导致患病和器官损伤[27]。SOD是体内很重要的抗氧化酶,其能清除危害机体的自由基,保护机体免受氧化损伤[27]。CAT 普遍存在于机体内,它能专一、高效催化过氧化氢分解为水和氧气,保护机体免受有害物质损伤[32] 。丙二醛作为生物膜脂质过氧化的产物之一,其在体系中的量常常可以反映膜质过氧化的程度,因此可以间接地评价实验样品抑制脂质过氧化的水平[33]。
不同剂量的扛板归粗多糖对小鼠体内T-SOD、CAT活力和蛋白质、MDA含量的影响见表1。由表1可知,在灌胃扛板归粗多糖15 d后,各剂量组T-SOD活力与对照组对比,均有一定的提高;在肝脏组织中,低剂量组、中剂量组和高剂量组T-SOD活力分别提高5.27%(P<0.05)、15.92%(P<0.01)和12.64%(P<0.01);在肾脏组织中,中剂量组和高剂量组T-SOD活力分别提高17.01%(P<0.05)和34.80%(P<0.01)。CAT活力与对照组相比,均有一定程度提高,高剂量组肝脏组织中CAT活力提高了33.24%(P<0.05)。蛋白含量与对照组对比,均有一定程度增多,在肝脏组织中,低剂量组、中剂量组和高剂量组分别增多17.06%(P<0.05)、19.41%(P<0.05)和24.12%(P<0.01)。MDA含量与对照组相比,均有所降低,中剂量组和高剂量组能显著降低肝脏组织中MDA含量,降低比例分别为47.59%(P<0.01)和56.39%(P<0.01)。剩余各组测定指标量的变化对评价扛板归粗多糖的体内抗氧化活性没有显著性差异。
表 1 粗多糖对小鼠组织抗氧化指标的影响Table 1. Effect of crude polysaccharides on tissue antioxidant indexes of mice组别 剂量(mg/(kg·d)) 动物数量(只) 蛋白含量(g prot/L) T-SOD活力(U/mg prot) CAT活力(U/g prot) MDA含量(nmol/mL) 对照组 - 8 肝 1.70±0.22 54.51±2.33 402.97±94.02 4.77±1.19 肾 0.60±0.20 98.71±11.55 354.45±59.34 3.32±0.94 低剂量组 50 8 肝 1.99±0.10* 57.38±1.54* 431.94±80.43 3.78±1.19 肾 0.72±0.17 102.25±13.15 371.76±40.11 3.20±0.88 中剂量组 100 8 肝 2.03±0.25* 63.19±1.41** 443.76±28.46 2.50±1.08** 肾 0.78±0.16 115.50±5.96* 390.10±45.71 2.62±0.73 高剂量组 200 8 肝 2.11±0.16** 61.40±1.24** 536.93±67.83* 2.08±1.00** 肾 0.80±0.17 133.07±10.65** 421.21±46.71 2.54±1.01 注:*与对照组相比差异显著(P<0.05);**与对照组相比差异极显著(P<0.01)。 2.6 粗多糖对二甲苯诱导小鼠耳肿胀的影响
二甲苯属于非特异性致炎因子,其致炎机制有可能涉及炎症介质如组胺、5-羟色胺和缓激肽的释放,从而引起炎症[34]。扛板归粗多糖对小鼠耳廓肿胀的抑制实验结果见表2。据表2可知,各样品组对二甲苯诱导小鼠耳肿胀均有一定抑制作用,中剂量组抑制率为26.26%,高剂量组抑制率高达40.95%。粗多糖抑制作用明显,具有较好的抗炎活性。
表 2 粗多糖对二甲苯诱导小鼠耳肿胀的影响Table 2. Effect of crude polysaccharides on ear swelling model induced by xylol in mice组别 剂量(mg/(kg·d)) 动物数量(只) 肿胀度(mg) 抑制率(%) 模型组 − 8 18.85±2.04 − 阳性对照组 5 8 14.38±5.07 23.71 低剂量组 50 8 14.97±8.32 20.58 中剂量组 100 8 13.90±4.01* 26.26 高剂量组 200 8 11.13±4.79** 40.95 注:*与模型组相比差异显著(P<0.05),**与模型组相比差异极显著(P<0.01)。 2.7 粗多糖对热刺激痛的镇痛作用
粗多糖对热刺激痛的镇痛作用结果见表3,由表3可知,与对照组相比,阳性对照组痛阈时间极显著延长,痛阈值提高了42.36%。然而,粗多糖各实验组小鼠对痛阈时间的延长并不明显,高剂量组小鼠的痛阈提高值仅为14.22%。实验结果表明,扛板归粗多糖对热刺激痛的镇痛作用不明显。
表 3 粗多糖对热板所致小鼠疼痛的影响Table 3. Effect of crude polysaccharides on ache induced by hot plate in mice组别 剂量(mg/(kg·d)) 动物数量(只) 痛阈(s) 痛阈提高率(%) 对照组 − 8 17.30±2.80 − 阳性对照组 5 8 24.63±4.48** 42.36 低剂量组 50 8 17.70±2.58 2.32 中剂量组 100 8 17.86±2.38 3.23 高剂量组 200 8 19.76±4.68 14.22 注:**与对照组相比差异极显著(P<0.01)。 2.8 抑菌实验
抗生素的滥用,耐药细菌的出现,给临床疾病患者构成极大威胁,给医务工作者工作带来很大挑战。随着科技的发展,科研工作者虽然能合成新的抗生素对抗病变菌,但是病变菌的变异速度[35]和合成抗生素的副作用[36]更是让人堪忧。因此,重回自然界,寻求和开发天然抑菌剂越来越被科研人员重视。质量浓度为50 mg/mL和100 mg/mL的扛板归粗多糖溶液,对实验条件下的大肠埃希氏菌和金黄色葡萄球菌抑制作用不明显,无抑菌圈产生。实验结果见表4。
表 4 抑菌作用结果(n=3)Table 4. Results of bacteriostatic action (n=3)样品 浓度(mg/mL) 大肠埃希氏菌(mm) 金黄色葡萄球菌(mm) 蒸馏水 − − − − − 硫酸链霉素 2 32.67±0.58 ++++ 24.33±0.58 ++++ 粗多糖 50 − − − − 100 − − − − 注:抑菌圈抑菌判断标准:抑菌圈直径≥20 mm为极敏感,用“++++”表示;无抑菌圈为耐药,用“−”表示。 3. 结论
本实验采用水提醇沉法、Sevag法脱蛋白、AB-8大孔吸附树脂脱色、透析除去小分子化合物等方法制备扛板归粗多糖,该粗多糖中多糖含量为82.44%,多糖得率为3.35%。实验结果表明,扛板归粗多糖在体内外均具有良好的抗氧化活性和较好的抗炎活性,有望开发为天然抗氧化剂。但是该粗多糖镇痛作用不明显,对大肠埃希氏菌和金黄色葡萄球菌均无抑制作用。在后期研究中,继续完善扛板归粗多糖中单糖组成分析及各单糖组成比例,并探索其抗氧化、抗炎活性的作用机制,为扛板归的药用价值提供科学依据,为开发扛板归多糖在食品、医药行业的使用打下实验基础。
-
表 1 粗多糖对小鼠组织抗氧化指标的影响
Table 1 Effect of crude polysaccharides on tissue antioxidant indexes of mice
组别 剂量(mg/(kg·d)) 动物数量(只) 蛋白含量(g prot/L) T-SOD活力(U/mg prot) CAT活力(U/g prot) MDA含量(nmol/mL) 对照组 - 8 肝 1.70±0.22 54.51±2.33 402.97±94.02 4.77±1.19 肾 0.60±0.20 98.71±11.55 354.45±59.34 3.32±0.94 低剂量组 50 8 肝 1.99±0.10* 57.38±1.54* 431.94±80.43 3.78±1.19 肾 0.72±0.17 102.25±13.15 371.76±40.11 3.20±0.88 中剂量组 100 8 肝 2.03±0.25* 63.19±1.41** 443.76±28.46 2.50±1.08** 肾 0.78±0.16 115.50±5.96* 390.10±45.71 2.62±0.73 高剂量组 200 8 肝 2.11±0.16** 61.40±1.24** 536.93±67.83* 2.08±1.00** 肾 0.80±0.17 133.07±10.65** 421.21±46.71 2.54±1.01 注:*与对照组相比差异显著(P<0.05);**与对照组相比差异极显著(P<0.01)。 表 2 粗多糖对二甲苯诱导小鼠耳肿胀的影响
Table 2 Effect of crude polysaccharides on ear swelling model induced by xylol in mice
组别 剂量(mg/(kg·d)) 动物数量(只) 肿胀度(mg) 抑制率(%) 模型组 − 8 18.85±2.04 − 阳性对照组 5 8 14.38±5.07 23.71 低剂量组 50 8 14.97±8.32 20.58 中剂量组 100 8 13.90±4.01* 26.26 高剂量组 200 8 11.13±4.79** 40.95 注:*与模型组相比差异显著(P<0.05),**与模型组相比差异极显著(P<0.01)。 表 3 粗多糖对热板所致小鼠疼痛的影响
Table 3 Effect of crude polysaccharides on ache induced by hot plate in mice
组别 剂量(mg/(kg·d)) 动物数量(只) 痛阈(s) 痛阈提高率(%) 对照组 − 8 17.30±2.80 − 阳性对照组 5 8 24.63±4.48** 42.36 低剂量组 50 8 17.70±2.58 2.32 中剂量组 100 8 17.86±2.38 3.23 高剂量组 200 8 19.76±4.68 14.22 注:**与对照组相比差异极显著(P<0.01)。 表 4 抑菌作用结果(n=3)
Table 4 Results of bacteriostatic action (n=3)
样品 浓度(mg/mL) 大肠埃希氏菌(mm) 金黄色葡萄球菌(mm) 蒸馏水 − − − − − 硫酸链霉素 2 32.67±0.58 ++++ 24.33±0.58 ++++ 粗多糖 50 − − − − 100 − − − − 注:抑菌圈抑菌判断标准:抑菌圈直径≥20 mm为极敏感,用“++++”表示;无抑菌圈为耐药,用“−”表示。 -
[1] 张荣林, 孙晓翠, 李文欣, 等. 杠板归化学成分的分离与鉴定[J]. 沈阳药科大学学报,2008,25(2):105−107. [ZHANG R L, SUN X C, LI W X, et al. Isolation and identification of chemical constituents of Polygonum perfoliatum L doi: 10.3969/j.issn.1006-2858.2008.02.006 J]. Journal of Shenyang Pharmaceutical University,2008,25(2):105−107. doi: 10.3969/j.issn.1006-2858.2008.02.006
[2] 张道英, 孙湘婷, 钟亮, 等. 声辅助酶解法提取杠板归中总黄酮[J]. 赣 南 医 学 院 学 报,2019,39(6):552−557. [ZHANG D Y, SUN X T, ZHONG L, et al. Ultrasound-assisted enzymatic extraction of total flavonoids from Ploygonum perfoliatum L J]. Journal of Gannan Medical University,2019,39(6):552−557.
[3] XU L Y, HUANG G K, GUO X B, et al. Total flavonoids, extracted from Polygonum knotweed L. exert beneficial hepatoprotection against liver injury[J]. Journal of Cellular Biochemistry,2019,120(8):12677−12683. doi: 10.1002/jcb.28535
[4] LIU J Y, ZENG Y L, SUN G J, et al. Polygonum perfoliatum L. an excellent herbal medicine widely used in China:A review[J]. Frontiers in Pharmacology,2020,11:581260.
[5] LI Q L, FU X X, GE X Y, et al. Antitumor effects and related mechanisms of ethyl acetate extracts of Polygonum perfoliatum L.[J]. Frontiers in Oncology,2019,9(9):578.
[6] PENG L, CHEN H G, ZHOU X. Lipidomic investigation of the protective effects of Polygonum perfoliatum against chemical liver injury in mice[J]. Journal of Integrative Medicine,2023,21(3):289−301. doi: 10.1016/j.joim.2023.03.002
[7] GONG X J, ZHOU X, ZHAO C, et al. Anti-inflammatory properties of quercetin-3-O-β-D-glucuronide-methyl ester from Polygonum perfoliatum in mice[J]. International Journal of Pharmacology,2013,9(8):533−537. doi: 10.3923/ijp.2013.533.537
[8] 徐顶巧, 黄露, 乐世俊, 等. 基于层次分析-熵权法和指纹图谱的杠板归质量标志物研究[J]. 中国中药杂志,2022,47(7):1776−1789. [XU D Q, HUANG L, YUE S J, et al. Research on Q-markers of Polygoni perfoliati herba based on analytic hierarchy process-entropy weight method and fingerprints[J]. China Journal of Chinese Matria Medica,2022,47(7):1776−1789.] XU D Q, HUANG L, YUE S J, et al. Research on Q-markers of Polygoni perfoliati herba based on analytic hierarchy process-entropy weight method and fingerprints[J]. China Journal of Chinese Matria Medica, 2022, 47(7): 1776−1789.
[9] 徐顶巧, 黄露, 陈艳琰, 等. 杠板归的化学成分、药理作用及质量标准研究进展[J]. 中国野生植物资源,2021,40(12):31−34. [XU D Q, HUANG L, CHEN Y Y, et al. Research progress on chemical constituents, pharmacological action and quality standard of Polygonum perfoliatum L doi: 10.3969/j.issn.1006-9690.2021.12.008 J]. Chinese Wild Plant Resources,2021,40(12):31−34. doi: 10.3969/j.issn.1006-9690.2021.12.008
[10] 郑伊琦, 张安强, 张小军, 等. 响应面优化猪苓菌核多糖超声辅助提取工艺及抗氧化活性分析[J]. 食品工业科技,2023,44(16):255−263. [ZHENG Y Q, ZHANG A Q, ZHANG X J, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Polyporus umbellatus sclerotium by response surface methodology and antioxidant activity[J]. Science and Technology of Food Industry,2023,44(16):255−263.] ZHENG Y Q, ZHANG A Q, ZHANG X J, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Polyporus umbellatus sclerotium by response surface methodology and antioxidant activity[J]. Science and Technology of Food Industry, 2023, 44(16): 255−263.
[11] 魏磊, 王伟, 谢晓阳, 等. 响应面优化博爱赤松茸多糖提取工艺及其抑菌和抗氧化活性研究[J]. 食品工业科技,2023,44(15):213−220. [WEI L, WANG W, XIE X Y, et al. Optimization of extraction process of polysaccharides from Stropharia rugosoannulata in Bo'ai county by response surface method and evalation of their antibacterial and antioxidant activity[J]. Science and Technology of Food Industry,2023,44(15):213−220.] WEI L, WANG W, XIE X Y, et al. Optimization of extraction process of polysaccharides from Stropharia rugosoannulata in Bo'ai county by response surface method and evalation of their antibacterial and antioxidant activity[J]. Science and Technology of Food Industry, 2023, 44(15): 213−220.
[12] 陈晓乐, 李文文, 陈锵, 等. 牛蒡中性多糖结构分析与抗炎活性评价[J]. 食品工业科技,2023,44(12):45−54. [CHEN X L, LI W W, CHEN Q, et al. Structure analysis and anti-inflammatory activity evaluation of neutral polysaccharides from Arctium lappa L J]. Science and Technology of Food Industry,2023,44(12):45−54.
[13] 李媛媛, 李奉楠, 杨小明, 等. 桑黄菌丝体多糖的分离纯化及抗氧化、抗肿瘤活性分析[J]. 食品工业科技,2023,44(11):127−135. [LI Y Y, LI F N, YANG X M, et al. Fractionation, purification and antioxidant, antitumor activity of polysaccharides from Phellinus igniarius mycelia[J]. Science and Technology of Food Industry,2023,44(11):127−135.] LI Y Y, LI F N, YANG X M, et al. Fractionation, purification and antioxidant, antitumor activity of polysaccharides from Phellinus igniarius mycelia[J]. Science and Technology of Food Industry, 2023, 44(11): 127−135.
[14] 赵婷婷, 戴映笛, 舒昉, 等. 灵芝菌丝体多糖提取工艺优化及其对慢性酒精肝损伤的保护作用[J]. 食品工业科技,2023,44(5):388−396. [ZHAO T T, DAI Y D, SHU F, et al. Optimization of extraction technology of polysaccharides from Ganoderma lingzhi mycelium and its protective effect on alcoholic liver injury[J]. Science and Technology of Food Industry,2023,44(5):388−396.] ZHAO T T, DAI Y D, SHU F, et al. Optimization of extraction technology of polysaccharides from Ganoderma lingzhi mycelium and its protective effect on alcoholic liver injury[J]. Science and Technology of Food Industry, 2023, 44(5): 388−396.
[15] 许继隆, 李中原, 于子豪, 等. 多糖的降血压作用及其机制研究进展[J]. 食品工业科技,2023,44(3):461−469. [XU J D, LI Z Y, YU Z H, et al. Research progress on antihypertensive effect of polysaccharide and its mechanism[J]. Science and Technology of Food Industry,2023,44(3):461−469.] XU J D, LI Z Y, YU Z H, et al. Research progress on antihypertensive effect of polysaccharide and its mechanism[J]. Science and Technology of Food Industry, 2023, 44(3): 461−469.
[16] 关玉婷, 温思萌, 冯雪, 等. 茯苓渣多糖组成分析及体外抗癌、免疫活性研究[J]. 食品工业科技,2022,43(21):381−387. [GUAN Y T, WEN S M, FENG X, et al. Composition analysis, anticancer and immune activities of polysaccharides from Poria cocos residues in vitro[J]. Science and Technology of Food Industry,2022,43(21):381−387.] GUAN Y T, WEN S M, FENG X, et al. Composition analysis, anticancer and immune activities of polysaccharides from Poria cocos residues in vitro[J]. Science and Technology of Food Industry, 2022, 43(21): 381−387.
[17] LAI X X, LI Y P. Antitumor effect and mechanism of action of polysaccharides extracted from Polygonum perfoliatum L. whole plant in human lung carcinoma A549 cell line[J]. Tropical Journal of Pharmaceutical Research,2016,15(6):1243−1249. doi: 10.4314/tjpr.v15i6.17
[18] 杨菁, 蒋乐巧, 谢娟, 等. 响应面法优化杠板归多糖的提取工艺[J]. 安徽农业科学,2018,46(23):136−138. [YANG J, JIANG L Q, XIE J, et al. Optimization of extraction process of Polygonum perfoliatum L. polysaccharides by response surface method[J]. Journal of Anhui Agricultural Sciences,2018,46(23):136−138.] doi: 10.3969/j.issn.0517-6611.2018.23.042 YANG J, JIANG L Q, XIE J, et al. Optimization of extraction process of Polygonum perfoliatum L. polysaccharides by response surface method[J]. Journal of Anhui Agricultural Sciences, 2018, 46(23): 136−138. doi: 10.3969/j.issn.0517-6611.2018.23.042
[19] 黄家伟, 王非非, 邱玉婷, 等. 丙酮沉淀法提取杠板归多糖的工艺研究[J]. 华夏医学,2012,25(4):484−486. [[HUANG J W, WANG F F, QIU Y T, et al. Study on acetone extraction of the polysaccharide from Polygonum perfoliatum[J]. Acta Medicine Sinica,2012,25(4):484−486.] doi: 10.3969/j.issn.1008-2409.2012.04.005 [HUANG J W, WANG F F, QIU Y T, et al. Study on acetone extraction of the polysaccharide from Polygonum perfoliatum[J]. Acta Medicine Sinica, 2012, 25(4): 484−486. doi: 10.3969/j.issn.1008-2409.2012.04.005
[20] 王庆, 薛天乐, 丁锐. 杠板归多糖的纤维素酶提取工艺及体外抗氧化作用[J]. 宜宾学院学报,2017,17(6):103−107. [WANG Q, XUE T L, DING R. The cellulase extraction technology and antioxidant activity of Polygonum perfoliatum L. polysaccharide[J]. Journal of Yibin University,2017,17(6):103−107.] doi: 10.3969/j.issn.1671-5365.2017.06.023 WANG Q, XUE T L, DING R. The cellulase extraction technology and antioxidant activity of Polygonum perfoliatum L. polysaccharide[J]. Journal of Yibin University, 2017, 17(6): 103−107. doi: 10.3969/j.issn.1671-5365.2017.06.023
[21] 梁珊珊, 魏晴, 薛娟, 等. 杠板归多糖提取工艺优化及其体外抗氧化活性研究[J]. 广州化工,2021(17):94−97. [LIANG S S, WEI Q, XUE J, et al. Extraction technology of polysaccharides and in vitro antioxidant activities from Polygonum perfoliatum L doi: 10.3969/j.issn.1001-9677.2021.17.028 J]. Guangzhou Chemical Industry,2021(17):94−97. doi: 10.3969/j.issn.1001-9677.2021.17.028
[22] 刘玉佳, 孔繁东, 刘兆芳, 等. 桔梗多糖Sevag法除蛋白工艺的研究[J]. 中国调味品,2014,39(4):5−7. [LIU Y J, KONG F D, LIU Z F, et al. Research on technology of deprotinization from polysaccharide of Platycodon grandiflorum by Sevag method[J]. China Condiment,2014,39(4):5−7.] doi: 10.3969/j.issn.1000-9973.2014.04.002 LIU Y J, KONG F D, LIU Z F, et al. Research on technology of deprotinization from polysaccharide of Platycodon grandiflorum by Sevag method[J]. China Condiment, 2014, 39(4): 5−7. doi: 10.3969/j.issn.1000-9973.2014.04.002
[23] 徐怀德, 李晋, 李钰金, 等. 大孔吸附树脂脱除洋葱多糖色素技术研究[J]. 食品科学,2012,33(6):127−131. [XU H D, LI J, LI Y J, et al. Using macroporous resin AB-8 for pigment removal from onion polysaccharides[J]. Food Science,2012,33(6):127−131.] XU H D, LI J, LI Y J, et al. Using macroporous resin AB-8 for pigment removal from onion polysaccharides[J]. Food Science, 2012, 33(6): 127−131.
[24] 裴世成, 卢慧英, 王云, 等. 扛板归多糖含量测定方法的建立[J]. 食品工业科技,2018,39(18):201−208. [PEI S C, LU H Y, WANG Y, et al. Establish a determination method of polysaccharides from Polygonum perfoliatum L J]. Science and Technology of Food Industry,2018,39(18):201−208.
[25] LI J W, LIU Y F, FAN L P, et al. Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus jujuba cv. Jinsixiaozao[J]. Carbohydrate Polymers,2011,84(1):390−394. doi: 10.1016/j.carbpol.2010.11.051
[26] OHATA M, UCHIDA S, ZHOU L X, et al. Antioxidant activity of fermented meat sauce and isolation of an associated antioxidant peptide[J]. Food Chemistry,2016,194(0):1034−1039.
[27] 刘梦杰, 王飞, 张燕, 等. 黄芩多糖的体内抗氧化活性[J]. 中国食品学报,2016,16(7):52−59. [LIU M J, WANG F, ZHANG Y, et al. Antioxidant activity in vivo of polysaccharides from Scutellaria baicalensis georgi[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(7):52−59.] LIU M J, WANG F, ZHANG Y, et al. Antioxidant activity in vivo of polysaccharides from Scutellaria baicalensis georgi[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(7): 52−59.
[28] 张正兵, 蔡俊生, 王素军, 等. 艾叶水提液对二甲苯致炎小鼠的抗炎作用研究[J]. 临床医药文献,2017,4(48):9318−9319. [ZHANG Z B, CAI J S, WANG S J, et al. Study on the anti-inflammatory effect of water extract from Artemisia argyi leaf on xylene induced inflammation in mice[J]. Journal of Clinical Medical,2017,4(48):9318−9319.] ZHANG Z B, CAI J S, WANG S J, et al. Study on the anti-inflammatory effect of water extract from Artemisia argyi leaf on xylene induced inflammation in mice[J]. Journal of Clinical Medical, 2017, 4(48): 9318−9319.
[29] 黄莹, 兰天, 裴世成, 等. 复方中药烫伤凝胶的抗炎、抑菌及镇痛作用研究[J]. 广西医学,2015,37(12):1705−1707. [HUANG Y, LAN T, PEI S C, et al. Anti-inflmmatory, anti-bacteria and analgesic effects of compound traditional Chinese medicine Tangshang gelatin[J]. Guangxi Medical Journal,2015,37(12):1705−1707.] HUANG Y, LAN T, PEI S C, et al. Anti-inflmmatory, anti-bacteria and analgesic effects of compound traditional Chinese medicine Tangshang gelatin[J]. Guangxi Medical Journal, 2015, 37(12): 1705−1707.
[30] INDRANIL B, KUMAR C S, GHOSH A, et al. Antibacterial activities of some plant extracts used in Indian traditional folk medicine[J]. Asian Pacific Journal of Tropical Biomedicine,2011,1(2Supp):S165−S169.
[31] 席波. 海洋微藻的活性筛选及活性成分的功能研究[D]. 天津:天津科技大学, 2015. [XI B. Functional studies of marine microalgae on activity screening and active ingredients[D]. Tianjin:Tianjin University of Science and Technology, 2015.] XI B. Functional studies of marine microalgae on activity screening and active ingredients[D]. Tianjin: Tianjin University of Science and Technology, 2015.
[32] 罗磊, 张冰洁, 关宁宁, 等. 金银花叶黄酮对衰老模型小鼠的体内抗氧化作用[J]. 食品科学,2017,38(19):171−176. [LUO L, ZHANG B J, GUAN N N, et al. In vivo antioxidant activity of Honeysuckle leaf flavonoids in aging mice[J]. Food Science,2017,38(19):171−176.] doi: 10.7506/spkx1002-6630-201719027 LUO L, ZHANG B J, GUAN N N, et al. In vivo antioxidant activity of Honeysuckle leaf flavonoids in aging mice[J]. Food Science, 2017, 38(19): 171−176. doi: 10.7506/spkx1002-6630-201719027
[33] ABUJA P M, ALBERTINI R. Methods for monitoring oxidative stress, lipid peroxidation and oxidation resistance of lipoproteins[J]. Clinica Chimica Acta,2001,306(1-2):1−17. doi: 10.1016/S0009-8981(01)00393-X
[34] 谷捷, 李鑫, 余黄合, 等. 二甲苯致小鼠耳肿胀急性炎症模型的建立[J]. 湖南中医药大学学报,2016,32(5):32−35. [GU J, LI X, YU H H, et al. Establishment of acute inflammation mice models with ear edema induced by dimethylbenzene[J]. Journal of Hunan University of Chinese Medicine,2016,32(5):32−35.] doi: 10.3969/j.issn.1674-070X.2016.05.008 GU J, LI X, YU H H, et al. Establishment of acute inflammation mice models with ear edema induced by dimethylbenzene[J]. Journal of Hunan University of Chinese Medicine, 2016, 32(5): 32−35. doi: 10.3969/j.issn.1674-070X.2016.05.008
[35] NAVARRO M B, HUTTNER B, HARBARTH S. Methicillin-resistant Staphylococcus aureuscontrol in the 21st century:Beyond the acute care hospital[J]. Current Opinion in Infectious Diseases,2008,21(4):372−379. doi: 10.1097/QCO.0b013e3283013add
[36] KANMANI P, SATISH KUMAR R, YUVARA J, et al. Production and purification of a novel exopolysaccharide from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J]. Bioresource Technology,2011,102(7):4827−4833. doi: 10.1016/j.biortech.2010.12.118





 下载:
下载:


 下载:
下载:
