Optimization of Lutein Complex Nanoparticle Preparation Process and Analysis of Stability and Antioxidant Activity
-
摘要: 为提高叶黄素(Lutein,LUT)溶解度和稳定性,本研究采用静电自组装法以大豆分离蛋白(Soybean protein isolates,SPI)及褐藻糖胶(Fucoidin,FUD)分别构建蛋白纳米粒和复合纳米粒的食品级纳米载药体系对LUT进行包埋。考察SPI/FUD质量比对叶黄素-大豆分离蛋白-褐藻糖胶三元复合纳米粒(LUT-SPI-FUD NPs)的影响,在此条件下,通过单因素实验和Box-Behnken响应面法优化其制备工艺;采用X射线衍射、差示扫描量热法和傅里叶红外光谱等表征方法来探讨两种纳米粒形成机制,对比研究两种纳米粒的溶解度、稳定性和抗氧化活性。结果表明,SPI/FUD质量比4:1时LUT-SPI-FUD NPs的Zeta电位绝对值大于30 mV、多分散指数和粒径较小;其最佳处方及工艺为:LUT/SPI质量比1:7.587,SPI质量浓度为0.83 mg/mL,搅拌时间为1.493 h;表征分析研究验证了两种纳米粒粒径大小理想,分布较为集中,结合作用力为氢键、疏水和静电相互作用;溶解度、稳定性及抗氧化试验表明将LUT制备成LUT-SPI NPs、LUT-SPI-FUD NPs后,其在纯化水中的溶解度分别提高了350.74、432.42倍,两者均极显著提高(P<0.01)LUT的紫外光、高温、氧气条件下的稳定性和抗氧化能力,且LUT-SPI-FUD NPs优于LUT-SPI NPs。因此,SPI与FUD构建的复合食品级纳米载药体系是更加有效提高LUT的溶解度、增强其稳定性和抗氧化活性并极具前途的技术,为LUT提供了新的选择。Abstract: To improve the solubility and stability of lutein (LUT), this study utilized the electrostatic self-assembly method to encapsulate LUT within food-grade protein nanoparticles and composite nanoparticles derived from soybean protein isolates (SPI) and fucoidin (FUD). The impact of the SPI/FUD mass ratio on the formation of ternary composite nanoparticles, known as lutein-soybean protein isolate-fucoidin nanoparticles (LUT-SPI-FUD NPs), was examined. The preparation process underwent optimization through single-factor experiments and the Box-Behnken response surface methodology. Various characterization techniques, including ultraviolet spectroscopy, Fourier-transform infrared spectroscopy, differential scanning calorimetry and X-ray diffraction were employed to delve into the mechanisms governing the formation of these two types of nanoparticles to compare with their solubility, stability, and antioxidant properties. The results showed that LUT-SPI-FUD NPs with SPI/FUD mass ratio of 4:1 had an absolute value of zeta potential greater than 30 mV, a polydispersity index, and a smaller particle size. Under these conditions, the most favorable formulation and process parameters were as follows: A LUT/SPI mass ratio of 1:7.587, SPI mass concentration of 0.83 mg/mL, and a stirring time of 1.493 hours. Characterization analysis verified the ideal particle size and more concentrated distribution of both LUT-SPI NPs and LUT-SPI-FUD NPs, and the binding forces were the interplay of hydrogen bonds, hydrophobic interactions, and electrostatic forces. Solubility, stability, and antioxidant assessments indicated that the conversion of LUT into LUT-SPI NPs and LUT-SPI-FUD NPs substantially increased its solubility in purified water by 350.74 and 432.42 times, respectively. Moreover, both formulations very significant (P<0.01) enhanced the stability and antioxidant capacity of LUT when subjected to ultraviolet light, high temperatures, and oxygen exposure, with LUT-SPI-FUD NPs exhibiting superior performance over LUT-SPI NPs. Consequently, the composite food-grade nanocarrier system, built upon SPI and FUD, represented a more effective technology for augmenting the solubility, stability, and antioxidant properties of LUT, and would offer a promising avenue for future LUT applications.
-
Keywords:
- lutein /
- nanoparticles /
- soybean isolate protein /
- fucoidan /
- process optimization /
- stability /
- antioxidants
-
叶黄素(Lutein,LUT)是一种重要的含氧类胡萝卜素,常见于花卉、玉米、菠菜和蛋黄中[1]。因其具有强大的抗氧化活性[2−3],所以LUT在维持人体正常生理功能方面发挥重要作用。如可以保护视网膜病变[4],降低肿瘤细胞活性[5],预防自闭症谱系障碍[6]等。但机体中LUT的补充仅能够通过从食物或保健品等来实现,不能自身合成[7],且天然LUT以全反式构象为主[8],其有8个立体异构体,3个不对称手性中心,其结构末端为2个羟基,1个共轭碳双键,且双键主链相对较长,导致其水溶性和稳定性差、易发生降解和异构化[9]。此外,LUT还易受光、氧、高温等环境因素的影响而失活,口服后生物利用度仅为2%~9.4%[10],极大限制LUT在食品工业、药品等领域的应用。因此,提高LUT的溶解度和稳定性是至关重要的问题。
利用蛋白质构建纳米营养物质传递载体,是提高食品活性成分稳定性和生物利用度很有前途的解决方案[11]。目前,基于蛋白质的LUT递送系统主要包括乳剂[12]、凝胶[13]和纳米颗粒[14]等。其中,纳米颗粒具有粒径小(1~100 nm)、载药量大等特点,应用最为广泛。大豆分离蛋白(Soybean protein isolates,SPI)作为一种营养价值高、价格低廉的蛋白质,具有可再生和自组装等特性,在水溶液中呈球形结构,外部亲水,内部疏水[15],可以将疏水性的功能性营养成分通过疏水相互作用和氢键等结合在载体的疏水性区域[16]。采用SPI作为LUT的载药材料构建的蛋白纳米粒,可通过非共价相互作用与LUT自组装形成纳米粒子[17−18],以提高LUT溶解度和稳定性。同时,研究表明在蛋白质纳米粒的基础上加入多糖,可以构建出更加稳定的复合纳米颗粒系统[19−20]。褐藻糖胶(Fucoidin,FUD)是一种海洋多糖,以生物相容性好、无毒等优势作为一种优良的载体材料,可以用来构建相应的纳米运载体系[21−22],发挥协同体系稳定作用。
因此,本研究以LUT水不溶性、不稳定性为研究出发点,采用具有营养价值的SPI以及生物相容性好的FUD分别构建蛋白纳米粒和复合纳米粒的食品级纳米载药体系对LUT进行包埋,通过差示扫描量热法及傅里叶红外光谱分析两种纳米粒的形成机制并对其稳定性、溶解度及抗氧化活性进行对比研究,选出更优的纳米载药体系,以解决LUT溶解度差及生物活性低等缺点,为以后LUT新剂型的研发提供了新的理论思路支撑,拓展了在食品、医药行业等领域的应用。
1. 材料与方法
1.1 材料与仪器
叶黄素 山东天音生物科技有限公司;叶黄素标准品、大豆分离蛋白、褐藻糖胶、溴化钾 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼 青岛捷世康生物科技有限公司;ABTS试剂盒 四川省维克奇生物科技有限公司;甲醇、无水乙醇 国药集团化学试剂有限公司;所有试剂均为分析纯。
JA5103X 十万分之一电子精密天平 上海民桥精密科学仪器有限公司;DKZ-2电热恒温振荡水槽 上海精宏实验设备有限公司;KQ2200B超声波清洗器 昆山市超声仪器有限公司;1200 HPLC色谱仪 安捷伦科技有限公司;DZ30-32C6高速台式离心机 上海安亭科学仪器厂;85-2数显恒温磁力搅拌器 常州市江南实验仪器厂;Epsilon 2-4 LSCplus真空冷冻干燥机 德国Christ有限公司;WP-UP-II-40超纯水机 四川沃特尔科技发展有限公司;RE-52AA旋转蒸发器 上海亚荣仪器厂;FTIR-8400S 傅立叶变换红外光谱仪 德国Bruker有限公司;LS-909E激光粒度分析仪 英国Malvern有限公司;XRD-7000 X-射线衍射仪 日本Shimadzu有限公司;DSC 3+差示扫描量热仪 梅特勒-托利多仪器有限公司;SYNERGY-LX型酶标仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 叶黄素-大豆分离蛋白-褐藻糖胶复合纳米粒的制备
参照Wu等[23]的方法并略作修改,精密称取100 mg大豆分离蛋白溶于5 mL去离子水中,水化过夜,备用。另取叶黄素溶于3 mL无水乙醇中,即得叶黄素溶液。将叶黄素溶液滴加至大豆分离蛋白溶液中,再加入适量褐藻糖胶,使最终大豆分离蛋白与褐藻糖胶质量比依次为8:1、6:1、4:1、2:1、1:1、1:2,搅匀,45 ℃减压除去无水乙醇,即得叶黄素-大豆分离蛋白-褐藻糖胶复合纳米粒(LUT-SPI-FUD NPs)溶液,11000 r/min离心30 min,上清液置于4 ℃冰箱内保存备用,以去除未包封的叶黄素。并以粒径、多分散指数(PDI)、Zeta电位为考察指标,来考察上述不同大豆分离蛋白与褐藻糖胶质量比对复合纳米粒溶液的影响。不加褐藻糖胶得叶黄素-大豆分离蛋白纳米粒(LUT-SPI NPs)溶液。
1.2.2 叶黄素复合纳米粒制备工艺优化
1.2.2.1 包封率、载药量及渗漏率的测定
HPLC色谱条件:色谱柱:ZORBOX XDB-C18;流动相:甲醇-水(95:5,V/V);检测波长:445 nm;柱温:25 ℃;流速:1.0 mL/min;进样量:10 μL。此色谱条件下对叶黄素对照品进行线性关系考察。精密称取叶黄素对照品1.0 mg,置于25 mL棕色量瓶中,加入甲醇定容,摇匀,0.22 μm微孔滤膜过滤,即得对照品溶液,取对照品溶液适量,分别稀释至浓度梯度为10、15、20、25、30、35 μg/mL,按上述条件测定峰面积,以Y(峰面积)与X(对照品浓度)得线性回归方程Y=139.84X+32.578,R2=0.9990,表明叶黄素在10~35 μg/mL范围内具有良好的线性关系。
采用高速离心法[24]测定包封率(EE)、载药量(DL)及渗漏率(LR),精密吸取LUT-SPI-FUD NPs 1 mL于离心管中,11000 r/min离心30 min,沉淀用无水乙醇溶解,0.22 μm滤膜过滤,HPLC色谱仪进样,代入线性回归方程中测定游离药量,计算EE和DL公式如下:
EE(%)=总药量−游离药量总药量×100 DL(%)=总药量−游离药量纳米粒总重×100 式中:EE为包封率,%;DL为载药量,%;总药量为纳米粒中叶黄素总投药量,mg;游离药量为离心后游离的叶黄素量,mg;纳米粒总重,mg。
再分别取新鲜制备的及置于4 ℃冰箱内储存48 h后的LUT-SPI-FUD NPs混悬液,在11000 r/min离心30 min,计算纳米粒渗漏率[25],公式如下:
LR(%)=m48−m游m−m游×100 式中:LR为渗漏率,%;m48为经48 h沉降后的复合纳米粒混悬液药物含量,mg;m游为游离药量,mg;m为投药量,mg。
1.2.2.2 单因素实验
在确定SPI/FUD质量比后,按“1.2.1”项下方法,固定其余条件不变,以EE、DL、LR为考察指标,研究SPI质量浓度(0.5、1、1.5、2、2.5、3 mg/mL)、滴加速度(0.5、1、2、3、4 mL/min)、搅拌速度(150、300、450、600、900、1200 r/min)、LUT/SPI质量比(1:6、1:8、1:10、1:12、1:14、1:16)、搅拌时间(0.5、1、1.5、2、2.5、3 h)等因素对LUT-SPI-FUD NPs的影响。
1.2.2.3 Box-Behnken响应面法优化试验
在进行单因素考察后,以EE、DL及LR的总归一值(OD)作为LUT-SPI-FUD NPs工艺优化的评价指标。进一步选三个因素进行Box-Behnken Design响应面法实验设计以确定最优工艺。设置三个水平,具体水平如表1所示。
表 1 响应面试验设计与因素水平Table 1. Response surface experimental design and factor levels水平 因 素 A LUT/SPI质量比 B SPI质量浓度(mg/mL) C搅拌时间(h) −1 1:10 2.0 1:2 0 1:8 2.5 1:3 1 1:6 3.0 1:4 OD值由Hassan法[26]计算得到,且EE和DL值越大,LR值越小则表明LUT-SPI-FUD NPs越稳定,计算公式如下:
d1或d2=Y1−YminYmax−Ymin d3=Ymax−Y1Ymax−Ymin 总归一值OD计算公式如下:
OD=3√(d1×d2×d3) 式中:OD代表总归一值;d1、d2、d3分别代表着LUT-SPI-FUD NPs的EE、DL及LR的相应归一值;Y1代表各处方的实测值;Ymax代表测得的最大值;Ymin代表测得的最小值。
1.2.3 叶黄素蛋白纳米粒、复合纳米粒表征及形成机制分析
1.2.3.1 粒径、Zeta电位、多分散指数的测定
参考孙艺等[27]的方法并略有修改,将新鲜制备的LUT-SPI NPs、LUT-SPI-FUD NPs纳米溶液稀释至合适浓度后,置于样品池中,采用激光粒度分析仪测定LUT-SPI NPs、LUT-SPI-FUD NPs的粒径、Zeta电位以及多分散指数(PDI)。
1.2.3.2 X射线衍射分析
参考李伟宏等[28]的方法并略有修改,取适量叶黄素、蛋白纳米粒、复合纳米粒,置于X射线衍射仪上,在40 kV/30 mA的管压/管流下,测定各样品在3°~50°(2θ)的衍射峰强度,绘制XRD谱图。
1.2.3.3 差示扫描量热法分析
参考Hosseini等[29]的方法并略有修改,以空铝坩作为空白,在铝坩中分别放置5 mg的LUT、SPI、FUD、相应物理混合物和蛋白纳米粒、复合纳米粒,N2为吹扫气,以10 ℃/min的升温速度,在30~300 ℃温程内进行差示扫描量热分析。
1.2.3.4 傅里叶红外光谱分析
参考Zhao等[30]的方法并略有修改,取2 mg的LUT、SPI、FUD、相应物理混合物和LUT-SPI NPs、LUT-SPI-FUD NPs,与200 mg的溴化钾粉末混合研匀,压片,利用红外光谱仪测定400~4000 cm−1范围内的透光率。
1.2.4 不同条件下叶黄素稳定性研究
参考马晴等[31]及马晓雨[32]的方法并略有修改,取叶黄素2.5 mg,分别考察置于不同光照(避光、自然光、强光和紫外光)、避光置于不同温度(4、25、40、60、75 ℃)、避光置于氧气和无氧条件下放置12 h,每隔2 h取样,用甲醇定容至2 mL,按“1.2.2.1”色谱条件下,于HPLC色谱仪进样测定含量,保存率计算公式如下:
保存率(%)=不同条件作用后的叶黄素的含量叶黄素的初始含量×100 1.2.5 叶黄素蛋白纳米粒、复合纳米粒稳定性研究
1.2.5.1 光稳定性
稳定性研究方法与上述“1.2.4”项下方法一致,取适量LUT、LUT-SPI NPs、LUT-SPI-FUD NPs置于紫外光条件下,分别在1、2、3、4、5、6、7 d时取样,用甲醇定容至2 mL容量瓶,按“1.2.2.1”色谱条件下,于HPLC色谱仪进样测定,并按上述公式计算保存率。
1.2.5.2 温度稳定性
取适量LUT、LUT-SPI NPs、LUT-SPI-FUD NPs置于75 ℃恒温水浴锅中,分别在1、2、3、4、5、6、7 d取样,用甲醇定容至2 mL,按“1.2.2.1”色谱条件下,于HPLC色谱仪进样测定,并按上述公式计算保存率。
1.2.5.3 空气稳定性
取适量LUT、LUT-SPI NPs、LUT-SPI-FUD NPs置于空气中,分别在1、2、3、4、5、6、7 d时取样,用甲醇定容至2 mL,按“1.2.2.1”色谱条件下,于HPLC色谱仪进样测定,并按上述公式计算保存率。
1.2.6 叶黄素蛋白纳米粒、复合纳米粒溶解度测定
参考赵宏宇等[33]的方法并略有修改,精密称取过量LUT粉末、LUT-SPI NPs、LUT-SPI-FUD NPs、LUT和SPI二者物理混合物、LUT、SPI和FUD三者物理混合物,分别加入10 mL纯化水(WP-UP-II-40超纯水机纯化后),涡旋10 min后置37 ℃恒温振荡器中,100 r/min连续振荡48 h,在3600 r/min条件下离心10 min,取上清液过滤,按“1.2.2.1”色谱条件下,于HPLC色谱仪进样测定,代入标准曲线,即得各物质在水中的平衡溶解度。
1.2.7 叶黄素蛋白纳米粒、复合纳米粒抗氧化活性分析
1.2.7.1 DPPH自由基清除率测定
参考王崑仑等[34]的方法并略有修改,取LUT、SPI-LUT、SPI-LUT-FUD分别配制浓度为25、50、100、150、200、250 μg/mL的相应溶液。取100 μL相应浓度的上述样品溶液分别与同体积的DPPH溶液混合,在避光条件下放置30 min,测定其在517 nm处的吸光度值记为A1;取100 μL LUT、LUT-SPI NPs、LUT-SPI-FUD NPs溶液,分别与同体积的无水乙醇混合,作为样品对照组,吸光度记为A2;取100 μL的无水乙醇与DPPH溶液混合,作为空白对照组,吸光度记为A0。按照如下公式计算DPPH自由基的清除率:
DPPH清除率(%)=A0−A1+A2A0×100 1.2.7.2 ABTS+自由基清除率测定
参考涂玲飞等[35]的方法并略有修改,取LUT、LUT-SPI NPs、LUT-SPI-FUD NPs分别配制浓度为25、50、100、150、200、250 μg/mL的相应溶液。将0.1 mL ABTS+工作液与上述不同浓度样品溶液混合,常温避光反应6 min,测定各样品溶液在734 nm处的吸光度值记为A1;将0.1 mL ABTS+工作液与无水乙醇溶液混合,作为空白对照组,吸光度记为A0。ABTS+自由基清除能力由下式计算:
ABTS+自由基清除率(%)=A0−A1A0×100 1.3 数据处理
每个实验至少重复三次,结果表示为“平均值±标准差”,采用Origin 2019软件作图,Excel数据处理,统计差异通过单因素方差分析(ANOVA)确定,使用软件Design-Expert 12对响应面优化实验数据进行分析。
2. 结果与分析
2.1 SPI/FUD质量比对叶黄素复合纳米粒的影响
蛋白与多糖质量比的不同,会改变它们各自的电荷密度值,影响二者间相互作用,由此改变所形成的复合纳米粒的性质[36]。随着SPI/FUD质量比的增加,LUT-SPI-FUD NPs的粒径呈逐渐上升的变化趋势(表2),这可能是因为有更多的FUD链缠绕在了SPI的表面,导致粒径的增大,但也正是由于FUD吸附在了SPI表面,才能够抑制SPI的聚集;因此,除2:1外,PDI随着FUD的增多而呈现下降趋势,PDI越小,纳米粒子溶液的均一性越好。同时FUD多糖链的伸展,在一定程度上也可能为LUT提供更多的结合位点和封闭空间,进而增强LUT的相应稳定性。而随着FUD的增加,LUT-SPI-FUD NPs的Zeta电位绝对值逐渐增大,表明LUT-SPI-FUD NPs的电位主要依靠FUD,FUD的确在LUT-SPI-FUD NPs表面,形成了以FUD为壳,SPI为核的核壳型复合纳米粒子。一般来说,Zeta电位的绝对值大于30 mV时,可认为此分散体是稳定的,故虽然SPI与FUD质量比为8:1、6:1时粒径最小,但其Zeta电位均小于30 mV,而4:1时Zeta电位绝对值大于30 mV,粒径和PDI均较小,综合考虑,最终选择4:1作为SPI与FUD的最佳质量比。
表 2 不同SPI/FUD质量比对粒径、PDI和Zeta电位的影响Table 2. Effects of different SPI/FUD mass ratios on particle size, PDI and Zeta potentialSPI/FUD质量比 粒径(nm) PDI Zeta电位(mV) 8:1 109.07±0.15b 0.21±0.04bc −27.27±0.06a 6:1 125.63±0.66ab 0.22±0.16b −28.07±1.16a 4:1 139.83±1.20ab 0.15±0.02e −31.90±1.70b 2:1 144.23±3.47ab 0.46±0.50a −35.27±4.55c 1:1 147.53±2.78a 0.17±0.12d −37.77±1.25c 1:2 178.70±1.10a 0.09±0.34f −41.60±1.76d 注:同列数据不同小写字母表示差异显著(P<0.05)。 2.2 叶黄素复合纳米粒制备工艺优化结果
2.2.1 单因素实验对叶黄素复合纳米粒制备工艺的影响
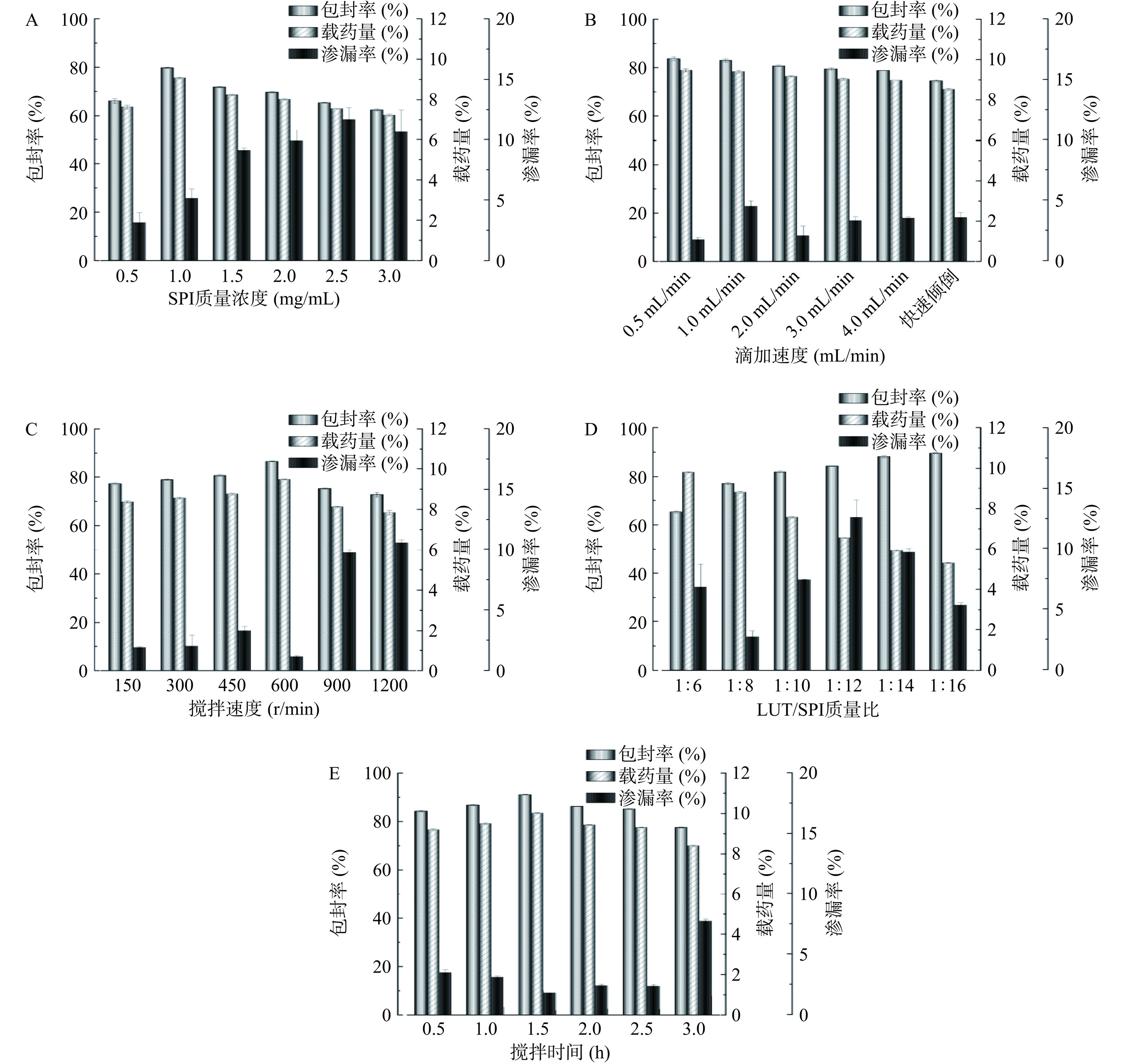
随着SPI质量浓度的增加,渗漏率大幅度增加,包封率与载药量均呈现先上升后下降的趋势(图1A),至1 mg/mL时相应的包封率、载药量均达到最大值,但SPI浓度超过1 mg/mL时,较高的浓度导致蛋白与蛋白之间相互作用,发生一定程度地聚集,导致体系不稳定,因此,蛋白浓度越高,其渗漏率越大,同时造成包封率、载药量略下降,综上,选择0.5、1、1.5 mg/mL进行后续响应面优化设计。
随着滴加速度的加快,LUT的包封率和载药量变低(图1B)。因为滴加速度越慢,叶黄素越能更好地分散在蛋白溶液中,进而形成纳米粒;滴加速度过快时,易导致瞬间叶黄素粒子聚集在某一区域,使叶黄素易分散不均匀,不能更好地与SPI蛋白进行结合,导致包封率与载药量反而下降,同时,滴加速度过快也会导致未包封的叶黄素吸附在纳米粒表面,使渗漏率逐渐增加。因此,确定最佳的滴加速度为0.5 mL/min。
当搅拌速度小于600 r/min时,随着搅拌速度的增大,叶黄素与载体具有充足的作用力使二者能够充分地进行结合,使包封率和载药量呈上升趋势,且渗漏率先增大后变小(图1C);在600 r/min时,包封率和载药量达至最大值,且此时渗漏率最小;当搅拌速度超过600 r/min,随着转速的加大,较强地机械作用力会破坏纳米粒,使其包封率下降,渗漏率增加。综上,选择600 r/min作为最佳搅拌速度,进行后续实验。
随着SPI投入量的增大,包封率呈逐渐上升趋势(图1D),这是由于当SPI载体量较少时,相应的,其能提供的疏水性区域有限,不能保证与全部叶黄素都能进行反应,也超过了载体的最大承载量,以致一部分叶黄素会游离或者吸附聚集在SPI表面[32];而随着载体量的增多,使之能够提供足够的疏水区域用来结合叶黄素,进而提高包封率,但同时,由于整体质量的增加,会使载药量越来越小;渗漏率的变化反应纳米粒的稳定性,随着载体的增多,渗漏率整体上逐渐加大,表明过多的载体会造成纳米粒的不稳定性。故综合考虑,选择LUT/SPI质量比为1:6、1:8、1:10进行后续响应面优化设计。
当搅拌时间为0.5~1.5 h时,其包封率和载药量均逐渐增大,且渗漏率逐渐变小(图1E),可能是因为随着搅拌时间的延长,叶黄素与载体具有充分的时间进行结合,且此时的纳米体系相对稳定,但当搅拌时间超过1.5 h后,过长的搅拌时间可能导致了纳米粒子间及其与容器壁的碰撞增多,进而引发药物泄漏。综合考虑,选择1、1.5、2 h进行后续响应面优化设计。
2.2.2 Box-Behnken响应面试验结果
使用软件Design-Expert 12对BBD设计得到的实验数据(表3)进行数据分析。由分析结果表4可知,所建立的回归模型具有显著性(P<0.0001),失拟项无显著性(P>0.05),表明所建模型可靠,拟合效果好,可用于结果分析。
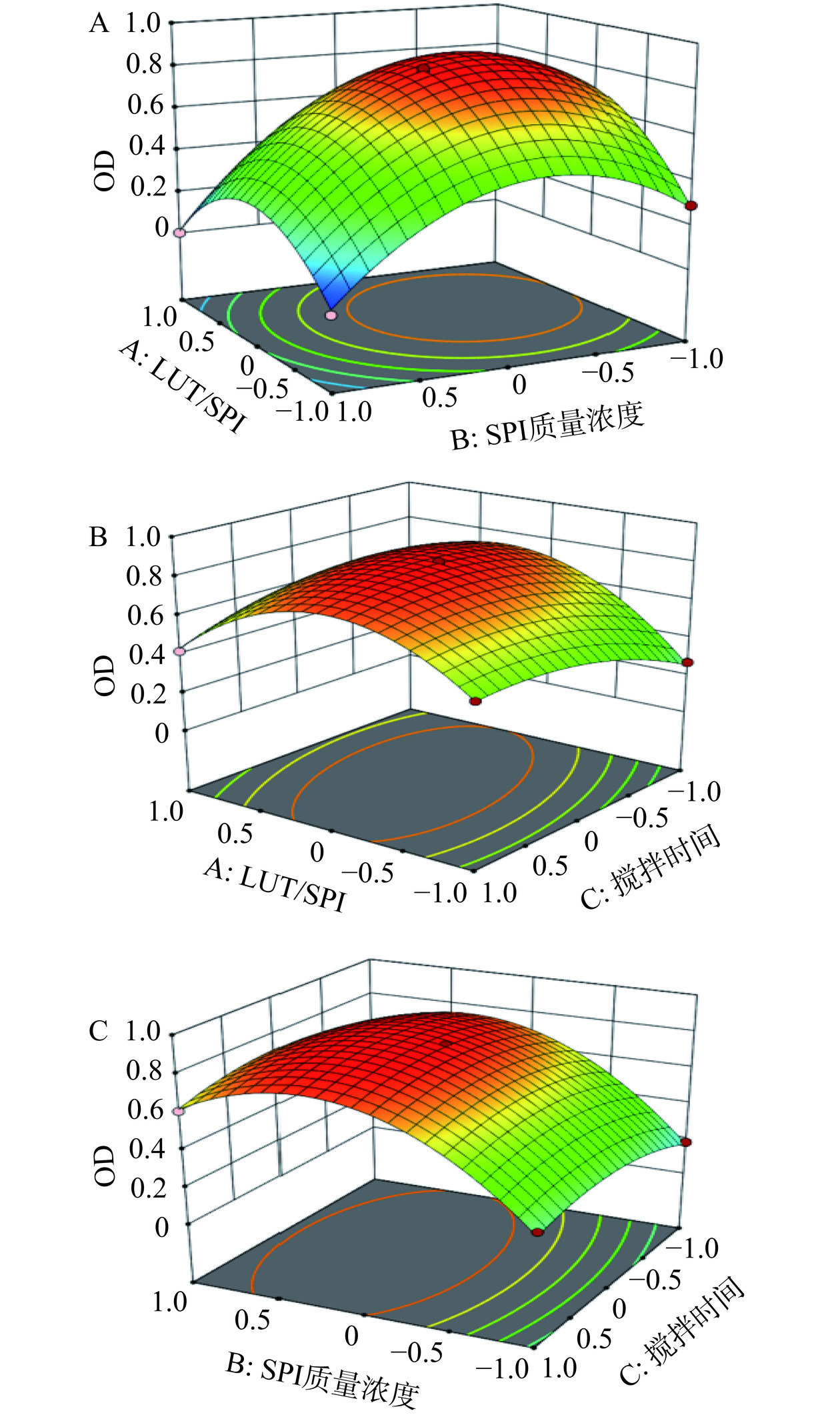
表 3 Box-Behnken试验设计与结果Table 3. Design and results of Box-Behnken experimental实验号 A(LUT/SPI质量比) B(SPI质量浓度) C(搅拌时间) EE(%) DL(%) LR(%) OD值 1 0 0 0 91.42±0.064 8.38±0.005 0.75±0.067 0.83 2 1 −1 0 80.39±0.385 9.68±0.042 4.58±0.326 0.59 3 1 0 1 73.20±0.576 8.89±0.064 2.34±0.126 0.42 4 0 1 −1 71.52±0.191 6.67±0.017 3.51±0.747 0.18 5 0 0 0 92.15±0.125 8.44±0.010 0.91±0.412 0.84 6 0 0 0 92.13±0.001 8.44±0.000 0.85±0.134 0.84 7 0 0 0 92.22±0.149 8.44±0.012 1.65±0.161 0.81 8 −1 0 −1 88.55±0.141 6.62±0.010 6.88±0.142 0.27 9 1 0 −1 77.17±0.316 9.33±0.035 2.30±0.124 0.59 10 0 1 1 73.37±0.164 6.84±0.014 2.52±0.480 0.28 11 0 −1 −1 83.20±0.244 7.68±0.021 1.79±0.290 0.60 12 −1 0 1 90.33±0.215 6.74±0.015 2.40±0.073 0.50 13 −1 −1 0 83.21±0.195 6.24±0.014 1.03±0.143 0.29 14 0 0 0 93.66±0.071 8.56±0.006 1.92±0.303 0.83 15 1 1 0 70.30±0.075 8.57±0.008 8.18±0.287 0.00 16 0 −1 1 83.17±0.532 7.68±0.045 1.24±0.175 0.61 17 −1 1 0 80.98±0.298 6.08±0.021 4.42±0.019 0.00 表 4 Box-Behnken设计的方差分析结果Table 4. ANOVA results of Box-Behnken design来源 平方和 自由度 均方 F值 P值 显著性 模型 1.33 9 0.1482 298.60 <0.0001 ** A 0.0365 1 0.0365 73.42 <0.0001 ** B 0.3321 1 0.3321 669.00 <0.0001 ** C 0.0036 1 0.0036 7.28 0.0307 * AB 0.0225 1 0.0225 45.32 0.0003 ** AC 0.0400 1 0.0400 80.58 <0.0001 ** BC 0.0020 1 0.0020 4.08 0.0832 A2 0.3572 1 0.3572 719.47 <0.0001 ** B2 0.4278 1 0.4278 861.75 <0.0001 ** C2 0.0370 1 0.0370 74.55 <0.0001 ** 残差 0.0035 7 0.0005 失拟项 0.0029 3 0.0010 6.39 0.0526 纯误差 0.0006 4 0.0001 总离差 1.34 16 注:*代表具有显著性差异P<0.05;**代表具有极显著差异P<0.001。 拟合分析得到二次回归方程为:Y=0.83+0.0675A−0.2037B+0.0213C−0.0750AB−0.1000AC+0.0225BC−0.2913A2−0.3187B2−0.0938C2。其中A、B、C、AB、AC、A2、B2、C2对OD值的影响均显著(P<0.05或P<0.01),且A、B、C对OD值影响的大小顺序为B>A>C。
同时对表4的数据进行二元多次回归拟合,A(LUT/SPI质量比)、B(SPI质量浓度)、C(搅拌时间)三个因素对OD值(Y)的影响交互作用关系见图2。一般响应曲线越陡峭,等高线越密集,该工艺条件对响应值影响越显著,交互作用越强。由图2结果分析可知,AC之间交互作用对响应值的影响比AB、BC之间的交互作用强。
2.2.3 最优处方验证试验结果
响应面试验得到的最佳处方为:LUT/SPI质量比为1:7.587,SPI质量浓度为0.83 mg/mL,搅拌时间为1.493 h,模型预测OD值为0.87。按此处方平行制备三批LUT-SPI-FUD NPs,得到OD值为0.87±2.64,与预测OD值偏差极小,无显著性差异,说明预测性好,表明LUT-SPI-FUD NPs最优制备工艺稳定可靠。
2.3 叶黄素蛋白纳米粒、复合纳米粒的表征及形成机制分析
2.3.1 粒径、PDI与Zeta电位的测定
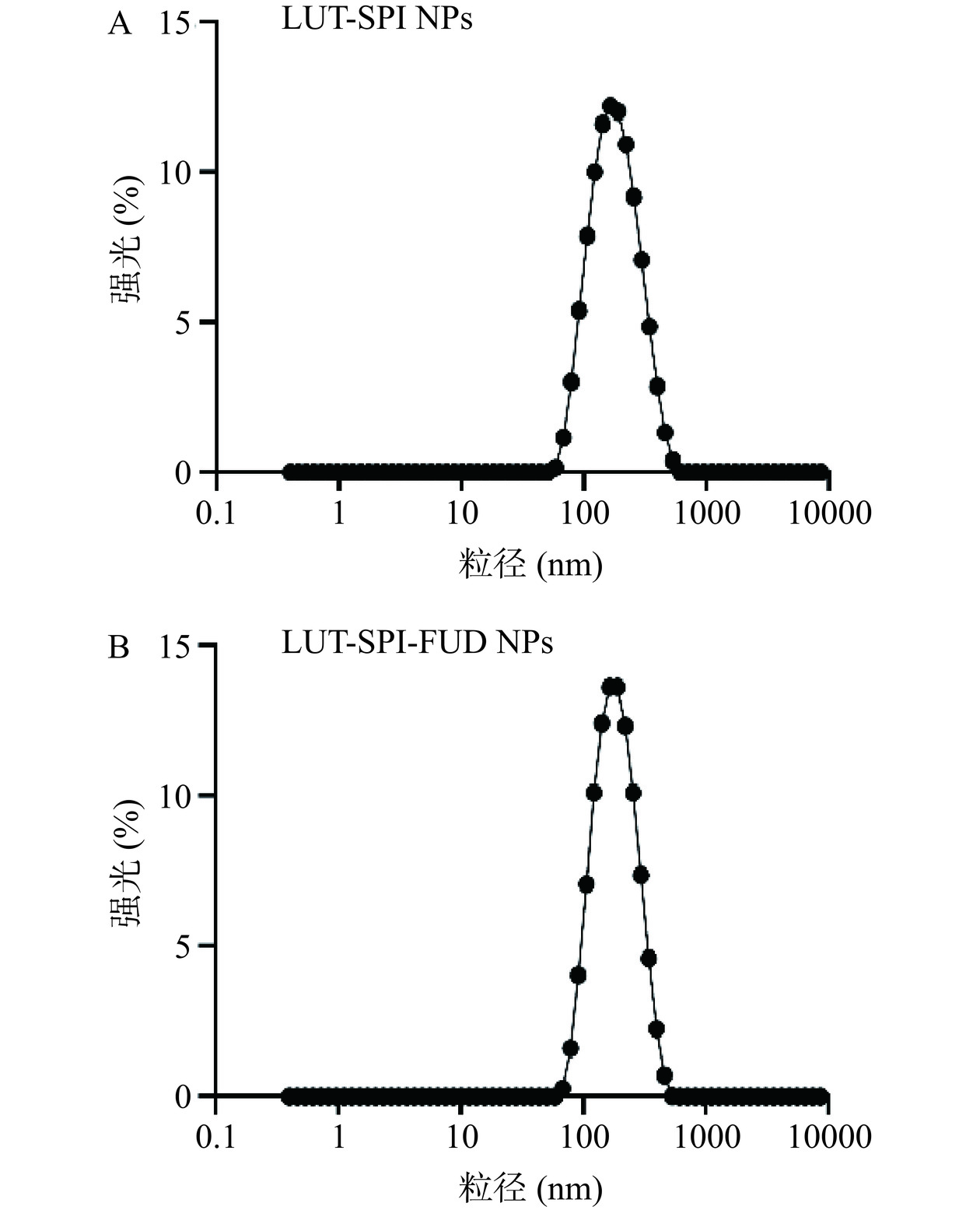
粒径分布、PDI与Zeta电位可以在一定程度上反映稳定性和分布均匀程度,一般来说,纳米颗粒的粒径越小、Zeta电位的绝对值越大,说明纳米颗粒在体系中越稳定;PDI越小,分子量分布越均匀。如图3、表5所示,因为FUD的加入,FUD会吸附在SPI表面,使得LUT-SPI-FUD NPs的平均粒径比LUT-SPI NPs稍大,有显著性差异(P<0.05);PDI和Zeta电位的绝对值比LUT-SPI NPs稍小,但无显著性差异。总体来说,两种纳米粒的粒径均大小理想,分布较为集中,Zeta电位绝对值都大于30 mV,状态较为稳定。
表 5 LUT-SPI NPs、LUT-SPI-FUD NPs的粒径、PDI及Zeta电位结果Table 5. Results of particle size, PDI and zeta potential of LUT-SPI NPs, LUT-SPI-FUD NPs样品 粒径(nm) PDI Zeta电位(mV) LUT-SPI NPs 107.3±1.20 0.21±0.01 −32.87±0.75 LUT-SPI-FUD NPs 139.0±1.20* 0.15±0.02 −31.90±1.70 注:*表示与LUT-SPI NPs相比,同列差异显著,P<0.05。 2.3.2 X射线衍射分析
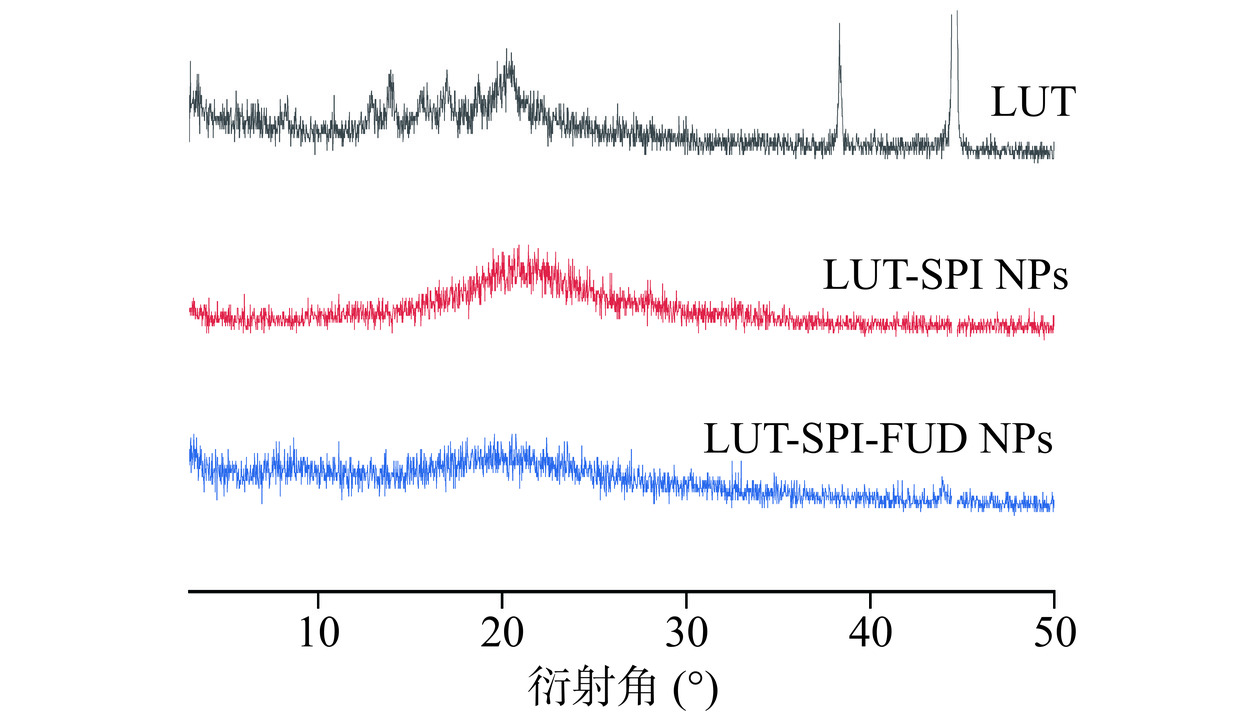
LUT在2θ=13.84°、20.56°、38.32°、44.42°处存在着相关衍射峰(图4),这表明LUT具有典型的晶体结构。而在LUT-SPI NPs、LUT-SPI-FUD NPs上述特征衍射峰完全消失,说明LUT在纳米粒子中所占的比重减小,有部分衍射峰被载体覆盖而导致结晶度下降。对于纳米粒子来讲,LUT特征峰的减弱和消失表明药物是以无定形态存在于纳米粒子中或者高度分散于纳米粒子中。再结合红外光谱图的数据,可得到LUT-SPI NPs、LUT-SPI-FUD NPs最终形成了稳定的且具有无定形结构的非共价复合物的结论。
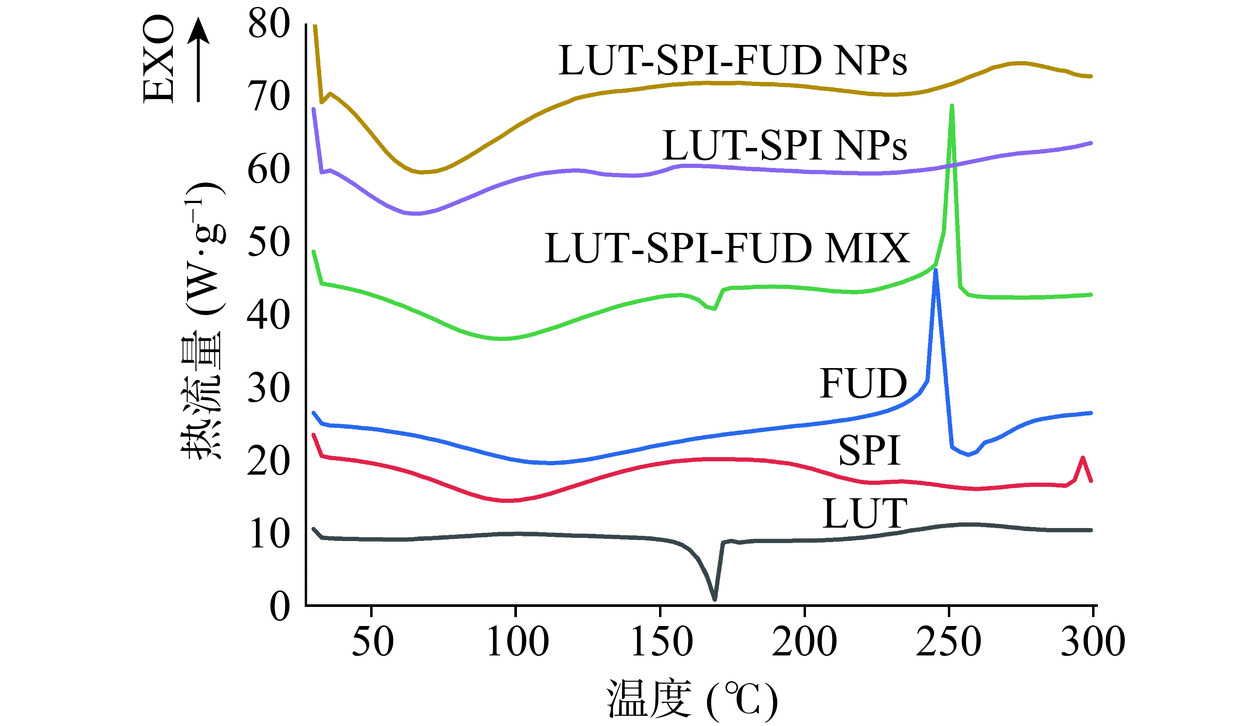
2.3.3 差示扫描量热法(DSC)分析
DSC扫描结果如图5所示:LUT在168.83 ℃有一尖锐特征吸热峰,SPI在98.00 ℃有一较宽吸热峰,FUD在109.33 ℃有一宽吸热峰,且在245.33 ℃出现尖锐放热峰,在三者的物理混合物中,均表现出了三者的相应熔点峰,在LUT-SPI NPs、LUT-SPI-FUD NPs中,叶黄素的168.83 ℃的特征吸热峰均完全消失,表明LUT被成功包埋在两种纳米粒中,其中,在LUT-SPI NPs中,在66.83 ℃、140.50 ℃出现了区别于LUT、SPI的特征峰,表明LUT与SPI二者发生了某种相互作用;而在LUT-SPI-FUD NPs中,与LUT-SPI NPs对比可知,在69.67 ℃出现了区别于LUT、SPI、FUD的特征峰,说明LUT-SPI-FUD NPs既不是三者的简单混合物,也不是LUT-SPI NPs的衍生物,是加入FUD后新形成的物质,表明LUT-SPI-FUD NPs的形成。
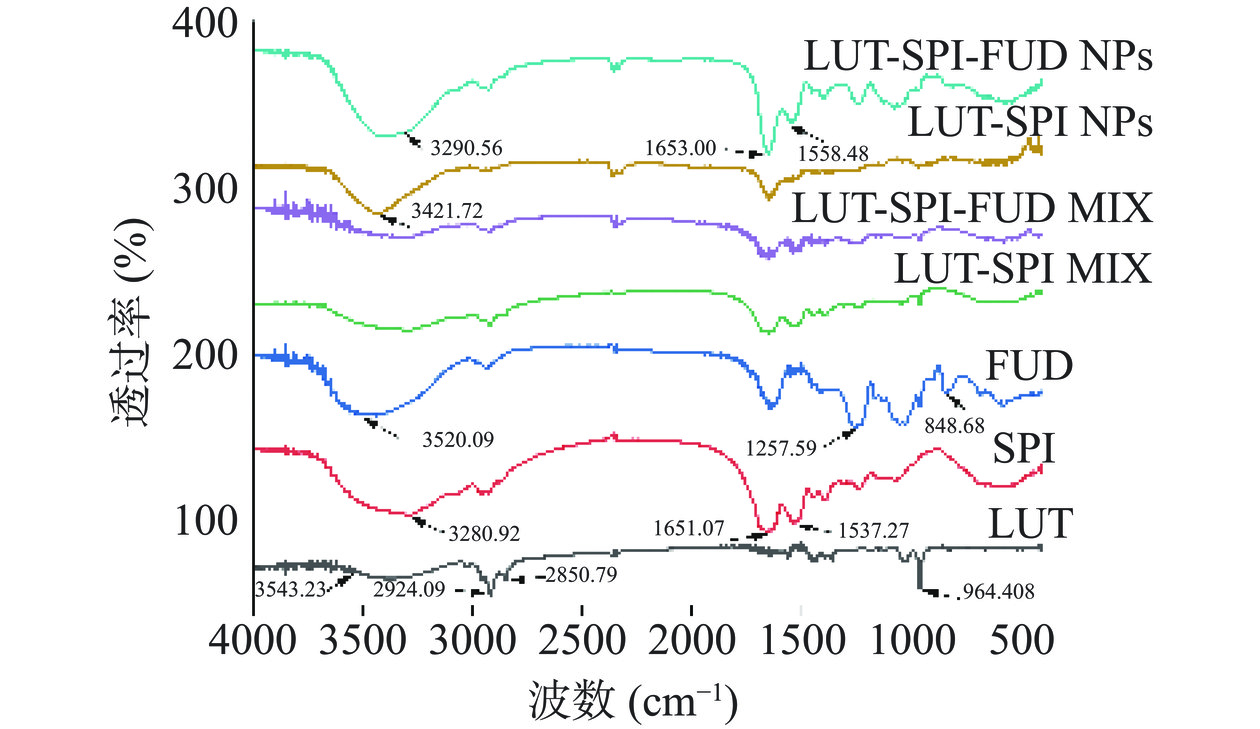
2.3.4 傅立叶红外光谱(FT-IR)分析
各物质所得到的红外光谱图如图6所示。LUT在964.41 cm−1处有一个其共轭多烯链中C-H面外弯曲振动所产生的特征峰,2924.09和2850.79 cm−1为LUT的-CH2的伸缩振动峰,3543.23 cm−1对应于LUT的-OH的伸缩振动峰。但在LUT-SPI NPs、LUT-SPI-FUD NPs中,LUT的964.41 cm−1特征峰消失,这可能是由于LUT与纳米颗粒的结合使其化学键的伸缩和弯曲受到了限制,表明LUT被成功封装在了复合纳米颗粒中,且在LUT-SPI NPs中,LUT的-OH伸缩振动峰发生了蓝移,由3543.23 cm−1移到了3421.72 cm−1,表明LUT与SPI之间可能有氢键和疏水相互作用进行结合。
FUD和SPI分别在3520.09和3280.92 cm−1都出现了强吸收峰,这是-OH的伸缩振动引起的,但在LUT-SPI-FUD NPs中,FUD和SPI的羟基吸收峰分别出现了蓝移(3520.09 cm−1→3290.56 cm−1)和红移(3280.92 cm−1→3290.56 cm−1),表明FUD和SPI之间可能形成了氢键[37]。除此之外,FUD在1257.59 cm−1和848.68 cm−1处出现的吸收峰是其硫酸酯基团的特征峰,SPI在1651.07和1537.27 cm−1处的特征峰分别对应其酰胺I带(C=O伸缩振动)和酰胺II带(C-N伸缩振动和N-H弯曲振动)的特征吸收。在LUT-SPI-FUD NPs中,FUD在1257.59 cm−1处的S=O特征峰强度明显减小;其酰胺I带和酰胺II带吸收峰发生了变化,分别移到了1653.00、1558.48 cm−1,这些变化均表明FUD和SPI之间产生了静电相互作用[38]。
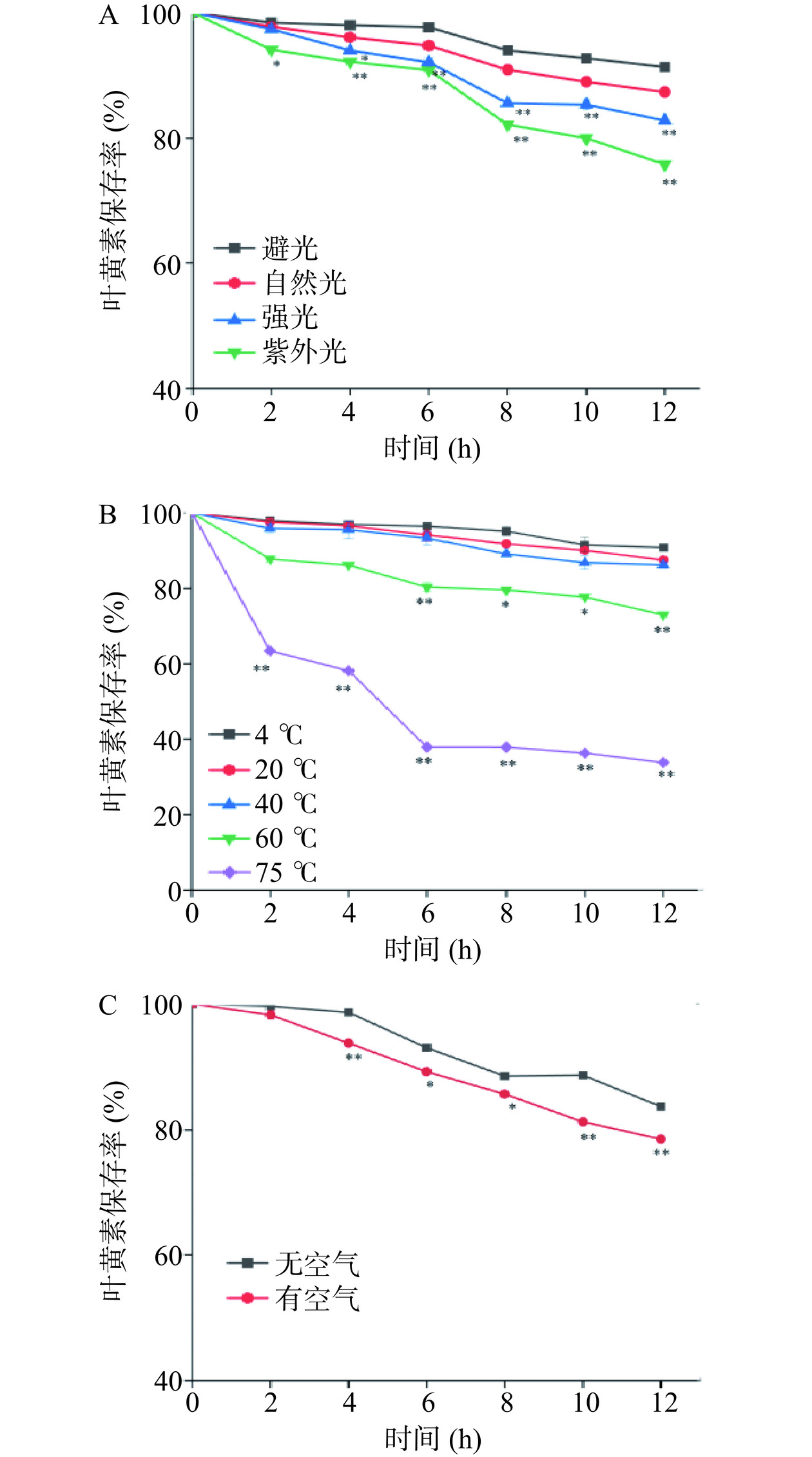
2.4 不同条件对叶黄素稳定性的影响
光照对于LUT具有明显的降解作用,这是由于光加速LUT分子链的氧化,载色体降解断裂,形成低分子量化合物,使LUT失去颜色。同时,LUT的共轭多烯链发生去质子化、失去电子且稳定性降低[39]。如图7A所示,在自然光、强光、紫外光下均有不同程度的降解,且表现为光度越强,光照时间越久,降解率越高,尤其在放置时间超过6 h后,保存率极具下降,放置12 h后,在自然光下的保存率为87.37%,在强光下的保存率为82.85%,在紫外光下保存率为75.88%。因此,应注意在避光条件下储存,选择显著性(P<0.01)差异最明显的紫外光条件进行对比研究。
高温加热能使全反式LUT异构化为顺式异构体,甚至裂解为环氧化物、羟基氧化物[40]。如图7B所示,在4 ℃放置12 h后LUT保存率仍在90%以上。随着环境温度的升高,LUT的降解逐渐增快,且表现为加热的时间越长,保存率越低,在60、75 ℃条件下,12 h后LUT保存率仅为72.97%、33.85%,因此,要注意避免过高的温度,选择显著性(P<0.01)差异最明显的75 ℃高温条件进行对比研究。
由于LUT含有许多不饱和双键,且两个紫罗酮环均连有羟基,因此LUT降解最常见的原因是氧化。同时LUT多烯链的直接断裂还会形成无色的小分子化合物,导致生物活性也会丧失[41]。如图7C示,可以看出,在空气条件下,LUT的稳定性较差,放置4 h后其保存率出现明显下降,12 h后保存率为78.55%,相比较而言,在无空气条件下,LUT的稳定性更好。因此,应尽量密封保存,选择显著性(P<0.01)差异明显的空气条件进行对比研究。
2.5 叶黄素蛋白纳米粒、复合纳米粒对稳定性的影响
2.5.1 光稳定性
如表6所示,在紫外光条件放置7 d后,LUT-SPI NPs、LUT-SPI-FUD NPs相较于LUT保存率分别提高了24.23%、34.07%,说明LUT-SPI NPs、LUT-SPI-FUD NPs极显著(P<0.01)提高了LUT的紫外光稳定性,且LUT-SPI-FUD NPs具有更好的紫外光稳定性。这可能是因为SPI和FUD的存在一定的隔绝LUT同光照接触作用,实现了保护屏障的作用。
表 6 LUT-SPI NPs及LUT-SPI-FUD NPs在紫外光条件下稳定性结果Table 6. Stability results of LUT-SPI NPs and LUT-SPI-FUD NPs under UV conditions时间(d) 保存率(%) LUT LUT-SPI NPs LUT-SPI-FUD NPs 1 69.55±0.05 82.94±0.89** 88.37±0.21** 2 65.18±0.29 79.77±0.22** 87.68±0.37** 3 61.84±0.19 76.86±0.49** 87.57±0.23** 4 58.20±0.05 73.34±0.19** 86.02±0.41** 5 54.03±0.88 72.98±0.34** 84.19±0.10** 6 51.92±0.86 71.36±0.23** 81.27±0.42** 7 46.81±0.52 71.04±0.76** 80.88±0.21** 注:与LUT组相比:**代表具有显著性差异(P<0.01)。 2.5.2 温度稳定性
如表7所示,在75 ℃条件下,LUT-SPI NPs、LUT-SPI-FUD NPs在7 d内的保存率均极显著(P<0.01)高于LUT,相较于LUT保存率提高了41.04%,49.69%,说明LUT-SPI NPs、LUT-SPI-FUD NPs显著提高了LUT的热稳定性,LUT-SPI-FUD NPs在此时间内相较于LUT-SPI NPs提高了8.65%,虽然纳米粒本身也具有较好的稳定作用可以减缓LUT的高温变性,但是LUT与 FUD之间的交联缠绕也能够降低LUT本身的反应活性,因此在较高温度的环境中,LUT-SPI-FUD NPs显然具有更好的稳定性。
表 7 LUT-SPI NPs及LUT-SPI-FUD NPs在75 ℃下稳定性结果Table 7. Stability results of LUT-SPI NPs and LUT-SPI-FUD NPs at 75 °C时间(d) 保存率(%) LUT LUT-SPI NPs LUT-SPI-FUD NPs 1 29.85±1.09 56.78±0.23** 66.81±0.48** 2 21.19±1.53 54.99±0.35** 64.07±0.25** 3 20.91±0.12 54.31±0.19** 63.40±0.16** 4 18.88±1.06 53.61±0.16** 62.37±0.08** 5 15.30±0.85 52.34±0.17** 59.44±0.14** 6 10.29±1.14 50.98±0.16** 58.87±0.14** 7 8.85±1.31 49.89±0.04** 58.54±0.04** 注:与LUT组相比,**代表具有显著性差异(P<0.01)。 2.5.3 空气稳定性
如表8所示,在有空气条件下,LUT-SPI NPs、LUT-SPI-FUD NPs在7 d后的保存率分别为75.12%、82.35%,相较于同时间点的LUT(51.55%),其保存率分别提高了23.57%、30.98%。另外,LUT-SPI NPs、LUT-SPI-FUD NPs在7 d中的各取样点的保存率均大于LUT,证明LUT-SPI NPs、LUT-SPI-FUD NPs极显著(P<0.01)提高了LUT的空气稳定性;并且,LUT-SPI-FUD NPs相比于LUT-SPI NPs具有更高的空气稳定性。这是因为蛋白质与多糖的复合可以明显改善蛋白质的空间稳定性,同时也能提高生物活性分子在蛋白质-多糖复合物中的稳定性[42]。
表 8 LUT-SPI NPs及LUT-SPI-FUD NPs在空气下稳定性结果Table 8. Stability results of LUT-SPI NPs and LUT-SPI-FUD NPs under air时间(d) 保存率(%) LUT LUT-SPI NPs LUT-SPI-FUD NPs 1 70.13±0.11 81.12±0.04** 86.49±0.07** 2 65.81±0.09 80.57±0.22** 85.61±0.05** 3 63.25±0.13 80.16±0.02** 84.37±0.04** 4 62.71±0.11 79.50±0.10** 83.46±0.05** 5 59.29±0.05 78.29±0.04** 82.92±0.06** 6 54.55±0.09 76.34±0.19** 82.61±0.03** 7 51.55±0.30 75.12±0.06** 82.35±0.01** 注:与LUT组相比,**代表具有显著性差异(P<0.01)。 2.6 叶黄素蛋白纳米粒、复合纳米粒对溶解度的影响
如表9所示,相较于LUT,LUT-SPI NPs、LUT-SPI-FUD NPs在纯化水中溶解度分别提高了350.74倍和432.42倍;相较于相应物理混合物,LUT-SPI NPs、LUT-SPI-FUD NPs溶解度分别提高了325.36倍和406.60倍,表明将LUT制备成LUT-SPI NPs、LUT-SPI-FUD NPs的食品级纳米载药体系能够极大地提高水溶性(P<0.01)。并且,相较于LUT-SPI NPs,LUT-SPI-FUD NPs提高的效果更加明显,证明FUD的加入可进一步提高LUT溶解度。
表 9 各物质的饱和溶解度测定结果Table 9. Saturated solubility measurement results for each substance样品 溶解度(μg/mL) LUT 6.28±0.067 LUT-SPI物理混合物 6.77±0.125 LUT-SPI-FUD物理混合物 6.87±0.077 LUT-SPI NPs 2202.96±0.64** LUT-SPI-FUD NPs 2794.76±0.90** 注:与LUT组相比,**代表具有显著性差异(P<0.01)。 2.7 叶黄素蛋白纳米粒、复合纳米粒对抗氧化活性的影响
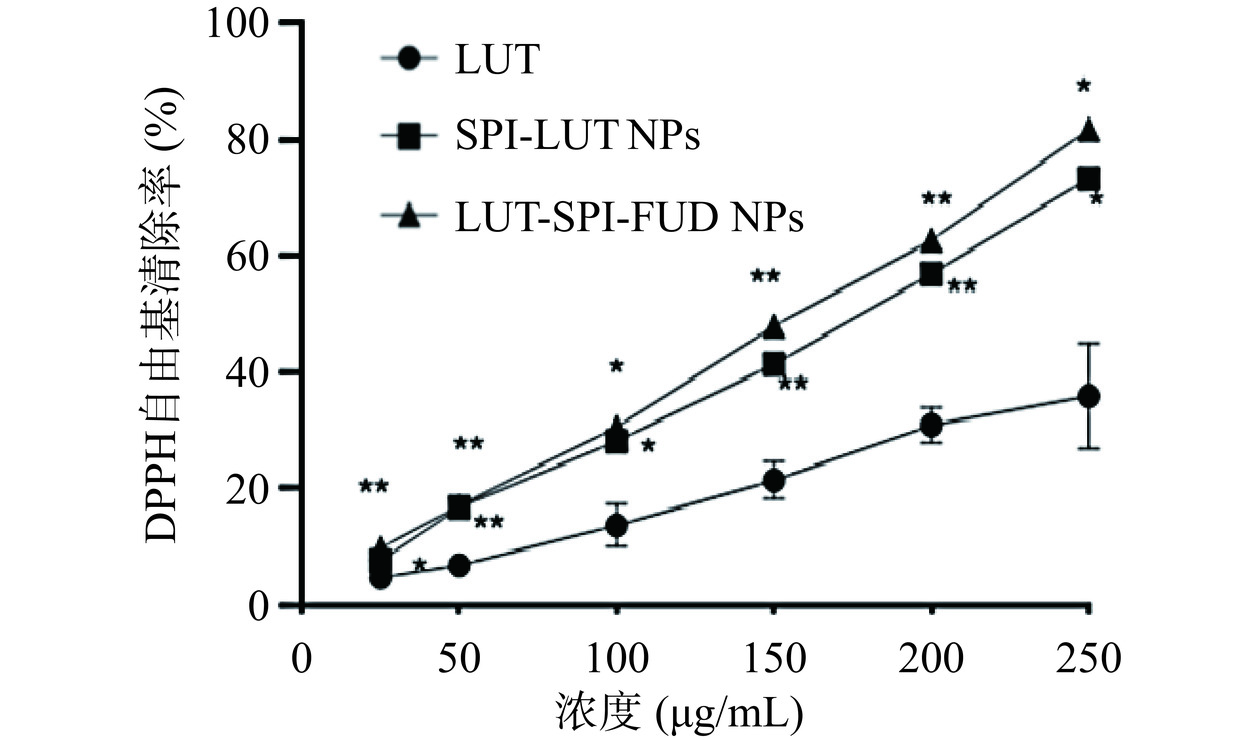
2.7.1 DPPH自由基清除率
如图8所示,在此测量浓度范围内,LUT、LUT-SPI NPs、LUT-SPI-FUD NPs样品的DPPH自由基清除率与LUT的浓度呈正相关,具体表现为:在同一组别中,样品浓度越大,其对DPPH自由基的清除率越高。可以看出,在相同浓度下,LUT-SPI NPs、LUT-SPI-FUD NPs的清除率始终显著(P<0.05)高于LUT原料药,证明LUT-SPI NPs、LUT-SPI-FUD NPs均有效提高了LUT的抗氧化能力。此外,LUT-SPI NPs与LUT-SPI-FUD NPs的IC50分别为161.562、137.837 μg/mL,表明LUT-SPI-FUD NPs的DPPH自由基清除能力高于LUT-SPI NPs。
2.7.2 ABTS+自由基清除率
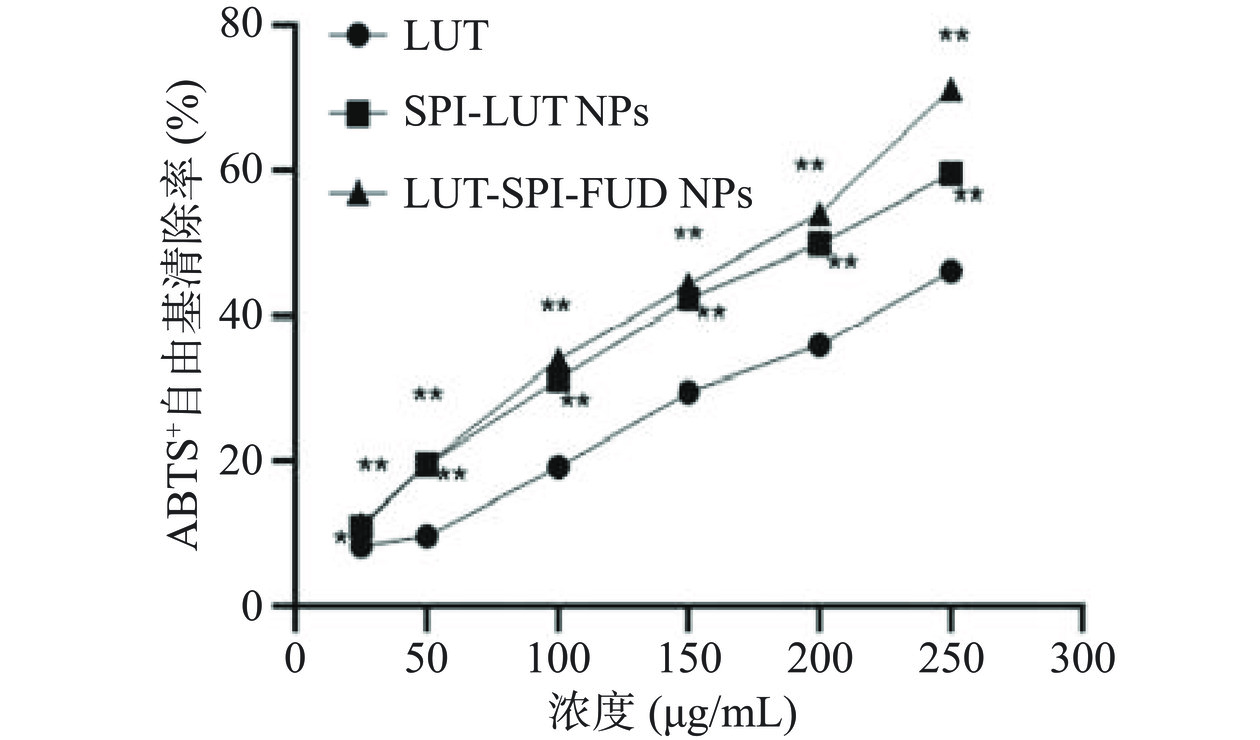
如图9所示,LUT、LUT-SPI NPs、LUT-SPI-FUD NPs均具有一定的ABTS+自由基清除能力,且随着浓度的增加,ABTS+自由基清除能力就越强,在测定浓度范围内,三者IC50值大小顺序为LUT-SPI-FUD NPs<LUT-SPI NPs<LUT,表明LUT-SPI-FUD NPs的ABTS+自由基清除能力最强,LUT-SPI NPs次之,LUT最差,这与DPPH自由基清除结论一致。这是因为一方面LUT被包埋在LUT-SPI NPs、LUT-SPI-FUD NPs中,增强了LUT的溶解度,减轻了LUT的降解,提高了其物理化学稳定性;另一方面可能是由于SPI和FUD本身具有一定的抗氧化性,在LUT-SPI-FUD NPs中发挥了一定的协同作用。
3. 结论
本研究以粒径、PDI、Zeta电位为考察指标,确定SPI/FUD质量比为4:1时LUT-SPI-FUD NPs溶液的Zeta电位绝对值大于30 mV、多分散指数和粒径较小,在此条件下通过单因素实验和Box-Behnken响应面试验确定了LUT-SPI-FUD NPs最佳制备的工艺:LUT/SPI质量比1:7.587,SPI质量浓度为0.83 mg/mL,搅拌时间为1.493 h。表征研究发现,纳米粒粒径大小理想,分布较为集中,SPI和LUT二者可能是通过氢键和疏水相互作用进行结合,FUD与SPI之间的作用力可能是静电相互作用和氢键。并且将LUT制备成LUT-SPI NPs、LUT-SPI-FUD NPs后,均能显著提高LUT的紫外光、高温、空气条件下的稳定性、溶解度和抗氧化能力,且LUT-SPI-FUD NPs优于LUT-SPI NPs。综上,此食品级蛋白质-多糖复合纳米载药体系不仅更能改善LUT水溶性、稳定性和生物利用度低等问题,还更加符合功能性食品绿色、安全的理念。本研究可为新型食品级纳米载药体系的应用提供一定实验基础,对LUT的开发具有重要意义。
-
表 1 响应面试验设计与因素水平
Table 1 Response surface experimental design and factor levels
水平 因 素 A LUT/SPI质量比 B SPI质量浓度(mg/mL) C搅拌时间(h) −1 1:10 2.0 1:2 0 1:8 2.5 1:3 1 1:6 3.0 1:4 表 2 不同SPI/FUD质量比对粒径、PDI和Zeta电位的影响
Table 2 Effects of different SPI/FUD mass ratios on particle size, PDI and Zeta potential
SPI/FUD质量比 粒径(nm) PDI Zeta电位(mV) 8:1 109.07±0.15b 0.21±0.04bc −27.27±0.06a 6:1 125.63±0.66ab 0.22±0.16b −28.07±1.16a 4:1 139.83±1.20ab 0.15±0.02e −31.90±1.70b 2:1 144.23±3.47ab 0.46±0.50a −35.27±4.55c 1:1 147.53±2.78a 0.17±0.12d −37.77±1.25c 1:2 178.70±1.10a 0.09±0.34f −41.60±1.76d 注:同列数据不同小写字母表示差异显著(P<0.05)。 表 3 Box-Behnken试验设计与结果
Table 3 Design and results of Box-Behnken experimental
实验号 A(LUT/SPI质量比) B(SPI质量浓度) C(搅拌时间) EE(%) DL(%) LR(%) OD值 1 0 0 0 91.42±0.064 8.38±0.005 0.75±0.067 0.83 2 1 −1 0 80.39±0.385 9.68±0.042 4.58±0.326 0.59 3 1 0 1 73.20±0.576 8.89±0.064 2.34±0.126 0.42 4 0 1 −1 71.52±0.191 6.67±0.017 3.51±0.747 0.18 5 0 0 0 92.15±0.125 8.44±0.010 0.91±0.412 0.84 6 0 0 0 92.13±0.001 8.44±0.000 0.85±0.134 0.84 7 0 0 0 92.22±0.149 8.44±0.012 1.65±0.161 0.81 8 −1 0 −1 88.55±0.141 6.62±0.010 6.88±0.142 0.27 9 1 0 −1 77.17±0.316 9.33±0.035 2.30±0.124 0.59 10 0 1 1 73.37±0.164 6.84±0.014 2.52±0.480 0.28 11 0 −1 −1 83.20±0.244 7.68±0.021 1.79±0.290 0.60 12 −1 0 1 90.33±0.215 6.74±0.015 2.40±0.073 0.50 13 −1 −1 0 83.21±0.195 6.24±0.014 1.03±0.143 0.29 14 0 0 0 93.66±0.071 8.56±0.006 1.92±0.303 0.83 15 1 1 0 70.30±0.075 8.57±0.008 8.18±0.287 0.00 16 0 −1 1 83.17±0.532 7.68±0.045 1.24±0.175 0.61 17 −1 1 0 80.98±0.298 6.08±0.021 4.42±0.019 0.00 表 4 Box-Behnken设计的方差分析结果
Table 4 ANOVA results of Box-Behnken design
来源 平方和 自由度 均方 F值 P值 显著性 模型 1.33 9 0.1482 298.60 <0.0001 ** A 0.0365 1 0.0365 73.42 <0.0001 ** B 0.3321 1 0.3321 669.00 <0.0001 ** C 0.0036 1 0.0036 7.28 0.0307 * AB 0.0225 1 0.0225 45.32 0.0003 ** AC 0.0400 1 0.0400 80.58 <0.0001 ** BC 0.0020 1 0.0020 4.08 0.0832 A2 0.3572 1 0.3572 719.47 <0.0001 ** B2 0.4278 1 0.4278 861.75 <0.0001 ** C2 0.0370 1 0.0370 74.55 <0.0001 ** 残差 0.0035 7 0.0005 失拟项 0.0029 3 0.0010 6.39 0.0526 纯误差 0.0006 4 0.0001 总离差 1.34 16 注:*代表具有显著性差异P<0.05;**代表具有极显著差异P<0.001。 表 5 LUT-SPI NPs、LUT-SPI-FUD NPs的粒径、PDI及Zeta电位结果
Table 5 Results of particle size, PDI and zeta potential of LUT-SPI NPs, LUT-SPI-FUD NPs
样品 粒径(nm) PDI Zeta电位(mV) LUT-SPI NPs 107.3±1.20 0.21±0.01 −32.87±0.75 LUT-SPI-FUD NPs 139.0±1.20* 0.15±0.02 −31.90±1.70 注:*表示与LUT-SPI NPs相比,同列差异显著,P<0.05。 表 6 LUT-SPI NPs及LUT-SPI-FUD NPs在紫外光条件下稳定性结果
Table 6 Stability results of LUT-SPI NPs and LUT-SPI-FUD NPs under UV conditions
时间(d) 保存率(%) LUT LUT-SPI NPs LUT-SPI-FUD NPs 1 69.55±0.05 82.94±0.89** 88.37±0.21** 2 65.18±0.29 79.77±0.22** 87.68±0.37** 3 61.84±0.19 76.86±0.49** 87.57±0.23** 4 58.20±0.05 73.34±0.19** 86.02±0.41** 5 54.03±0.88 72.98±0.34** 84.19±0.10** 6 51.92±0.86 71.36±0.23** 81.27±0.42** 7 46.81±0.52 71.04±0.76** 80.88±0.21** 注:与LUT组相比:**代表具有显著性差异(P<0.01)。 表 7 LUT-SPI NPs及LUT-SPI-FUD NPs在75 ℃下稳定性结果
Table 7 Stability results of LUT-SPI NPs and LUT-SPI-FUD NPs at 75 °C
时间(d) 保存率(%) LUT LUT-SPI NPs LUT-SPI-FUD NPs 1 29.85±1.09 56.78±0.23** 66.81±0.48** 2 21.19±1.53 54.99±0.35** 64.07±0.25** 3 20.91±0.12 54.31±0.19** 63.40±0.16** 4 18.88±1.06 53.61±0.16** 62.37±0.08** 5 15.30±0.85 52.34±0.17** 59.44±0.14** 6 10.29±1.14 50.98±0.16** 58.87±0.14** 7 8.85±1.31 49.89±0.04** 58.54±0.04** 注:与LUT组相比,**代表具有显著性差异(P<0.01)。 表 8 LUT-SPI NPs及LUT-SPI-FUD NPs在空气下稳定性结果
Table 8 Stability results of LUT-SPI NPs and LUT-SPI-FUD NPs under air
时间(d) 保存率(%) LUT LUT-SPI NPs LUT-SPI-FUD NPs 1 70.13±0.11 81.12±0.04** 86.49±0.07** 2 65.81±0.09 80.57±0.22** 85.61±0.05** 3 63.25±0.13 80.16±0.02** 84.37±0.04** 4 62.71±0.11 79.50±0.10** 83.46±0.05** 5 59.29±0.05 78.29±0.04** 82.92±0.06** 6 54.55±0.09 76.34±0.19** 82.61±0.03** 7 51.55±0.30 75.12±0.06** 82.35±0.01** 注:与LUT组相比,**代表具有显著性差异(P<0.01)。 表 9 各物质的饱和溶解度测定结果
Table 9 Saturated solubility measurement results for each substance
样品 溶解度(μg/mL) LUT 6.28±0.067 LUT-SPI物理混合物 6.77±0.125 LUT-SPI-FUD物理混合物 6.87±0.077 LUT-SPI NPs 2202.96±0.64** LUT-SPI-FUD NPs 2794.76±0.90** 注:与LUT组相比,**代表具有显著性差异(P<0.01)。 -
[1] PERRY A, RASMUSSEN H, JOHNSON E J. Xanthophyll (lutein, zeaxanthin) content in fruits, vegetables and corn and egg products[J]. Journal of Food Composition and Analysis,2009,22(1):9−15. doi: 10.1016/j.jfca.2008.07.006
[2] 苏卿, 李谦, 陈浩, 等. 叶黄素的抗氧化促氧化作用研究[J]. 食品工业科技,2014,35(9):68−71,77. [SU Q, LI Q, CHEN H, et al. Anti-oxidative and pro-oxidative character study of lutein[J]. Science and Technology of Food Industry,2014,35(9):68−71,77.] SU Q, LI Q, CHEN H, et al. Anti-oxidative and pro-oxidative character study of lutein[J]. Science and Technology of Food Industry, 2014, 35(9): 68−71,77.
[3] RAMÓNA P, EDINA P, GERGELY J, et al. Lutein exerts antioxidant and anti-inflammatory effects and influences iron utilization of BV-2 microglia[J]. Antioxidants,2021,10(3):1−26.
[4] HISAMUDDIN A S B, NAOMI R, MANAN K A B, et al. The role of lutein-rich purple sweet potato leaf extract on the amelioration of diabetic retinopathy in streptozotocin-induced Sprague–Dawley rats[J]. Frontiers in Pharmacology,2023,14:1175907. doi: 10.3389/fphar.2023.1175907
[5] ZHANG S Y, LU Y Y, HE X L, et al. Lutein inhibits tumor progression through the ATR/Chk1/p53 signaling pathway in non-small cell lung cancer[J]. Phytotherapy Research,2023,37(4):1260−1273. doi: 10.1002/ptr.7682
[6] VIANA C E, BORTOLOTTO V C, ARAUJO S M, et al. Lutein-loaded nanoparticles reverse oxidative stress, apoptosis, and autism spectrum disorder-like behaviors induced by prenatal valproic acid exposure in female rats[J]. Neuro Toxicology,2023,94:223−234.
[7] 王敏, 王晓黎, 沈慧. 叶黄素预防心血管疾病的研究进展[J]. 职业与健康,2020,36(3):424−427. [WANG M, WANG X L, SHEN H. Research progress of lutein in preventing cardiovascular diseases[J]. Occup and Health,2020,36(3):424−427.] WANG M, WANG X L, SHEN H. Research progress of lutein in preventing cardiovascular diseases[J]. Occup and Health, 2020, 36(3): 424−427.
[8] MAO L K, MIAO S. Structuring food emulsions to improve nutrient delivery during digestion[J]. Food Engineering Reviews,2015,7:439−451. doi: 10.1007/s12393-015-9108-0
[9] BECERRA M O, CONTRERAS L M, LO M H, et al. Lutein as a functional food ingredient:Stability and bioavailability[J]. Journal of Functional Foods,2020,66:103771. doi: 10.1016/j.jff.2019.103771
[10] LIENAU A, GLASER T, TANG G, et al. Bioavailability of lutein in humans from intrinsically labeled vegetables determined by LC-APCI-MS[J]. The Journal of Nutritional Biochemistry,2003,14(11):663−670. doi: 10.1016/j.jnutbio.2003.08.004
[11] LI Y J, LIU J B, MA S T, et al. Co-assembly of egg white-derived peptides and protein-polysaccharide complexes for curcumin encapsulation:The enhancement of stability, redispersibility, and bioactivity[J]. Food Chemistry,2022,394:133496. doi: 10.1016/j.foodchem.2022.133496
[12] LENG X, CHENG S Y, WU H Q, et al. High internal phase emulsions stabilized with polyphenol-amyloid fibril supramolecules for encapsulation and protection of lutein[J]. Journal of Agricultural and Food Chemistry,2022,70(7):2328−2338. doi: 10.1021/acs.jafc.1c04615
[13] LIU K, ZHA X Q, LI Q M, et al. Hydrophobic interaction and hydrogen bonding driving the self-assembling of quinoa protein and flavonoids[J]. Food Hydrocolloids,2021,118:106807. doi: 10.1016/j.foodhyd.2021.106807
[14] QI X, XU D X, ZHU J J, et al. Interaction of ovalbumin with lutein dipalmitate and their effects on the color stability of marigold lutein esters extracts[J]. Food Chemistry,2022,372:131211. doi: 10.1016/j.foodchem.2021.131211
[15] XIANG H, SUN-WATERHOUSE D, CUI C, et al. Modification of soy protein isolate by glutaminase for nanocomplexation with curcumin[J]. Food Chemistry,2018,268:504−512. doi: 10.1016/j.foodchem.2018.06.059
[16] HAN L, LI J L, JIANG Y T, et al. Changes in the structure and functional properties of soybean isolate protein:Effects of different modification methods[J]. Food Chemistry,2024,432:137214. doi: 10.1016/j.foodchem.2023.137214
[17] CHUACHAROEN T, SABLIOV C M. Stability and controlled release of lutein loaded in zein nanoparticles with and without lecithin and pluronic F127 surfactants[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,503:11−18.
[18] JIAO Y, ZHENG X Q, CHANG Y, et al. Zein-derived peptides as nanocarriers to increase the water solubility and stability of lutein[J]. Food & Function,2018,9(1):117−123.
[19] LI H, WANG D F, LIU C Z, et al. Fabrication of stable zein nanoparticles coated with soluble soybean polysaccharide for encapsulation of quercetin[J]. Food Hydrocolloids,2019,87:342−351. doi: 10.1016/j.foodhyd.2018.08.002
[20] CHEN F P, OU S Y, TANG C H. Core–shell soy protein–soy polysaccharide complex (nano) particles as carriers for improved stability and sustained release of curcumin[J]. Journal of Agricultural and Food Chemistry,2016,64(24):5053−5059. doi: 10.1021/acs.jafc.6b01176
[21] ZHENG Z J, PENG D C, LI M F, et al. Gemcitabine and Pin1 siRNA co-delivery with fucoidan-coated nano-liposomes for therapy of pancreatic cancer[J]. Journal of Drug Delivery Science and Technology,2023,87:104872. doi: 10.1016/j.jddst.2023.104872
[22] ZHANG X, ZHU Y F, FAN L H, et al. Delivery of curcumin by fucoidan-coated mesoporous silica nanoparticles:Fabrication, characterization, and in vitro release performance[J]. International Journal of Biological Macromolecules,2022,211:368−379. doi: 10.1016/j.ijbiomac.2022.05.086
[23] WU D, TANG L, ZENG Z, et al. Delivery of hyperoside by using a soybean protein isolated-soy soluble polysaccharide nanocomplex:Fabrication, characterization, and in vitro release properties[J]. Food Chemistry,2022,386:132837. doi: 10.1016/j.foodchem.2022.132837
[24] 秦责语, 周小影, 刘宇萌, 等. 甘草次酸介导的马钱子碱自组装纳米粒的工艺优化与表征[J]. 中药材,2023,46(1):164−171. [QIN Z Y, ZHOU X Y, LIU Y M, et al. Ga-mediated process optimization and characterization of brucine, B self-assembled nanoparticles[J]. Journal of Chinese Medicinal Materials,2023,46(1):164−171.] QIN Z Y, ZHOU X Y, LIU Y M, et al. Ga-mediated process optimization and characterization of brucine, B self-assembled nanoparticles[J]. Journal of Chinese Medicinal Materials, 2023, 46(1): 164−171.
[25] 胡悦. 基于磷脂复合物的羟甲香豆素磷脂-壳聚糖纳米粒的制备研究[D]. 长春:长春中医药大学, 2022. [HU Y. Study on the preparation of Hymecromone phospholipid-chitosan nanoparticles based on phospholipid complex[D]. Changchun:Changchun University of Traditional Chinese Medicine, 2022.] HU Y. Study on the preparation of Hymecromone phospholipid-chitosan nanoparticles based on phospholipid complex[D]. Changchun: Changchun University of Traditional Chinese Medicine, 2022.
[26] 吴伟, 崔光华, 陆彬. 实验设计中多指标的优化:星点设计和总评“归一值”的应用[J]. 中国药学杂志,2000(8):26−29. [WU W, CUI G H, LU B. Optimization of multiple evariables:Application of central composite design and overall desirability[J]. Chinese Pharmaceutical Journal,2000(8):26−29.] WU W, CUI G H, LU B. Optimization of multiple evariables: Application of central composite design and overall desirability[J]. Chinese Pharmaceutical Journal, 2000(8): 26−29.
[27] 孙艺, 乔旭光, 郑振佳, 等. 大蒜多糖脂质体制备及结构表征[J]. 食品工业科技,2023,44(14):9−15. [SUN Y, QIAO X G, ZHENG Z J, et al. Preparation and structural characterization of garlic polysaccharide liposomes[J]. Science and Technology of Food Industry,2023,44(14):9−15.] SUN Y, QIAO X G, ZHENG Z J, et al. Preparation and structural characterization of garlic polysaccharide liposomes[J]. Science and Technology of Food Industry, 2023, 44(14): 9−15.
[28] 李伟宏, 郑伟, 王风云, 等. 金丝桃苷磷脂复合物及其介孔二氧化硅纳米粒的制备和口服药动学研究[J]. 中草药,2023,54(13):4157−4167. [LI W H, ZHEN W, WANG F Y, et al. Preparation of hyperoside phospholipids complex and its mesoporous silica nanoparticles and oral pharmacokinetics study[J]. Chinese Traditional and Herbal Drugs,2023,54(13):4157−4167.] LI W H, ZHEN W, WANG F Y, et al. Preparation of hyperoside phospholipids complex and its mesoporous silica nanoparticles and oral pharmacokinetics study[J]. Chinese Traditional and Herbal Drugs, 2023, 54(13): 4157−4167.
[29] HOSSEINI F, MIRI M A, NAJAFI M, et al. Encapsulation of rosemary essential oil in zein by electrospinning technique[J]. Journal of Food Science,2021,86(9):4070−4086. doi: 10.1111/1750-3841.15876
[30] ZHAO R X, ZHANG B, SUN J R, et al. Evaluation of degradation of pigments formed during garlic discoloration in different pH[J]. Food Research International,2021,140:109957. doi: 10.1016/j.foodres.2020.109957
[31] 马晴, 金美熹, 王晓丽, 等. 叶黄素酯冻干亚微乳的制备及体内外评价[J]. 中国医药工业杂志,2023,54(10):1450−1458. [MA Q, JIN M X, WANG X L, et al. Preparation, in vitro and in vivo evaluation of lutein ester freeze-dried submicron emulsion[J]. Chinese Journal of Pharmaceuticals,2023,54(10):1450−1458.] MA Q, JIN M X, WANG X L, et al. Preparation, in vitro and in vivo evaluation of lutein ester freeze-dried submicron emulsion[J]. Chinese Journal of Pharmaceuticals, 2023, 54(10): 1450−1458.
[32] 马晓雨. 基于大米蛋白酶解物构建的叶黄素纳米输送体系的制备及性质研究[D]. 南昌:南昌大学, 2019. [MA X Y. Fabrication and characterization of lutein nano-delivery systembased on rice protein hydrolysate[D]. Nanchang:Nanchang University, 2019.] MA X Y. Fabrication and characterization of lutein nano-delivery systembased on rice protein hydrolysate[D]. Nanchang: Nanchang University, 2019.
[33] 赵宏宇, 顾正彪, 程力, 等. 莱鲍迪苷A在甲醇-水体系中溶解度与超溶解度的测定[J]. 食品工业科技,2012,33(11):340−342,378. [ZHAO H Y, GU Z B, CHENG L, et al. Determination of solubility and supersolubility of Rebaudioside A in methanol aqueous solution[J]. Science and Technology of Food Industry,2012,33(11):340−342,378.] ZHAO H Y, GU Z B, CHENG L, et al. Determination of solubility and supersolubility of Rebaudioside A in methanol aqueous solution[J]. Science and Technology of Food Industry, 2012, 33(11): 340−342,378.
[34] 王崑仑, 管立军, 高扬, 等. 裂褶菌发酵西洋参工艺优化及体外抗氧化能力研究[J/OL]. 食品工业科技, 2023:1−13[2023-10-09]. https://doi.org/10.13386/j.issn1002-0306.2023040063 [WANG K L, GUAN L J, GAO Y, et al. Optimization of fermentation process of Panax quinquefolius L. by schizophyllum commune and antioxidant capacity in vitro[J/OL]. Science and Technology of Food Industry, 2023: 1−13[2023-10-09]. https://doi.org/10.13386/j.issn1002-0306.2023040063.] WANG K L, GUAN L J, GAO Y, et al. Optimization of fermentation process of Panax quinquefolius L. by schizophyllum commune and antioxidant capacity in vitro[J/OL]. Science and Technology of Food Industry, 2023: 1−13[2023-10-09]. https://doi.org/10.13386/j.issn1002-0306.2023040063.
[35] 涂玲飞, 李焱, 张振. 响应面优化硒化白及多糖的制备工艺及其体外抗氧化活性研究[J/OL]. 食品工业科技, 2023:1−15[2023-10-09]. https://doi.org/10.13386/j.issn1002-0306.2023060295. [TU L F, LI Y, ZHANG Z. Preparation and antioxidant activity of selenized white and polysaccharide by response surface optimization[J/OL]. Science and Technology of Food Industry, 2023: 1−15[2023-10-09]. https://doi.org/10.13386/j.issn1002-0306.2023060295.] TU L F, LI Y, ZHANG Z. Preparation and antioxidant activity of selenized white and polysaccharide by response surface optimization[J/OL]. Science and Technology of Food Industry, 2023: 1−15[2023-10-09]. https://doi.org/10.13386/j.issn1002-0306.2023060295.
[36] 何蕾. 低密度脂蛋白/羧甲基纤维素钠纳米凝胶靶向递送体系研究[D]. 武汉:华中农业大学, 2015. [HE L. Study on low density lipoprotein/sodium carboxymethyl cellulose nanogels as targeted delivery system[D]. Wuhan:Huazhong Agricultural University, 2015.] HE L. Study on low density lipoprotein/sodium carboxymethyl cellulose nanogels as targeted delivery system[D]. Wuhan: Huazhong Agricultural University, 2015.
[37] JIANG Q B, LI P Y, JI M R, et al. Synergetic effects of water-soluble polysaccharides for intensifying performances of oleogels fabricated by oil-absorbing cryogels[J]. Food Chemistry,2022,372:131357. doi: 10.1016/j.foodchem.2021.131357
[38] SOUZA C J F, GARCIA-ROJAS E E. Interpolymeric complexing between egg white proteins and xanthan gum:Effect of salt and protein/polysaccharide ratio[J]. Food Hydrocolloids,2017,66:268−275. doi: 10.1016/j.foodhyd.2016.11.032
[39] JU D J, JI T H, XU Z M, et al. The remarkable enhancement of photo-stability and antioxidant protection of lutein coupled with carbon-dot[J]. Food Chemistry,2023,405:134551. doi: 10.1016/j.foodchem.2022.134551
[40] KIM M J, SHIN W S. Stability of zeaxanthin/lutein in yolk oil obtained from microalgae-supplemented egg under various storage conditions[J]. LWT,2022,155:112899. doi: 10.1016/j.lwt.2021.112899
[41] KOBORI C N, WAGNER R, PADULA M, et al. Formation of volatile compounds from lycopene by autoxidation in a model system simulating dehydrated foods[J]. Food Research International,2014,63:49−54. doi: 10.1016/j.foodres.2014.04.029
[42] HOSSEINI S M H, EMAM-DJOMEH Z, SABATINO P, et al. Nanocomplexes arising from protein-polysaccharide electrostatic interaction as a promising carrier for nutraceutical compounds[J]. Food Hydrocolloids,2015,50:16−26. doi: 10.1016/j.foodhyd.2015.04.006





 下载:
下载:
 下载:
下载:
